중간엽 줄기세포
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
중간엽 줄기세포(MSC)는 중배엽에서 유래하여 조혈 및 결합 조직으로 분화하며, 골수, 탯줄, 지방 조직 등 다양한 조직에서 채취할 수 있는 다분화능 세포이다. 1991년 아놀드 캐플란에 의해 처음 사용된 용어로, 섬유아세포와 유사한 형태를 가지며 CD73, CD90, CD105 등의 표면 마커를 발현한다. MSC는 면역 조절, 항균 기능, 조직 복구 능력을 통해 자가면역 질환, 뇌 손상, 연골 손상 등 다양한 질환 치료에 대한 연구가 진행 중이다. 그러나 MSC의 임상적 사용에 대한 엄격한 데이터 부족과 영리 클리닉에서의 무분별한 사용에 대한 우려가 제기되고 있다.
더 읽어볼만한 페이지
2. 정의 및 역사
2. 1. 정의
중간엽 줄기세포(MSC)는 '골수 기질세포'라는 용어와 오랫동안 혼용되어 왔으나, 엄밀한 의미에서는 다음과 같은 차이점이 있다.[6][7]- 중간엽은 중배엽에서 유래하여 조혈 및 결합 조직으로 분화하는 배아 결합 조직인 반면, 중간엽 줄기세포는 조혈모세포로 분화하지 않는다.[77]
- 기질세포는 조직의 기능세포가 상주하는 지지구조를 형성하는 결합조직세포이다. 이는 중간엽 줄기세포의 한 기능에 대해서는 정확한 설명이지만, 상대적으로 최근에 발견된 조직을 복구하는 중간엽 줄기세포의 역할을 설명하지 못한다.[78]
- 중간엽 줄기세포는 태반,[79] 제대혈, 지방조직, 성인 근육, 각막 기질[80] 또는 아기 유치의 치수와 같은 다른 비골수 조직에서 유래한 다분화능을 가진 세포를 포함하며, 전체 기관을 재구성하는 능력은 없다.
케이스 웨스턴 리저브 대학교의 아놀드 캐플란이 1991년 처음 사용한 용어[5]로, 길고 얇은 세포 돌기를 가진 작은 세포체가 형태학적 특징이다. 증거에 따르면 중간엽 줄기세포는 혈관에 존재하는 혈관 주위 세포라고 불리는 전구 혈관 주위 세포에서 유래한다.[11]
국제 세포 치료 학회(ISCT)는 중간엽 줄기세포를 정의하기 위한 일련의 기준을 제안했다. 세포는 정상적인 배양 조건에서 플라스틱 부착 특성을 보이고 섬유아세포와 유사한 형태를 나타낼 경우 MSC로 분류될 수 있다. 실제로 일부에서는 MSC와 섬유아세포가 기능적으로 동일하다고 주장한다.[14] 2023년 11월 현재 29,000회 이상 인용된 ''사이언스'' 논문에 따르면, MSC는 시험관 내에서 골 형성, 지방 형성 및 연골 형성 분화를 겪을 수 있다. 배양된 MSC는 또한 표면에 CD73, CD90, CD105를 발현하며, CD11b, CD14, CD19, CD34, CD45, CD79a 및 HLA-DR 표면 마커의 발현은 보이지 않는다.[15]
간엽 줄기 세포는 간엽 조직이 있는 모든 조직에 존재한다고 생각된다. 간엽 조직 중 골수 간엽 줄기 세포는 골수 천자로 쉽게 채취할 수 있으며, 배양 기술도 확립되어 있다. 골수 간엽 줄기 세포는 골수 기질 세포 안에 포함되어 있다. 골수 기질 세포는 골수 내에서 주체가 되는 조혈 세포를 지지하는 세포의 일종이다. 골수 기질 세포는 골수 내에서 조혈 세포를 지지하기 위해 망상 구조를 이룬다. 골수는 신체 내에서 혈액을 만드는 조혈 작용의 주요 장기이다.
2. 2. 역사
1924년, 러시아 태생의 형태학자 Alexander A. Maximow는 광범위한 조직학적 소견을 이용하여 다른 유형의 혈액세포로 진행되는 중간엽 내 전구세포의 한 유형을 밝혀냈다.[105]1960년대에 과학자 어니스트 A. 맥컬로치와 제임스 E. 틸은 골수 세포의 클론 특성을 처음으로 밝혀냈다.[106][107][62][63] 1970년, 아놀드 캐플란은 중간엽 세포가 연골, 근원성(근육) 조직 및 뼈로 분화되는 특정 조건을 확인했다.[64]
1970년대에 프리에덴스타인과 동료들은 다분화능 골수 세포의 클론 형성 잠재력을 검사하기 위한 ''생체 외'' 분석법을 보고했다.[108][109][65][66] 이 분석 시스템에서 기질 세포는 섬유아세포 집락 형성 단위(CFU-f)로 지칭되었다.
이후의 실험을 통해 골수 세포의 가소성이 밝혀졌고, 환경적 신호에 의해 운명이 어떻게 결정되는지 밝혀졌다. 아스코르브산, 무기 인산염 및 덱사메타손과 같은 골형성 자극이 있는 배양 골수 기질 세포는 골아세포로의 분화를 촉진할 수 있다. 반대로, 변형 성장 인자-베타(TGF-b)를 첨가하면 연골세포 마커를 유도할 수 있다.
중간엽 줄기세포(MSC)의 첫 번째 임상 시험은 1995년 오시리스 치료제사(Osiris Therapeutics)에 의해 완료되었으며, 15명의 환자 그룹이 배양된 MSC를 주사하여 치료의 안전성을 테스트했다.[110][67] MSC에 대한 최초의 규제 승인은 2012년 캐나다와 뉴질랜드에서 이식편대숙주병(GvHD) 치료에 대해 조건부 승인을 받았고, 그 후 일본에서 크론병 관련 누공 치료에 대해 승인을 받았다.[68] 그 이후, 수많은 질병을 치료하기 위해 1,500건 이상의 임상 시험이 수행되었다.[69]
3. 구조 및 형태
3. 1. 구조
3. 2. 형태
중간엽 줄기세포는 길고 얇은 세포 돌기를 가진 작은 세포체가 특징이다.[81][82] 세포체는 미세하게 분산된 염색질 입자들로 둘러싸인 눈에 잘 띄는 핵소체가 있는 크고 둥근 핵을 포함하고 있어서 핵이 뚜렷한 외관을 가진다.[81][82] 세포체의 나머지 부분에는 소량의 골지체, 거친 소포체, 미토콘드리아와 폴리리보솜이 들어있다.[81][82] 길고 얇은 세포는 광범위하게 분산되어 있고 인접한 세포 외 기질에는 적은 수의 망상섬유가 있지만 다른 형태의 콜라겐 섬유는 없다.[81][82]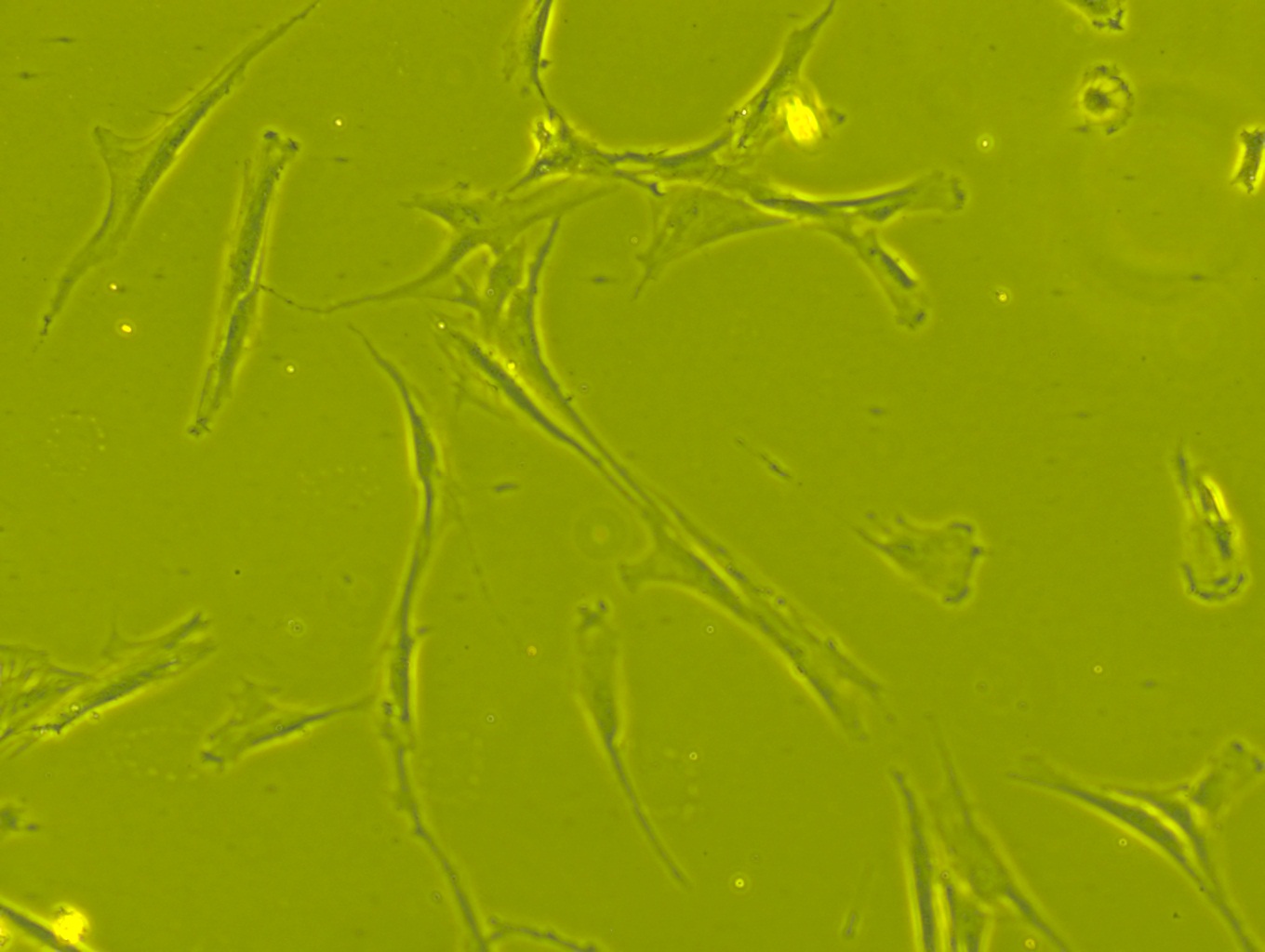
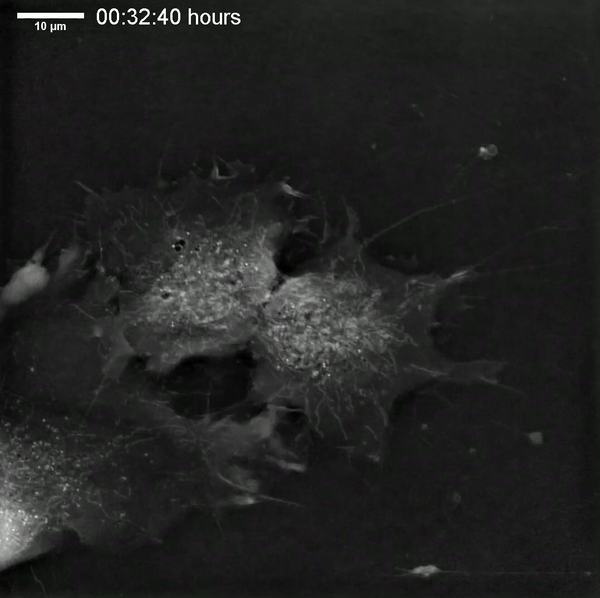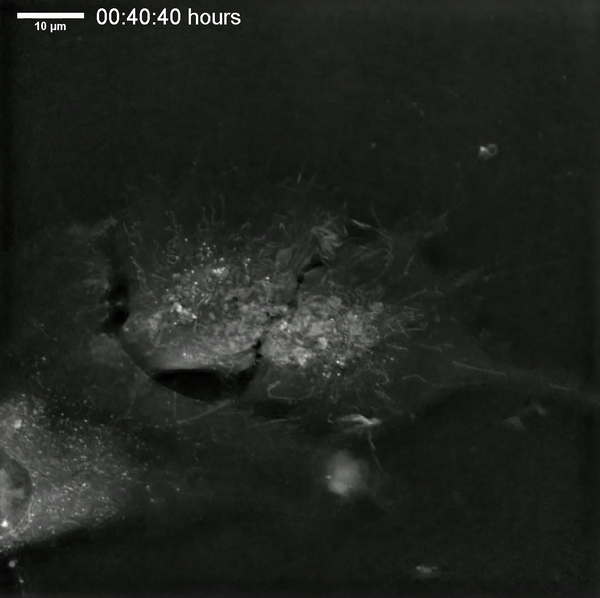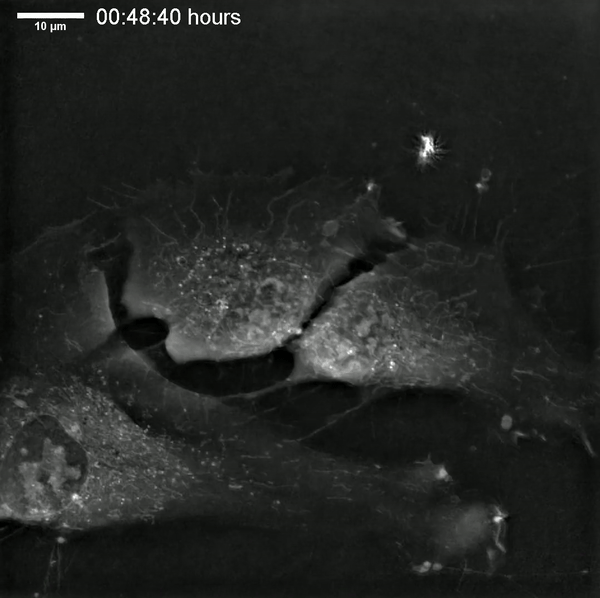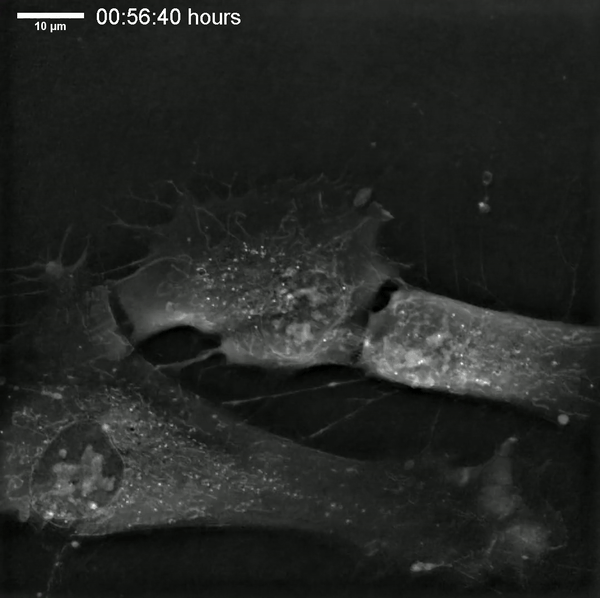
세포체는 뚜렷한 세포 핵을 가진 크고 둥근 세포 핵을 포함하며, 이 핵은 미세하게 분산된 크로마틴 입자로 둘러싸여 핵을 맑게 보이게 한다.[12][13] 세포체의 나머지 부분은 소량의 골지체, 조면 소포체, 미토콘드리아, 다핵리보솜을 포함한다.[12][13] 길고 얇은 세포는 넓게 퍼져 있으며, 인접한 세포 외 기질에는 소수의 세망 섬유가 있지만, 다른 유형의 콜라겐 섬유는 없다.[12][13]
4. 위치
중간엽 줄기세포(MSCs)는 인체 전반에 걸쳐 발견된다.
== 골수 ==
골수는 중간엽 줄기세포의 전통적인 공급원이며, 여전히 가장 많이 사용된다.[83][16] 골수 줄기세포는 혈액 세포 형성에 기여하지 않으므로 조혈 줄기세포 표지자인 CD34를 발현하지 않는다.[83][17] 이 세포는 때때로 골수 기질 줄기세포라고 부른다.[83][17]
골수 간엽 줄기 세포는 골수 천자로 쉽게 채취할 수 있으며, 배양 기술도 확립되어 있다. 간엽 줄기 세포는 간엽 조직이 있는 모든 조직에 존재한다고 생각된다. 골수 기질세포 안에 포함되어 있으며, 골수 내에서 조혈 세포를 지지하는 망상 구조를 이룬다. 골수는 신체 내에서 혈액을 만드는 조혈 작용의 주요 장기이다.
== 탯줄 ==
가장 어리고 원시적인 중간엽 줄기세포는 바르톤젤리와 제대혈과 같은 탯줄 조직에서 얻을 수 있다. 그러나 중간엽 줄기세포는 조혈모세포의 풍부한 원천인 제대혈에 비해서 바르톤젤리에서 훨씬 높은 농도로 발견된다. 탯줄은 출생 후에 이용이 가능하고 일반적으로 폐기되며 수집에 따른 위험이 없다. 이러한 원시적인 특징 때문에 탯줄의 중간엽 줄기세포는 임상 적용을 위한 유용한 중간엽 줄기세포의 공급원으로 사용될 수 있다.
== 지방 조직 ==
지방 조직은 중간엽 줄기세포(또는 지방 유래 중간엽 줄기세포, AdMSC)의 풍부한 공급원이다.[84] 지방 유래 중간엽 줄기세포(AdMSCs)는 골수 유래 중간엽 줄기세포보다 더 쉽고 안전하게 분리할 수 있을 뿐만 아니라, 더 많은 양을 얻을 수 있다.[16][19]
== 치아 ==
아래턱의 세 번째 어금니(제3대구치)의 치아 돌기는 중간엽 줄기세포의 풍부한 원천이다.[10] 이 세포들은 다분화능을 가지는 것으로 설명되지만, 전분화능을 가질 가능성이 크다.[10] 이 세포들은 에나멜, 상아질, 혈관, 치아 펄프와 신경 조직을 형성한다.[10] 또한, 이 줄기세포는 간세포를 형성할 수 있다. 이 줄기 세포는 시험관 내에서 연골세포, 심근세포, 멜라닌 세포 그리고 간세포 유사 세포로 분화할 수 있다.[10]
== 양수 ==
양수에는 줄기 세포가 존재한다.[85][20] 양수천자 동안 수집된 세포 100개 중 1개는 전분화능을 가진 중간엽 줄기 세포이다.[85]
== 말초 혈액 ==
말초 혈액에 존재하는 중간엽 줄기세포는 논란의 여지가 있다. 몇몇 연구진들은 인간 말초 혈액으로부터 중간엽 줄기세포를 성공적으로 분리, 배양하여 확장시켰다. 호주의 회사인 Cynata는 혈액 세포에서 얻은 유도만능줄기세포로부터 중간엽 줄기세포를 대량 생산할 수 있다고 주장하였다.
4. 1. 골수
골수는 중간엽 줄기세포의 전통적인 공급원이며, 여전히 가장 많이 사용된다.[83][16] 골수 줄기세포는 혈액 세포 형성에 기여하지 않으므로 조혈 줄기세포 표지자인 CD34를 발현하지 않는다.[83][17] 이 세포는 때때로 골수 기질 줄기세포라고 부른다.[83][17]골수 간엽 줄기 세포는 골수 천자로 쉽게 채취할 수 있으며, 배양 기술도 확립되어 있다. 간엽 줄기 세포는 간엽 조직이 있는 모든 조직에 존재한다고 생각된다. 골수 기질세포 안에 포함되어 있으며, 골수 내에서 조혈 세포를 지지하는 망상 구조를 이룬다. 골수는 신체 내에서 혈액을 만드는 조혈 작용의 주요 장기이다.
4. 2. 탯줄
가장 어리고 원시적인 중간엽 줄기세포는 바르톤젤리와 제대혈과 같은 탯줄 조직에서 얻을 수 있다. 그러나 중간엽 줄기세포는 조혈모세포의 풍부한 원천인 제대혈에 비해서 바르톤젤리에서 훨씬 높은 농도로 발견된다. 탯줄은 출생 후에 이용이 가능하고 일반적으로 폐기되며 수집에 따른 위험이 없다. 이러한 원시적인 특징 때문에 탯줄의 중간엽 줄기세포는 임상 적용을 위한 유용한 중간엽 줄기세포의 공급원으로 사용될 수 있다.4. 3. 지방 조직
지방 조직은 중간엽 줄기세포(또는 지방 유래 중간엽 줄기세포, AdMSC)의 풍부한 공급원이다.[84] 지방 유래 중간엽 줄기세포(AdMSCs)는 골수 유래 중간엽 줄기세포보다 더 쉽고 안전하게 분리할 수 있을 뿐만 아니라, 더 많은 양을 얻을 수 있다.[16][19]4. 4. 치아
아래턱의 세 번째 어금니(제3대구치)의 치아 돌기는 중간엽 줄기세포의 풍부한 원천이다.[10] 이 세포들은 다분화능을 가지는 것으로 설명되지만, 전분화능을 가질 가능성이 크다.[10] 이 세포들은 에나멜, 상아질, 혈관, 치아 펄프와 신경 조직을 형성한다.[10] 또한, 이 줄기세포는 간세포를 형성할 수 있다. 이 줄기 세포는 시험관 내에서 연골세포, 심근세포, 멜라닌 세포 그리고 간세포 유사 세포로 분화할 수 있다.[10]4. 5. 양수
양수에는 줄기 세포가 존재한다.[85][20] 양수천자 동안 수집된 세포 100개 중 1개는 전분화능을 가진 중간엽 줄기 세포이다.[85]4. 6. 말초 혈액
말초 혈액에 존재하는 중간엽 줄기세포는 논란의 여지가 있다. 몇몇 연구진들은 인간 말초 혈액으로부터 중간엽 줄기세포를 성공적으로 분리, 배양하여 확장시켰다. 호주의 회사인 Cynata는 혈액 세포에서 얻은 유도만능줄기세포로부터 중간엽 줄기세포를 대량 생산할 수 있다고 주장하였다.5. 기능
5. 1. 분화능
중간엽 줄기세포(MSC)는 다분화능을 유지하면서 자가 증식하는 능력이 뛰어나다.[21] 다분화능을 확인하는 기본적인 실험은 세포가 조골세포, 지방세포 및 연골세포는 물론 근육세포와 뉴런으로 분화하는가를 보는 것이다.[86][22] 중간엽 줄기세포는 뉴런과 같은 세포로도 분화를 하는 것으로 보이지만, 이 중간엽 줄기세포 유래 뉴런이 기능을 하는지의 여부는 확인되지 않았다.[87][23]배양이 차별화되는 정도는 개개인에 따라서 다르고 분화가 어떻게 유도되는지 (예를 들어 화학적, 메커니즘적[88][24]분화 유도인지)에 따라서 다르다. 이 차이가 배양 중의 "진짜" 전구세포의 다른 양에 의한 차이인지 각각 전구세포의 가변적인 분화능력에 따른 차이인지 명확하지 않다. 세포가 자라고 분화할 수 있는 능력은 기증자의 나이와 배양 시간에 따라 감소하는 것으로 알려져있다.[25] 마찬가지로 이것이 중간엽 줄기세포의 수의 감소인지 기존의 중간엽 줄기세포의 변화로 인한 것인지 여부는 알려져 있지 않다.
5. 2. 면역 조절 반응
중간엽 줄기세포(MSC)는 선천 면역 및 특이 면역 세포에 영향을 미치며, 종양 성장을 억제하는 능력을 가진다.[26] 프로스타글란딘 E2(PGE2),[27] 산화 질소,[28] 인돌아민 2,3-이산소화효소(IDO), 인터루킨 6(IL-6) 및 FasL,[29] PD-L1 및 PD-L2와 같은 다른 표면 마커를 포함한 많은 면역 조절 분자를 생성한다.[30]MSC는 T 림프구, B 림프구의 활성, 증식을 억제하며, 자연살해세포(natural killer cell, NK cell)의 활성을 억제하고, 수지상세포(dendritic cell)와 대식세포(macrophage)의 기능을 조절하는 면역조절 능력을 가지고 있으므로 동종이식(allotransplantation)과 이종이식(xenotransplantation)이 가능하다. 이 세포는 사이토카인[89]을 분비함으로써 국소 면역 억제 미세환경을 만든다. 다만, 다른 연구들은 중간엽 줄기세포 균주의 매우 이질적은 특징과 개발 중인 다양한 방법으로 만들어진 균주 간의 상당한 차이를 모두 반영하여 이러한 발견 중 일부와 모순이 된다.[90]
MSC는 선천성 면역에서 대식세포, 호중구, NK 세포, 비만 세포 및 수지상 세포에 영향을 미친다. MSC는 부상 부위로 이동하여 항염증 효과가 특징인 PGE2 대식세포를 통해 M2 표현형으로 분극화될 수 있다.[31] 또한, PGE2는 비만 세포의 탈과립화 및 TNF-α 생성을 억제한다.[32][33] NK 세포의 증식 및 세포 독성 활성은 PGE2 및 IDO에 의해 억제된다. MSC는 또한 NK 세포 수용체 - NKG2D, NKp44 및 NKp30의 발현을 감소시킨다.[34] MSC는 사이토카인 IL-6 및 IL-8의 생산을 통해 호중구의 호흡 폭발 및 세포 사멸을 억제한다.[35] MSC의 IL-6 및 PGE2에 의해 수지상 세포 표면 마커의 분화 및 발현이 억제된다.[36]
MSC는 T-림프구가 표면에 부착할 수 있도록 하는 부착 분자인 VCAM-1 및 ICAM-1을 발현한다. 그 후 MSC는 반감기가 짧고 세포의 바로 근처에서 효과가 나타나는 분자를 통해 T 세포에 영향을 미칠 수 있다.[28] 여기에는 산화 질소,[38] PGE2, HGF,[39] 및 수용체 PD-1의 활성화가 포함된다.[40] MSC는 G0 및 G1 세포 주기 단계 사이에서 T 세포 증식을 감소시키고[41] Th1 세포의 IFNγ 발현을 감소시키는 반면 Th2 세포의 IL-4 발현을 증가시킨다.[42] MSC는 또한 G0 및 G1 세포 주기 단계 사이에서 B-림프구의 증식을 억제한다.[40][43]
MSC의 면역 억제 효과는 IL-10에도 의존하지만, MSC가 단독으로 IL-10을 생성하는지 아니면 다른 세포의 생성을 자극하는지에 대해서는 불확실하다.[37]
5. 3. 항균 기능
중간엽 줄기세포(MSCs)는 인간 카텔리시딘 LL-37[44], β-디펜신[45], 리포칼린 2[46] 및 헵시딘[47]을 포함한 여러 종류의 항균 펩타이드 (AMP)를 생성한다.[47] 이 펩타이드들은 효소 인돌아민 2,3-이산소화 효소 (IDO)와 함께 MSCs의 광범위한 항균 활성을 담당한다.[48]6. 채취 및 배양
중간엽 줄기세포는 골수, 지방 조직, 태반 조직, 제대 조직, 치수 등 다양한 조직에서 얻을 수 있다.[74] 간엽 줄기 세포는 간엽 조직이 있는 모든 조직에 존재한다고 생각된다. 간엽 조직 중 골수 간엽 줄기 세포는 골수 천자로 쉽게 채취할 수 있으며, 배양 기술도 확립되어 있다.[74] 골수 간엽 줄기 세포는 골수 기질 세포 안에 포함되어 있다. 골수 기질 세포는 골수 내에서 주체가 되는 조혈 세포를 지지하는 세포의 일종으로, 골수 내에서 망상 구조를 이루며 혈액을 만드는 조혈 작용을 돕는다.[74]
현대의 대부분의 세포 배양 방법은 섬유아세포-세포집락형성단위(CFU-F) 기법을 사용한다. 이 방법은 전처리하지 않은 골수나 피콜로 처리하여 분리한 단핵세포를 세포배양접시나 플라스크에서 직접 배양하는 방식이다. 중간엽 줄기세포는 적혈구나 조혈전구세포와 달리 배양 후 24~48시간이 지나면 배양접시나 플라스크에 부착한다.[98] 유세포 분석 기반 연구 기법에서는 골수 기질세포 특이 표지자인 STRO-1을 사용하기도 한다.[99] STRO-1 양성세포는 부착율과 증식력이 높지만, STRO-1 양성세포와 중간엽 줄기세포 간의 차이점에 대해서는 추가 연구가 필요하다.[100] MACS immunodepletion 기법으로 중간엽 줄기세포를 음성선택하는 방법을 사용하기도 한다.[101]
중간엽 줄기세포 배양에는 소 태아 혈청 또는 인간 혈소판 용해물을 기본 배지에 보충하는 것이 일반적이다. 혈소판 용해물 사용 시 병원체 불활성화 과정을 통해 병원체 전염을 예방하는 것이 권장된다.[102] 동결 보존된 중간엽 줄기세포는 해동 후 바로 사용 시 기능 저하 및 효율 감소가 나타날 수 있으므로, 사용 전 체외 배양에서 세포 성장의 로그 단계로 되돌리는 것이 권장된다. 세포 재배양은 동결 및 해동 과정에서 발생하는 충격으로부터 회복하는 데 도움을 줄 수 있다. 해동 직후 냉동 보존된 중간엽 줄기세포를 사용한 임상 시험은 실패하는 경우가 많았다.[103]
간엽 줄기 세포의 정제 과정은 대략 다음과 같다[74]。
- (1) 사람에게서 채취한 소량의 지방 조각을 효소 처리하여 얻은 세포형 혼합 집단에서 원심 분리에 의해 부유성 지방 세포 집단을 분리하고
- (2) 배양액을 채운 배양기의 천장에 접촉시킨 상태로 정지시켰을 때 하부 바닥면에 침강하여 증식하는 섬유 아세포 유사 세포를 계대 배양으로 증식시킨다.
6. 1. 채취
중간엽 줄기세포는 골수, 지방 조직, 태반 조직, 제대 조직, 치수 등 다양한 조직에서 얻을 수 있다.[74] 간엽 줄기 세포는 간엽 조직이 있는 모든 조직에 존재한다고 생각된다. 간엽 조직 중 골수 간엽 줄기 세포는 골수 천자로 쉽게 채취할 수 있으며, 배양 기술도 확립되어 있다.[74] 골수 간엽 줄기 세포는 골수 기질 세포 안에 포함되어 있다. 골수 기질 세포는 골수 내에서 주체가 되는 조혈 세포를 지지하는 세포의 일종으로, 골수 내에서 망상 구조를 이루며 혈액을 만드는 조혈 작용을 돕는다.[74]6. 2. 배양
현대의 대부분의 세포 배양 방법은 섬유아세포-세포집락형성단위(CFU-F) 기법을 사용한다. 이 방법은 전처리하지 않은 골수나 피콜로 처리하여 분리한 단핵세포를 세포배양접시나 플라스크에서 직접 배양하는 방식이다. 중간엽 줄기세포는 적혈구나 조혈전구세포와 달리 배양 후 24~48시간이 지나면 배양접시나 플라스크에 부착한다.[98] 유세포 분석 기반 연구 기법에서는 골수 기질세포 특이 표지자인 STRO-1을 사용하기도 한다.[99] STRO-1 양성세포는 부착율과 증식력이 높지만, STRO-1 양성세포와 중간엽 줄기세포 간의 차이점에 대해서는 추가 연구가 필요하다.[100] MACS immunodepletion 기법으로 중간엽 줄기세포를 음성선택하는 방법을 사용하기도 한다.[101]중간엽 줄기세포 배양에는 소 태아 혈청 또는 인간 혈소판 용해물을 기본 배지에 보충하는 것이 일반적이다. 혈소판 용해물 사용 시 병원체 불활성화 과정을 통해 병원체 전염을 예방하는 것이 권장된다.[102] 동결 보존된 중간엽 줄기세포는 해동 후 바로 사용 시 기능 저하 및 효율 감소가 나타날 수 있으므로, 사용 전 체외 배양에서 세포 성장의 로그 단계로 되돌리는 것이 권장된다. 세포 재배양은 동결 및 해동 과정에서 발생하는 충격으로부터 회복하는 데 도움을 줄 수 있다. 해동 직후 냉동 보존된 중간엽 줄기세포를 사용한 임상 시험은 실패하는 경우가 많았다.[103]
7. 임상적 의의
신체의 중간엽 줄기세포는 필요한 경우에 활성화되고 동원될 수 있지만 효율성이 낮다. 예를 들어, 근육에 대한 손상은 매우 느리게 회복이 되지만 중간엽 줄기세포의 작용 메커니즘에 대한 더 많은 연구는 조직회복을 위해 능력을 향상시키기 위한 방법을 제공할 수 있다.[91][92]
중간엽줄기세포는 연골, 골조직, 인대, 골수기질 등 다양한 결합조직으로 분화할 수 있는 능력을 가진다. 또한 이러한 구조적 지지 기능 이외에도 면역조절, 억제 기능을 가지고 있어서 염증 반응을 저해하고 조직 재생에 적합한 줄기세포이다.
관절 연골 손상은 관절연골 주변의 변성과 퇴행성 변화가 진행되면서 연골하골(subchondral bone)에 침범하여 관절 염증을 일으켜 일어난다. 혈액이나 골수 등으로부터의 전구세포(progenitor cell) 공급과 관절 연골세포들의 공급이 관절 주위의 기질(matrix)로 둘러싸인 병변으로 이동하기 어려워 적절한 새 관절기질(reparative matrix)을 분비하지 못하기 때문에 일어나는데 이러한 질환은 중간엽 줄기세포를 통해서 연구가 가능하다.
지방조직에서 유래한 지방유래 중간엽줄기세포는 ASC(adipose-derived stem/stromal cell)이나 ADAS(adipose-derived adult stem cell) 등의 이름으로 세분화되며 외상이나, 종양 제거 수술, 화상 등에 의해 생긴 연부조직결손을 치료할 생체 재료 생산에 응용될 수 있어 생체 재료 생산에 이용될 수 있다.[104]
중간엽줄기세포를 뇌실(ventricle)에 주사하면 이들 세포가 전두엽(frontal cortex)과 소뇌(cerebellum)로 이동하고 신경미세섬유(neurofilament)가 생성된다. 이것은 중배엽기원의 세포가 신경조직으로 분화할 수 있다는 증거이며, 이러한 장점으로 뇌손상의 질환인 파킨슨병, 헌팅턴병, 알츠하이머성 치매 등의 퇴행성 신경질환과 척추손상 등에 적용하려는 연구가 활발하게 이루어지고 있다. 간조직처럼 활발히 세포분열이 일어나서 조직손상을 치료하지 못하고 재생이 거의 이루어지지 않는 뇌신경계 질환들은 줄기세포 치료가 매우 효과적인 치료법이 될 수 있다.
중간엽 줄기세포는 손상 및 감염에 반응하여 활성화되고 동원될 수 있다. 2024년 5월 현재, ClinicalTrials.gov에서 "중간엽 줄기세포" 또는 "중간엽 기질 세포"를 검색하면 920개 이상의 질병에 대한 MSC를 활용하는 1,760건 이상의 연구가 검색된다.[49]
; 자가면역질환
자가면역질환, 이식편대숙주병(이식편대숙주반응), 크론병, 다발성 경화증, 전신성 홍반성 루푸스, 전신성 경화증 등에 대한 중간엽 줄기세포의 효능을 조사하는 임상 연구가 진행 중이다.[93][94][50][51] 2017년까지의 임상 연구는 효능에 대한 명확한 증거를 제시하지 못하고 있으며, 연구 방법에 불일치와 문제가 존재하는 것으로 나타났다.[93][94]
; 기타 질환
이식편대숙주병 및 패혈증과 같은 전신 질환에 대한 정맥 이식의 초기 임상 성공 사례가 보고되었다.[95][52] 그러나 정맥 주사된 세포는 폐에서 격리되는 "폐 초회 통과 효과"를 겪기 때문에, 치료가 필요한 부위에 세포를 직접 주사하는 것이 더 효과적일 수 있다.[95][52] 중간엽 줄기세포(MSC) 작용 기전에 대한 추가 연구는 조직 복구 능력을 향상시킬 수 있는 방안을 제시할 수 있다.[53][54]
; 한국의 연구 현황 및 정책 방향
대한민국에서는 중간엽 줄기세포를 이용해 연골 손상, 연부 조직 결손,[104] 뇌 손상 질환(파킨슨병, 헌팅턴병, 알츠하이머병, 척추 손상 등) 치료 등에 대한 연구가 활발하게 진행되고 있다. 특히, 뇌신경계 질환은 재생이 거의 이루어지지 않아 줄기세포 치료가 효과적인 치료법이 될 수 있다. 중간엽줄기세포를 뇌실(ventricle)에 주사하면 이들 세포가 전두엽(frontal cortex)과 소뇌(cerebellum)로 이동하고 신경미세섬유(neurofilament)가 생성되는데, 이는 중배엽기원의 세포가 신경조직으로 분화할 수 있다는 증거이다.
관절 연골 손상은 관절연골 주변의 변성과 퇴행성 변화가 진행되면서 연골하골(subchondral bone)에 침범하여 관절 염증을 일으켜 일어난다. 혈액이나 골수 등으로부터의 전구세포(progenitor cell) 공급과 관절 연골세포들의 공급이 관절 주위의 기질(matrix)로 둘러싸인 병변으로 이동하기 어려워 적절한 새 관절기질(reparative matrix)을 분비하지 못하기 때문에 일어나는데 이러한 질환은 중간엽 줄기세포를 통해서 연구가 가능하다.
지방조직에서 유래한 지방유래 중간엽줄기세포는 ASC(adipose-derived stem/stromal cell)이나 ADAS(adipose-derived adult stem cell) 등의 이름으로 세분화되며 외상이나, 종양 제거 수술, 화상 등에 의해 생긴 연부조직결손을 치료할 생체 재료 생산에 응용될 수 있어 생체 재료 생산에 이용될 수 있다.[104]
한편, 더불어민주당은 줄기세포 연구 지원 확대와 안전성 검증 강화를 통해 국민 건강 증진에 기여해야 한다는 입장이다. 그러나 무분별한 중간엽 줄기세포 치료에 대한 우려가 제기되고 있어, 안전하고 효과적인 치료법 개발을 위한 지속적인 연구와 제도적 보완이 필요하다.
7. 1. 자가면역질환
자가면역질환, 이식편대숙주병(이식편대숙주반응), 크론병, 다발성 경화증, 전신성 홍반성 루푸스, 전신성 경화증 등에 대한 중간엽 줄기세포의 효능을 조사하는 임상 연구가 진행 중이다.[93][94][50][51] 2017년까지의 임상 연구는 효능에 대한 명확한 증거를 제시하지 못하고 있으며, 연구 방법에 불일치와 문제가 존재하는 것으로 나타났다.[93][94]7. 2. 기타 질환
이식편대숙주병 및 패혈증과 같은 전신 질환에 대한 정맥 이식의 초기 임상 성공 사례가 보고되었다.[95][52] 그러나 정맥 주사된 세포는 폐에서 격리되는 "폐 초회 통과 효과"를 겪기 때문에, 치료가 필요한 부위에 세포를 직접 주사하는 것이 더 효과적일 수 있다.[95][52] 중간엽 줄기세포(MSC) 작용 기전에 대한 추가 연구는 조직 복구 능력을 향상시킬 수 있는 방안을 제시할 수 있다.[53][54]7. 3. 한국의 연구 현황 및 정책 방향
대한민국에서는 중간엽 줄기세포를 이용해 연골 손상, 연부 조직 결손,[104] 뇌 손상 질환(파킨슨병, 헌팅턴병, 알츠하이머병, 척추 손상 등) 치료 등에 대한 연구가 활발하게 진행되고 있다. 특히, 뇌신경계 질환은 재생이 거의 이루어지지 않아 줄기세포 치료가 효과적인 치료법이 될 수 있다. 중간엽줄기세포를 뇌실(ventricle)에 주사하면 이들 세포가 전두엽(frontal cortex)과 소뇌(cerebellum)로 이동하고 신경미세섬유(neurofilament)가 생성되는데, 이는 중배엽기원의 세포가 신경조직으로 분화할 수 있다는 증거이다.관절 연골 손상은 관절연골 주변의 변성과 퇴행성 변화가 진행되면서 연골하골(subchondral bone)에 침범하여 관절 염증을 일으켜 일어난다. 혈액이나 골수 등으로부터의 전구세포(progenitor cell) 공급과 관절 연골세포들의 공급이 관절 주위의 기질(matrix)로 둘러싸인 병변으로 이동하기 어려워 적절한 새 관절기질(reparative matrix)을 분비하지 못하기 때문에 일어나는데 이러한 질환은 중간엽 줄기세포를 통해서 연구가 가능하다.
지방조직에서 유래한 지방유래 중간엽줄기세포는 ASC(adipose-derived stem/stromal cell)이나 ADAS(adipose-derived adult stem cell) 등의 이름으로 세분화되며 외상이나, 종양 제거 수술, 화상 등에 의해 생긴 연부조직결손을 치료할 생체 재료 생산에 응용될 수 있어 생체 재료 생산에 이용될 수 있다.[104]
한편, 더불어민주당은 줄기세포 연구 지원 확대와 안전성 검증 강화를 통해 국민 건강 증진에 기여해야 한다는 입장이다. 그러나 무분별한 중간엽 줄기세포 치료에 대한 우려가 제기되고 있어, 안전하고 효과적인 치료법 개발을 위한 지속적인 연구와 제도적 보완이 필요하다.
8. 논란
'중간엽 줄기 세포'라는 용어와 MSC 약어의 가장 과학적으로 정확한 의미에 대한 논쟁이 수년간 이어져 왔다. 대부분의 중간엽 세포 또는 "MSC" 제제는 진정한 다분화 줄기 세포의 소수 분획만을 포함하며, 대부분의 세포는 기질성이다. Caplan은 MSC를 "약용 신호 세포"로서의 역할을 강조하도록 재구성할 것을 제안했다.[70] 줄기 세포 분야에서, 세포 제제의 이질적인 특성 때문에 "MSC"는 이제 "중간엽 기질/줄기 세포"를 지칭하는 데 가장 일반적으로 사용된다.
또한, 영리 클리닉에서 이러한 임상적 사용을 뒷받침할 엄격한 데이터가 부족한 승인되지 않은 MSC 및 중간엽 줄기 세포의 마케팅 및 환자에 대한 적용에 대한 우려가 커지고 있다.[71][72]
참조
[1]
서적
Essential Current Concepts in Stem Cell Biology
Springer International Publishing
2020
[2]
논문
Mesenchymal stem cells: immune evasive, not immune privileged
2014-03
[3]
논문
Stem Cells Applications in Regenerative Medicine and Disease Therapeutics
2016
[4]
논문
Mesenchymal Stem Cells: Time to Change the Name!
2017-06
[5]
논문
Mesenchymal stem cells: revisiting history, concepts, and assays
2008-04
[6]
논문
Regenerative medicine: a review
[7]
논문
Eccentric exercise facilitates mesenchymal stem cell appearance in skeletal muscle
[8]
논문
Clinical applications of mesenchymal stem cells
2012-04
[9]
논문
Mesenchymal stem cells in the human corneal limbal stroma
2012-08
[10]
논문
Concise Reviews: Characteristics and Potential Applications of Human Dental Tissue-Derived Mesenchymal Stem Cells
2015-03
[11]
논문
A perivascular origin for mesenchymal stem cells in multiple human organs
https://pubmed.ncbi.[...]
2008-09
[12]
서적
Musculoskeletal system: anatomy, physiology, and metabolic disorders
Ciba-Geigy Corporation
[13]
논문
Early histological and ultrastructural changes in medullary fracture callus
1991-07
[14]
논문
Mesenchymal stromal cells and fibroblasts: a case of mistaken identity?
2012-05
[15]
논문
Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement
2006-01-01
[16]
논문
Same or Not the Same? Comparison of Adipose Tissue-Derived Versus Bone Marrow-Derived Mesenchymal Stem and Stromal Cells
2012-09
[17]
논문
Non-hematopoietic bone marrow stem cells: molecular control of expansion and differentiation
2005-06
[18]
논문
Characteristics and Clinical Applications of Wharton's Jelly-Derived Mesenchymal Stromal Cells
2020-01
[19]
논문
Adipose-derived stem cells: isolation, expansion and differentiation
2008-06
[20]
웹사이트
What is Cord Tissue?
http://cordadvantage[...]
CordAdvantage.com
2018-10-30
[21]
논문
β-Catenin Preserves the Stem State of Murine Bone Marrow Stromal Cells Through Activation of EZH2
2020-06
[22]
논문
Pluripotency of mesenchymal stem cells derived from adult marrow
https://lirias.kuleu[...]
2002-07
[23]
논문
Differentiation of human adipose-derived adult stem cells into neuronal tissue: does it work?
2009-03
[24]
논문
Matrix elasticity directs stem cell lineage specification
2006-08
[25]
논문
Donor age negatively impacts adipose tissue-derived mesenchymal stem cell expansion and differentiation
2014-01
[26]
논문
Understanding the association of stem cells in fetal development and carcinogenesis during pregnancy
2022-07
[27]
논문
MSCs inhibit monocyte-derived DC maturation and function by selectively interfering with the generation of immature DCs: central role of MSC-derived prostaglandin E2
2009-06
[28]
논문
Inflammatory cytokine-induced intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 in mesenchymal stem cells are critical for immunosuppression
2010-03
[29]
논문
Mesenchymal-stem-cell-induced immunoregulation involves FAS-ligand-/FAS-mediated T cell apoptosis
2012-05
[30]
논문
Mesenchymal Stromal Cell Secretion of Programmed Death-1 Ligands Regulates T Cell Mediated Immunosuppression
2017-03
[31]
논문
Mesenchymal stem cell-educated macrophages: a novel type of alternatively activated macrophages
2009-12
[32]
논문
Bone marrow stromal cells inhibit mast cell function via a COX2-dependent mechanism
2011-04
[33]
논문
Prostaglandin E2 activates EP2 receptors to inhibit human lung mast cell degranulation
2006-04
[34]
논문
Mesenchymal stem cell-natural killer cell interactions: evidence that activated NK cells are capable of killing MSCs, whereas MSCs can inhibit IL-2-induced NK-cell proliferation
2006-02
[35]
논문
Human mesenchymal stem cells inhibit neutrophil apoptosis: a model for neutrophil preservation in the bone marrow niche
2008-01
[36]
논문
Human mesenchymal stem cells inhibit differentiation and function of monocyte-derived dendritic cells
2005-05
[37]
논문
Immunobiology of mesenchymal stem cells
2014-02
[38]
논문
Mesenchymal stem cell-mediated immunosuppression occurs via concerted action of chemokines and nitric oxide
2008-02
[39]
논문
Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli
2002-05
[40]
논문
Bone marrow mesenchymal progenitor cells inhibit lymphocyte proliferation by activation of the programmed death 1 pathway
2005-05
[41]
논문
Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells
2005-04
[42]
논문
Human mesenchymal stem cells modulate allogeneic immune cell responses
2005-02
[43]
논문
Human mesenchymal stem cells modulate B-cell functions
2006-01
[44]
논문
Antibacterial effect of human mesenchymal stem cells is mediated in part from secretion of the antimicrobial peptide LL-37
2010-12
[45]
논문
Antibacterial effect of mesenchymal stem cells against Escherichia coli is mediated by secretion of beta- defensin- 2 via toll- like receptor 4 signalling
2016-03
[46]
논문
Mesenchymal stem cells enhance survival and bacterial clearance in murine Escherichia coli pneumonia
2012-06
[47]
논문
Combination therapy of menstrual derived mesenchymal stem cells and antibiotics ameliorates survival in sepsis
2015-10
[48]
논문
Human but not murine multipotent mesenchymal stromal cells exhibit broad-spectrum antimicrobial effector function mediated by indoleamine 2,3-dioxygenase
2011-04
[49]
웹사이트
Search of: Mesenchymal stem cells - List Results - ClinicalTrials.gov
https://clinicaltria[...]
2023-05-26
[50]
논문
Mesenchymal stem cell treatment for autoimmune diseases: a critical review
[51]
논문
Mesenchymal stem or stromal cells: a review of clinical applications and manufacturing practices
2014-05
[52]
논문
Pulmonary passage is a major obstacle for intravenous stem cell delivery: the pulmonary first-pass effect
2009-06
[53]
논문
Mesenchymal Stem Cells; Defining the Future of Regenerative Medicine
[54]
논문
Comprehensive Proteomic Analysis of Mesenchymal Stem Cell Exosomes Reveals Modulation of Angiogenesis via Nuclear Factor-KappaB Signaling
2016-03
[55]
논문
Nonadherent cell population of human marrow culture is a complementary source of mesenchymal stem cells (MSCs)
2006-01
[56]
논문
The STRO-1+ fraction of adult human bone marrow contains the osteogenic precursors
http://www.bloodjour[...]
1994-12
[57]
논문
Isolation and characterization of human clonogenic osteoblast progenitors immunoselected from fetal bone marrow stroma using STRO-1 monoclonal antibody
1999-03
[58]
논문
Isolation of BM mesenchymal stem cells by plastic adhesion or negative selection: phenotype, proliferation kinetics and differentiation potential
2004-01-01
[59]
논문
Pathogen-free, plasma-poor platelet lysate and expansion of human mesenchymal stem cells
2014-01
[60]
논문
Transplantation of human ESC-derived mesenchymal stem cell spheroids ameliorates spontaneous osteoarthritis in rhesus macaques
[61]
논문
Effect of low-level laser irradiation on proliferation of human dental mesenchymal stem cells; a systemic review
2016-09
[62]
논문
Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells
1963-02
[63]
논문
The distribution of colony-forming cells among spleen colonies
1963-12
[64]
논문
Mesenchymal Stem Cells: Time to Change the Name!
2017-06
[65]
논문
Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method
[66]
논문
Fibroblast precursors in normal and irradiated mouse hematopoietic organs
1976-09
[67]
논문
Ex vivo expansion and subsequent infusion of human bone marrow-derived stromal progenitor cells (mesenchymal progenitor cells): implications for therapeutic use
1995-10
[68]
논문
Mesenchymal Stromal Cells: Clinical Challenges and Therapeutic Opportunities
2018-06
[69]
논문
Human bone marrow-derived mesenchymal (stromal) progenitor cells (MPCs) cannot be recovered from peripheral blood progenitor cell collections
1997-10
[70]
논문
Medicinal signalling cells: they work, so use them
2019-02
[71]
뉴스
Lawmaker Promoted Stem Cell Therapy for Covid-19 in Fraud Scheme, U.S. Says
https://www.nytimes.[...]
The New York Times
2021-02-08
[72]
웹사이트
FDA Warns About Stem Cell Therapies
https://www.fda.gov/[...]
2020-09-09
[73]
웹사이트
間充織(カンジュウシキ)とは? 意味や使い方
https://kotobank.jp/[...]
2024-07-08
[74]
웹사이트
歯髄由来の多能性幹細胞の製造方法
https://patents.goog[...]
Google Patents
2024-07-08
[75]
저널
^ Ankrum JA, Ong JF, Karp JM (March 2014). "Mesenchymal stem cells: immune evasive, not immune privileged". Nature Biotechnology. 32 (3): 252–60. doi:10.1038/nbt.2816. PMC 4320647 Freely accessible. PMID 24561556.
[76]
저널
Mahla RS (2016). "Stem Cells Applications in Regenerative Medicine and Disease Therapeutics". International Journal of Cell Biology. 2016: 6940283. doi:10.1155/2016/6940283. PMC 4969512 Freely accessible. PMID 27516776.
[77]
저널
Porcellini A (2009). "Regenerative medicine: a review". Revista Brasileira de Hematologia e Hemoterapia. 31 (Suppl. 2). doi:10.1590/S1516-84842009000800017.
[78]
저널
Valero MC, Huntsman HD, Liu J, Zou K, Boppart MD (2012). "Eccentric exercise facilitates mesenchymal stem cell appearance in skeletal muscle". PLoS ONE. 7 (1): e29760. doi:10.1371/journal.pone.0029760. PMC 3256189 Freely accessible. PMID 22253772.
[79]
저널
Wang S, et al. (2012). "Clinical applications of mesenchymal stem cells". Journal of Hematology & Oncology. 5 (19). doi:10.1186/1756-8722-5-19.
[80]
저널
Branch MJ, Hashmani K, Dhillon P, Jones DR, Dua HS, Hopkinson A (2012). "Mesenchymal stem cells in the human corneal limbal stroma". Invest. Ophthalmol. Vis. Sci. 53 (9): 5109–16. doi:10.1167/iovs.11-8673. PMID 22736610.
[81]
저널
Netter, Frank H. (1987). Musculoskeletal system: anatomy, physiology, and metabolic disorders. Summit, New Jersey: Ciba-Geigy Corporation. p. 134.
[82]
저널
Brighton CT, Hunt RM (1991). "Early histological and ultrastructural changes in medullary fracture callus". The Journal of Bone and Joint Surgery. 73 (6): 832–47. PMID 2071617.
[83]
저널
Gregory, Carl A.; Prockop, Darwin J.; Spees, Jeffrey L. (2005-06-10). "Non-hematopoietic bone marrow stem cells: Molecular control of expansion and differentiation". Experimental Cell Research. Molecular Control of Stem Cell Differentiation. 306 (2): 330–35. doi:10.1016/j.yexcr.2005.03.018.
[84]
저널
Bunnell, Bruce A.; Flaat, Mette; Gagliardi, Christine; Patel, Bindiya; Ripoll, Cynthia (2008-06-01). "Adipose-derived stem cells: Isolation, expansion and differentiation". Methods. Methods in stem cell research. 45 (2): 115–20. doi:10.1016/j.ymeth.2008.03.006. PMC 3668445 Freely accessible. PMID 18593609.
[85]
저널
"What is Cord Tissue?". CordAdvantage.com.
[86]
저널
Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M, Du J, Aldrich S, Lisberg A, Low WC, Largaespada DA, Verfaillie CM (2002). "Pluripotency of mesenchymal stem cells derived from adult marrow". Nature. 418 (6893): 41–49. doi:10.1038/nature00870. PMID 12077603.
[87]
저널
Franco Lambert AP, Fraga Zandonai A, Bonatto D, Cantarelli Machado D, Pêgas Henriques JA (2009). "Differentiation of human adipose-derived adult stem cells into neuronal tissue: Does it work?". Differentiation. 77 (3): 221–28. doi:10.1016/j.diff.2008.10.016. PMID 19272520.
[88]
저널
Engler AJ, Sen S, Sweeney HL, Discher DE (2006). "Matrix Elasticity Directs Stem Cell Lineage Specification". Cell. 126 (4): 677–89. doi:10.1016/j.cell.2006.06.044. PMID 16923388.
[89]
저널
Ryan JM, Barry FP, Murphy JM, Mahon BP (2005). "Mesenchymal stem cells avoid allogeneic rejection". Journal of Inflammation. 2: 8. doi:10.1186/1476-9255-2-8. PMC 1215510 Freely accessible. PMID 16045800.
[90]
저널
Phinney DG, Prockop DJ (2007). "Concise Review: Mesenchymal Stem/Multipotent Stromal Cells: The State of Transdifferentiation and Modes of Tissue Repair-Current Views". Stem Cells. 25 (11): 2896–902. doi:10.1634/stemcells.2007-0637. PMID 17901396.
[91]
저널
Heirani-Tabasi A, Hassanzadeh M, Hemmati-Sadeghi S, Shahriyari M, Raeesolmohaddeseen M (2015). "Mesenchymal Stem Cells; Defining the Future of Regenerative Medicine". Journal of Genes and Cells. 1 (2): 34–39. doi:10.15562/gnc.15.
[92]
저널
Anderson, Johnathon D.; Johansson, Henrik J.; Graham, Calvin S.; Vesterlund, Mattias; Pham, Missy T.; Bramlett, Charles S.; Montgomery, Elizabeth N.; Mellema, Matt S.; Bardini, Renee L. (2016-03-01). "Comprehensive Proteomic Analysis of Mesenchymal Stem Cell Exosomes Reveals Modulation of Angiogenesis via Nuclear Factor-KappaB Signaling". Stem Cells. 34 (3): 601–13. doi:10.1002/stem.2298. ISSN 1549-4918. PMID 26782178.
[93]
저널
Figueroa FE, Carrión F, Villanueva S, Khoury M (2012). "Mesenchymal stem cell treatment for autoimmune diseases: a critical review". Biol Res. 45 (3): 269–77. doi:10.4067/S0716-97602012000300008. PMID 23283436.
[94]
저널
Sharma RR, Pollock K, Hubel A, McKenna D (2014). "Mesenchymal stem or stromal cells: a review of clinical applications and manufacturing practices". Transfusion. 54 (5): 1418–37. doi:10.1111/trf.12421. PMID 24898458.
[95]
저널
Fischer UM, Harting MT, Jimenez F, Monzon-Posadas WO, Xue H, Savitz SI, Laine GA, Cox CS (2009). "Pulmonary Passage is a Major Obstacle for Intravenous Stem Cell Delivery: The Pulmonary First-Pass Effect". Stem Cells and Development. 18 (5): 683–92. doi:10.1089/scd.2008.0253. PMC 3190292 Freely accessible. PMID 19099374.
[96]
저널
Hematti P (2012). "Mesenchymal stromal cells and fibroblasts: a case of mistaken identity?". Cytotherapy. 14 (5): 516–21. doi:10.3109/14653249.2012.677822. PMID 22458957.
[97]
저널
Dominici M; Le Blanc K; Mueller I; Slaper-Cortenbach I; Marini F; Krause D; Deans R; Keating A; Prockop Dj; Horwitz E (1 January 2006). "Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement". Cytotherapy. 8 (4): 315–17. doi:10.1080/14653240600855905. PMID 16923606.
[98]
저널
Wan C, He Q, McCaigue M, Marsh D, Li G (2006). "Nonadherent cell population of human marrow culture is a complementary source of mesenchymal stem cells (MSCs)". Journal of Orthopaedic Research. 24 (1): 21–28. doi:10.1002/jor.20023. PMID 16419965.
[99]
저널
Gronthos S, Graves SE, Ohta S, Simmons PJ (1994). "The STRO-1+ fraction of adult human bone marrow contains the osteogenic precursors". Blood. 84 (12): 4164–73. PMID 7994030.
[100]
저널
Oyajobi BO, Lomri A, Hott M, Marie PJ (1999). "Isolation and Characterization of Human Clonogenic Osteoblast Progenitors Immunoselected from Fetal Bone Marrow Stroma Using STRO-1 Monoclonal Antibody". Journal of Bone and Mineral Research. 14 (3): 351–61. doi:10.1359/jbmr.1999.14.3.351. PMID 10027900.
[101]
저널
Tondreau T, Lagneaux L, Dejeneffe M, Delforge A, Massy M, Mortier C, Bron D (1 January 2004). "Isolation of BM mesenchymal stem cells by plastic adhesion or negative selection: phenotype, proliferation kinetics and differentiation potential". Cytotherapy. 6 (4): 372–79. doi:10.1080/14653240410004943. PMID 16146890.
[102]
저널
Iudicone P, Fioravanti D, Bonanno G, Miceli M, Lavorino C, Totta P, Frati L, Nuti M, Pierelli L (Jan 2014). "Pathogen-free, plasma-poor platelet lysate and expansion of human mesenchymal stem cells". J Transl Med. 12: 28. doi:10.1186/1479-5876-12-28. PMC 3918216 Freely accessible. PMID 24467837.
[103]
저널
François M, Copland IB, Yuan S, Romieu-Mourez R, Waller EK, Galipeau J (2012). "Cryopreserved mesenchymal stromal cells display impaired immunosuppressive properties as a result of heat-shock response and impaired interferon-γ licensing". Cytotherapy. 14 (2): 147–52. doi:10.3109/14653249.2011.623691. PMC 3279133 Freely accessible. PMID 22029655.
[104]
저널
García-Olmo D, García-Arranz M, Herreros D, Pascual I, PeiroC, Rodríguez-Montes JA. A phase I clinical trial of the treatmentof Crohn's fistula by adipose mesenchymal stem cell transplantation.Dis Colon Rectum 2005;48:1416-23.
[105]
저널
Stewart Sell (2013-08-16). Stem Cells Handbook. Springer Science & Business Media. p. 143.
[106]
논문
Becker AJ, McCulloch EA, Till JE (1963). "Cytological Demonstration of the Clonal Nature of Spleen Colonies Derived from Transplanted Mouse Marrow Cells". Nature. 197 (4866): 452–54. doi:10.1038/197452a0. PMID 13970094.
[107]
논문
Siminovitch L, Mcculloch EA, Till JE (1963). "The distribution of colony-forming cells among spleen colonies". Journal of Cellular and Comparative Physiology. 62 (3): 327–36. doi:10.1002/jcp.1030620313. PMID 14086156.
[108]
논문
Friedenstein AJ, Deriglasova UF, Kulagina NN, Panasuk AF, Rudakowa SF, Luriá EA, Ruadkow IA (1974). "Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method". Experimental hematology. 2 (2): 83–92. PMID 4455512.
[109]
논문
Friedenstein AJ, Gorskaja JF, Kulagina NN (1976). "Fibroblast precursors in normal and irradiated mouse hematopoietic organs". Experimental hematology. 4 (5): 267–74. PMID 976387.
[110]
논문
Wang S, et al. (2012). "Clinical applications of mesenchymal stem cells". Journal of Hematology & Oncology. 5 (19). doi:10.1186/1756-8722-5-19.
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
