리간드 개폐 이온 통로
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
리간드 개폐 이온 통로는 특정 리간드(신경전달물질 등)의 결합에 의해 열리고 닫히는 막 단백질로, 이온의 이동을 조절하여 세포의 흥분성을 변화시킨다. 주요 유형으로는 시스테인 루프 수용체, 이온성 글루탐산 수용체, ATP 개폐 채널(P2X 수용체) 등이 있으며, 뇌, 신경계, 근육 등 다양한 조직에서 발견된다. 이러한 수용체는 마취제, 알츠하이머병 치료제, 항우울제 등 다양한 약물의 표적이 되며, 간접적으로 G 단백질 연결 수용체에 의해 조절되기도 한다.
더 읽어볼만한 페이지
- 막 단백질 - 나트륨-칼륨 펌프
나트륨-칼륨 펌프는 ATP 에너지를 사용하여 나트륨 이온과 칼륨 이온을 세포 내외로 능동 수송하는 막 단백질로, 세포의 휴지 전위 유지, 물질 수송, 세포 부피 조절 등 생리적 기능 수행 및 세포 활동 조절에 중요한 역할을 한다. - 막 단백질 - 짝풀림 단백질
짝풀림 단백질은 미토콘드리아 내막에서 양성자 흐름을 조절하여 ATP 합성 없이 열을 발생시키는 단백질로, 포유류에는 5가지 종류가 있으며, 체온 유지, 활성 산소 농도 조절, 뉴런 기능 등에 관여한다. - 분자신경과학 - 오렉신
오렉신은 시상하부에서 생성되는 신경 펩타이드로, 각성, 식욕 조절, 에너지 소비 등 다양한 생리적 기능에 관여하며, 오렉신-A와 오렉신-B 두 종류가 OX1, OX2 수용체에 결합하여 수면-각성 주기를 안정화하는 데 기여하고, 기능 장애 시 기면증과 같은 질환을 유발할 수 있으며, 약물 조절을 통해 불면증 치료 등에 활용될 수 있다. - 분자신경과학 - NMDA 수용체
NMDA 수용체는 글루탐산과 글리신에 의해 활성화되는 이온 채널형 수용체로서, 뇌의 시냅스 가소성과 흥분독성에 중요한 역할을 하며, 다양한 신경 질환과의 관련성이 밝혀져 치료 연구가 진행 중이다. - 이온 통로 - 니코틴성 아세틸콜린 수용체
니코틴성 아세틸콜린 수용체는 아세틸콜린에 의해 활성화되어 이온을 통과시키는 리간드 개폐 이온 채널 막단백질로, 척추동물에서 근육형과 신경형으로 나뉘어 신경 전달에 중요한 역할을 하며, 활성화는 뉴런 탈분극을 유발하고 니코틴 의존증과 같은 질병 위험과도 연관된다. - 이온 통로 - 고리형 뉴클레오타이드 개폐 이온 통로
고리형 뉴클레오타이드 개폐 이온 통로는 cAMP 또는 cGMP에 의해 활성화되는 이온 채널로, 다양한 생물학적 시스템에서 생체 신호 전달, 시각, 후각 등 다양한 생리적 기능을 수행하며, 구조는 4개의 단백질 소단위체로 구성된다.
2. Cys-루프 수용체
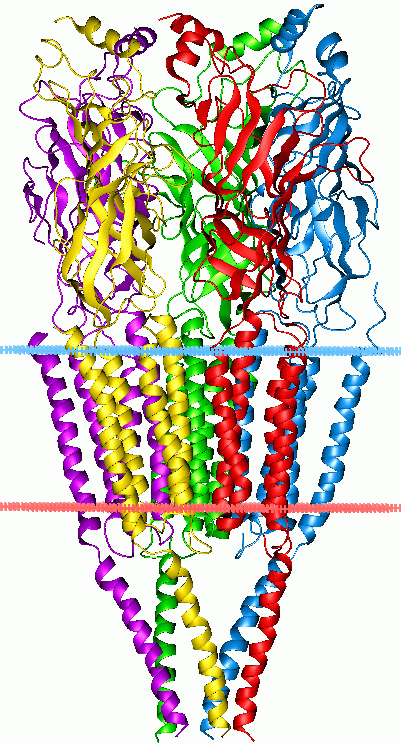
Cys-루프 수용체는 N-말단 세포 외 도메인에 있는 두 개의 시스테인 잔기 사이의 이황화 결합으로 형성되는 특징적인 루프 구조를 가진 리간드 개폐 이온 통로의 한 종류이다. 이들은 이황화 결합이 없는 더 큰 5량체 리간드 개폐 이온 채널 패밀리의 일부이며, "Pro-루프 수용체"라는 잠정적인 이름으로도 불린다.[4][5]
척추동물에서 Cys-루프 수용체의 세포 외 N-말단 리간드 결합 도메인은 아세틸콜린(AcCh), 세로토닌, 글리신, 글루탐산, γ-아미노부티르산(GABA)에 대한 수용체 특이성을 갖게 한다. 이 수용체들은 전도하는 이온의 유형(음이온 또는 양이온)에 따라, 그리고 내인성 리간드에 의해 정의된 패밀리로 더 세분화된다. Cys-루프 수용체는 일반적으로 5량체이며, 각 하위 단위는 막 횡단 도메인을 구성하는 4개의 막 횡단 알파 나선과 베타 시트 샌드위치형, 세포 외 N 말단, 리간드 결합 도메인을 포함한다.[6] 일부는 세포 내 도메인도 포함한다.
니코틴성 아세틸콜린 수용체는 대표적인 리간드 개폐 이온 통로이다. 아세틸콜린이 결합하면 수용체의 구조가 변경되어 이온이 통과할 수 있게 된다. 이 공극을 통해 Na+ 이온이 전기화학적 기울기를 따라 세포 안으로 흘러, 시냅스 후 막을 탈분극시켜 활동 전위를 유발한다.
화학 수용체로 작용하는 것으로 추정되는 박테리아 상동체가 확인되었으며, GLIC 수용체로 알려져 있다.[4]
2. 1. 구조
시스테인 루프 수용체는 N-말단 세포 외 도메인에 있는 두 개의 시스테인 잔기 사이의 이황화 결합에 의해 형성되는 특징적인 루프에서 이름이 유래되었다. 이들은 5개의 단백질 소단위체로 구성된 5량체 구조를 가지며, 각 소단위체는 막관통 도메인을 구성하는 4개의 막 횡단 알파 나선과 베타 시트 샌드위치형, 세포 외 N-말단, 리간드 결합 도메인을 포함한다.[6] 일부는 세포 내 도메인도 포함한다.Cys-루프 수용체는 잘 보존된 구조적 요소를 가지고 있으며, 알파 나선과 10개의 베타 가닥을 포함하는 큰 세포외 도메인(ECD)을 가지고 있다. ECD 다음에는 4개의 막횡단 세그먼트 (TMS)가 세포 내 및 세포 외 루프 구조에 의해 연결된다.[7] TMS 3-4 루프를 제외하고, 그 길이는 단 7-14개의 잔기이다. TMS 3-4 루프는 세포 내 도메인(ICD)의 가장 큰 부분을 형성하며, 이러한 모든 동족 수용체 사이에서 가장 가변적인 영역을 나타낸다. ICD는 이온 채널 구멍에 앞서 TMS 1-2 루프와 함께 TMS 3-4 루프에 의해 정의된다.[7]
결정화는 이 계열의 일부 구성원에 대한 구조를 밝혀냈지만, 결정화를 허용하기 위해 세포 내 루프는 일반적으로 원핵 시스-루프 수용체에 존재하는 짧은 링커로 대체되었으므로 그 구조는 알려져 있지 않다. 그럼에도 불구하고, 이 세포 내 루프는 탈감작, 약리학적 물질에 의한 채널 생리학의 조절 및 번역 후 변형에 관여하는 것으로 보인다. 수송에 중요한 모티프가 그 안에 있으며, ICD는 억제성 시냅스 형성을 가능하게 하는 스캐폴드 단백질과 상호 작용한다.[7]
2. 2. 양이온성 Cys-루프 수용체
시스테인 루프 수용체는 N 말단 세포 외 도메인에서 두 개의 시스테인 잔기 사이의 이황화 결합으로 형성되는 특징적인 루프의 이름을 따서 명명되었다.[4][5] 이들은 나트륨(Na⁺), 칼륨(K⁺), 칼슘(Ca²⁺)과 같은 양이온을 통과시키는 채널이다.세포 외 N-말단 리간드 결합 도메인의 결합 부위는 척추동물에서 (1) 아세틸콜린(AcCh), (2) 세로토닌, (3) 글리신, (4) 글루탐산, (5) γ-아미노부티르산(GABA)에 대한 수용체 특이성을 부여한다. 수용체는 전도하는 이온의 유형(음이온 또는 양이온)에 따라 세분되며, 내인성 리간드에 의해 정의된 패밀리로 더 세분된다. 그들은 일반적으로 5량체이며, 각 하위 단위는 막 횡단 도메인을 구성하는 4개의 막 횡단 알파 나선과 베타 시트 샌드위치형, 세포 외 N 말단, 리간드 결합 도메인을 포함한다.[6] 일부는 세포 내 도메인도 포함한다.
대표적인 리간드 개폐 이온 통로는 니코틴성 아세틸콜린 수용체이다. 이 수용체는 단백질 하위 단위의 5량체(일반적으로 ααβγδ)로 구성되며, 아세틸콜린에 대한 두 개의 결합 부위(각 알파 하위 단위의 인터페이스에 하나)가 있다. 아세틸콜린이 결합하면 수용체의 구조가 변경되고 공극의 수축이 약 3 옹스트롬에서 약 8 옹스트롬으로 넓어져 이온이 통과할 수 있다. 이 공극을 통해 Na+ 이온이 전기화학적 기울기를 따라 세포 안으로 흐를 수 있다. 충분한 수의 채널이 동시에 열리면, Na+ 이온에 의해 운반되는 양전하의 내부 흐름이 시냅스 후 막을 충분히 탈분극시켜 활동 전위를 시작한다.
화학 수용체로 작용한다고 추정되는 GLIC 수용체가 박테리아에서 확인되었다.[4]
양이온성 Cys-루프 수용체의 종류는 다음과 같다.
5량체 5-HT3 수용체는 나트륨(Na⁺) 이온, 칼륨(K⁺) 이온, 그리고 칼슘(Ca²⁺) 이온에 대한 투과성을 가지고 있다.
2. 3. 음이온성 Cys-루프 수용체
시스테인 루프 수용체는 N-말단 세포 외 영역에 두 개의 시스테인 잔기가 이황화 결합을 통해 형성하는 특징적인 루프 구조에서 이름이 유래되었다. 척추동물에서 이 수용체의 세포 외 N-말단 리간드 결합 부위는 (1) 아세틸콜린(AcCh), (2) 세로토닌, (3) 글리신, (4) 글루탐산, (5) γ-아미노부티르산(GABA)에 대한 수용체 특이성을 갖는다.[6]γ-아미노뷰티르산(GABA) 수용체는 동물의 대뇌 피질에 있는 주요 억제성 신경전달물질이다. GABAA 수용체는 리간드 개폐 이온 통로이며, 내인성 리간드인 GABA는 중추신경계의 주요 억제성 신경전달물질이다. GABAA 수용체는 활성화되면 신경세포로 Cl- 이온이 흐르도록 하여 신경세포를 과분극시킨다. 이 수용체는 신경계를 가진 모든 생물에 존재하며, 포유류의 신경계에 널리 분포하여 뇌 기능에 중요한 역할을 한다.[40]
다양한 리간드가 GABAA 수용체에 특이적으로 결합하여 Cl- 채널을 활성화하거나 억제할 수 있다. 대표적인 리간드는 다음과 같다.
- '''작용제''': GABA, 무시몰, Progabide|프로가비드영어, Gaboxadol|가복사돌영어
- '''길항제''': 비쿠쿨린, 가바진(gabazine)
- '''부분 작용제''': 피페리딘-4-술폰산
3. 이온성 글루탐산 수용체
이온성 글루탐산 수용체는 신경전달물질인 글루탐산에 결합하여 양이온을 통과시키는 리간드 개폐 이온 통로이다. 이들은 4개의 서브유닛으로 구성된 사량체(tetramer) 형태로 존재하며, 각 서브유닛은 세포 বাইরের 아미노 말단 도메인(ATD), 글루탐산이 결합하는 세포 বাইরের 리간드 결합 도메인(LBD), 그리고 이온 채널을 형성하는 막횡단 도메인(TMD)으로 구성된다.
각 서브유닛의 TMD는 3개의 막횡단 나선(helix)과 1개의 반쪽 막 나선(half-membrane helix)을 포함한다. 단백질 구조는 N-말단에서 ATD로 시작하여 LBD의 첫 번째 절반, TMD의 나선 1, 2, 3, 다시 LBD의 나머지 절반, 그리고 C-말단에서 TMD의 나선 4로 이어진다. 즉, TMD와 세포외 도메인 사이에는 3개의 연결 고리가 존재한다.
사량체의 각 서브유닛은 조개껍데기 모양의 두 LBD 섹션으로 형성된 글루탐산 결합 부위를 갖는다. 이온 채널이 열리려면 사량체의 4개 결합 부위 중 2곳에 글루탐산이 결합해야 한다. 기공(pore)은 칼륨 채널과 유사하게 반쪽 나선 2에 의해 주로 형성된다.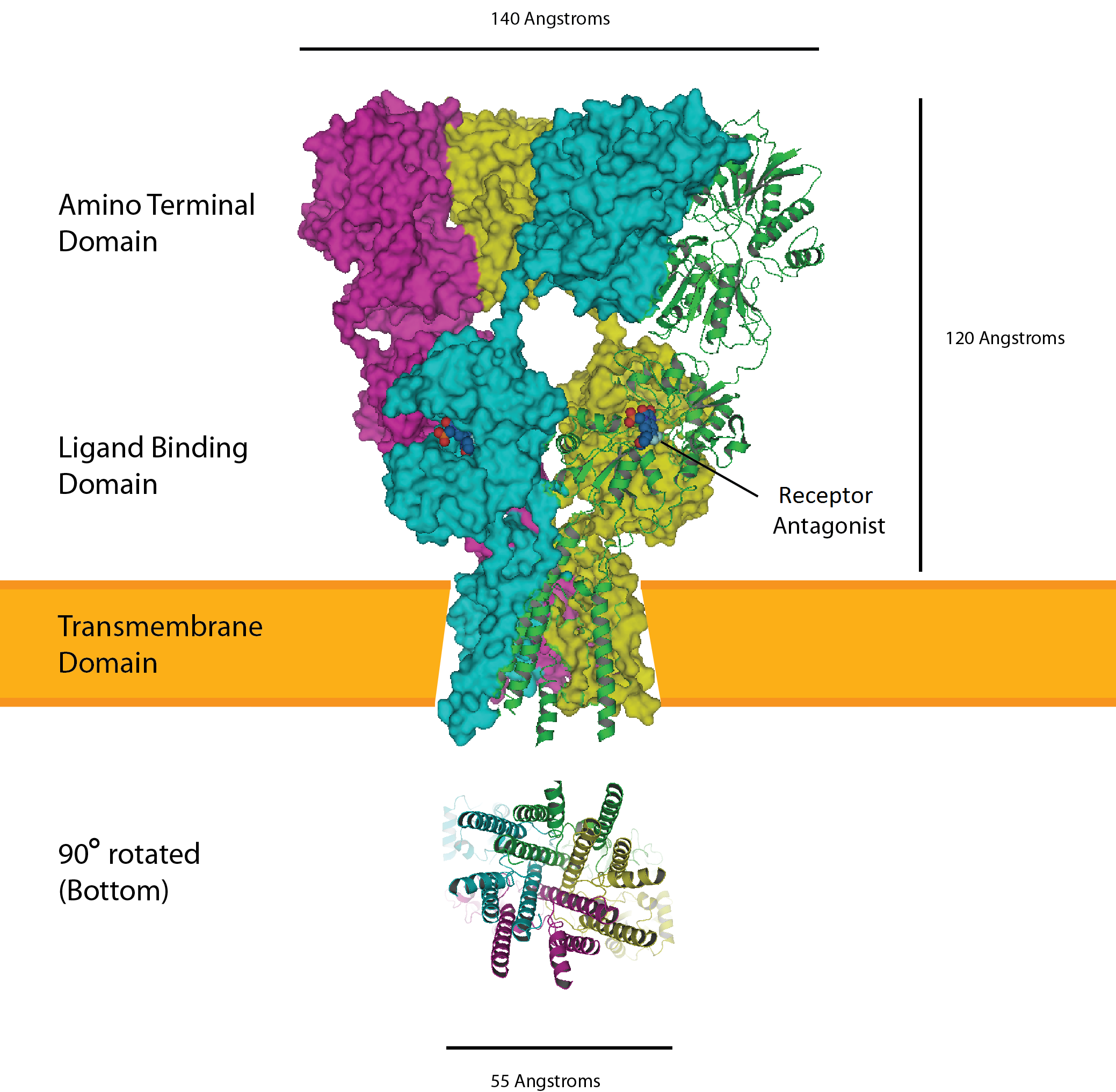
이온성 글루탐산 수용체는 AMPA 수용체, 카인산 수용체, NMDA 수용체 등으로 분류할 수 있다.
3. 1. AMPA 수용체
'''AMPA 수용체''' ('''α-아미노-3-히드록시-5-메틸-4-이소옥사졸프로피온산 수용체''', '''퀴스쿠알산 수용체''')는 글루탐산에 대한 비-NMDA형 이온성 막 수용체로, 중추신경계에서 빠른 시냅스 전달을 매개한다.AMPA 수용체는 인공 글루탐산 유사체 AMPA에 의해 활성화될 수 있어 이러한 이름이 붙었다. 처음에는 자연 발생 작용제 퀴스쿠알산을 따 "퀴스쿠알산 수용체"로 명명되었으나, 이후 덴마크 왕립 약학대학의 Tage Honore와 동료들이 개발한 선택적 작용제에 따라 "AMPA 수용체"라는 이름이 붙었다.[10] AMPA 수용체는 뇌의 여러 부분에서 발견되며, 신경계에서 가장 흔하게 발견되는 수용체이다. GluA2(GluR2) 사량체는 최초로 단백질 결정화된 글루탐산 수용체 이온 채널이었다.
3. 1. 1. 리간드
- 작용제: 글루탐산, AMPA, 5-플루오로윌라르디인, 도모산, 퀴스쿠알산 등.[10]
- 길항제: CNQX, 키누렌산, NBQX, 페람파넬, 피라세탐 등.[10]
- 양성 알로스테릭 조절제: 아니라세탐, 사이클로티아지드, CX-516, CX-614 등.[10]
- 음성 알로스테릭 조절제: 에탄올, 페람파넬, 탈람파넬, GYKI-52,466 등.[10]
3. 2. NMDA 수용체

N-메틸-D-아스파르트산 수용체(NMDA 수용체)는 이온성 글루탐산 수용체의 일종으로, 글루타메이트와 공동 작용제(D-세린 또는 글리신)가 동시에 결합해야 개폐되는 리간드 개폐 이온 통로이다.[11] NMDA 수용체는 시냅스 가소성과 기억 형성에 중요한 역할을 한다.[12][13]
N-메틸-D-아스파르트산(NMDA)은 이 수용체에 선택적으로 작용하는 리간드이기 때문에 "NMDA 수용체"라는 이름이 붙었다. NMDA 수용체가 두 개의 공동 작용제와 결합하여 활성화되면 양이온 통로가 열리고 Na+와 Ca2+가 세포 안으로 들어와 세포의 막 전위가 증가한다. 이러한 이유로 NMDA 수용체는 흥분성 수용체이다. 안정 전위 상태에서는 Mg2+ 또는 Zn2+가 수용체의 세포 외 결합 부위에 결합하여 NMDA 수용체 통로를 통한 이온 흐름을 차단한다. 그러나 뉴런이 탈분극되면, 예를 들어 인접한 시냅스 후 AMPA 수용체가 강하게 활성화되면, Mg2+에 의한 전압 의존적 차단이 부분적으로 완화되어 활성화된 NMDA 수용체를 통해 이온이 유입될 수 있게 된다. 그 결과로 유입된 Ca2+는 다양한 세포 내 신호 전달 연쇄 반응을 일으켜, 궁극적으로 다양한 키나제와 포스파타제의 활성화를 통해 뉴런의 기능을 변화시킬 수 있다.[14]
3. 2. 1. 리간드
N-메틸-D-아스파르트산 수용체(NMDA 수용체) 활성화에 관여하는 주요 내인성 공동 작용제는 글루타메이트, D-세린, 글리신이다.[11]다른 작용제는 아미노시클로프로판카르복실산, D-사이클로세린, L-아스파르트산, 퀴놀린산 등이 있다. 부분 작용제는 N-메틸-D-아스파르트산(NMDA), NRX-1074, 3,5-디브로모-L-페닐알라닌[15] 등이 있다.
수용체 길항제는 케타민, PCP, 덱스트로프로폭시펜, 케토베미돈, 트라마돌, 퀴누레닌산(내인성) 등이 있다.[11]
4. ATP 개폐 채널
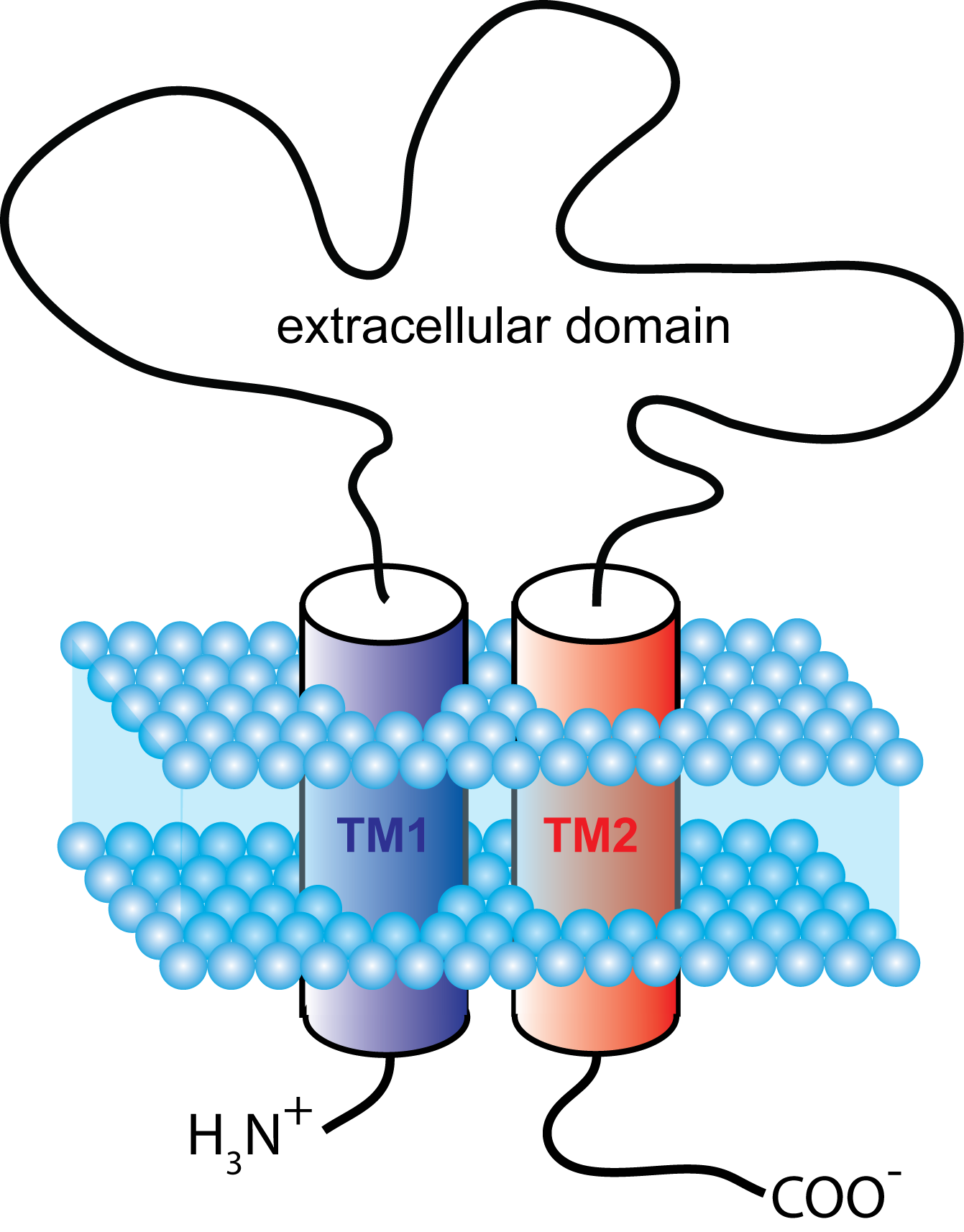
ATP-개폐 채널은 뉴클레오타이드의 일종인 ATP가 결합하면 열리는 리간드 개폐 이온 통로이다. 이들은 서브유닛당 두 개의 막 횡단 나선을 가지며, 세포 내 쪽에 C 말단과 N 말단을 모두 가진 삼량체(3개의 소단위체로 구성)를 형성한다.
5. 임상적 중요성
리간드 개폐 이온 통로는 다양한 신경 및 정신 질환과 관련이 있으며, 많은 약물의 표적이 된다. 이러한 수용체에서 작용할 수 있는 기전과 화학적, 생물학적, 물리적 구성 요소를 이해하고 탐구함으로써, 더 많은 임상 적용이 예비 실험이나 FDA에 의해 입증되고 있다.
NMDA 수용체는 시냅스 가소성과 기억 조절에 관여하는 것으로 알려져 있다.[12][13]
5. 1. 관련 질환
메만틴은 NMDA 수용체 길항제로, 중등도에서 중증의 알츠하이머병 치료에 사용된다.[19] 이 약물은 FDA와 EMA의 승인을 받았으며,[19] 영국의 국립 보건 및 임상 진료 연구원에서는 다른 치료 옵션에 실패한 환자에게 제한적으로 권고하고 있다.[20]아고멜라틴은 멜라토닌-세로토닌 이중 경로에 작용하는 항우울제의 일종으로, 임상 시험에서 불안 우울증 치료에 효과가 있는 것으로 나타났다.[21][22] 또한, 비정형 우울증 및 멜랑콜리형 우울증 치료에도 효과가 있다는 연구 결과가 있다.[23]
이 외에도 리간드 개폐 이온 통로는 간질, 파킨슨병, 조현병, 불안 장애 등 다양한 질환과 관련이 있을 가능성이 제기되고 있으며, 활발히 연구가 진행되고 있다.
5. 2. 마취제 및 에탄올의 작용 기전
마취제와 에탄올은 GABAA 수용체 및 NMDA 수용체 등 리간드 개폐 이온 통로에 작용하여 효과를 나타낼 수 있다.[16][17] 특히, GABAA 및 NMDA 수용체는 임상 마취에 사용되는 농도와 유사한 농도의 마취제에 의해 영향을 받는다.[18]GABAA 수용체는 리간드 개폐 이온 통로이다. 이 수용체의 내인성 리간드인 GABA (γ-아미노부티르산)는 중추 신경계의 주요 억제성 신경 전달 물질이다. 활성화되면 신경 세포로의 Cl-의 흐름을 매개하여 신경 세포를 과분극화시킨다. GABAA 수용체는 신경계를 가진 모든 생물에 존재한다.
NMDA 수용체는 이온성 글루탐산 수용체의 일종으로, 글루타메이트와 공동 작용제(D-세린 또는 글리신)의 동시 결합에 의해 개폐되는 리간드 개폐 이온 통로이다.
6. 간접 조절
리간드 개폐 이온 통로와는 대조적으로, 수용체와 이온 통로가 하나의 분자가 아닌, 세포막 내에서 서로 다른 단백질로 존재하는 수용체계도 있다. 이 경우, 이온 통로는 직접 열리고 닫히는 것이 아니라, 수용체의 활성화에 의해 간접적으로 조절된다. 이러한 간접 조절의 대표적인 예는 G 단백질 연결 수용체 (GPCR)를 통한 조절이다. GPCR은 세포 외부의 신호를 감지하여 세포 내부의 신호 전달 경로를 활성화하는 막 단백질로, 이온 채널을 직접 조절하지 않고 간접적으로 영향을 준다.
6. 1. G 단백질 연결 수용체
G 단백질 연결 수용체(GPCR)는 7회 막관통 수용체, 7TM 수용체라고도 불리며, 세포 외부의 신호를 감지하여 세포 내부의 신호 전달 경로를 활성화하는 막 단백질이다. 이 수용체는 세포막을 7번 통과하는 구조를 가지고 있다. G 단백질 연결 수용체는 수백 개의 구성원을 가진 거대한 단백질 군(패밀리)을 형성하며, 이온 채널 연결 수용체 (GABAB 수용체, NMDA 수용체 등)는 이 군의 일부에 불과하다.[44]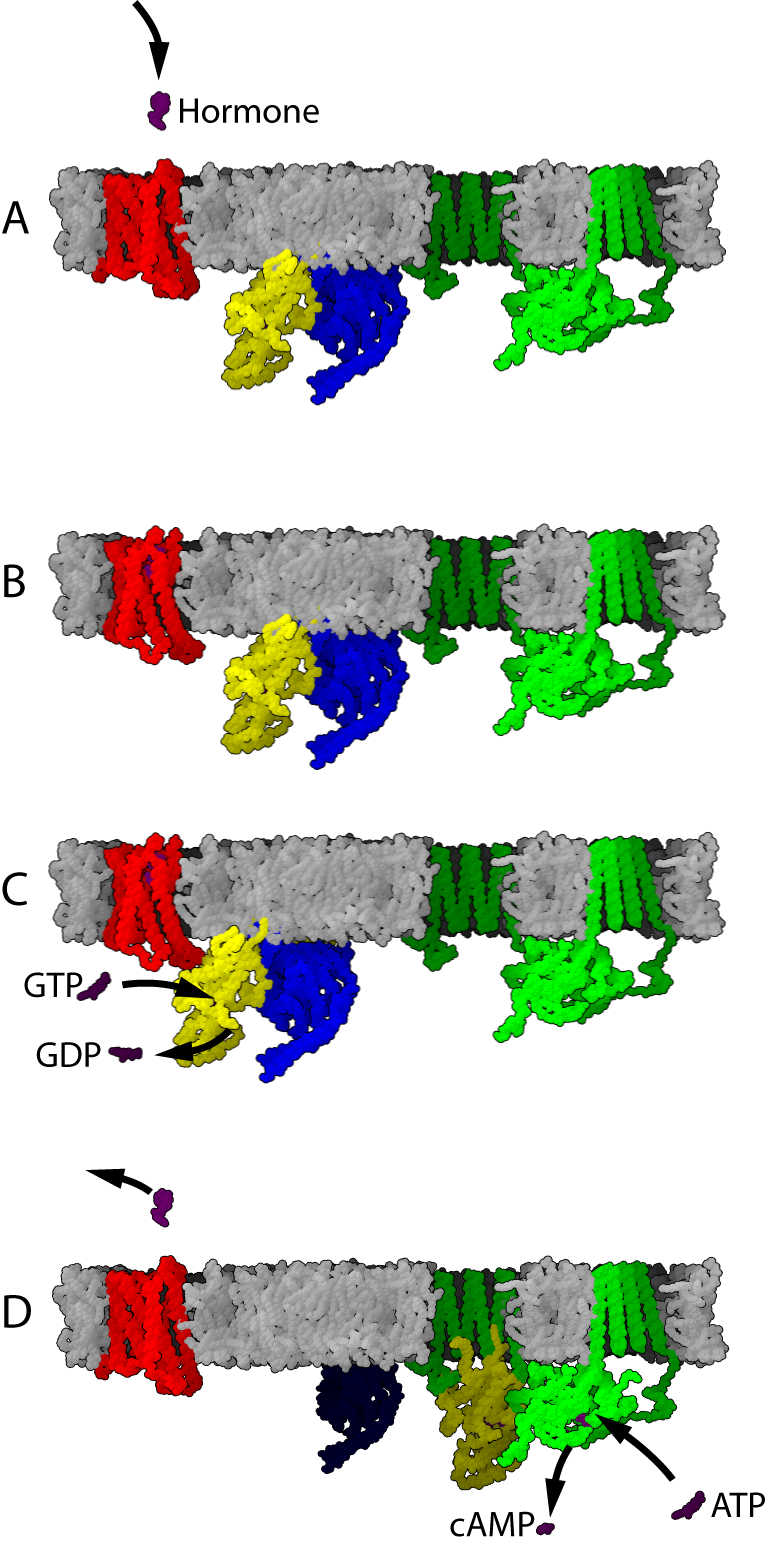
G 단백질 연결 수용체는 리간드 개폐 이온 통로와 달리, 수용체와 이온 통로가 별개의 단백질로 존재한다. 이온 통로는 수용체의 활성화에 의해 간접적으로 조절된다.
세포 내 신호 전달은 주로 삼량체 G 단백질을 통해 이루어진다. 주요 G 단백질 패밀리와 그 기능은 다음과 같다.
환상 아데노신 일인산(cAMP)을 생성하는 효소인 아데닐산 시클라제는 Gαs 경로와 Gαi/o 경로의 효과기(effector)이다. 포유류에는 10가지 종류의 아데닐산 시클라제 유전자 산물이 있으며, 이들은 조직 분포나 기능에서 약간의 차이를 보인다. 이들은 모두 세포 기질의 아데노신 삼인산(ATP)을 cAMP로 전환하는 반응을 촉매하며, Gαs 클래스의 G 단백질에 의해 직접적으로 자극받는다. 반대로, Gαi/o 형태의 Gα 소단위체와 상호작용하면 아데닐산 시클라제에 의한 cAMP 생성이 억제된다. 이처럼 Gαs에 결합된 G 단백질 연결 수용체는 Gαi/o에 결합된 G 단백질 연결 수용체의 작용을 상쇄하며, 그 반대도 마찬가지다. 세포 기질의 cAMP 농도는 다양한 이온 채널의 활성뿐만 아니라 세린/트레오닌 특이적 단백질 키나아제 A(PKA) 패밀리의 구성원을 결정한다. 결과적으로 cAMP는 2차 전달자(second messenger)로, PKA는 2차 효과기(effector)로 간주된다.
Gαq/11 경로의 효과기는 포스포리파아제 C-β(PLCβ)이며, 이는 막 결합형 포스파티딜이노시톨 4,5-이중인산(PIP2)를 2차 전달자인 이노시톨 삼인산(IP3)와 다이아실글리세롤(DAG)로 분해하는 반응을 촉매한다. IP3는 소포체(ER) 막에 있는 IP3 수용체에 작용하여 소포체로부터 Ca2+ 방출을 유도한다. DAG는 원형질막을 따라 확산되어 단백질 키나아제 C(PKC)라고 불리는 두 번째 세린/트레오닌 키나아제의 세포막 국소화를 활성화한다. PKC의 많은 동형체(isoform)는 세포 내 Ca2+ 증가에 의해서도 활성화되기 때문에, 이 두 경로는 서로 수렴하여 동일한 2차 효과기를 통해 신호를 전달할 수 있다. 세포 내 Ca2+ 상승은 칼모듈린이라는 단백질에도 결합하여 알로스테릭하게 활성화되지만, 이 단백질은 Ca2+/칼모듈린 의존성 키나아제(CAMK) 등의 효소와 결합하여 알로스테릭하게 활성화한다.
Gα12/13 경로의 효과기는 3개의 RhoGEF 도메인(p115-RhoGEF, PDZ-RhoGEF, LARG)이며, Gα12/13에 결합하면 세포질의 저분자량 GTP아제, Rho를 알로스테릭하게 활성화한다. Rho는 일단 GTP에 결합하면 Rho 키나아제(ROCK) 등 세포 골격 조절과 관련된 다양한 단백질을 활성화할 수 있다. Gα12/13에 결합하는 대부분의 G 단백질 연결 수용체는 다른 소그룹(subclass), 많은 경우 Gαq/11에도 결합한다.
6. 1. 1. GABAB 수용체
GABAB 수용체는 γ-아미노낙산의 대사형 막관통 수용체이다. 이들은 G 단백질을 통해 K+ 채널과 결합하여 활성화되면 세포 내 전위를 낮춰 과분극 효과를 발휘한다.[45]'''리간드:'''
- 작용제: GABA, 바클로펜, γ-히드록시낙산, 페니부트 등.
- 양성 알로스테릭 조절제: CGP-7930|CGP-7930영어[46], Fendiline|펜딜린영어, BSPP 등.
- 길항제: 2-OH-사클로펜, Saclofen|사클로펜영어, SCH-50911|SCH-50911영어
6. 1. 2. G 단백질 신호 전달
G 단백질의 α 소단위체(Gα)는 아데닐산 고리화효소(AC) 또는 포스포리파아제 C(PLC)와 같은 효소를 조절하여 2차 신호전달물질(cAMP, IP3, DAG)을 생성한다.[1] G 단백질의 βγ 소단위체(Gβγ)는 G 단백질 조절 내향성 정류 K⁺ 채널(GIRK) 등을 조절한다.[1]구체적으로, Gαs 경로는 아데닐산 시클라제를 활성화시켜 아데노신 삼인산(ATP)을 환상 아데노신 일인산(cAMP)으로 전환시킨다.[1] 반대로, Gαi/o 경로는 아데닐산 시클라제를 억제하여 cAMP 생성을 억제한다.[1] Gαq/11 경로는 포스포리파아제 C-β(PLCβ)를 활성화시켜 포스파티딜이노시톨 4,5-이중인산(PIP2)를 이노시톨 삼인산(IP3)와 다이아실글리세롤(DAG)로 분해한다.[1] IP3는 소포체(ER)에서 Ca2+ 방출을 유발하고, DAG는 단백질 키나아제 C(PKC)를 활성화시킨다.[1] Gα12/13 경로는 RhoGEF domain|로GEF 도메인영어을 통해 저분자량 GTP아제인 Rho를 활성화시켜 세포 골격 조절에 관여한다.[1]
Gβγ는 G 단백질 조절 내향성 정류 K+ 채널 (GIRKs), P/Q- 및 N형 전압 개폐 Ca2+ 채널, 그리고 AC 및 PLC, 포스파티딜이노시톨 3 키나아제 (PI3K)의 여러 아이소폼과 같은 다양한 이온 채널을 조절한다.[1]
참조
[1]
웹사이트
Gene Family: Ligand gated ion channels
https://web.archive.[...]
HUGO Gene Nomenclature Committee
2018-03-23
[2]
DorlandsDict
ligand-gated channel
[3]
서적
Neuroscience. 4th ed.
Sinauer Associates
[4]
논문
Identification of the prokaryotic ligand-gated ion channels and their implications for the mechanisms and origins of animal Cys-loop ion channels
[5]
논문
Evolution of Pentameric Ligand-Gated Ion Channels: Pro-Loop Receptors
[6]
논문
Structure and function of the glycine receptor and related nicotinicoid receptors
2004-05
[7]
논문
The Intracellular Loop of the Glycine Receptor: It's not all about the Size
2016-01-01
[8]
논문
A nomenclature for ligand-gated ion channels
2009-01
[9]
논문
International Union of Pharmacology. LXX. Subtypes of gamma-aminobutyric acid(A) receptors: classification on the basis of subunit composition, pharmacology, and function. Update
2008-09
[10]
논문
The binding of [3H]AMPA, a structural analogue of glutamic acid, to rat brain membranes
1982-01
[11]
서적
Molecular Neuropharmacology: A Foundation for Clinical Neuroscience
McGraw-Hill Medical
[12]
논문
Memory and the NMDA receptors
2009-07
[13]
논문
Maintenance of superior learning and memory function in NR2B transgenic mice during ageing
2007-03
[14]
논문
The glutamate receptor ion channels
1999-03
[15]
논문
Differential modulation of glutamatergic transmission by 3,5-dibromo-L-phenylalanine
2005-05
[16]
논문
General anaesthetic actions on ligand-gated ion channels
1999-08
[17]
논문
The effects of general anaesthetics on ligand-gated ion channels
2002-07
[18]
논문
Actions of anesthetics on ligand-gated ion channels: role of receptor subunit composition
http://www.fasebj.or[...]
1995-11
[19]
논문
Alzheimer disease: progress or profit?
2006-07
[20]
간행물
Azheimer's disease - donepezil, galantamine, rivastigmine and memantine (review): final appraisal determination
http://www.nice.org.[...]
NICE technology appraisal
2011-01-18
[21]
논문
1643 – Efficacy of agomelatine in more anxious elderly depressed patients. A randomized, double-blind study vs placebo
[22]
서적
Goodman and Gilman's The Pharmacological Basis of Therapeutics
McGraw-Hill Professional
[23]
논문
2639 – The effectiveness of agomelatine (valdoxan) in the treatment of atypical depression
[24]
웹사이트
Gene Family: Ligand gated ion channels
https://www.genename[...]
HUGO Gene Nomenclature Committee
2020-08-02
[25]
DorlandsDict
ligand-gated channel
[26]
서적
Neuroscience. 4th ed.
Sinauer Associates
[27]
논문
Identification of the prokaryotic ligand-gated ion channels and their implications for the mechanisms and origins of animal Cys-loop ion channels
[28]
논문
Evolution of Pentameric Ligand-Gated Ion Channels: Pro-Loop Receptors
[29]
논문
Structure and function of the glycine receptor and related nicotinicoid receptors
2004-05
[30]
논문
Identification of the prokaryotic ligand-gated ion channels and their implications for the mechanisms and origins of animal Cys-loop ion channels
[31]
논문
The Intracellular Loop of the Glycine Receptor: It's not all about the Size
2016-01-01
[32]
논문
A nomenclature for ligand-gated ion channels
2009-01
[33]
논문
International Union of Pharmacology. LXX. Subtypes of gamma-aminobutyric acid(A) receptors: classification on the basis of subunit composition, pharmacology, and function. Update
2008-09
[34]
논문
The binding of [3H]AMPA, a structural analogue of glutamic acid, to rat brain membranes
1982-01
[35]
서적
Molecular Neuropharmacology: A Foundation for Clinical Neuroscience
McGraw-Hill Medical
[36]
논문
Memory and the NMDA receptors
2009-07
[37]
논문
Maintenance of superior learning and memory function in NR2B transgenic mice during ageing
2007-03
[38]
논문
The glutamate receptor ion channels
1999-03
[39]
논문
Differential modulation of glutamatergic transmission by 3,5-dibromo-L-phenylalanine
2005-05
[40]
논문
GABA receptors in brain development, function, and injury
2015-04
[41]
논문
Structural basis of PIP2 activation of the classical inward rectifier K+ channel Kir2.2
2011-08
[42]
논문
Lipid agonism: The PIP2 paradigm of ligand-gated ion channels
2015-05
[43]
논문
TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action
2016-06
[44]
서적
Molecular cell biology
Macmillan
2008
[45]
논문
Role of GABAB receptors in GABA and baclofen-induced inhibition of adult rat cerebellar interpositus nucleus neurons in vitro
2005-10
[46]
논문
Positive allosteric modulation of native and recombinant gamma-aminobutyric acid(B) receptors by 2,6-Di-tert-butyl-4-(3-hydroxy-2,2-dimethyl-propyl)-phenol (CGP7930) and its aldehyde analog CGP13501
2001-11
[47]
논문
General anaesthetic actions on ligand-gated ion channels
1999-08
[48]
논문
The effects of general anaesthetics on ligand-gated ion channels
2002-07
[49]
논문
Alzheimer disease: progress or profit?
2006-07
[50]
간행물
Azheimer's disease - donepezil, galantamine, rivastigmine and memantine (review): final appraisal determination
http://www.nice.org.[...]
NICE technology appraisal
2011-01-18
[51]
논문
1643 – Efficacy of agomelatine in more anxious elderly depressed patients. A randomized, double-blind study vs placebo
2013
[52]
서적
Goodman and Gilman's The Pharmacological Basis of Therapeutics
McGraw-Hill Professional
2010
[53]
논문
2639 – The effectiveness of agomelatine (valdoxan) in the treatment of atypical depression
2013
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

