바이러스 복제
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
바이러스 복제는 바이러스가 숙주 세포의 자원을 이용하여 자신을 증식하는 과정을 의미한다. 이 과정은 흡착, 침투, 유전체 방출, 전사 및 mRNA 생성, 바이러스 구성체 형성, 바이리온 조립, 방출의 7단계로 이루어진다. 바이러스는 유전체의 종류에 따라 7가지 그룹으로 분류되며, 각 그룹은 고유한 복제 전략을 가진다. 바이러스는 숙주 세포의 유전자와 섞여 변이가 빠르며, 이러한 변이는 면역 회피와 대유행을 일으킬 수 있다.
더 읽어볼만한 페이지
- 바이러스 - 종양바이러스
종양바이러스는 숙주에게 암을 유발할 수 있으며, 암유전자 삽입이나 원종양유전자 활성 증가를 통해 종양을 발생시키고, 인간 유두종 바이러스, B형 간염 바이러스 등이 대표적이며, 백신 개발 및 예방 노력이 이루어지고 있다. - 바이러스 - 바이러스 분류
바이러스 분류는 바이러스의 정의, 분류 체계, 그리고 아바이러스 인자를 포함하여, 국제 바이러스 분류 위원회(ICTV)의 계층적 분류와 볼티모어 분류를 통해 바이러스를 다양한 기준으로 구분한다. - 바이러스학 - 코로나19 백신
코로나19 백신은 코로나19 감염을 예방하기 위해 개발되었으며, 다양한 기술 플랫폼을 기반으로 전 세계적으로 사용되었으나, 백신 접근성 불평등, 허위 정보, 법적 책임 문제 등 논란과 변이 바이러스 출현으로 인한 효과 감소, 부작용 등의 문제도 존재한다. - 바이러스학 - 백신
백신은 약화된 병원체나 일부를 활용하여 인체의 면역계를 활성화, 특정 질병에 대한 항체 생성을 유도하는 의약품으로 감염병 예방에 효과적이지만, 부작용 발생 가능성과 효과의 다양성, 백신 거부와 오해로 인한 접종률 저하 및 감염병 확산의 위험이 존재하며, 지속적인 연구개발을 통해 안전성과 효능이 향상되고 새로운 기술을 이용한 백신들이 개발되고 있다. - 유전자 발현 - RNA 간섭
RNA 간섭은 이중가닥 RNA에 의해 유전자 발현이 억제되는 과정으로, 다이서 효소에 의해 생성된 작은 간섭 RNA가 RNA 유도 침묵 복합체와 결합하여 표적 mRNA를 분해하거나 번역을 억제하며, 바이러스 방어, 발생 조절, 유전체 안정성 유지 등 다양한 기능과 응용 분야를 가진다. - 유전자 발현 - 유전자 재조합
유전자 재조합은 유성 생식 생물의 염색체 유전자 교차를 통한 유전자 재배열 현상으로, 유전적 변이를 증가시키고 유전학적 지도 작성에 활용되며, 생명공학 등 다양한 분야에서 기술로 이용된다.
2. 바이러스 복제 과정
바이러스는 숙주 세포의 에너지와 대사활동을 가로 채 자신의 복제에 이용하기 때문에 살아있는 세포 안에서만 복제될 수 있다.[25]
바이러스 복제는 다음의 과정을 거친다.[26];
# 흡착: 바이러스가 숙주 세포의 표면에 달라 붙는다.
# 침입: 바이러스가 숙주 세포 안으로 들어간다.
# 유전체 방출: 숙주 세포 안에 바이러스의 유전체가 방출된다.
# 전사와 mRNA 생성: 방출된 바이러스의 유전체는 숙주 세포 안에서 원래 작동되고 있던 유전자 발현 과정에 끼어들어 자신의 유전체가 전사되도록 한다.
# 바이러스 구성체 형성: 숙주의 리보솜과 골지체를 통해 바이러스 구성체가 형성된다.
# 바이리온: 숙주의 유전자 발현을 이용해 만든 구성체들이 조합되어 새로운 바이러스가 된다. 단독 입자 형태를 갖춘 바이러스는 바이리온(바이러스 입자/virion영어)이라고 부른다.
# 방출: 바이러스의 복제 과정은 숙주 세포가 갖고 있는 에너지와 자원을 이용하여 진행되고 이렇게 만들어진 새롭게 복제된 바이러스는 숙주 세포 밖으로 방출된다. 이 과정에서 숙주 세포는 파괴된다.
바이러스는 살아있는 세포 내에서만 증식한다. 숙주 세포는 바이러스 단백질과 핵산 합성에 필요한 에너지와 합성 기구, 그리고 저분자량 전구체를 제공해야 한다.[2]
바이러스 복제는 7단계로 이루어진다.
# 부착
# 침투
# 탈피
# 복제
# 조립
# 성숙
# 방출 (방출 단계).
바이러스는 살아있는 세포 내에서만 증식한다. 숙주 세포는 바이러스의 단백질과 핵산 합성에 필요한 에너지 및 합성 기구, 그리고 저분자량 전구체를 제공해야 한다.[22]
바이러스 복제는 다음 7단계로 진행된다.
# 부착
# 침입
# 탈피
# 전사/mRNA 생성
# 바이러스 성분 합성
# 비리온 집합
# 방출 (방출 단계)
2. 1. 흡착
바이러스 복제의 첫 번째 단계이다.[26] 바이러스는 숙주 세포의 세포막에 부착한다.[3] 숙주 세포에의 부착은 종종 바이러스의 단백질 껍질(캡시드)에서 뻗어 나오는 바이러스 부착 단백질에 의해 이루어진다. 이 단백질은 숙주 세포의 원형질막(또는 막 탄수화물)의 표면 수용체에 결합하는 역할을 한다.[3] 바이러스는 숙주 세포 수용체에 결합하는 분자를 모방하여 부착이 일어나도록 정상적인 세포 수용체 기능을 이용할 수 있다. 예를 들어, 라이노바이러스는 바이러스 부착 단백질을 사용하여 다른 숙주 세포 간의 부착을 용이하게 하기 위해 일반적으로 사용되는 숙주 세포의 수용체 ICAM-1에 결합한다.[3]2. 2. 침투
바이러스는 숙주 세포의 세포질 막을 통과하여 세포 안으로 침투한다.[3] 바이러스가 숙주 세포에 진입하는 가장 일반적인 방법은 수용체 매개 세포내이입으로, 바이러스는 에너지 비용을 소모하지 않지만 숙주 세포는 에너지를 소비한다. 수용체 매개 세포내이입은 바이러스가 세포막의 수용체에 결합할 때 발생하며, 이 결합으로 인해 일련의 화학적 신호가 발생하여 세포가 부착된 바이러스를 세포질 막으로 감싸 세포 내부에 바이러스를 포함하는 소포를 형성한다.[3]바이러스는 세포내이입 및 비세포내이입 경로 등 다양한 메커니즘을 사용하여 숙주 세포에 진입한다.[4] 또한 세포질 막에서 융합되거나 세포-세포 융합을 통해 숙주 내에서 확산될 수 있다.[5] 바이러스는 진입을 돕기 위해 세포 수용체 또는 부착 인자로 알려진 숙주 세포 표면의 단백질에 부착된다.[6] 바이러스는 바이러스 진입 시 숙주 세포의 이온 채널을 활용하기도 한다.[6]
- 융합: 외부 바이러스 단백질은 바이러스 입자가 세포질 막과 융합하도록 촉진한다.[7] 이는 숙주 막에 구멍을 형성하고, 진입 후 바이러스 입자의 외피가 벗겨지며, 유전 물질이 세포질로 전달된다.[8]
- 세포 간 융합: 일부 바이러스는 감염된 세포 표면에서 특정 단백질 발현을 유도하여 감염되지 않은 세포를 유인한다.[9] 이러한 상호 작용은 감염되지 않은 세포가 낮은 pH 수준에서 감염된 세포와 융합하여 합포체로 알려진 다핵 세포를 형성하게 한다.[10]
- 세포내이입 경로: 세포 외 및 막 결합 성분, 즉 바이러스를 둘러싸는 막 함입에 의해 세포 내 소포가 형성되는 과정이다.[11]
- 비세포내이입 경로: 세포 외 바이러스 외피와 숙주 세포의 막 융합에 의해 바이러스 입자가 세포로 방출되는 과정이다.[4]
숙주 세포의 세포막은 바이러스 입자에 함입되어 이를 음세포 작용액포(pinocytotic vacuole영어)으로 둘러싼다. 이는 HIV 바이러스의 경우처럼 항체로부터 세포를 보호한다.
2. 3. 유전체 방출
바이러스는 숙주 세포의 에너지와 대사활동을 가로 채 자신의 복제에 이용하기 때문에 살아있는 세포 안에서만 복제될 수 있다.[25] 바이러스 복제 과정에서 유전체 방출은 세 번째 단계로, 바이러스 입자의 단백질 "껍질" 제거와 유전 물질의 방출로 정의된다.[26]세포 효소(리소좀에서)는 바이러스의 단백질 외피를 벗겨내어 바이러스의 핵산 또는 게놈이 방출되거나 접근 가능하게 한다. 이 단계는 바이러스 전사가 일어나는 동일한 영역에서 발생하며, 바이러스마다 탈피 메커니즘이 다르다.
일부 RNA 바이러스는 숙주 세포의 엔도솜에서 낮은 pH를 사용하여 탈피 메커니즘을 활성화한다. 많은 DNA 바이러스는 숙주 세포의 핵으로 이동하여 핵공을 통해 유전 물질을 방출한다.
2. 4. 전사 및 mRNA 생성
바이러스는 숙주 세포의 에너지와 대사활동을 가로 채 자신의 복제에 이용하기 때문에 살아있는 세포 안에서만 복제될 수 있다.[25] 바이러스 복제 과정에서 방출된 바이러스 유전체는 숙주 세포 안에서 원래 작동되고 있던 유전자 발현 과정에 끼어들어 자신의 유전체가 전사되도록 한다.[26]바이러스가 어떻게 복제를 거치는지는 바이러스가 가진 유전 물질의 종류에 따라 달라진다. 이중 가닥 DNA(dsDNA)를 포함하는 바이러스는 숙주 세포 핵 내의 복제 효소를 사용하여 바이러스 게놈을 복제할 수 있다. 많은 RNA 바이러스는 일반적으로 세포질에서 복제되며, RNA가 복제 형태가 되면 숙주 세포의 리보솜에 직접 접근하여 바이러스 단백질을 생산할 수 있다.
일부 RNA 바이러스에서는 감염된 RNA가 메신저 RNA (mRNA)를 생성한다. 이것은 게놈의 단백질 생성물로의 번역이다. 마이너스 가닥 RNA와 DNA를 가진 다른 바이러스에서는, 바이러스는 전사 후에 번역에 의해 생성된다. mRNA는 바이러스 성분을 만들도록 숙주 세포에 지시하기 위해 사용된다. 바이러스는 기존의 세포 구조를 이용하여 자기 복제를 수행한다.
용원성 생명 주기에서 바이러스 게놈은 숙주 게놈에 통합된다. 숙주 게놈은 정상적인 생명 주기를 거치면서 자신의 게놈과 함께 바이러스 게놈을 복제하고 분열한다.[13] 바이러스 게놈은 화학적, 환경적 자극을 통해 바이러스 생산을 시작하도록 유발될 수 있다.[14] 일단 용원성 바이러스가 용균성 생명 주기에 들어가면 바이러스 생산 경로를 계속 진행하여 전사/mRNA 생산을 진행한다. (예: 입술 포진, 단순 헤르페스 바이러스(HSV)-1, 용원성 박테리오파지 등)
2. 5. 바이러스 구성체 형성
바이러스 구성체 형성은 숙주의 리보솜과 골지체를 통해 이루어진다.[26] 숙주의 기존 세포 소기관을 이용하여 바이러스는 다음 성분들을 제조한다.[2]- 바이러스 단백질(viral proteins): 바이러스 mRNA는 세포 내 리보솜에서 구조 단백질과 비구조 단백질 두 종류로 번역된다. 구조 단백질은 바이러스 입자를 구성하고, 비구조 단백질은 바이러스 입자에는 존재하지 않으며 주로 바이러스 게놈 복제를 위한 효소로 작용한다.
- 바이러스 핵산(게놈 복제): 새로운 바이러스 게놈이 합성된다. 템플릿은 부모 게놈 또는, 단일 가닥 게놈의 경우 새로 형성된 상보 가닥 중 하나이다. 이러한 게놈은, 특히 급속하게 분열하는 세포에서는 바이러스 폴리머레이스 또는 (일부 DNA 바이러스에서는) 세포 효소 중 하나에 의해 만들어진다.
새로 제조된 바이러스 단백질과 유전체가 모여 미성숙 바이러스를 형성하는 과정을 조립이라고 한다. 조립은 형질막, 세포질, 핵, 골지체 등 숙주 세포 내의 다양한 위치에서 발생할 수 있다. 일부 바이러스는 캡시드가 완성된 후에야 게놈을 캡시드에 삽입하는 반면, 다른 바이러스는 게놈이 복제되는 동안 캡시드가 게놈을 감싼다.[2]
2. 6. 바이리온 조립
바이러스는 숙주 세포의 에너지와 대사활동을 가로 채 자신의 복제에 이용하기 때문에 살아있는 세포 안에서만 복제될 수 있다.[25]바이러스 복제는 다음의 과정을 거친다.[26]
# 흡착: 바이러스가 숙주 세포의 표면에 달라 붙는다.
# 침입: 바이러스가 숙주 세포 안으로 들어간다.
# 유전체 방출: 숙주 세포 안에 바이러스의 유전체가 방출된다.
# 전사와 mRNA 생성: 방출된 바이러스의 유전체는 숙주 세포 안에서 원래 작동되고 있던 유전자 발현 과정에 끼어들어 자신의 유전체가 전사되도록 한다.
# 바이러스 구성체 형성: 숙주의 리보솜과 골지체를 통해 바이러스 구성체가 형성된다.
# 바이리온: 숙주의 유전자 발현을 이용해 만든 구성체들이 조합되어 새로운 바이러스가 된다. 단독 입자 형태를 갖춘 바이러스는 바이리온(바이러스 입자/virion영어)이라고 부른다.
# 방출: 바이러스의 복제 과정은 숙주 세포가 갖고 있는 에너지와 자원을 이용하여 진행되고 이렇게 만들어진 새롭게 복제된 바이러스는 숙주 세포 밖으로 방출된다. 이 과정에서 숙주 세포는 파괴된다.
조립은 새로 제조된 바이러스 단백질과 유전체가 모여 미성숙 바이러스를 형성하는 과정이다. 다른 단계와 마찬가지로 특정 바이러스가 어떻게 조립되는지는 해당 바이러스의 유형에 따라 달라진다. 조립은 형질막, 세포질, 핵, 골지체 및 숙주 세포 내의 다른 위치에서 발생할 수 있다. 일부 바이러스는 캡시드가 완성된 후에야 게놈을 캡시드에 삽입하는 반면, 다른 바이러스는 게놈이 복제되는 동안 캡시드가 게놈을 감싼다.[2] 바이러스가 온전한 형태를 갖추기 위한 마지막 단계로, 이 단계는 일반적으로 효소(숙주 또는 바이러스가 암호화함)에 의해 제공되는 캡시드 변형을 포함한다.[3]
비리온(바이러스 입자/virion영어)은 활성화되거나 손상되지 않은 바이러스 입자를 말한다. 이 단계에서 새로 합성된 게놈(핵산)과 단백질이 결합하여 새로운 바이러스 입자가 형성된다. 이는 세포의 핵, 세포질, 또는 거의 발육이 완료된 바이러스의 세포막에서 이루어진다.
2. 7. 방출
바이러스 복제의 마지막 단계는 방출 단계로, 새롭게 조립된 성숙한 바이러스가 숙주 세포를 떠나는 단계이다.[3] 바이러스는 숙주 세포의 에너지와 대사활동을 가로 채 자신의 복제에 이용하기 때문에 살아있는 세포 안에서만 복제될 수 있다.[25] 바이러스 복제 과정에서 만들어진 새롭게 복제된 바이러스는 숙주 세포 밖으로 방출되며, 이 과정에서 숙주 세포는 파괴된다.[26]바이러스가 숙주 세포로부터 어떻게 방출되는지는 바이러스의 종류에 따라 다르다. 흔한 방출 방식 중 하나는 출아인데, 이는 숙주의 외피에서 원형질막을 형성하는 바이러스가 캡시드를 둘러싸면서 원형질막을 구부릴 때 발생한다. 바이러스가 원형질막을 구부리면서 캡시드 전체를 감싸기 시작하여 바이러스가 더 이상 숙주 세포에 부착되지 않게 된다. 또 다른 흔한 바이러스 방출 방식은 세포 용해를 통하는 것인데, 이때 바이러스는 세포를 용해시켜 파열시키고, 이로 인해 숙주 세포 내에 있던 성숙한 바이러스가 방출된다.[3] 여기까지 성숙한 바이러스는 세포가 갑자기 파열되거나, 또는 외피 바이러스가 세포막을 통해 서서히 밀려 나오는(짜내는) 방식으로 방출된다.
새로운 바이러스는 다른 세포에 침투하거나 공격하거나, 세포 내에서 휴면 상태로 남을 수도 있다. 세균 바이러스의 경우, 자손 비리온의 방출은 감염된 세균의 용해에 의해 일어난다. 하지만 동물 바이러스의 경우, 방출은 보통 세포 용해를 동반하지 않고 일어난다.
3. 바이러스 분류 및 복제 전략
바이러스는 유전체의 종류에 따라 7 종류로 구분되며 이들 각각의 종류들은 저마다 독특한 복제 전략을 가지고 있다. 노벨상 수상자인 데이비드 볼티모어는 바이러스를 구분하는 바이러스 분류 방법인 볼티모어 분류법을 개발하였다. 이 방식은 바이러스를 유전체의 종류에 따라 구별한 것으로 로마 숫자를 이용하여 I, II, III, IV, V, VI, VII로 바이러스의 종류를 구분한다.[27] 이렇게 묶인 바이러스 종류는 다른 생물의 계통 분류 개념을 도입하면 과에 해당한다. 볼티모어 분류법은 과 단계에서만 유효하고 그 아래 단계인 속에 대한 분류는 다른 기준이 필요하다.[28]
- I: dsDNA 바이러스(겹가닥 DNA 바이러스) - 아데노바이러스, 헤르페스바이러스, 마마바이러스 등
- II: ssDNA 바이러스(외가닥 DNA 바이러스) - 파르보바이러스 등
- III: dsRNA 바이러스(겹가닥 RNA 바이러스) - 레오바이러스 등
- IV: (+)ssRNA 바이러스(양성-극성 외가닥 RNA 바이러스) - 피코르나바이러스, 토가바이러스 등
- V: (−)ssRNA 바이러스(음성-극성 외가닥 RNA 바이러스) - 오르토믹소바이러스, 라브도바이러스 등
- VI: ssRNA-RT 바이러스(외가닥 RNA-RT 바이러스) - 레트로바이러스 등
- VII: dsDNA-RT 바이러스(겹가닥 DNA-RT 바이러스) - 헤파드나바이러스 등
종류에 따른 복제 방식은 아래와 같다.
바이러스는 유전 물질의 종류와 mRNA 생산 방법에 따라 7개의 그룹으로 나뉘며, 각 그룹은 고유한 바이러스 계열을 가지고 있으며, 이 계열은 자체적으로 서로 다른 복제 전략을 가지고 있다. 노벨상 수상 생물학자 데이비드 볼티모어는 고유한 복제 전략에 따라 다양한 바이러스를 분류하기 위해 볼티모어 분류법이라는 시스템을 고안했다. 이 시스템을 기반으로 7가지의 서로 다른 복제 전략(볼티모어 I, II, III, IV, V, VI, VII 그룹)이 있다. 7가지 바이러스 그룹은 여기에 간략하게 일반적인 내용으로 나열되어 있다.
바이러스는 7가지 유형의 유전자로 분류되며, 각 유전자에는 바이러스 과(family)가 있으며, 서로 다른 복제 전략을 가지고 있다. 노벨상을 수상한 생물학자 데이비드 볼티모어(David Baltimore)는 볼티모어 분류(Baltimore 분류)라고 불리는 시스템을 고안하여 고유한 복제 전략에 따라 다양한 바이러스를 분류했다. 이 시스템을 기반으로 7가지의 서로 다른 복제 전략이 있다 (볼티모어 I, II, III, IV, V, VI, VII). 다음은 7가지 클래스의 바이러스를 간단하고 일반적으로 나타낸 것이다.[23]
3. 1. DNA 바이러스
DNA 바이러스의 대부분은 숙주 세포의 세포핵으로 침투하여 숙주의 세포 활동을 자신의 복제를 위해 이용한다. 볼티모어 분류법에서 I과 II가 DNA 바이러스에 속한다.- I: 겹가닥 DNA 바이러스
이 종류의 바이러스는 복제를 위해 반드시 숙주 세포의 세포핵에 침입해야 한다. 이 가운데 몇몇은 복제 과정에 숙주 세포의 DNA 중합효소가 필요하다. 한편, 아데노바이러스와 같은 것은 스스로를 복제할 인자가 바이러스 자체에 포함되어 있기도 하다. 그러 이 경우에도 바이러스 복제는 숙주 세포의 세포 주기에 따른 활동에 의존하고 있다. 이 종류의 바이러스는 숙주의 세포 분열 과정에 끼어들어 마치 암과 같이 숙주 세포를 악성 전환시킨다. 그 결과 숙주 세포는 분열 대신 바이러스 복제에 에너지와 자원을 사용하게 된다.
이 종류에 속하지만 세포핵 안에서 복제하지 않는 것으로는 척추동물을 감염시키는 폭스바이러스 한 종류만이 알려져 있다.[29]
- II: 외가닥 DNA 바이러스
외가닥 DNA 바이러스의 성질에 대해서는 아직 밝혀지지 않은 부분이 많지만 척추동물이 흔히 감염되는 바이러스 가운데 하나이다. 두 종류의 바이러스 복제 방식이 연구되어 있으며 모두 숙주 세포의 세포핵 내에서 복제된다. 이 종류에 속하는 토크 테노 바이러스는 거의 모든 사람의 몸 전체에서 발견되지만 특별히 증상을 일으키지는 않는다.
이 유형의 바이러스는 일반적으로 복제하기 전에 숙주 세포핵에 들어가야 한다. 이러한 바이러스 중 일부는 게놈을 복제하기 위해 숙주 세포 DNA 중합 효소를 필요로 하는 반면, 아데노바이러스나 헤르페스 바이러스와 같은 다른 바이러스는 자체 복제 인자를 암호화한다. 그러나 어느 경우든, 바이러스 게놈의 복제는 DNA 복제를 허용하는 세포 상태, 즉 세포 주기에 크게 의존한다. 바이러스는 세포가 강제로 세포 분열을 겪도록 유도할 수 있으며, 이는 세포의 세포 변형 및 궁극적으로 암으로 이어질 수 있다. 이 분류에 속하는 한 가족의 예는 아데노바이러스과(Adenoviridae)이다.
1군 바이러스가 핵 내에서 복제되지 않는 잘 연구된 예가 하나 있다. 이것은 폭스바이러스과(Poxvirus)로, 척추동물을 감염시키는 병원성이 높은 바이러스를 포함한다.
이 범주에 속하는 바이러스에는 아직 잘 연구되지 않았지만 척추동물과 매우 관련이 있는 바이러스가 포함됩니다. 두 가지 예로는 환상바이러스과와 파보바이러스과가 있습니다. 이들은 핵 내에서 복제하며, 복제 과정에서 이중 가닥 DNA 중간체를 형성합니다. TTV라고 불리는 인간의 아넬로바이러스도 이 분류에 포함되며, 거의 모든 인간에게서 발견되어 거의 모든 주요 기관에서 무증상으로 감염시킵니다.
3. 1. 1. 겹가닥 DNA 바이러스 (I)
이 종류의 바이러스는 복제를 위해 반드시 숙주 세포의 세포핵에 침입해야 한다. 이 가운데 몇몇은 복제 과정에 숙주 세포의 DNA 중합효소가 필요하다. 한편, 아데노바이러스와 같은 것은 스스로를 복제할 인자가 바이러스 자체에 포함되어 있기도 하다. 그러 이 경우에도 바이러스 복제는 숙주 세포의 세포 주기에 따른 활동에 의존하고 있다. 이 종류의 바이러스는 숙주의 세포 분열 과정에 끼어들어 마치 암과 같이 숙주 세포를 악성 전환시킨다. 그 결과 숙주 세포는 분열 대신 바이러스 복제에 에너지와 자원을 사용하게 된다.이 종류에 속하지만 세포핵 안에서 복제하지 않는 것으로는 척추동물을 감염시키는 폭스바이러스 한 종류만이 알려져 있다.[29]
3. 1. 2. 외가닥 DNA 바이러스 (II)
외가닥 DNA 바이러스의 성질에 대해서는 아직 밝혀지지 않은 부분이 많지만 척추동물이 흔히 감염되는 바이러스 가운데 하나이다. 두 종류의 바이러스 복제 방식이 연구되어 있으며 모두 숙주 세포의 세포핵 내에서 복제된다. 이 종류에 속하는 토크 테노 바이러스는 거의 모든 사람의 몸 전체에서 발견되지만 특별히 증상을 일으키지는 않는다.[29] 이 범주에 속하는 바이러스에는 아직 잘 연구되지 않았지만 척추동물과 매우 관련이 있는 바이러스가 포함됩니다. 두 가지 예로는 환상바이러스과와 파보바이러스과가 있습니다. 이들은 핵 내에서 복제하며, 복제 과정에서 이중 가닥 DNA 중간체를 형성합니다. TTV라고 불리는 인간의 아넬로바이러스도 이 분류에 포함되며, 거의 모든 인간에게서 발견되어 거의 모든 주요 기관에서 무증상으로 감염시킵니다.3. 2. RNA 바이러스
볼티모어 분류법에서 III, IV, V는 RNA 바이러스이다. 코로나바이러스나 인플루엔자와 같은 감염원들이 여기에 속해 있다.[30] RNA 바이러스는 세포핵이 아닌 세포질에서 숙주 세포의 전사 과정에 끼어들어 자신을 복제한다.[30]== 겹가닥 RNA 바이러스 (III) ==
대부분의 RNA 게놈을 가진 바이러스와 마찬가지로, 이중 가닥 RNA 바이러스는 DNA 게놈을 가진 바이러스만큼 복제에 숙주 중합 효소에 의존하지 않는다. 이중 가닥 RNA 바이러스는 다른 종류의 바이러스만큼 잘 연구되지 않았다. 이 종류에는 레오바이러스과와 비르나바이러스과의 두 가지 주요 과가 포함된다. 복제는 단일 시스트론이며 개별 분절 게놈을 포함하는데, 이는 다른 바이러스와 달리 각 유전자가 하나의 단백질만을 암호화한다는 것을 의미하며, 다른 바이러스는 더 복잡한 번역을 보인다.
2본쇄 RNA 바이러스는 RNA 게놈을 가진 대부분의 바이러스와 마찬가지로, DNA 게놈을 가진 바이러스처럼 복제를 숙주 중합효소에 의존하지 않는다. 2본쇄 RNA 바이러스는 다른 분류군만큼 잘 연구되지 않았다. 이 분류군에는 레오바이러스과와 비르나바이러스과의 두 가지 주요 과가 포함된다. 복제는 단일 유전자이며, 개별 분절 게놈을 포함한다. 즉, 더 복잡한 번역을 보이는 다른 바이러스와 달리 각 유전자는 하나의 단백질만 암호화한다.
== 양성-극성 외가닥 RNA 바이러스 (IV) ==
이 바이러스는 두 가지 유형으로 구성되어 있지만, 복제가 주로 세포질에서 이루어지며 복제가 DNA 바이러스만큼 세포 주기에 의존하지 않는다는 사실을 공유한다. 이 부류의 바이러스는 이중 가닥 DNA 바이러스와 함께 가장 많이 연구되는 바이러스 유형 중 하나이다.
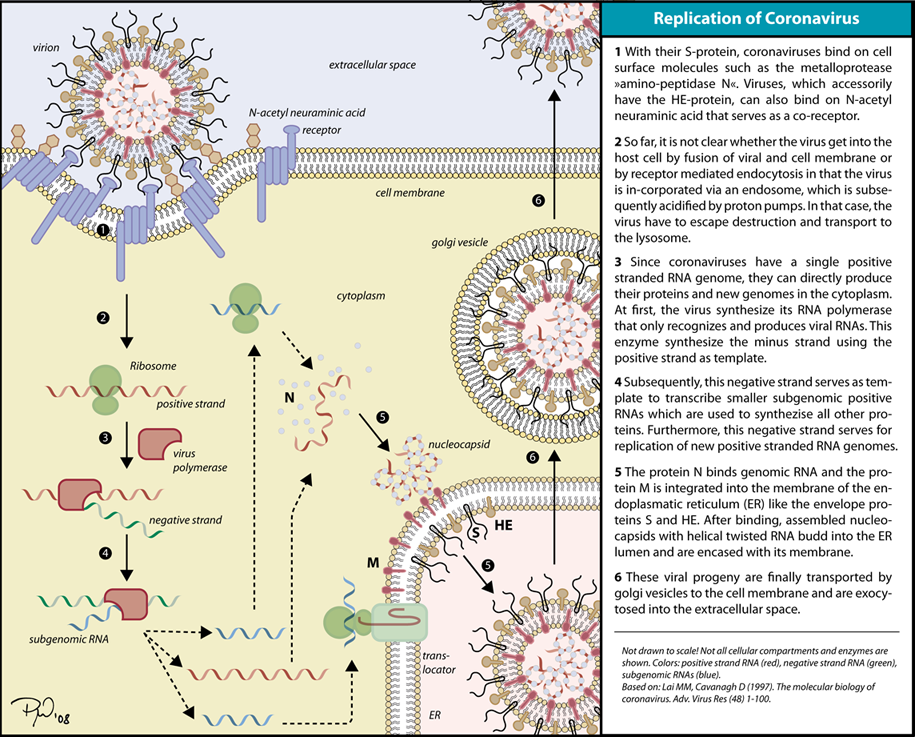
양성 가닥 RNA 바이러스, 그리고 실제로 '''양성 가닥'''으로 정의된 모든 유전자는 숙주 리보솜에 의해 직접 접근하여 즉시 단백질을 형성할 수 있다. 이는 세포질에서 복제되는 두 그룹으로 나눌 수 있다.
- 폴리시스트론 mRNA를 가진 바이러스로, 게놈 RNA가 mRNA를 형성하고, 이후 분해되어 성숙 단백질을 형성하는 폴리단백질 산물로 번역된다. 이는 유전자가 동일한 RNA 가닥으로부터 단백질을 생성하기 위해 몇 가지 방법을 활용할 수 있으며, 게놈 크기를 줄일 수 있음을 의미한다.
- 복잡한 전사를 가진 바이러스로, 서브게놈 mRNA, 리보솜 프레임 이동 및 폴리단백질의 단백질 분해 처리가 사용될 수 있다. 이들은 모두 동일한 RNA 가닥으로부터 단백질을 생성하는 데 사용되는 서로 다른 메커니즘이다.
이 부류의 예시에는 코로나바이러스과, 플라비바이러스과, 피코르나바이러스과가 포함된다.
== 음성-극성 외가닥 RNA 바이러스 (V) ==
음성 가닥 RNA 바이러스, 그리고 실제로 '''음성 가닥'''으로 정의된 모든 유전자는 숙주 리보솜에 의해 직접 접근하여 즉시 단백질을 형성할 수 없다. 대신, 바이러스 중합효소에 의해 "읽을 수 있는" 상보적인 양성 가닥으로 전사되어야 한다. 이들은 또한 두 그룹으로 나눌 수 있다.[30]
- 비분절 게놈을 포함하는 바이러스는 복제의 첫 번째 단계가 바이러스 RNA 의존성 RNA 중합효소에 의한 음성 가닥 게놈으로부터의 전사로, 다양한 바이러스 단백질을 암호화하는 단일 유전자 mRNA를 생성하는 것이다. 음성 가닥 게놈 생산을 위한 템플릿 역할을 하는 양성 가닥 게놈 사본이 생성된다. 복제는 세포질 내에서 이루어진다.
- 분절 게놈을 가진 바이러스는 복제가 세포질에서 발생하고 바이러스 RNA 의존성 RNA 중합효소에 의해 각 게놈 분절로부터 단일 유전자 mRNA를 생성한다.
이 계열의 예로는 오르토믹소바이러스과, 파라믹소바이러스과, 부니야바이러스과, 필로바이러스과, 랍도바이러스과 (광견병을 포함)가 있다.
3. 2. 1. 겹가닥 RNA 바이러스 (III)
볼티모어 분류법에서 III, IV, V는 RNA 바이러스이다. 코로나바이러스나 인플루엔자와 같은 감염원들이 여기에 속해 있다.[30] 대부분의 RNA 게놈을 가진 바이러스와 마찬가지로, 이중 가닥 RNA 바이러스는 DNA 게놈을 가진 바이러스만큼 복제에 숙주 중합 효소에 의존하지 않는다. 이중 가닥 RNA 바이러스는 다른 종류의 바이러스만큼 잘 연구되지 않았다. 이 종류에는 레오바이러스과와 비르나바이러스과의 두 가지 주요 과가 포함된다. 복제는 단일 시스트론이며 개별 분절 게놈을 포함하는데, 이는 다른 바이러스와 달리 각 유전자가 하나의 단백질만을 암호화한다는 것을 의미하며, 다른 바이러스는 더 복잡한 번역을 보인다.2본쇄 RNA 바이러스는 RNA 게놈을 가진 대부분의 바이러스와 마찬가지로, DNA 게놈을 가진 바이러스처럼 복제를 숙주 중합효소에 의존하지 않는다. 2본쇄 RNA 바이러스는 다른 분류군만큼 잘 연구되지 않았다. 이 분류군에는 레오바이러스과와 비르나바이러스과의 두 가지 주요 과가 포함된다. 복제는 단일 유전자이며, 개별 분절 게놈을 포함한다. 즉, 더 복잡한 번역을 보이는 다른 바이러스와 달리 각 유전자는 하나의 단백질만 암호화한다.
3. 2. 2. 양성-극성 외가닥 RNA 바이러스 (IV)
볼티모어 분류법에서 III, IV, V는 RNA 바이러스이다. 코로나바이러스나 인플루엔자와 같은 감염원들이 여기에 속해 있다. RNA 바이러스는 세포핵이 아닌 세포질에서 숙주 세포의 전사 과정에 끼어들어 자신을 복제한다.[30]이 바이러스는 두 가지 유형으로 구성되어 있지만, 복제가 주로 세포질에서 이루어지며 복제가 DNA 바이러스만큼 세포 주기에 의존하지 않는다는 사실을 공유한다. 이 부류의 바이러스는 이중 가닥 DNA 바이러스와 함께 가장 많이 연구되는 바이러스 유형 중 하나이다.
양성 가닥 RNA 바이러스, 그리고 실제로 '''양성 가닥'''으로 정의된 모든 유전자는 숙주 리보솜에 의해 직접 접근하여 즉시 단백질을 형성할 수 있다. 이는 세포질에서 복제되는 두 그룹으로 나눌 수 있다.
- 폴리시스트론 mRNA를 가진 바이러스로, 게놈 RNA가 mRNA를 형성하고, 이후 분해되어 성숙 단백질을 형성하는 폴리단백질 산물로 번역된다. 이는 유전자가 동일한 RNA 가닥으로부터 단백질을 생성하기 위해 몇 가지 방법을 활용할 수 있으며, 게놈 크기를 줄일 수 있음을 의미한다.
- 복잡한 전사를 가진 바이러스로, 서브게놈 mRNA, 리보솜 프레임 이동 및 폴리단백질의 단백질 분해 처리가 사용될 수 있다. 이들은 모두 동일한 RNA 가닥으로부터 단백질을 생성하는 데 사용되는 서로 다른 메커니즘이다.
이 부류의 예시에는 코로나바이러스과, 플라비바이러스과, 피코르나바이러스과가 포함된다.
3. 2. 3. 음성-극성 외가닥 RNA 바이러스 (V)
음성 가닥 RNA 바이러스, 그리고 실제로 '''음성 가닥'''으로 정의된 모든 유전자는 숙주 리보솜에 의해 직접 접근하여 즉시 단백질을 형성할 수 없다. 대신, 바이러스 중합효소에 의해 "읽을 수 있는" 상보적인 양성 가닥으로 전사되어야 한다. 이들은 또한 두 그룹으로 나눌 수 있다.[30]- 비분절 게놈을 포함하는 바이러스는 복제의 첫 번째 단계가 바이러스 RNA 의존성 RNA 중합효소에 의한 음성 가닥 게놈으로부터의 전사로, 다양한 바이러스 단백질을 암호화하는 단일 유전자 mRNA를 생성하는 것이다. 음성 가닥 게놈 생산을 위한 템플릿 역할을 하는 양성 가닥 게놈 사본이 생성된다. 복제는 세포질 내에서 이루어진다.
- 분절 게놈을 가진 바이러스는 복제가 세포질에서 발생하고 바이러스 RNA 의존성 RNA 중합효소에 의해 각 게놈 분절로부터 단일 유전자 mRNA를 생성한다.
이 계열의 예로는 오르토믹소바이러스과, 파라믹소바이러스과, 부니야바이러스과, 필로바이러스과, 랍도바이러스과 (광견병을 포함)가 있다.
3. 3. 레트로바이러스
레트로바이러스는 유전체 안에 전사와 역전사 기능이 모두 들어 있는 바이러스이다. 볼티모어 분류법에서 VI는 RNA 레트로바이러스, VII는 DNA 레트로바이러스이다. 이들은 일종의 트로이목마 전략으로 복제를 한다. VI의 경우 먼저 RNA 상태로 숙주에 침입한 다음 역전사되어 DNA로 탈바꿈하여 숙주의 세포핵에서 복제된다. 일반적인 유전자 발현과는 순서가 정반대인 셈이다. 이때문에 숙주의 면역계가 항원을 인식하기 힘들다.[30]이 부류의 바이러스 중 잘 연구된 과에는 레트로바이러스가 있다. 이들의 특징 중 하나는 역전사 효소를 사용하여 양성 가닥 RNA를 DNA로 변환하는 것이다. RNA를 단백질의 주형으로 사용하는 대신, DNA를 주형으로 사용하여 인테그라제를 통해 숙주 게놈에 삽입한다. 그런 다음 숙주 세포의 중합 효소의 도움을 받아 복제가 시작될 수 있다.
이 소규모 바이러스 그룹은 B형 간염 바이러스가 대표적이며, 이들은 이중 가닥의 틈새 게놈을 가지고 있으며, 이후 이것이 채워져 공유 결합으로 닫힌 고리(cccDNA)를 형성하여 바이러스 mRNA와 부분 게놈 RNA를 생성하는 템플릿 역할을 한다. 프리게놈 RNA는 바이러스 역전사 효소와 DNA 게놈 생산을 위한 템플릿 역할을 한다.
3. 3. 1. 외가닥 RNA-RT 바이러스 (VI)
레트로바이러스는 유전체 안에 전사와 역전사 기능이 모두 들어 있는 바이러스이다. 볼티모어 분류법에서 VI는 RNA 레트로바이러스 VII는 DNA 레트로바이러스이다. 이들은 일종의 트로이목마 전략으로 복제를 한다. VI의 경우 먼저 RNA 상태로 숙주에 침입한 다음 역전사되어 DNA로 탈바꿈하여 숙주의 세포핵에서 복제된다. 일반적인 유전자 발현과는 순서가 정반대인 셈이다. 이때문에 숙주의 면역계가 항원을 인식하기 힘들다.[30]레트로바이러스는 역전사 효소를 사용하여 양성 가닥 RNA를 DNA로 변환한다. RNA를 단백질의 주형으로 사용하는 대신, DNA를 주형으로 사용하여 인테그라제를 통해 숙주 게놈에 삽입한다. 그런 다음 숙주 세포의 중합 효소의 도움을 받아 복제가 시작될 수 있다.
3. 3. 2. 겹가닥 DNA-RT 바이러스 (VII)
레트로바이러스는 유전체 안에 전사와 역전사 기능이 모두 들어 있는 바이러스이다. 볼티모어 분류법에서 VI는 RNA 레트로바이러스 VII는 DNA 레트로바이러스이다. 이들은 일종의 트로이목마 전략으로 복제를 한다. VI의 경우 먼저 RNA 상태로 숙주에 침입한 다음 역전사되어 DNA로 탈바꿈하여 숙주의 세포핵에서 복제된다. 일반적인 유전자 발현과는 순서가 정반대인 셈이다. 이때문에 숙주의 면역계가 항원을 인식하기 힘들다.[30]이 소규모 바이러스 그룹은 B형 간염 바이러스가 대표적이며, 이들은 이중 가닥의 틈새 게놈을 가지고 있으며, 이후 이것이 채워져 공유 결합으로 닫힌 고리(cccDNA)를 형성하여 바이러스 mRNA와 부분 게놈 RNA를 생성하는 템플릿 역할을 한다. 프리게놈 RNA는 바이러스 역전사 효소와 DNA 게놈 생산을 위한 템플릿 역할을 한다.
B형 간염 바이러스에 대표되는 이 작은 바이러스군은 2중 가닥 갭을 가진 게놈을 가지며, 그 후 채워져 바이러스 mRNA 및 서브게놈 RNA 생성의 템플릿으로 기능하는 공유 결합 폐환상 DNA(cccDNA)를 형성한다. 프리게놈 RNA는 바이러스 역전사 효소 및 DNA 게놈의 생성 템플릿으로 기능한다.
4. 바이러스 변이
바이러스는 자체 신진 대사를 하지 못하고 숙주에 기생해야만 존속할 수 있다. 복제 과정에서 바이러스 유전자는 숙주의 유전자와 섞이는 경우가 흔하기 때문에 변이가 빠른 편이다. 특히 인플루엔자와 같은 전염원이 속해있는 RNA 바이러스는 변이가 매우 빠르다.[31]
바이러스의 변이와 숙주의 면역계는 서로 진화적 영향을 미친다. 항원 역할을 하는 바이러스의 인지질 구조가 바뀌면 면역계의 항체는 더 이상 항원을 감별하지 못하고 그 결과 바이러스의 대유행으로 번지게 된다.[32] 인류는 역사적으로 이러한 변형된 감염원과의 관계 속에서 질병의 대유행과 소강을 반복해 왔다. 20세기 초 스페인독감과 같은 질병은 수 많은 사람의 희생을 불러일으키기도 하였다. 미생물학과 면역학의 발전으로 바이러스에 대한 백신을 공급할 수 있게 되면서 바이러스성 질병의 위험은 조금 낮아지게 되었지만, 지금도 백신이 없는 신종 바이러스는 위험한 유행병이다.[33] 2019년 출현하여 세계적 대유행을 불러일으킨 코로나바이러스의 변종 코로나19는 이제까지 경험한 적이 없는 감염원이어서 인간이 갖고 있는 집단 면역을 무력화 시켰고 피해를 키웠다.[34]
4. 1. 변이와 면역
바이러스는 자체 신진 대사를 하지 못하고 숙주에 기생해야만 존속할 수 있다. 복제 과정에서 바이러스 유전자는 숙주의 유전자와 섞이는 경우가 흔하기 때문에 변이가 빠른 편이다. 특히 인플루엔자와 같은 전염원이 속해있는 RNA 바이러스는 변이가 매우 빠르다.[31]바이러스의 변이와 숙주의 면역계는 서로 진화적 영향을 미친다. 항원 역할을 하는 바이러스의 인지질 구조가 바뀌면 면역계의 항체는 더 이상 항원을 감별하지 못하고 그 결과 바이러스의 대유행으로 번지게 된다.[32] 인류는 역사적으로 이러한 변형된 감염원과의 관계 속에서 질병의 대유행과 소강을 반복해 왔다. 20세기 초 스페인독감과 같은 질병은 수 많은 사람의 희생을 불러일으키기도 하였다. 미생물학과 면역학의 발전으로 바이러스에 대한 백신을 공급할 수 있게 되면서 바이러스성 질병의 위험은 조금 낮아지게 되었지만, 지금도 백신이 없는 신종 바이러스는 위험한 유행병이다.[33] 2019년 출현하여 세계적 대유행을 불러일으킨 코로나바이러스의 변종 코로나19는 이제까지 경험한 적이 없는 감염원이어서 인간이 갖고 있는 집단 면역을 무력화 시켰고 피해를 키웠다.[34]
4. 2. 변이와 대유행
바이러스는 자체 신진 대사를 하지 못하고 숙주에 기생해야만 존속할 수 있다. 복제 과정에서 바이러스 유전자는 숙주의 유전자와 섞이는 경우가 흔하기 때문에 변이가 빠른 편이다. 특히 인플루엔자와 같은 전염원이 속해있는 RNA 바이러스는 변이가 매우 빠르다.[31]바이러스의 변이와 숙주의 면역계는 서로 진화적 영향을 미친다. 항원 역할을 하는 바이러스의 인지질 구조가 바뀌면 면역계의 항체는 더 이상 항원을 감별하지 못하고 그 결과 바이러스의 대유행으로 번지게 된다.[32] 인류는 역사적으로 이러한 변형된 감염원과의 관계 속에서 질병의 대유행과 소강을 반복해 왔다. 20세기 초 스페인독감과 같은 질병은 수 많은 사람의 희생을 불러일으키기도 하였다. 미생물학과 면역학의 발전으로 바이러스에 대한 백신을 공급할 수 있게 되면서 바이러스성 질병의 위험은 조금 낮아지게 되었지만, 지금도 백신이 없는 신종 바이러스는 위험한 유행병이다.[33] 2019년 출현하여 세계적 대유행을 불러일으킨 코로나바이러스의 변종 코로나19는 이제까지 경험한 적이 없는 감염원이어서 인간이 갖고 있는 집단 면역을 무력화 시켰고 피해를 키웠다.[34]
참조
[1]
서적
Fish pathology
Elsevier Health Sciences
[2]
서적
Jawetz Melnick & Adelbergs Medical Microbiology
McGraw Hill Professional
2012-12-21
[3]
서적
Essential Human Virology
Elsevier
2016
[4]
논문
Virus entry: molecular mechanisms and biomedical applications
2004-02
[5]
논문
A comparative review of viral entry and attachment during large and giant dsDNA virus infections.
2017
[6]
논문
Virus entry: open sesame.
Cell Press
2006
[7]
논문
The cell biology of receptor-mediated virus entry
https://rupress.org/[...]
Journal of Cell Biology
2011
[8]
논문
Virus membrane-fusion proteins: more than one way to make a hairpin
Nature
2006
[9]
논문
Avoiding the void: cell-to-cell spread of human viruses
https://www.nature.c[...]
2008
[10]
논문
Cell-to-cell transmission of viruses
2013-02
[11]
논문
Multiscale perspectives of virus entry via endocytosis
2013
[12]
논문
The future of bacteriophage biology
2003
[13]
논문
Lysogeny in nature: mechanisms, impact and ecology of temperate phages
2017
[14]
논문
The Life Cycle Transitions of Temperate Phages: Regulating Factors and Potential Ecological Implications
MDPI
2022
[15]
논문
Viruses and Metabolism: The Effects of Viral Infections and Viral Insulins on Host Metabolism
2021-09-29
[16]
서적
Introduction to Modern Virology
Blackwell Publishing
[17]
논문
Fooling the coronavirus proofreading machinery
2013
[18]
논문
The not-so-infinite malleability of RNA viruses: Viral and cellular determinants of RNA virus mutation rates
2017
[19]
논문
Genetic Instability of RNA Viruses
Elsevier
2016
[20]
웹사이트
HIV Treatment: The Basics
https://hivinfo.nih.[...]
NIH
[21]
서적
Fish pathology, 3rd Edition
Elsevier Health Sciences
[22]
서적
Jawetz, Melnick & Adelberg's MEDICAL MICROBIOLOGY
McGraw Hill
[23]
서적
Introduction to Modern Virology, 6th edition.
Blackwell Publishing
[24]
서적
Fish pathology, 3rd Edition
Elsevier Health Sciences
[25]
서적
Jawetz, Melnick & Adelberg's MEDICAL MICROBIOLOGY
McGraw Hill
[26]
뉴스
인간과 바이러스의 끝없는 전쟁
https://www.sciencet[...]
사이언스타임즈
2019-10-25
[27]
서적
Introduction to Modern Virology, 6th edition.
Blackwell Publishing
[28]
논문
바이러스 핵산중합효소의 아미노산 서열에 의한 바이러스 분류
2007-12
[29]
웹사이트
폭스바이러스
https://www.sciencea[...]
사이언스올
2015-09-09
[30]
뉴스
인류와 질병 - 신종 코로나바이러스 이름의 기원
http://dongascience.[...]
동아사이언스
2020-03-07
[31]
뉴스
신종바이러스 생기는 이유
http://newsteacher.c[...]
조선맴버스
2018-01-31
[32]
뉴스
메르스·사스 바이러스의 변이와 감염 전략은?
http://scienceon.han[...]
사이언스온
2015-06-17
[33]
뉴스
바이러스, 인류의 역사와 함께하다
https://times.kaist.[...]
카이스트신문
2020-03-17
[34]
웹사이트
사스(SARS), 메르스(MERS)와 같이 변형된 (유전자 변이가 발생한) 동물 유래 코로나바이러스가 큰 유행을 일으키는 이유가 무엇인가요?
http://www.ksid.or.k[...]
대한감염학회
2020-02-07
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
