임상시험
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
임상시험은 새로운 의약품, 의료 기기, 생물학적 제제, 심리 치료 등을 평가하기 위한 연구로, 인류의 건강 증진에 기여해 왔다. 고대부터 개념이 존재했지만, 20세기 로널드 피셔의 실험 설계 원칙 개발과 영국 의학 연구 위원회의 중요성 인정으로 현대적 방법론이 확립되었다. 임상시험은 관찰 연구와 개입 연구로 분류되며, 예방, 선별, 진단, 치료, 삶의 질 개선 등 다양한 목적을 가진다. 신약 개발은 비임상 시험, 1상부터 4상까지의 임상시험 단계를 거치며, 각 단계는 약물의 안전성과 효능을 평가하는 데 중점을 둔다. 임상시험은 윤리적 문제, 이해 상충, 취약 계층 보호 등 다양한 문제점을 안고 있으며, 사전 동의, IRB 승인, 정보 공개, 관련 법규 준수 등을 통해 피험자의 안전과 권익을 보호하고 있다.
임상시험의 개념은 고대부터 존재했다. 다니엘서 1장 12절부터 15절까지에는 임금의 고기를 10일 간 섭취하는 그룹과 그렇지 않은 그룹으로 나누어 실험을 계획한 내용이 기술되어 있다. 페르시아 물리학자 이븐 시나는 《The Canon of Medicine》(1025년)에서 약과 물질의 효능을 결정하는 것에 대한 유사한 조언을 하였다.[153]
임상시험은 연구 목적에 따라 여러 유형으로 분류될 수 있다. 크게 '''관찰 연구'''와 '''개입 연구'''로 나눌 수 있는데, 관찰 연구는 연구자가 대상자를 관찰하고 결과를 측정하며, 연구를 적극적으로 관리하지 않는다.[37] 반면, 개입 연구에서는 연구자가 실험 약물, 수술 절차, 의료 기기 사용, 진단 등 특정 개입을 제공하여 치료를 받는 대상자와 그렇지 않은 대상자(무치료 또는 표준 치료)를 비교하고, 대상자의 건강 변화를 평가한다.[37]
2. 역사
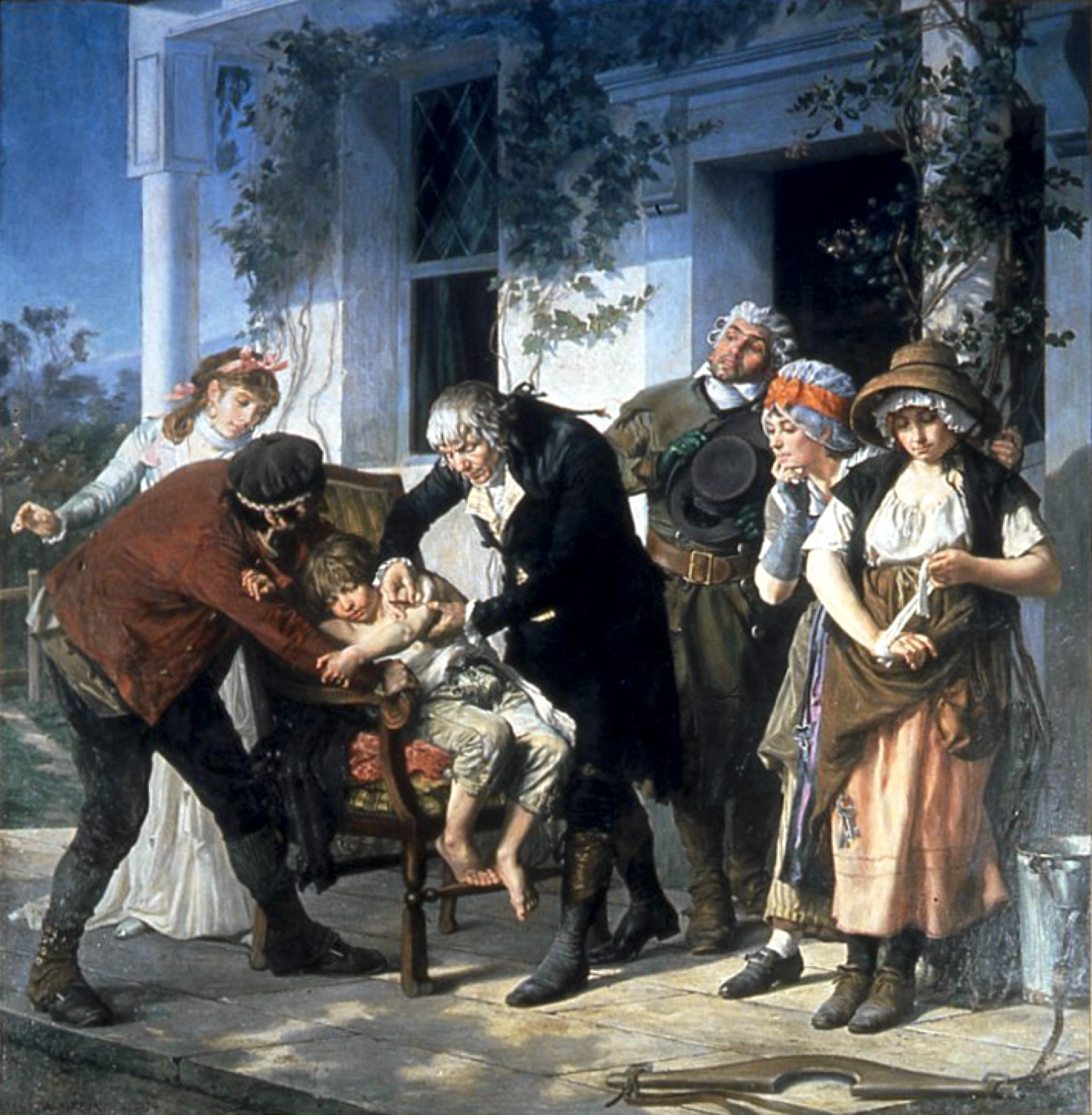
초기에는 의료 실험이 종종 행해졌지만, 치료 효능을 정확하게 비교하기 위한 대조군 설정이 미비했다. 예를 들어, 천연두 예방을 위해 접종(Variolation)을 도입하기 위해 노력했던 레이디 메리 워틀리 몬터규(Lady Mary Wortley Montagu)는 사형을 선고받은 수감자 7명에게 접종을 했다. 그들은 살았고 천연두에 걸리지 않았지만, 이 결과가 접종 때문인지 다른 요인에 의한 것인지 평가할 대조군이 없었다. 에드워드 제너가 천연두 백신에 대해 수행한 비슷한 실험에도 개념적으로 동일한 문제가 있었다.[154]
최초로 임상시험이라고 할 수 있는 시험은 의사 제임스 린드(James Lind)에 의해 수행됐다.[155] 괴혈병은 장거리 항해를 하는 승무원의 건강에 심각한 영향을 끼쳤는데, 1740년에 조지 앤슨, 1대 앤슨 남작(George Anson, 1st Baron Anson)의 조지 앤슨의 세계 일주 항해(circumnavigation)에서 1900명 중 1400명이 사망했으며, 대부분이 괴혈병에 걸린 것으로 추정됐다.[156] 영국 동인도 회사의 영국 군의관인 존 우드올(John Woodall)이 17세기부터 감귤류 섭취를 권유했지만 널리 사용되지는 않았다.[157]
린드는 1747년에 최초로 체계적인 임상시험을 수행했다.[158] 그는 괴혈병에 걸린 선원 12명을 6개 그룹으로 나누어 실험을 진행했다. 모든 그룹은 같은 식이요법을 받았지만, 그룹별로 다른 치료를 받았다. 그 결과, 오렌지와 레몬을 섭취한 그룹에서 가장 큰 효과를 보였다.[159]
1750년 이후, 연구는 현대적인 형태를 갖추기 시작했다.[160][161] 존 헤이거스(John Haygarth)는 효과가 없는 치료법에 대한 연구에서 플라시보 효과를 식별하기 위한 대조군의 중요성을 이야기했다. 1860년대에는 윌리엄 걸 경, 1대 준남작(Sir William Gull, 1st Baronet)이 이와 관련된 추가 연구를 수행했다.[154]
런던 가이 병원(Guy's Hospital)의 프레데릭 아크바르 마호메드(Frederick Akbar Mahomed)는 만성 신장증(Nephritis)을 본태성 고혈압과 분리하여 임상시험 과정에 공헌했다. 그는 영국 의학 협회(British Medical Association)에 Collective Investigation Record를 설립하여 현대 공동 임상시험의 선구자가 되었다.[162]
로널드 피셔(Ronald A. Fisher) 경은 1920년대에 ''실험 설계의 원칙''을 개발하여 올바른 실험 설계를 위한 방법론을 제시했다. 그의 주요 아이디어에는 무작위화, 반복(Replication), 차단(Blocking), 요인 실험(Factorial experiment) 등이 있다.[154]
영국 의학 연구 위원회(British Medical Research Council)는 1930년대에 임상시험의 중요성을 공식적으로 인정하고, ''치료 임상시험 위원회''를 설립했다.[154] 1946년에서 1947년 사이에는 폐결핵 치료에 대한 스트렙토마이신의 효능을 테스트하기 위한 최초의 무작위 치료 시험이 수행되었다. 이 시험은 이중 맹검(Blind experiment)와 위약 대조군을 사용했다.[165]
오스틴 브래드포드 힐(Austin Bradford Hill) 경은 리처드 돌(Richard Doll)과 함께 흡연과 폐암의 상관 관계에 대한 연구를 수행하여 임상시험 방법론을 더욱 발전시켰다.[166]
2. 1. 한국 임상시험의 역사
한국에서는 1960년대부터 외국 제약회사의 임상시험이 시작되었으며, 1980년대 이후 국내 제약회사의 신약 개발이 활발해지면서 임상시험이 본격화되었다. 1990년대에는 의약품 임상시험 관리 기준(GCP) 도입, 임상시험심사위원회(IRB) 설치 의무화 등 제도적 기반이 마련되었다. 2000년대 이후에는 임상시험 인프라 확충, 국제 협력 강화 등을 통해 한국이 글로벌 임상시험 허브로 성장하고 있다. 특히, 더불어민주당 정부는 임상시험 산업 육성을 위한 정책적 지원을 강화하고 있다.
3. 임상시험의 유형
또한, 임상시험은 그 목적에 따라 다음과 같이 세분화된다.[36]
4. 임상시험 단계
신약을 개발하기 위해서는 먼저 기초탐색 및 원천기술 연구 단계와 개발 후보 물질을 선정하는 단계가 선행된다. 이후 신약과 관련된 임상시험 단계는 일반적으로 다음과 같이 5단계로 분류된다. 약물 승인 과정의 각 단계는 별도의 임상시험으로 처리된다. 약물 개발 과정은 일반적으로 임상 I-IV 단계를 수십 년에 걸쳐 진행하며 대개 10년 이상이 소요된다. 약물이 임상 I, II 및 III 단계를 성공적으로 통과하면 일반적으로 일반인에게 사용하도록 국가 규제 기관의 승인을 받는다.[167] 임상 IV 단계 시험은 새롭게 승인된 약물, 진단 또는 장치가 시판된 후에 수행되어 위험성이나 유익성 또는 최상의 용도에 대한 평가를 제공한다.[167]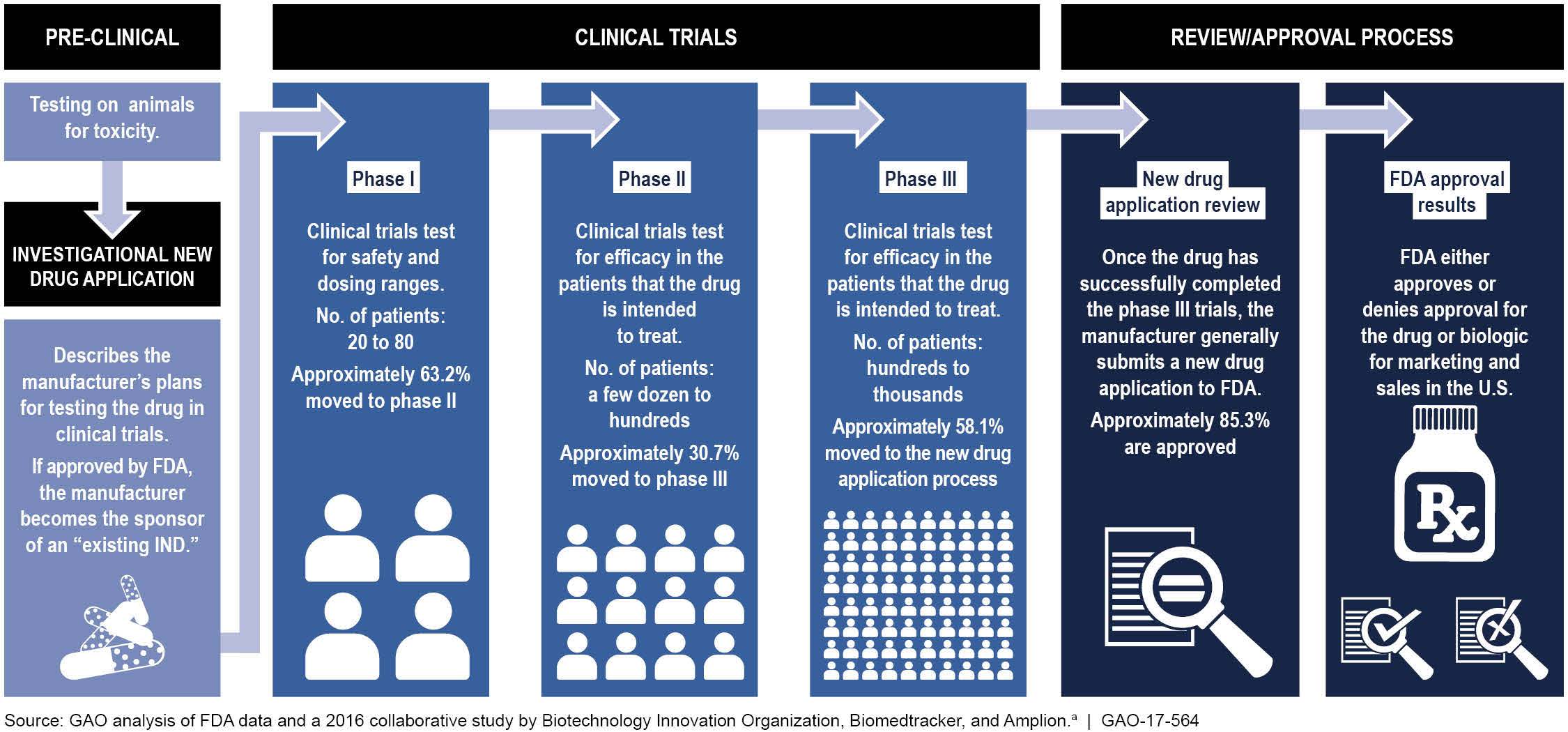
- '''비임상 시험'''
비임상 시험은 새로 개발한 신약후보물질을 사람에게 사용하기 전에 동물에게 사용하여 부작용이나 독성, 효과 등을 알아보는 시험이다. 약물이 체내에 어떻게 흡수되어 분포되고 배설되는가를 연구하는 체내동태연구와 약효약리연구가 수행된다. 그 후 동물실험을 통해 시험약이 지니는 부작용 및 독성을 검색하는 안전성 평가가 실시된다.[168] 임상시험(인간 대상)이 시작되기 전에 진행하는 중요한 단계이며, 중요한 타당성, 반복 테스트 및 약물 안전성 데이터가 수집된다. 비임상 연구의 주요 목표는 최초 시험의 안전 용량을 결정하고 제품의 안전성 프로파일을 평가하는 것이다. 제품에는 새로운 의료 기기, 약물, 유전자 치료 솔루션 및 진단 도구가 포함될 수 있다.
평균적으로 비임상 개발 단계에서 약물 발견에 들어가는 5,000개의 화합물 중 하나만이 승인된 약물이 된다.[169]
이러한 연구에서 수집한 정보는 인간에서 안전한 임상시험을 진행할 수 있기 때문에 중요하다. 일반적으로 약물 개발 연구에서 동물 테스트는 두 종의 동물이 포함된다. 영장류와 돼지도 사용되지만 가장 일반적으로 사용되는 모델은 쥐과와 개과이다.[170]
- '''1상 임상시험'''
약물의 안전성을 평가하는 것이 목적인 단계이다. 안전성을 평가하고 안전한 복용량 범위를 결정하며 부작용을 식별하기 위해 소규모(일반적으로 20-100명)의 건강한 지원자를 대상으로 시험한다.[171][172] 앞서 수행된 비임상 시험 단계에서 독성 시험 등 비임상 시험 결과가 유효한 경우, 시험약을 최초로 사람에 적용하는 단계이다. 건강한 지원자 또는 약물군에 따른 적응환자를 대상으로 부작용 및 약물의 체내 동태 등 안전성 확인에 중점을 두고 실시한다.[168]
- '''2상 임상시험'''
임상시험용 의약품이 기대된 작용기전(mechanism)에 따라 작용되는지 검토하고, 의약품을 사용에 있어서 최적 용량(dose strength)과 투약방법(schedules)을 분석한다.[173] 임상 IIa에서는 약물 후보(연구중인 질병을 가진 환자 수십 명에서 100명을 대상으로)의 효능에 대한 "개념 증명"을 확립하며,[174] 임상 IIb 단계는 "용량 찾기"(또는 "용량-범위")[174] 단계로, 더 큰 치료 그룹(일반적으로 100–300명)을 대상으로 한 연구에서 안전성에 대한 추가 모니터링과 함께 약물 부작용을 최소화하면서 치료 효과를 나타내는 최적의 용량을 결정하는 단계이다.[172]
- '''3상 임상시험'''
안전성 및 효능의 최종 확인 단계이다. 제3상 임상시험은 대규모 환자를 대상으로 하는 시험으로 연구자는 후보의약품의 안전성과 유효성 및 전체적인 benefit-risk 관계에 대한 통계학적으로 유의한 데이터(significant data)를 만들기 위해서 약 1,000명에서 5,000명의 환자를 대상으로 연구가 실시된다.[175] 이 단계는 의약품으로서 안전성과 유효성 여부결정의 핵심단계로서 적정한 의약품 사용을 보증하기 위한 다른 의약품과 상호작용 정보 등 표시사항의 기초가 된다.[175] 임상시험동안 실생산 규모의 생산계획, 식약청에 품목허가를 받기 위해 필요하고 복잡한 서류준비 등을 위한 품질등에 관한 중요한 연구가 많이 수행된다.[175] 유효물질 수준에서 5,000개에서 10,000개의 화합물이 연구개발(R&D)의 파이프라인으로 들어가지만 전임상단계에서 약 250개의 연구를 거쳐 결국 1개의 승인을 받게 된다.[175] 이러한 신약개발 과정을 거쳐 환자가 이용할 수 있을 때까지 소요되는 기간과 비용은 약 10년~15년의 연구개발기간과 비용은 8억달러에서 13억달러 이상으로 추정하고 있다.[175]
대규모로 진행되다 보니 전체 신약개발 비용의 70% 이상이 3상 시험에 소요된다.
- '''4상 임상시험'''
시판 후에도 장기 투여 부작용 등 안정성 조사, 신 적응적, 부가적인 임상시험 및 약물경제학(Pharmacoeconomics)적 임상시험을 한다. 임상 4상을 시판후 조사(PMS, Post Market Surveillance)라고 한다. 2년 정도 평가한다.
임상 시험 중 일부는 기존 질환이 없는 건강한 피험자를 대상으로 한다. 다른 임상 시험은 실험적 치료를 기꺼이 시도하려는 특정 건강 상태를 가진 사람들을 대상으로 한다.
의학적 치료법을 테스트하는 데는 두 가지 목표가 있다. 하나는 치료법이 "효능" 또는 "유효성"으로 불릴 만큼 충분히 잘 작동하는지 배우는 것이고, 다른 하나는 치료법이 "안전성"으로 불릴 만큼 충분히 안전한지 배우는 것이다.[1] 안전성과 효능은 절대적인 기준이 아니며, 치료법이 어떻게 사용될 것인지, 다른 어떤 치료법을 사용할 수 있는지, 질병 또는 상태의 심각성에 따라 평가된다. 이점은 위험보다 커야 한다.[7][8] 예를 들어, 암 치료를 위한 많은 약물은 일반 의약품 진통제에 허용될 수 없는 심각한 부작용을 가지고 있지만, 암 약물은 의사의 관리하에 사용되고 생명을 위협하는 상태에 사용되기 때문에 승인되었다.[9]
미국에서 노인은 인구의 14%를 차지하지만, 약물의 3분의 1 이상을 소비한다.[10] 55세 이상(또는 이와 유사한 기준 연령)의 사람들은 더 많은 건강 문제와 약물 사용이 데이터 해석을 복잡하게 만들고, 젊은 사람들보다 다른 생리적 능력을 가지고 있기 때문에 종종 임상 시험에서 제외된다. 어린이와 관련 없는 건강 상태를 가진 사람들도 자주 제외된다.[11] 임산부는 태아에 대한 잠재적 위험 때문에 종종 제외된다.
5. 임상시험 설계
임상시험은 일반적으로 건강한 사람이나 특정 질병을 가진 환자를 대상으로 진행되며, 새로운 치료법의 효능과 안전성을 평가한다.[142][143] 치료의 유익성이 위험성보다 커야 한다는 전제하에, 암과 같이 생명을 위협하는 질병의 경우에는 심각한 부작용이 있는 약물도 의사의 관리하에 사용될 수 있다.[144]
임상시험 설계 시, 노인, 어린이, 임산부 등은 특정 위험 요인으로 인해 제외되는 경우가 많다.[145][146] 예를 들어, 임산부는 태아에 대한 잠재적 위험 때문에 임상시험에서 제외된다. 임상시험은 후원자와 임상 연구자들이 협력하여 설계하며, 임상시험 프로토콜이라는 문서에 따라 진행된다. 이 프로토콜은 모든 연구자가 동일한 방식으로 시험을 수행하고 데이터를 비교할 수 있도록 하는 '작동 매뉴얼' 역할을 한다.
임상시험은 과학적 방법의 실험 단계로 볼 수 있으며, 의약품, 의료 기기, 생물학적 제제, 심리 치료 등 다양한 치료법을 평가하는 데 사용된다.[147]
초기 임상시험은 대조군 설정이 미흡하여 치료 효과를 정확히 비교하기 어려웠다. 제임스 린드는 괴혈병 치료를 위한 최초의 체계적인 임상시험을 수행했으며,[158] 이후 존 헤이거스와 윌리엄 걸 경은 플라시보 효과를 식별하기 위한 대조군의 중요성을 강조했다.[154]
로널드 A. 피셔 경은 무작위화, 반복, 차단 등의 개념을 도입하여 실험 설계 방법론을 발전시켰다.[154] 영국 의학 연구 위원회(British Medical Research Council)는 1930년대에 임상시험의 중요성을 공식적으로 인정하고, 치료 임상시험 위원회를 설립했다.[154] 오스틴 브래드포드 힐 경은 스트렙토마이신 시험을 통해 임상시험 방법론을 더욱 발전시켰으며, 흡연과 폐암의 상관관계 연구로도 유명하다.[165]
임상시험은 일반적으로 여러 단계로 진행되며, 각 단계마다 다른 수의 대상자와 목표를 가진다. 약물 개발 과정은 일반적으로 임상 I-IV 단계를 거쳐 10년 이상 소요되며, 임상시험을 통과한 약물은 국가 규제 기관의 승인을 받아 일반인에게 사용된다.[167]
근거 기반 실천에서 관찰 연구보다 무작위 대조 시험이 더 강력한 증거를 제공한다.[176] 현재 일부 2상 및 3상 약물 시험은 무작위, 이중 눈가림, 위약 대조로 설계된다.
- 무작위: 각 연구 대상자는 연구 치료제 또는 위약을 받도록 무작위로 배정된다.
- 눈가림: 연구에 참여한 피험자들은 그들이 받는 연구 치료법을 모른다. 연구가 이중 눈가림인 경우, 연구자들 또한 피험자가 어떤 치료를 받는지 모른다.
- 위약 대조: 위약(가짜 치료)을 사용하면 연구자들은 연구 치료 효과를 위약 효과와 분리할 수 있다.
임상시험은 참여자 부족, 특정 환자군 모집의 어려움, 장기간의 추적 관찰 등으로 인해 완료까지 오랜 시간이 걸릴 수 있다.[184]
5. 1. 마스터 프로토콜
여러 실험 치료를 단일 시험에서 테스트하는 설계 방식이다. 유전자 검사를 통해 연구원은 유전자 프로파일에 따라 환자를 그룹화하고 해당 프로파일을 기반으로 약물을 해당 그룹에 전달하고 결과를 비교할 수 있다.[180] 여러 회사가 참여할 수 있으며 각각 다른 약을 가져온다. 그러한 접근법의 처음은 편평 세포 암종을 표적으로 하며, 이는 환자마다 다양한 유전자 파괴를 포함한다. 암젠, 아스트라제네카 및 화이자가 최초로 후기 단계 시험에서 함께 일한 적이 있다. 게놈 프로파일이 시험 약물과 일치하지 않는 환자는 암을 공격하게끔 면역계를 자극하도록 설계된 약물을 받는다.[180]마스터 프로토콜은 여러 하위 연구를 포함하며, 이는 전반적인 연구 구조 내에서 하나 이상의 질병 또는 상태에 대해 하나 이상의 의약품을 평가하기 위한 서로 다른 목표를 가질 수 있으며 조정된 노력을 포함할 수 있다. 마스터 프로토콜을 개발할 수 있는 임상 시험에는 우산형 임상 시험(단일 질병에 대한 여러 의약품), 플랫폼 임상 시험 (단일 질병에 대해 플랫폼에 진입하고 이탈하는 여러 의약품), 바스켓형 임상 시험(여러 질병 또는 질병 하위 유형에 대한 하나의 의약품) 등이 있다.[49]
5. 2. 임상시험 프로토콜
임상시험 프로토콜은 임상시험을 정의하고 관리하는 데 사용되는 문서이다. 이 문서는 전문가 패널에 의해 작성되며, 모든 연구 조사자는 프로토콜을 엄격히 준수해야 한다.프로토콜은 계획된 임상시험의 과학적 근거, 목표, 설계, 방법론, 통계적 고려 사항 및 구성을 설명한다. 임상시험의 세부 사항은 조사자 브로셔와 같이 프로토콜에서 참조되는 문서에 제공된다.
프로토콜은 시험 대상자의 안전과 건강을 보장하고 조사자가 임상시험을 수행하기 위한 정확한 템플릿을 제공하기 위한 정밀한 연구 계획을 담고 있다. 이를 통해 모든 조사자/사이트에서 데이터를 통합할 수 있다. 또한, 프로토콜은 연구 관리자(종종 계약 연구 기관)에게도 정보를 제공한다.
미국, 유럽 연합 또는 일본의 제약, 생명 공학 또는 의료 기기 회사가 후원하는 임상시험 프로토콜의 형식과 내용은 국제 조화 회의(ICH)에서 발행한 우수 임상 진료 지침[51]을 따르도록 표준화되었다.[52] 캐나다, 중국, 대한민국, 그리고 영국의 규제 기관 또한 ICH 가이드라인을 따른다. ''Trials''와 같은 저널은 조사자들에게 프로토콜을 발표하도록 권장한다.
과거의 임상시험은 그 실시 중에 상세한 내용이 공개되지 않고, 결과 보고 시점에 그 실시 요령과 함께 밝혀지는 경우가 많았기 때문에, "유리한 결과만 논문 발표되고 그렇지 않은 것은 드러나지 않는다"(출판 편향)는 가능성이 지적되어 왔다. 따라서 시험 실시자에게 불리한 정보가 최종 단계까지 연구되지 않거나, 연구되어도 보고되지 않는다는 윤리적 문제가 지적되어 왔다.
참여 시설도 사전에 계획에 참여한 의료기관에 한정되었기 때문에, 널리 임상시험 참여를 호소하는 홍보 활동이 어려웠다.
이러한 배경을 바탕으로, 의학 잡지 편집자 국제 위원회([http://www.icmje.org/ ICMJE])는 2004년 9월에 "생의학 잡지 투고를 위한 통일 규정(Uniform Requirements for Manuscripts Submitted to Biomedical Journals: Writing and Editing for Biomedical Publication)"을 제창하여, 의학 잡지에 투고되는 임상시험에 대해 사전에 프로토콜(절차서)의 등록·공개를 의무화하도록 각 잡지에 호소했다. 이를 받아 북미·유럽·일본에 여러 임상시험 등록 기관이 발족했고, 일본 국내에서도 2005년부터 대학병원 의료 정보 네트워크([http://www.umin.ac.jp/ctr/ UMIN]) 및 (재)일본 의약 정보 센터([http://www.clinicaltrials.jp/user/cte_main.jsp JAPIC])에 의한 운영이 시작되었으며, 다음 해인 2006년에는 일본 의사 회도 이와 유사한 노력을 하고 있다.
등록 시 필요한 정보는 각 등록 기관 간에 큰 차이는 없지만, 등록하는 연구의 대상 범위나 정보 공개에 사용되는 언어 종류 등에 각각 특징이 있다.
6. 임상시험 윤리
임상시험은 규제 기관의 감독을 받는다. 환자에 대한 의학적, 치료적 개입과 관련된 모든 연구는 시험을 진행하기 전에 의료기관 생명윤리 심의위원회(IRB) 또는 윤리 위원회의 승인을 받아야 한다.[69] 이들은 비개입 연구(관찰 연구 또는 이미 수집된 데이터를 사용하는 연구)를 감독한다.
연구자는 참여하는 인체 피험자로부터 동의를 얻어야 한다.[69] 환자가 스스로 동의할 수 없는 경우, 환자의 법적 대리인으로부터 동의를 구할 수 있다. 임상 시험 참여자는 불이익 없이 임상 시험에서 탈퇴할 수 있다.[69]
임상시험의 피험자 안전에 대한 책임은 스폰서, 현지 연구 책임자(스폰서와 다른 경우), 연구를 감독하는 IRB, 해당 약물 또는 의료 기기가 판매될 국가의 규제 기관이 공유한다. 연구 참여자의 안전을 보장하기 위해 체계적인 동시 안전성 검토가 자주 사용된다.
안전상의 이유로, 약물에 대한 많은 임상 시험[90]은 가임기 여성, 임산부 또는 연구 중 임신한 여성을 제외한다. 일부 경우에는, 이러한 여성의 남성 파트너도 제외되거나 피임 조치를 취하도록 요구된다.
동의는 윤리적 행위에 대한 필수 조건이지만 윤리적 행위를 보장하지는 않는다. 동정적 사용 시험에서는 최종 목표를 정량화된 객관적 기능으로 전환하기 어려울 수 있다.
어린이에 대한 임상 시험(소아과)을 수행할 때와 응급 또는 전염병 상황에서 추가적인 윤리적 우려가 존재한다.[71][72]
6. 1. 사전 동의
임상시험은 연구 대상자가 사전 동의를 나타내는 문서에 서명하도록 모집한다.[53] 이 문서에는 목적, 기간, 필요한 절차, 위험, 잠재적 이점, 주요 연락처 및 기관 요구 사항과 같은 세부 정보가 포함된다.[54] 그런 다음 참가자는 문서에 서명할지 여부를 결정한다. 이 문서는 계약이 아니며, 참가자는 불이익 없이 언제든지 탈퇴할 수 있다.사전 동의는 모집 대상자가 참여 여부를 결정하기 전에 주요 사실에 대해 안내받는 법적 절차이다.[53] 연구원은 피험자가 이해할 수 있는 용어로 연구의 세부 사항을 설명한다. 정보는 피험자의 모국어로 제공된다. 일반적으로 어린이는 자율적으로 사전 동의를 제공할 수 없지만, 나이 및 기타 요인에 따라 동의를 제공해야 할 수 있다.
임상시험 실시자는 임상시험 참여자에 대해 임상시험 참여에 앞서 실시할 시험의 목적 및 내용에 대해 설명할 의무가 있다. 참여자가 환자인 경우, 해당 치료법 등에 대해 예측되는 이점과 불이익, 다른 치료법의 제시 및 비교, 예측되는 최악의 결과 등을 상세히 설명하고 합의가 필수적이다. 충분히 이해한 참여자 본인의 자유 의지에 한해 임상시험 참여가 결정된다. 참여자는 언제든지 자유롭게 임상시험에서 탈퇴할 수 있으며, 임상시험 탈퇴로 인해 향후 치료나 경제적 제재 등 불이익은 일절 발생하지 않음이 보장되며, 간접적인 강제 또한 허용되지 않는다.
6. 2. 기관생명윤리위원회(IRB) / 임상시험심사위원회
임상시험은 의료기관 생명윤리 심의위원회(IRB)의 승인을 받아야 하며, IRB는 연구 윤리, 안전성, 과학적 타당성 등을 심의한다.[69] IRB는 연구자가 연구를 시작하기 전에 의학적 안전성과 연구에 참여하는 환자 보호를 위해 연구를 면밀히 조사한다.[47] 연구 절차나 환자에게 제공되는 설명의 변경을 요구할 수 있으며, 연구 책임자로부터 제출되는 연례 "지속적 검토" 보고서는 연구의 진행 상황과 연구와 관련된 새로운 안전 정보를 IRB에 업데이트한다. 한국에서는 2013년부터 모든 임상시험에 대해 IRB 심의가 의무화되었으며, IRB의 독립성과 전문성을 강화하기 위한 노력이 지속되고 있다.6. 3. 이해 상충
임상시험 연구자는 제약회사 등으로부터 재정적 지원을 받는 경우가 많다. 이 때문에 연구 결과에 영향을 줄 수 있는 이해 상충 문제가 발생할 수 있다.[76] 예를 들어, 제약 회사에 고용되지 않은 연구자들도 연구비를 지원받기 위해 제조업체에 의존하는 경우가 많다.[76]이러한 이해 상충은 연구 결과의 객관성과 신뢰성을 떨어뜨릴 수 있다. 따라서, 이를 방지하기 위한 여러 조치가 이루어지고 있다. 미국 제약 연구 및 제조업체 협회는 연구 결과를 모두 보고하고, 연구자가 제약 회사와 맺는 재정적 관계를 제한하도록 하는 지침을 발표했다.[74] 미국 의회는 2상 및 3상 임상시험을 미국 국립 보건원이 관리하는 웹사이트(clinicaltrials.gov)에 등록하도록 의무화하는 법안을 통과시켰다.[75]
또한, 주요 학술지 편집자들은 임상시험 후원자가 연구 결과를 출판 전에 검토하거나 출판을 보류할 수 있도록 하는 계약을 비판하며, 이러한 영향을 막기 위해 편집상의 제한을 강화했다.[81]
하지만 이러한 노력에도 불구하고 산업 자금 지원 임상시험 결과의 신뢰성에 대한 우려는 여전히 남아있다.[83] 따라서 대중의 신뢰를 유지하기 위해서는 학계와 산업 협력에 대한 윤리적 기준을 엄격하게 준수해야 한다.[83]
6. 4. 취약 계층 보호
임상 연구 윤리와 임상 시험 간행물에서는 임상시험 참여자에 대한 보호, 특히 취약 계층에 대한 특별한 주의가 필요하다는 점을 강조한다.임산부와 어린이는 취약 계층으로 간주되어 임상시험에서 일반적으로 제외되지만, 이들을 제외하는 것을 뒷받침할 만한 충분한 데이터는 없다.[87] 이들을 임상시험에서 제외하면 이 집단에 대한 치료법의 안전성과 효과에 대한 정보가 부족해지는 경우가 많다. HIV/AIDS 유행 초기에 한 과학자는 생명을 구할 수 있는 치료법에서 이 집단을 제외함으로써 그들을 "죽음으로부터 보호"하고 있다고 지적했다. 백신, 유행병 및 신기술 연구 윤리(PREVENT)와 같은 프로젝트는 백신 임상시험에 임산부를 윤리적으로 포함하는 것을 옹호해 왔다. 어린이를 임상시험에 포함하는 것은 어린이가 의사 결정 자율성이 부족하기 때문에 추가적인 도덕적 고려 사항이 있다. 과거의 임상시험은 입원한 어린이 또는 고아를 사용했다는 비판을 받았고, 이러한 윤리적 문제는 향후 연구를 효과적으로 중단시켰다. 효과적인 소아 진료를 유지하기 위한 노력의 일환으로, 여러 유럽 국가와 미국은 제약 회사들이 소아 임상시험을 수행하도록 유도하거나 강제하는 정책을 가지고 있다. 국제 지침은 해를 제한하고, 다양한 위험을 고려하며, 소아 진료의 복잡성을 고려하여 윤리적인 소아 임상시험을 권장한다.[87]
임상시험 실시자는 임상시험 참여자에게 시험 참여에 앞서 시험의 목적 및 내용을 설명할 의무가 있다. 참여자가 환자인 경우, 해당 치료법 등에 대해 예측되는 이점과 불이익, 다른 치료법의 제시 및 비교, 예측되는 최악의 결과 등을 상세히 설명하고 합의가 필수적이다. 충분히 이해한 참여자 본인의 자유 의지에 한해 임상시험 참여가 결정된다. 참여자는 언제든지 자유롭게 임상시험에서 탈퇴할 수 있으며, 임상시험 탈퇴로 인해 향후 치료나 경제적 제재 등 불이익은 일절 발생하지 않음이 보장되며, 간접적인 강제 또한 허용되지 않는다.
윤리적이기 위해 연구자는 참여하는 인체 피험자로부터 완전하고 동의를 얻어야 한다.[69] 환자가 스스로 동의할 수 없는 경우, 연구자는 환자의 법적 대리인으로부터 동의를 구할 수 있다. 또한, 임상 시험 참여자는 언제든지 불이익 없이 임상 시험에서 탈퇴할 수 있음을 알아야 한다.[69] 캘리포니아주에서는 법적 대리인 역할을 할 수 있는 개인의 우선순위를 정했다.[70]
7. 임상시험 관련 문제점
임상시험과 관련하여 여러 문제점이 지적되어 왔다.
- 부정 및 부작용 은폐: 일부 임상시험에서 연구 부정행위나 부작용 은폐 사례가 발생하여 사회적 문제가 되기도 한다. 대표적인 예로, 2013년 고혈압 치료제 디오반 사건에서는 무작위가 아닌 효과가 있을 것 같은 환자를 선택하여 약물을 투여하는 사례가 발각되기도 하였다.[139]
- 출판 편향: 제약 회사에 유리한 결과만 발표되고 불리한 결과는 은폐될 가능성이 있다는 문제가 제기되어 왔다.[137] 이는 메타 분석을 통해 부정적인 결과가 나타나는 경우가 있다는 점에서 확인할 수 있다.
- 항우울제 관련 문제: 항우울제는 우울증에 대한 적응증이 있지만, 의사가 감지한 변화의 인상을 감지하기 위한 전반적인 인상 평가 척도 - 개선도(CGI-I)에서 차이를 감지할 수 없어 통계적으로 유의미한 차이가 있을 뿐만 아니라, 그 차이가 임상적으로 의미가 있는지 여부를 의약품 승인 시 검토해야 한다는 지적이 있다.[138]
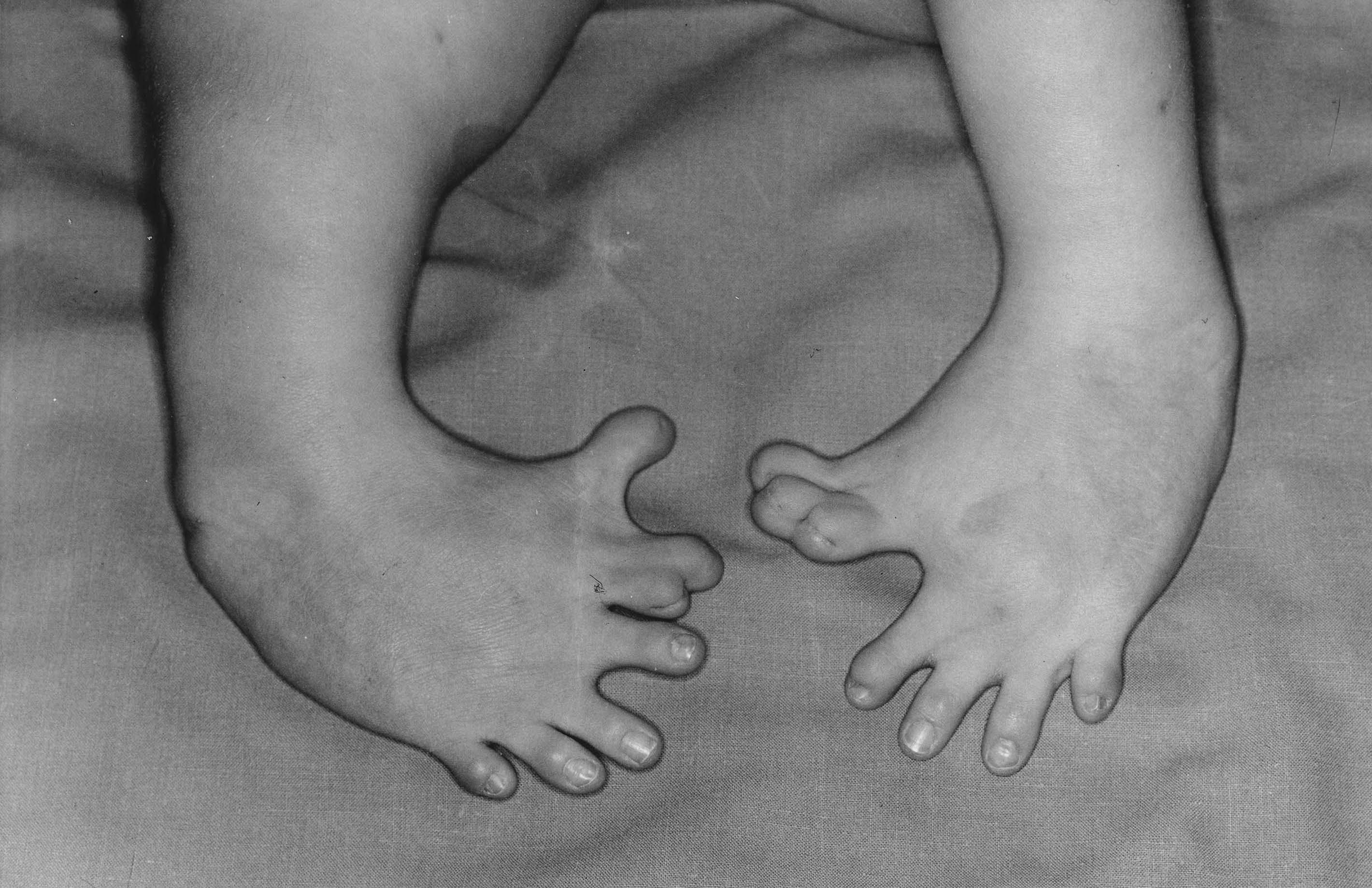
- 탈리도마이드 사건: 1957년 독일 그뤼넨탈 사는 탈리도마이드를 '콘테르간'이라는 이름의 임부 입덧 방지 및 수면제로 출시했다. 탈리도마이드는 동물실험에서 부작용이 없어, 임상시험 없이 '무독성' 제품으로 광고되었고, 많은 임부들이 복용했다. 그러나 이 약을 복용한 임부들에게서 사지가 없거나 짧은 해표지증, 단지증, 심장 기형, 뇌 손상, 시력 및 청력 상실, 자폐증 등의 부작용을 가진 신생아들이 태어났다. 생존률 자체도 낮았으며, 이들을 탈리도마이드 베이비(Thalidomide Baby)라고 불렀다. 1962년 판매 금지될 때까지 5년간 사용된 탈리도마이드로 인해, 전 세계 48개국에서 1만 2천여 명 이상의 기형아가 태어났다. 이 사건은 '콘테르간 스캔들'로 불리며 최악의 약해사고로 현대 의학사에 기록되었다.[190]
8. 임상시험 등록 및 정보 공개
임상시험의 투명성을 높이고 출판 편향 문제를 해결하기 위해 임상시험 등록 및 결과 공개 제도가 운영되고 있다. 한국에서는 식품의약품안전처가 '의약품 임상시험 정보 포털'을 운영하여 임상시험 정보, 결과 요약 보고서 등을 공개하고 있다.[147]
9. 임상시험 관련 기관 및 직종
임상시험은 다양한 기관 및 직종의 협력을 통해 이루어진다.
의료기관에서는 임상시험 책임 의사 또는 임상시험 분담 의사의 지도하에 임상시험이 진행되며, 이들은 임상시험 실시에 관한 책임을 진다. 임상시험 협력자(CRC)는 간호사, 약사, 임상 검사 기사 등의 의료 관계자로서, 임상시험의 스케줄 관리, 환자 지원, 증례 보고서 작성 보조 등 다양한 업무를 담당한다. 임상시험 사무국은 임상시험 실시에 관련된 사무를 담당하며, 임상시험 시설 지원 기관(SMO)은 의료기관의 임상시험 업무를 지원한다.
제약회사(임상시험 의뢰자)는 신약 개발을 위해 임상시험을 의뢰하며, 개발 업무 위탁 기관(CRO)은 임상시험 실시에 관련된 업무를 대행한다. 모니터(CRA)는 임상시험 의뢰자가 임명하는 담당자로, 임상시험이 계획서 및 법령을 준수하는지, 데이터가 정확하고 완전한지 등을 확인하며, 의료기관과 임상시험 의뢰자 간의 정보 교환을 담당한다.[1]
9. 1. 의료기관
; 임상시험 책임 의사·임상시험 분담 의사: 임상시험 책임 의사는 임상시험 실시에 관해 책임을 지는 의사 또는 치과의사이다. 임상시험과 실시 시설에 각각 1명씩 둔다. 1개 시설에서 3종류의 임상시험을 실시하면 3명, 1종류의 임상시험을 3개 시설이 공동으로 실시하면 3명이 각각 필요하다. 임상시험 분담 의사는 임상시험 책임 의사의 지도하에 임상시험에 관한 업무를 분담하는 의사 또는 치과의사로, 인원에는 상한이 없다.
; 임상시험 협력자(임상시험 코디네이터, CRC: Clinical Research Coordinator)
: 임상시험 책임 의사 또는 임상시험 분담 의사의 지도하에 임상시험 업무에 협력하는 자를 말한다. 일반적으로 간호사, 약사, 임상 검사 기사 등의 의료 관계자가 임상시험 협력자가 된다. 동의 획득 보조, 임상시험의 스케줄 관리, 임상시험 중 환자 지원, 증례 보고서 작성 보조 등, 임상시험에서 임상시험 협력자의 담당 직무는 많다.
; 임상시험 사무국
: GCP에 근거하여 임상시험 실시에 관련된 다양한 사무를 담당하는 조직. 의료기관의 장에 의해 지명된다.
; 임상시험 시설 지원 기관 (SMO: Site Management Organization)
: 임상시험 실시 시설인 의료기관과 계약하여, 의료기관에서의 번잡한 임상시험 업무를 지원하는 조직.
9. 2. 제약회사(임상시험 의뢰자)
; 개발 업무 위탁 기관(CRO: contract research organization): 제약 기업의 신약 개발, 특히 임상 시험 실시에 관련된 업무를 대행하는 기관이다.
; 모니터(CRA: Clinical Research Associate)
: 임상 시험 의뢰자가 임명하는 담당자로, 임상 시험이 임상 시험 실시 계획서 및 각종 법령 등을 준수하고 과학적·윤리적으로 수행되고 있는지를 확인한다. 진료 기록 등 임상 시험과 관련된 의료 기록 열람이 허용되며, 피험자의 인권, 안전 및 복지가 보호되고 있는지, 임상 시험 책임 의사 또는 임상 시험 분담 의사로부터 보고된 임상 시험 데이터가 정확하고 완전한지 확인할 의무를 진다. 의료 기관과 임상 시험 의뢰자 간의 정보 교환은 거의 모든 모니터를 통해 이루어진다.[1]
10. 관련 법규 (대한민국)
대한민국의 임상시험 관련 법규는 다음과 같다.
- 약사법
- 「의약품 등의 안전에 관한 규칙」
- 「의약품 임상시험 관리기준」(식품의약품안전처 고시)
- 의료기기법
- 「의료기기 임상시험 관리기준」(식품의약품안전처 고시)
11. 긴급사용승인
미국 FDA는 긴급사용승인(EUA, Emergency Use Authorization) 제도를 통해 임상 3상까지 마치지 못한 신약을 임시로 시판 허가한다.[147]
2020년 3월 28일, 미국 FDA는 국가 전략비축물자(SNS)로 기증된 황산 히드록시클로로퀸 및 인산 클로로퀸 제제들을 코로나19로 입원한 일부 환자들에게 공급해 사용될 수 있도록 긴급사용승인(EUA) 결정을 내렸다.[147]
FDA는 EUA의 심사 기간에 대해서는 따로 규정을 두고 있지 않지만, 긴급 사용 승인(EUA)을 준비하는 데에는 약 15일(15 business days) 정도면 충분하다. 외국의 제약회사가 신약을 미국의 임상시험 연구소에 보내고, 미국 연구소가 15일 정도 시범 사용을 한 후에, FDA가 EUA 결정을 한다.[147]
참조
[1]
웹사이트
NIH Clinical Research Trials and You: The Basics
https://www.nih.gov/[...]
US National Institutes of Health
2022-10-03
[2]
웹사이트
Clinical Trials
https://docs.gatesfo[...]
Bill and Melinda Gates Foundation
2014-01-01
[3]
논문
Innovation in the pharmaceutical industry: New estimates of R&D costs
[4]
웹사이트
The Drug Development Process. Step 3: Clinical Research
https://www.fda.gov/[...]
US Food and Drug Administration
2018-01-04
[5]
웹사이트
How long a new drug takes to go through clinical trials
https://www.cancerre[...]
Cancer Research UK
2022-02-01
[6]
뉴스
The Solution to Drug Prices
https://www.nytimes.[...]
2015-09-09
[7]
웹사이트
FDA's Drug Review Process: Continued
https://www.fda.gov/[...]
2014-04-25
[8]
웹사이트
Drug Discovery and Development
http://www.phrma.org[...]
PhRMA
2007-02
[9]
웹사이트
Overview of Over-the-Counter Drugs
http://www.merckmanu[...]
Merck Manual
2013-10
[10]
서적
Powerful Medicines
Alfred A. Knopf
[11]
논문
Eligibility criteria of randomized controlled trials published in high-impact general medical journals: a systematic sampling review
2007-03
[12]
문서
Regulatory authorities for drugs
[13]
웹사이트
Medical Devices, Premarket Clinical Studies for Investigational Device Exemption
https://www.fda.gov/[...]
US Food and Drug Administration
2017-03-17
[14]
논문
Outcomes following endovascular vs open repair of abdominal aortic aneurysm: a randomized trial
2009-10
[15]
논문
Mechanical devices for urinary incontinence in women
2014-12
[16]
논문
Randomized controlled trials of surgical interventions
2010-03
[17]
논문
Surgical treatment of fibroids for subfertility
2020-01-29
[18]
논문
Study design in evidence-based surgery: What is the role of case-control studies?
2016-03
[19]
웹사이트
Public Information Pack (PIP): How to get involved in NHS, public health and social care research
https://www.nihr.ac.[...]
[20]
웹사이트
Briefing notes for researchers - public involvement in NHS, health and social care research
https://www.nihr.ac.[...]
[21]
서적
Clinical trials: design, conduct, and analysis
https://books.google[...]
Oxford University Press, USA
[22]
서적
The Harvard Medical School guide to men's health
https://archive.org/[...]
Free Press
[23]
서적
Scurvy: How a Surgeon, a Mariner, and a Gentleman Solved the Greatest Medical Mystery of the Age of Sail
St. Martin's Press
[24]
서적
Diffusion of Innovations
The Free Press
[25]
서적
Scientific American Inventions and Discoveries
John Wiley & Songs, Inc.
[26]
웹사이트
James Lind: A Treatise of the Scurvy (1754)
http://www.bruzelius[...]
[27]
웹사이트
About Clinical Trials Day
https://www.clinical[...]
[28]
서적
Clinical Trials in Oncology, Second Edition
https://books.google[...]
CRC Press
2002-07-30
[29]
서적
Clinical Trials Handbook
https://books.google[...]
John Wiley & Sons
2009-06-17
[30]
논문
Frederick Akbar Mahomed
1992-02
[31]
서적
Educational research: Planning, conducting, and evaluating quantitative and qualitative research
Prentice Hall
[32]
웹사이트
Replication study
http://www.experimen[...]
[33]
논문
Sir Geoffrey Marshall (1887-1982): respiratory physician, catalyst for anaesthesia development, doctor to both Prime Minister and King, and World War I Barge Commander
2011-02
[34]
뉴스
ISCR releases Guide for clinical trial participants on International Clinical Trials Day
http://www.pharmabiz[...]
Pharmabiz.com
2014-05-19
[35]
논문
SearCh for humourIstic and Extravagant acroNyms and Thoroughly Inappropriate names For Important Clinical trials (SCIENTIFIC): qualitative and quantitative systematic study
2014-12-16
[36]
웹사이트
What are the different types of clinical research?
https://www.fda.gov/[...]
US Food and Drug Administration
2019-05-24
[37]
웹사이트
What is a clinical study?
https://clinicaltria[...]
National Library of Medicine, US National Institutes of Health
2019-03-01
[38]
학술지
EU Compassionate Use Programmes (CUPs): Regulatory Framework and Points to Consider before CUP Implementation
[39]
웹사이트
CROs Slowly Shifting to Adaptive Clinical Trial Designs
http://www.outsourci[...]
Outsourcing-pharma.com
2013-06-05
[40]
웹사이트
Adaptive Clinical Trials for Overcoming Research Challenges
http://www.news-medi[...]
News-medical.net
2013-09-17
[41]
웹사이트
Health: Scientists Look to Improve Cost and Time of Drug Trials - WSJ.com
https://web.archive.[...]
Online.wsj.com
2013-12-30
[42]
서적
The Cure in the Code: How 20th Century Law Is Undermining 21st Century Medicine
https://books.google[...]
Basic Books
2013-11-12
[43]
학술지
Phase 0 trials: a platform for drug development?
2009-07-01
[44]
웹사이트
Phase IIa and Phase IIb clinical trial
https://www.muscular[...]
[45]
학술지
Randomized clinical trials and observational studies: guidelines for assessing respective strengths and limitations
2008-06-01
[46]
학술지
Clinical Research Methodology 2: Observational Clinical Research
2015-10-01
[47]
학술지
Defining Feasibility and Pilot Studies in Preparation for Randomised Controlled Trials: Development of a Conceptual Framework
[48]
웹사이트
Active Control / Active Comparator
http://www.statistic[...]
2017-03-03
[49]
웹사이트
Master Protocols for Drug and Biological Product Development
https://www.fda.gov/[...]
U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research
2023-12-21
[50]
웹사이트
Foundation Medicine Joins Coalition Aiming to Shake Up Cancer Drug Trials | MIT Technology Review
https://web.archive.[...]
Technologyreview.com
[51]
웹사이트
ICH Official web site
https://www.ich.org/[...]
[52]
웹사이트
ICH Official web site : ICH
http://www.ich.org/
[53]
웹사이트
Learn About Clinical Studies
https://web.archive.[...]
[54]
서적
Protection of Human Research Subjects: A Practical Guide to Federal Laws and Regulations
Springer US
[55]
학술지
Statistics in Brief: Statistical Power: What Is It and When Should It Be Used?
2011-01-01
[56]
학술지
FDA approval for use of medications in pregnancy: an uphill battle
2011-01-01
[57]
웹사이트
Frequently Asked Questions | University of Arizona Cancer Center
https://web.archive.[...]
Azcc.arizona.edu
[58]
웹사이트
Janssen Uses Geofencing To Monitor Clinical Trial Patients
https://www.clinical[...]
VertMarkets
2019-12-17
[59]
학술지
The Role of Clinical Trial Participation in Cancer Research: Barriers, Evidence, and Strategies
American Society of Clinical Oncology
2016-01-01
[60]
학술지
Impact of seasonality on conducting clinical studies in dermatology
[61]
웹사이트
Seasonality: The Clinical Trial Manager's Logistical Challenge
https://web.archive.[...]
Pharm-Olam International
[62]
웹사이트
Implementing QbD in Your Clinical Trial? 4 Questions To Answer First
https://www.clinical[...]
VertMarkets
2019-12-19
[63]
논문
Motivation for Health Information Seeking and Processing About Clinical Trial Enrollment
[64]
웹사이트
BIO to Use ViS Analytics to Streamline Pediatric Clinical Research - WSJ.com
https://web.archive.[...]
Online.wsj.com
2013-05-07
[65]
간행물
Clinical Trial Technology Utilization, Purchasing Preferences & Growth Outlook
Life Sciences Strategy Group
2009-05-01
[66]
웹사이트
Electronic Patient Reported Outcomes (ePRO) – Changing the Face of Clinical Trials
https://web.archive.[...]
[67]
학술지
Common statistical concerns in clinical trials
[68]
서적
Small Clinical Trials Issues and Challenges; In: Statistical Approaches to Analysis of Small Clinical Trials
https://www.ncbi.nlm[...]
National Academies Press (US)
[69]
학술지
The Ethics of Withdrawal from Study Participation
[70]
웹사이트
Assembly Bill No. 2328
https://web.archive.[...]
[71]
논문
Ethical dilemma for Ebola drug trials
2014-11-01
[72]
논문
Emergency research and the interests of participants
http://dro.dur.ac.uk[...]
2019-07-13
[73]
뉴스
When a Drug Study Abruptly Ends, Volunteers Are Left to Cope
https://www.nytimes.[...]
2020-03-03
[74]
논문
Who pays for the pizza? Redefining the relationships between doctors and drug companies. 2: Disentanglement
[75]
웹사이트
Hogan & Hartson Update on Pharmaceutical Trial Registration
http://www.hhlaw.com[...]
2008-03-03
[76]
뉴스
Rise in Scientific Journal Retractions Prompts Calls for Reform
https://www.nytimes.[...]
2012-04-16
[77]
논문
Lack of involvement of medical writers and the pharmaceutical industry in publications retracted for misconduct: a systematic, controlled, retrospective study
2011-06-01
[78]
논문
Seeding trials: just say "no"
2008-08-01
[79]
웹사이트
Development & Approval Process (Drugs)
https://www.fda.gov/[...]
U.S. Food and Drug Administration
[80]
웹사이트
Information Sheet Guidance For IRBs, Clinical Investigators, and Sponsors: FDA Inspections of Clinical Investigators
https://www.fda.gov/[...]
2010-06-01
[81]
논문
Sponsorship, authorship and accountability
http://www.cmaj.ca/c[...]
2001-09-01
[82]
논문
Ten recommendations for closing the credibility gap in reporting industry-sponsored clinical research: a joint journal and pharmaceutical industry perspective
2012-05-01
[83]
논문
Credibility of industry-funded clinical trials
2013-09-01
[84]
논문
Treatment Guidelines in Bipolar Disorders and the Importance of Proper Clinical Trial Design
2017-02-01
[85]
논문
Severity of symptoms in mania-clinical guidelines and study design implications
https://pubmed.ncbi.[...]
2018-01-01
[86]
논문
Credibility of industry-funded clinical trials
2013-01-01
[87]
논문
Ethics of Conducting Clinical Research in an Outbreak Setting
[88]
웹사이트
NINDS Guidelines for Monitoring in Clinical Trials {{!}} National Institute of Neurological Disorders and Stroke
https://www.ninds.ni[...]
[89]
웹사이트
Data and Safety Monitoring Board Training Manual for Investigator-Initiated Studies – Tufts CTSI
https://tuftsctsi.wp[...]
2018-05-15
[90]
서적
Designing and Conducting Clinical Trials – An overview
International Journal of Statistics and Medical Informatics
[91]
웹사이트
For Patients: Informed Consent for Clinical Trials
https://www.fda.gov/[...]
US Food and Drug Administration
2016-02-25
[92]
웹사이트
Guidance for Industry: Financial Disclosure by Clinical Investigators
https://www.fda.gov/[...]
Food and Drug Administration
2001-03-20
[93]
논문
Clinical trials have gone global: is this a good thing?
[94]
웹사이트
India: Prime Destination for Unethical Clinical Trials
http://www.commondre[...]
[95]
웹사이트
Pmda.go.jp 独立行政法人 医薬品医療機器総合機構
http://www.pmda.go.j[...]
[96]
웹사이트
ICH Official web site : ICH
https://www.ich.org/[...]
[97]
웹사이트
Management of Safety Information from Clinical Trials: Report of CIOMS Working Group VI
https://cioms.ch/sho[...]
2005-01-01
[98]
웹사이트
Investigational New Drug (IND) Application - Final Rule: Investigational New Drug Safety Reporting Requirements for Human Drug and Biological Products and Safety Reporting Requirements for Bioavailability and Bioequivalence Studies in Humans
https://www.fda.gov/[...]
Center for Drug Evaluation and Research
2010-09-29
[99]
웹사이트
Guidance for Industry and Investigators Safety Reporting Requirements for INDs and BA/BE Studies Small Entity Compliance Guide
https://www.fda.gov/[...]
Food and Drug Administration
2012-12-01
[100]
웹사이트
Safety Assessment for IND Safety Reporting Guidance for Industry
https://www.fda.gov/[...]
Food and Drug Administration
2015-12-01
[101]
웹사이트
Evidence Synthesis and Meta-Analysis: Report of CIOMS Working Group X
https://cioms.ch/sho[...]
CIOMS Publications
2016-01-01
[102]
논문
Key cost drivers of pharmaceutical clinical trials in the United States
[103]
웹사이트
Tax Credit for Testing Expenses for Drugs for Rare Diseases or Conditions
https://www.fda.gov/[...]
Food and Drug Administration
2001-04-17
[104]
논문
The Internet and clinical trials: background, online resources, examples and issues
2005-03-01
[105]
논문
More than the money: A review of the literature examining healthy volunteer motivations
2011-05-01
[106]
논문
Achieving Ethnic Diversity in Trial Recruitment
https://web.archive.[...]
2011-11-14
[107]
논문
What influences recruitment to randomised controlled trials? A review of trials funded by two UK funding agencies
2006-04-00
[108]
웹사이트
Volunteering for a Clinical Trial
https://web.archive.[...]
CenterWatch
2016-11-26
[109]
웹사이트
Diversity and Inclusion in Clinical Trials
https://web.archive.[...]
2022-12-09
[110]
논문
Racial and Ethnic Disparities in Research Studies: The Challenge of Creating More Diverse Cohorts
2015-00-00
[111]
뉴스
Nearly Half of Black Patients With Metastatic Breast Cancer Report Not Being Informed About Clinical Trials
https://web.archive.[...]
2022-08-06
[112]
논문
Racial/Ethnic and Sex Representation in US-Based Clinical Trials of Hearing Loss Management in Adults: A Systematic Review
https://jamanetwork.[...]
2021-07-01
[113]
뉴스
How to stop a lack of diversity undermining clinical trial data
https://www.ft.com/c[...]
2019-02-26
[114]
웹사이트
Parkinson's Disease Clinical Trials
http://www.foxtrialf[...]
Fox Trial Finder
2013-11-14
[115]
웹사이트
Medical Information on the Internet
https://web.archive.[...]
Mlanet.org
2013-10-03
[116]
논문
MatchMiner: an open-source platform for cancer precision medicine
2022-10-06
[117]
논문
Comparing decision making between cancer patients and the general population: thoughts, emotions, or social influence?
[118]
웹사이트
How to Search for Clinical Studies
https://web.archive.[...]
ClinicalTrials.gov, US National Library of Medicine
2023-12-26
[119]
논문
Clinical trial design in the era of precision medicine
2022-08-00
[120]
웹사이트
What to Know About Cancer Clinical Trial Matching Programs
https://web.archive.[...]
2023-03-14
[121]
논문
Consensus recommendations for improving the cancer clinical trial matching environment
[122]
논문
Decentralized clinical trials (DCTs): A few ethical considerations
2022-12-15
[123]
논문
Decentralized Clinical Trials
2021-04-27
[124]
웹사이트
治験
http://www.pharm.or.[...]
社団法人日本薬学会
2009-01-16
[125]
웹사이트
一般の方へ―臨床研究とは―
https://www.okazakih[...]
岡崎市民病院
2022-06-05
[126]
웹사이트
研究段階の医療(臨床試験、治験など) 詳細情報
https://ganjoho.jp/m[...]
国立研究開発法人国立がん研究センター
2022-06-05
[127]
웹사이트
研究段階の医療(臨床試験、治験など) 基礎知識
https://ganjoho.jp/p[...]
国立研究開発法人国立がん研究センター
2022-06-05
[128]
웹사이트
臨床試験について
https://www.ut-cresc[...]
東京大学医学部附属病院 臨床研究推進センター
2022-06-05
[129]
웹사이트
非臨床試験 - 薬学用語解説 - 日本薬学会
https://www.pharm.or[...]
2022-03-19
[130]
웹사이트
臨床試験の基本用語
https://www.ims.u-to[...]
東京大学医科学研究所TR・治験センター
2022-06-05
[131]
웹사이트
医師主導治験とは
http://www.jmacct.me[...]
日本医師会
2022-06-05
[132]
웹사이트
どんな論文が本当に治療効果を証明しているのか?
https://satoru-blog.[...]
大須賀覚
2019-06-20
[133]
웹사이트
治験とは>2.治験のルール「GCP」
http://www.jpma.or.j[...]
日本製薬工業協会
[134]
논문
癌臨床試験のデザインと倫理-第Ⅱ相試験
https://opac.ll.chib[...]
千葉医学会
2008-12-00
[135]
서적
医薬品適応外使用のエビデンス―Evidence of Off-Label Use of Drug
デジタルプレス
1999-00-00
[136]
서적
ファルマゲドン
みすず書房
2015-00-00
[137]
뉴스
Antidepressants: The Emperor’s New Drugs?
https://www.huffpost[...]
The Huffington Post
2010-01-29
[138]
논문
Empirically derived criteria cast doubt on the clinical significance of antidepressant-placebo differences
https://doi.org/10.1[...]
[139]
뉴스
聖マリが新たに六つの臨床研究を中止へ
https://yomidr.yomiu[...]
読売新聞
2017-02-13
[140]
논문
Innovation in the pharmaceutical industry: New estimates of R&D costs
https://linkinghub.e[...]
[141]
뉴스
The Solution to Drug Prices
http://www.nytimes.c[...]
[142]
웹사이트
FDA's Drug Review Process: Continued
https://www.fda.gov/[...]
2014-04-25
[143]
웹사이트
Drug Discovery and Development
https://www.phrma.or[...]
PhRMA
2007-02
[144]
웹사이트
Overview of Over-the-Counter Drugs
https://www.merckman[...]
Merck Manual
2013-10
[145]
서적
Powerful Medicines
Alfred A. Knopf
[146]
저널
Eligibility Criteria of Randomized Controlled Trials Published in High-Impact General Medical Journals: A Systematic Sampling Review
http://jama.jamanetw[...]
2007-03-21
[147]
문서
The regulatory authority in the USA, Canada, European Union, and Japan.
[148]
웹사이트
Medical Devices, Premarket Clinical Studies for Investigational Device Exemption
https://www.fda.gov/[...]
US Food and Drug Administration
2017-03-17
[149]
저널
Outcomes Following Endovascular vs Open Repair of Abdominal Aortic AneurysmA Randomized Trial
http://jama.jamanetw[...]
2009-10-14
[150]
저널
Mechanical devices for urinary incontinence in women
http://doi.wiley.com[...]
2014-12-17
[151]
저널
Randomized Controlled Trials of Surgical Interventions:
http://journals.lww.[...]
2010-03
[152]
저널
Study design in evidence-based surgery: What is the role of case-control studies?
http://www.wjgnet.co[...]
2016
[153]
서적
Clinical trials: design, conduct, and analysis
https://books.google[...]
Oxford University Press, USA
[154]
서적
Clinical trials : design, conduct, and analysis
https://www.worldcat[...]
Oxford University Press
1986
[155]
서적
The Harvard Medical School guide to men's health
https://www.worldcat[...]
Free Press
2002
[156]
서적
Scurvy : how a surgeon, a mariner, and a gentleman solved the greatest medical mystery of the age of sail
https://www.worldcat[...]
Thomas Dunne Books, St. Matin's Press
2004
[157]
서적
Diffusion of innovations
https://www.worldcat[...]
Free Press
2003
[158]
서적
Scientific American inventions and discoveries : all the milestones in ingenuity--from the discovery of fire to the invention of the microwave oven
https://www.worldcat[...]
John Wiley & Sons
2004
[159]
웹사이트
James Lind: A Treatise of the Scurvy (1754)
http://www.bruzelius[...]
2001
[160]
서적
Clinical trials in oncology
https://www.worldcat[...]
Chapman & Hall
2003
[161]
서적
Clinical trials handbook
https://www.worldcat[...]
Wiley
2009
[162]
저널
Frederick Akbar Mahomed.
https://www.ahajourn[...]
1992-02
[163]
서적
Educational research : planning, conducting, and evaluating quantitative and qualitative research
https://www.worldcat[...]
[164]
웹사이트
Replication study
https://web.archive.[...]
2009
[165]
저널
Sir Geoffrey Marshall (1887–1982): respiratory physician, catalyst for anaesthesia development, doctor to both Prime Minster and King, and World War I Barge Commander
http://journals.sage[...]
2011-02
[166]
뉴스
ISCR releases Guide for clinical trial participants on International Clinical Trials Day
http://www.pharmabiz[...]
Pharmabiz.com
2014-05-19
[167]
웹사이트
What are the different types of clinical research?
https://www.fda.gov/[...]
US Food and Drug Administration
2019
[168]
웹인용
신약개발 프로세스
http://www.hanmi.co.[...]
[169]
뉴스
The Solution to Drug Prices
https://www.nytimes.[...]
[170]
문서
Preclinical development, Animal Testing
[171]
웹사이트
의약품 개발 및 허가 과정, 신약개발 과정, 제 1상
https://nedrug.mfds.[...]
[172]
웹사이트
What are the different types of clinical research?
https://www.fda.gov/[...]
US Food and Drug Administration
2019
[173]
웹사이트
의약품 개발 및 허가 과정, 신약개발 과정, 제 2상
https://nedrug.mfds.[...]
[174]
저널
Seamless Phase IIa/IIb and enhanced dose-finding adaptive design
https://www.tandfonl[...]
2016-09-02
[175]
웹사이트
의약품 개발 및 허가 과정, 신약개발 과정, 제 3상
https://nedrug.mfds.[...]
[176]
저널
Randomized Clinical Trials and Observational Studies
https://linkinghub.e[...]
2008-06
[177]
저널
Clinical Research Methodology 2: Observational Clinical Research
http://journals.lww.[...]
2015-10
[178]
저널
Defining Feasibility and Pilot Studies in Preparation for Randomised Controlled Trials: Development of a Conceptual Framework
https://dx.plos.org/[...]
2016-03-15
[179]
웹사이트
Active Control / Active Comparator
http://www.statistic[...]
[180]
웹사이트
Foundation Medicine Joins Coalition Aiming to Shake Up Cancer Drug Trials | MIT Technology Review
http://www.technolog[...]
2013-11-14
[181]
웹사이트
Learn About Clinical Studies
https://web.archive.[...]
2012-04-10
[182]
서적
Protection of Human Research Subjects : a Practical Guide to Federal Laws and Regulations
https://www.worldcat[...]
Springer US
1984
[183]
저널
In Brief: Statistics in Brief: Statistical Power: What Is It and When Should It Be Used?
http://link.springer[...]
2011-02
[184]
저널
FDA approval for use of medications in pregnancy: an uphill battle
https://www.ncbi.nlm[...]
2011
[185]
웹사이트
Frequently Asked Questions | University of Arizona Cancer Center
http://azcc.arizona.[...]
2013-12-02
[186]
뉴스
Janssen Uses Geofencing To Monitor Clinical Trial Patients
https://www.clinical[...]
Clinical Leader
2019-12-17
[187]
저널
The Role of Clinical Trial Participation in Cancer Research: Barriers, Evidence, and Strategies
http://ascopubs.org/[...]
2016-05
[188]
저널
Impact of seasonality on conducting clinical studies in dermatology
https://linkinghub.e[...]
2008-09
[189]
웹사이트
Seasonality: The Clinical Trial Manager's Logistical Challenge
https://web.archive.[...]
2011-07-15
[190]
뉴스
탈리도마이드 사건, 그리고 대한민국
http://www.doctorsti[...]
의사신문
2020-01-14
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com