신경독
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
신경독은 신경계에 해로운 영향을 미치는 물질로, 세포막을 통한 이온 조절 방해, 시냅스 간 신호 전달 차단, 흥분독성 유발 등 다양한 작용 기전을 통해 신경세포에 손상을 입힌다. 납, 메탄올, 글루탐산염, 보툴리눔 독소, 테트로도톡신 등 다양한 종류가 있으며, 체내에서 생성되는 내인성 신경독과 외부에서 유입되는 외인성 신경독, 생물에서 유래하는 신경독으로 구분된다. 신경독은 신경계 연구 및 특정 질환 연구에 활용되기도 하지만, 암살에 사용될 정도로 치명적인 독성을 지닌다.
더 읽어볼만한 페이지
- 표재성 막 단백질 - 알파-시누클레인
알파-시누클레인은 신경 조직에서 발견되는 시누클레인 단백질로, 시냅스 소포 조절, 도파민 조절 등 다양한 기능을 수행하지만 응집되어 레비 소체를 형성하면 파킨슨병과 같은 시누클레인병증을 유발하며, 장-뇌 축을 통해 파킨슨병 발병에 영향을 미치고 유전자 돌연변이는 가족성 파킨슨병의 원인이 될 수 있다. - 표재성 막 단백질 - 트롬빈
트롬빈은 혈액 응고 과정에서 중요한 세린 프로테아제 효소로서, 프로트롬빈 활성화를 통해 피브리노겐을 피브린으로 전환시켜 혈전 형성을 촉진하고, 혈소판 활성화, 혈관 수축, 단백질 C 활성화, 질병 발병 등 다양한 생리활성과 의학 및 식품 분야 응용 가능성을 가진다. - 신경독 - 이황화 탄소
이황화 탄소는 1796년 람파디우스가 합성한 무색 휘발성 액체로, 높은 굴절률과 우수한 용매 특성을 지니지만, 가연성과 독성으로 인해 건강 문제를 유발하여 사용량이 감소하고 법적 규제를 받고 있다. - 신경독 - 스트리크닌
스트리크닌은 마전과 스트리크노스속 식물에서 추출되는 맹독성 알칼로이드로, 신경 기능 억제 효과를 이용해 살서제 등으로 사용되며 유기화학 합성 연구의 대상이 되어 왔다. - 신경과학 - 인공 일반 지능
인공 일반 지능(AGI)은 추론, 지식 표현, 학습 등의 능력을 갖춘 인공지능 시스템을 의미하며, 기아와 빈곤 해결 등의 이점을 제공하지만 통제력 상실과 같은 위험도 존재한다. - 신경과학 - 계산신경과학
계산신경과학은 컴퓨터 과학과 신경과학의 융합 분야로, 뇌의 정보 처리 과정을 계산 모델로 연구하며, 뇌 기능 설명, 뉴런 및 신경망 모델링, 인공지능 활용 비교 연구, 계산 임상 신경과학 발전 등을 포함한다.
2. 신경독의 작용 메커니즘
신경독은 신경계에 악영향을 미치는 물질로, 그 작용 기전은 매우 다양하다. 신경독은 뉴런의 세포 과정을 억제하는데, 세포막 탈분극 기전부터 시냅스(뉴런 간 정보 전달)에 이르기까지 다양한 방식으로 작용한다. 뉴런 기능이나 신호 전달을 억제함으로써, 신경독은 보툴리눔 독소[12]처럼 전신 신경계 마비를 유발하거나 신경 조직 사멸[29]을 초래할 수 있다. 신경독 노출 후 증상이 나타나는 시간은 독소에 따라 다르며, 보툴리눔 독소는 수 시간[17], 납은 수년[30]이 걸릴 수 있다.
신경독의 작용 기전은 다음과 같이 분류할 수 있다.
신경독 노출은 신경세포 흥분독성이나 세포자살[135], 신경 아교 세포 손상[136]을 유발할 수 있다. 의약품의 신경 보호 작용 배양 시험에서는 글루탐산이나 N-메틸-D-아스파라긴산(NMDA), 카이닌산이 신경독으로 자주 사용된다. 동물 신경 세포 배양 시험에서 글루탐산(500μM 농도 이상)으로 24시간 배양 후 신경 세포 대부분이 사멸한다. 시험 약물이 어느 정도 농도에서 배양 신경 세포를 몇 % 생존시켰는지에 따라 신경 보호 능력을 평가한다. 글루탐산 수용체나 서브유닛을 활성화시켜 칼슘 이온 과잉 유입으로 신경 세포 아포토시스를 유도한다고 알려져 있다.
2. 1. 이온 채널 조절 방해
신경독은 세포 막을 건너는 이온 농도에 대한 신경세포 조절을 막거나,[133] 시냅스를 건너는 신경세포 간의 연락을 차단한다.[134] 신경독은 뉴런의 세포 과정을 억제하여 세포막 탈분극 기전부터 뉴런 간 정보 전달에 이르기까지 다양한 방식으로 작용한다. 뉴런의 기능 수행이나 인접 세포로의 신호 전달을 억제함으로써, 신경독은 보툴리눔 독소[12]처럼 전신 신경계 마비를 유발하거나 신경 조직의 사멸[29]을 초래할 수 있다.많은 신경독은 전압 의존성 이온 채널에 영향을 주어 작용한다. 예를 들어, 테트로도톡신과 바트라코톡신은 나트륨 채널에, maurotoxin|마우로톡신영어, agitoxin|아지톡신영어, charybdotoxin|카리브도톡신영어, margatoxin|마르가톡신영어, slotoxin|슬로톡신영어, scyllatoxin|실라톡신영어, hefutoxin|헤프토톡신영어은 칼륨 채널에, calciseptine|칼시셉틴영어, taicatoxin|타이카톡신영어, calcicludine|칼시클루딘영어은 칼슘 채널에 작용한다.
바트라코톡신과 같은 강력한 신경독은 흥분성 세포막의 나트륨 이온 투과성 증가에 따른 신경 및 근육 섬유의 탈분극을 통해 신경계에 영향을 미친다.
붕가로톡신은 신경전달물질 결합으로 활성화되는 이온 채널인 니코틴성 아세틸콜린 수용체(nAChR)와 상호작용한다.[81] α-붕가로톡신은 α7-nAChR에 특이적으로 작용하여[82] 칼슘 이온 유입을 차단하고 ACh 신호를 억제하여 손상을 유발한다.
다음은 이온 채널에 작용하는 신경독의 예시이다.
2. 2. 시냅스 전달 방해
신경독은 신경세포 조절을 막거나, 시냅스를 건너는 신경세포 사이의 연락을 못하게 하여 신경계에 악영향을 미친다.[134] 신경독의 작용 기전은 여러 가지가 있으며, 그중 하나는 뉴런의 세포 과정을 억제하는 것이다. 이러한 억제 과정은 세포막 탈분극 기전부터 뉴런 간의 정보 전달에 이르기까지 다양하다. 뉴런이 세포 내 기능을 수행하거나 인접 세포에 신호를 전달하는 능력을 억제함으로써, 신경독은 보툴리눔 독소[12]의 경우처럼 전신 신경계 마비를 유발하거나 심지어 신경 조직의 사멸[29]을 초래할 수 있다.2. 3. 혈액-뇌 장벽(BBB) 억제
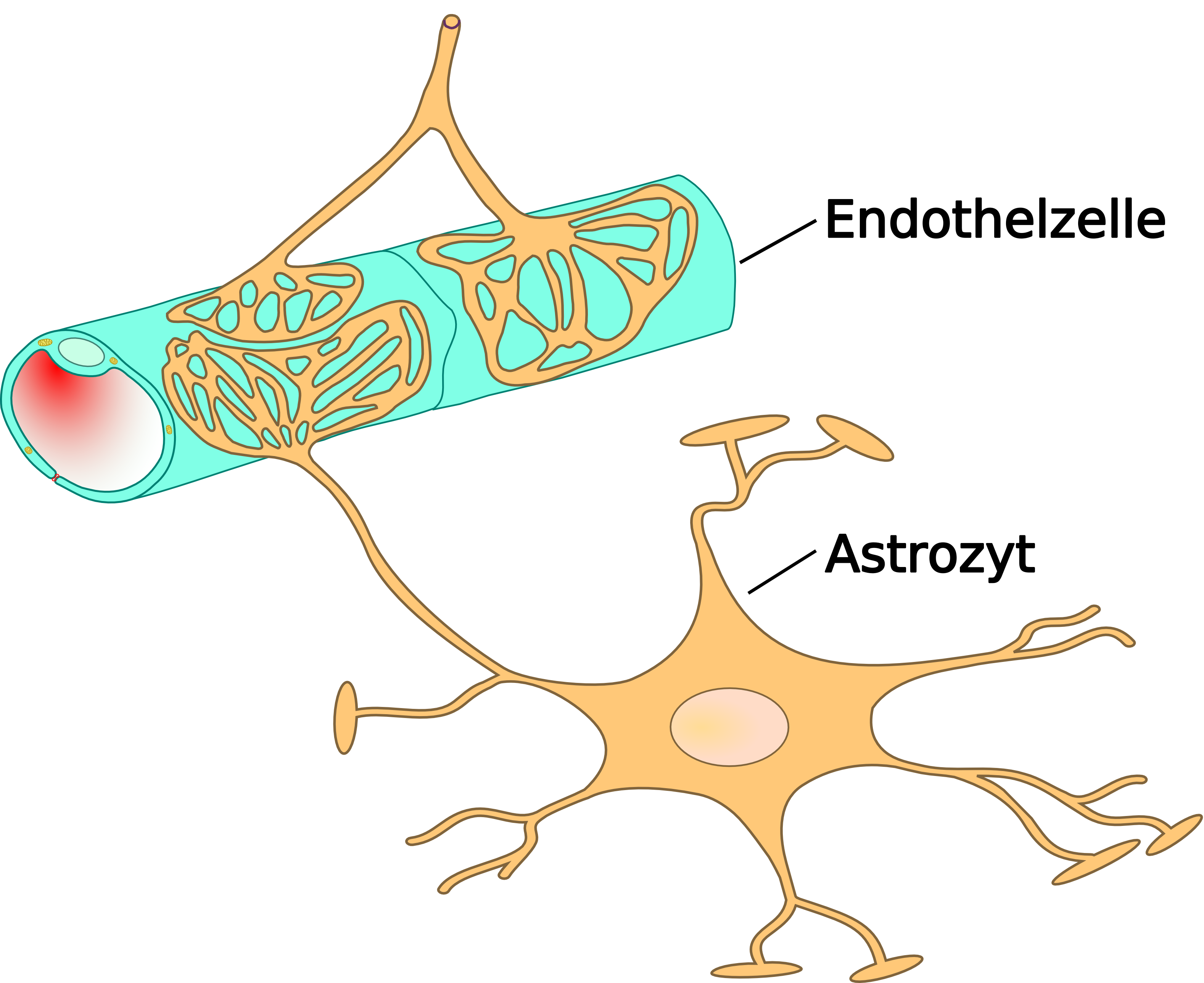
혈액-뇌 장벽(BBB)은 독소 및 기타 유해 화합물이 뇌에 도달하는 것을 방지하는 중요한 보호 체계이다.[21] 뇌는 영양소 유입과 노폐물 제거를 위해 혈류에 의해 관류되지만, 혈액은 섭취된 독소를 운반할 수 있어 뇌에 도달하면 뉴런 사멸을 유발할 수 있다. 성상교세포는 뇌의 모세혈관을 둘러싸고 혈액에서 영양소를 흡수하여 뉴런으로 전달함으로써 뇌를 잠재적인 화학적 손상으로부터 분리한다.[21]
이 장벽은 뇌 모세혈관 주위에 단단한 소수성 층을 형성하여 크거나 친수성 화합물의 이동을 억제한다. 맥락총은 뇌에서 독소 흡수에 대한 추가적인 보호층을 제공하며, 뇌의 제3, 제4 및 측면 뇌실에 있는 혈관이 풍부한 조직층으로, 상의세포의 기능을 통해 뇌척수액(CSF)의 합성을 담당한다.[22] 맥락총은 이온과 영양소의 선택적 통과와 중금속을 가두는 기능을 통해 뇌와 척수를 포함하는 엄격하게 조절되는 환경을 유지한다.[21][22]
소수성이고 크기가 작거나 성상교세포 기능을 억제하는 특정 신경독성 물질은 뇌에 침투하여 손상을 유발할 수 있다.
2. 4. 세포골격 간섭
암모니아는 섭취하거나 간부전과 같은 질환으로 인해 독성이 나타날 수 있다.[88][89] 간 기능 저하로 인한 암모니아 독성은 간경변증에 반응하여 간성 뇌증을 일으키고 뇌부종을 초래할 수 있다.[42] 뇌부종은 신경세포 재구성의 결과인데, 생체 내 암모니아 농도가 증가하면 세포 내 환상구아노신일인산(cGMP) 생성이 증가하여 뇌의 성상교세포가 팽창한다. 이는 단백질 키나제 G 매개(PKG) 세포골격 변형으로 이어진다.[42] 이러한 독성은 뇌 에너지 대사 및 기능 감소를 유발할 수 있다. L-카르니틴을 투여하면 성상교세포 재구성에 대한 암모니아의 독성 효과를 줄일 수 있다.[88] 암모니아 유도 미토콘드리아 투과성 전이는 글루타민 활동의 직접적인 결과로 나타나며,[90] 항산화제나 글루타미나제 억제제를 투여하면 미토콘드리아 전이와 성상교세포 재구성을 감소시킬 수 있다.[90]비소는 농업 유출수, 광산, 제련소 지역에서 흔히 발견되는 신경독이다.[91] 신경계 발달 과정에서 비소를 섭취하면 말초신경계와 중추신경계 모두에서 신경돌기 성장이 억제된다.[92] 이는 신경 세포 이동 결함과 뉴런의 형태 변화를 초래하여 신생아에게 신경관 결함을 유발할 수 있다.[93][94] 비소의 대사산물인 아르세나이트는 노출 후 약 24시간 안에 뉴런에 대한 독성을 나타낸다. 아르세나이트는 뉴런 내 세포 내 칼슘 이온 수치를 증가시켜 미토콘드리아 막 전위를 감소시키고 카스파제를 활성화하여 세포 사멸을 유발한다.[93] 또한 아르세나이트는 세포골격에 작용하여 신경섬유 수송을 억제한다.[43] 리튬을 투여하면 손실된 신경섬유 운동성을 회복시키고,[95] 특정 항산화제를 투여하면 비소의 신경독성을 감소시킨다.[93]
2. 5. 흥분독성 유발
글루탐산은 일산화질소와 마찬가지로 뉴런이 정상적으로 기능하기 위해 사용되는 화합물이다.[117] 중추신경계의 회백질 전체에 저농도로 존재하며,[117] 흥분성 신경전달물질로서 중요한 역할을 한다.[118] 그러나 글루탐산이 고농도가 되면 뉴런이 세포자멸사에 의해 자가사멸하는 흥분독성을 나타낸다. 이는 헌팅턴병, 간질, 뇌졸중 등의 질환 및 합병증과 관련이 있다.[119] 이처럼 체내에서 생성된 물질이라도 농도에 따라 독성을 나타내는 경우가 있으며, 이러한 물질을 내인성 신경독이라고 부른다.일산화질소(NO)는 신경계 뉴런 간 통신 및 신호 전달에 사용되지만, 대뇌 허혈(ischemia)로 이어지는 기전에서도 활성화될 수 있다(Iadecola 1998). NO의 신경독성은 글루탐산 흥분독성(glutamate excitotoxicity)에서의 중요성에 기반한다. 즉, NO는 글루탐산 매개 NMDA 활성화에 대한 반응으로 칼슘 의존적 방식으로 생성되며, 이는 글루탐산 흥분독성에서 증가된 비율로 발생한다.[47] NO는 뇌의 잠재적 허혈 부위로의 혈류 증가를 촉진하지만, 산화 스트레스를 증가시키고,[115] DNA 손상과 세포자멸사(apoptosis)를 유도할 수도 있다.[116] 따라서 중추신경계(CNS)의 허혈 부위에서 NO의 존재량이 증가하면 상당한 독성 효과를 나타낼 수 있다.
2. 6. 기타 메커니즘
신경독은 세포막을 건너는 이온의 농도에 대한 신경세포 조절을 막거나, 시냅스를 건너는 신경세포 사이의 연락을 못하게 한다.[133][134] 신경독 노출 시 지역 병리학에서는 종종 신경세포 흥분독성이나 세포자살을 포함하며,[135] 신경 아교 세포의 손상을 포함하기도 한다.[136] 신경독은 신경계에 악영향을 미치는 화합물이므로, 신경독의 작용 기전은 여러 가지가 있으며, 그 중 하나는 뉴런의 세포 과정을 억제하는 것이다. 이러한 억제 과정은 세포막 탈분극 기전부터 뉴런 간의 정보 전달에 이르기까지 다양하다.
신경독은 그 작용 기전에 따라 다양하게 분류될 수 있다. 신경독은 신경계에 악영향을 미치는 화합물로, 뉴런의 세포 과정을 억제하는 방식으로 작용한다. 이러한 억제는 세포막 탈분극 기전부터 뉴런 간의 정보 전달에 이르기까지 다양하다. 신경독은 뉴런의 기능 수행 및 신호 전달 능력을 억제하여 보툴리눔 독소[12]처럼 전신 신경계 마비를 유발하거나, 심지어 신경 조직의 사멸[29]을 초래할 수 있다.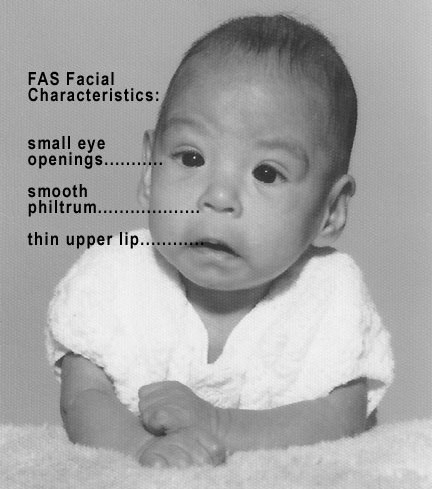
신경독으로서 에탄올은 신경계 손상을 유발하고 신체에 다양한 방식으로 영향을 미치는 것으로 나타났다. 에탄올 노출의 알려진 영향에는 일시적 및 지속적인 결과가 모두 포함된다. 일부 지속적인 영향에는 해마에서의 장기적인 신경발생 감소,[99][100] 광범위한 뇌 위축,[101] 및 뇌에서 유발된 염증[102]이 포함된다. 특히, 만성적인 에탄올 섭취는 세포막 성분의 재구성을 유도하여, 콜레스테롤과 포화 지방의 막 농도가 증가된 인지질 이중층을 형성하는 것으로 나타났다.[46] 신경세포 간 의사소통 감소의 중요한 예로는 에탄올이 해마의 NMDA 수용체를 억제하여 (LTP) 및 기억 획득을 감소시키는 능력이 있다.[45] 그러나 만성적인 에탄올 섭취로 인해 이러한 NMDA 수용체가 중뇌변연계 도파민 뉴런에서 이노시톨 1,4,5-삼인산(IP3) 의존적인 방식으로 LTP를 유도하는 감수성이 증가한다.[104] 또한, 에탄올은 억제된 NMDA 수용체 활동을 통해 세포 내 칼슘 이온 축적을 직접적으로 감소시키고, 따라서 LTP 발생 가능성을 감소시키는 것으로 나타났다.[105]
만성적인 에탄올 섭취는 심각한 발달 결함을 유발할 수 있다. 어머니의 만성적인 에탄올 섭취와 자녀의 결함 사이의 연관성은 1973년에 처음으로 밝혀졌다.[106] 이 연구는 태아알코올증후군의 분류를 만드는 데 기여했으며, 이 질병은 형태형성 이상(예: 두개안면 형성 결함, 사지 발달 결함 및 심혈관 형성 결함)을 특징으로 한다. 태아에서 태아알코올증후군으로 이어지는 에탄올 신경독성의 정도는 비타민 E와 같은 뇌의 항산화제 수치에 따라 달라지는 것으로 나타났다.[107] 에탄올 노출은 항산화제 수치 감소, 미토콘드리아 기능 장애, 그리고 그에 따른 뉴런 사멸을 초래하는 것으로 알려져 있으며, 이는 활성 산소종(ROS) 생성 증가의 결과로 보인다.[29] 이 메커니즘을 뒷받침하는 것으로, 높은 수준의 식이 비타민 E를 투여하면 태아에서 에탄올 유도 신경독성 효과가 감소하거나 제거된다.[7]
n-헥산은 신경독으로, 최근 몇 년 동안 중국 전자 제품 공장의 여러 노동자들의 중독을 야기한 것으로 알려져 있다.[110][111][112][113]
3. 신경독의 종류
납,[127] 메탄올(산업용 알코올), 망가니즈,[128] 글루탐산염,[129] 산화질소(NO),[130] 보툴리눔 독소(예: 보톡스),[131] 파상풍독소,[132] 테트로도톡신[133] 등이 흔히 알려진 신경독이다. 산화질소나 글루탐산처럼 신체 기능에 필수적인 물질도 과도하게 집중되면 신경독으로 작용할 수 있다.[133]
신경독 노출 후 증상이 나타나는 데 걸리는 시간은 독소에 따라 다르다. 예를 들어 보툴리눔 독소는 수 시간[17] 만에 증상이 나타나는 반면, 납은 수년[30]이 걸릴 수 있다.
'''아나톡신-''a'''''는 "매우 빠른 사망 인자(Very Fast Death Factor)"로도 알려져 있으며, 1961년 캐나다 서스캐처원 주의 호수에서 발생한 조류 대발생으로 인해 호수 물을 마신 소들이 폐사한 사건 이후 조사되기 시작했다.[71][72] 아나톡신-''a''는 최소 네 종류의 시아노박테리아 속에서 생성되는 시아노톡신으로, 북미, 유럽, 아프리카, 아시아, 뉴질랜드에서 보고되었다.[73]
아나톡신-''a''는 신경 세포(뉴런)에 직접 작용하여 매우 빠르게 독성 효과를 나타낸다. 아나톡신-''a''에 노출되면 협응력 상실, 근섬유연축(떨림), 경련이 나타나고, 호흡 마비로 빠르게 사망할 수 있다. 근육과 연결된 신경 조직에는 니코틴성 아세틸콜린 수용체라는 수용체가 있는데, 이 수용체가 자극되면 근육 수축이 일어난다. 아나톡신-''a''는 이 수용체에 결합하여 천연 신경전달물질인 아세틸콜린을 모방한다. 그러나 아나톡신-''a''는 콜린에스터라제에 의해 분해되지 않아 뉴런이 휴지 상태로 돌아가지 못하고, 근육 세포가 영구적으로 수축하게 된다. 이로 인해 뇌와 근육 간의 의사소통이 방해받아 호흡이 멈추게 된다.[74][75]
아나톡신-''a''는 처음 발견되었을 때 마우스 체강에 주사하면 몇 분 안에 진전, 마비, 사망을 유발하여 매우 빠른 사망 인자(VFDF)라고 불렸다. 1977년 VFDF의 구조가 이차적인 이환식 아민 알칼로이드로 밝혀지면서 아나톡신-''a''로 이름이 변경되었다.[76][77] 아나톡신-''a''는 구조적으로 코카인과 유사하며,[78] 신경계에서 아세틸콜린 수용체를 연구하는 데 유용하게 사용된다. 또한, 레크리에이션 및 음용수에 대한 위험성 때문에 지속적인 관심의 대상이며,[79] 치명적인 독성으로 인해 독소 무기로서의 군사적 잠재력도 높다.[80]
'''붕가로톡신'''(Bungarotoxin)은 신경전달물질 결합에 의해 활성화되는 이온 채널인 니코틴성 아세틸콜린 수용체(nAChR)와 상호작용하는 화합물이다.[81] 붕가로톡신은 여러 형태로 생성되는데, 그중 띠무늬살무사에서 분리되는 장쇄 알파 형태인 α-붕가로톡신(α-bungarotoxin)이 주로 사용된다.[38] α-붕가로톡신은 섭취 시 매우 독성이 강하지만, nAChR에 대한 높은 친화력 덕분에 신경과학에서 nAChR을 분리하는 데 유용하게 사용된다.[38]
붕가로톡신은 결합하는 nAChR의 형태에 따라 다른 종류로 나뉘며, α-붕가로톡신은 α7-nAChR에 특이적으로 결합한다.[82] α7-nAChR은 세포 내로 칼슘 이온 유입을 허용하는 기능을 하는데, 붕가로톡신에 의해 차단되면 ACh 신호가 억제되어 손상을 유발한다.[82] α-붕가로톡신은 다른 채널의 효과를 분리하기 위해 칼슘 유입을 차단해야 하는 신경과학 연구에 유용하며, 다른 형태의 붕가로톡신은 신체 বিভিন্ন 시스템에서 억제된 nAChR과 칼슘 이온 흐름을 연구하는 데 활용될 수 있다. 예를 들어, α-붕가로톡신은 근육 nAChR에, κ-붕가로톡신은 뉴런 nAChR에 특이적이다.[83]
뱀, 전갈 등 여러 생물이 척추동물에 대한 방어 수단으로 신경독을 사용한다. 벌, 전갈, 거미, 뱀의 독에는 다양한 종류의 독소가 포함될 수 있으며, 파상풍균이 생성하는 테타누스톡신[123]도 신경독의 일종이다.
공작과 같이 신경독에 내성을 가진 생물도 존재한다.
복어의 독으로 알려진 테트로도톡신은 진통제로 의료 분야에서 활용되기도 한다.
3. 1. 내인성 신경독
대부분의 신경독은 섭취를 통해 체내로 유입되지만, 내인성 신경독은 체내에서 생성되고 그 효과도 체내에서 나타난다. 독액과 외인성 신경독은 체내에서 유용한 기능을 거의 발휘하지 못하는 반면, 내인성 신경독은 세포 신호 전달에 사용되는 일산화질소와 같이 신체에서 유용하고 건강한 방식으로 사용된다.[114] 이러한 내인성 화합물이 고농도로 축적될 때만 위험한 영향을 미치는 경우가 많다.[8]
암모니아(Ammonia) 독성은 섭취 또는 간부전과 같은 내인성 질환을 통해 나타난다.[88][89] 암모니아 독성은 간의 간경변증에 대한 반응으로 간성뇌증을 유발하고 뇌부종을 초래할 수 있다(Haussinger 2006). 뇌부종은 신경세포 재구성의 결과일 수 있다. 생체 내 암모니아 활동은 세포 내 cGMP(환상구아노신일인산) 생성 증가를 통해 뇌의 성상세포 팽창을 유발하며, 이는 단백질 키나제 G 매개(Protein Kinase G-mediated)(PKG) 세포골격 변형으로 이어진다.[42] 뇌 에너지 대사 및 기능 감소가 이러한 독성의 결과가 될 수 있다. 성상세포 재구성에 대한 암모니아의 독성 효과는 L-카르니틴 투여를 통해 감소될 수 있다.[88] 성상세포 재구성은 암모니아 유도 미토콘드리아 투과성 전이를 통해 매개되는 것으로 보이며, 이 미토콘드리아 전이는 글루타민 활동의 직접적인 결과이다.[90] 항산화제 또는 글루타미나제 억제제를 투여하면 미토콘드리아 전이, 그리고 잠재적으로 성상세포 재구성을 감소시킬 수 있다.[90]
일산화질소(NO)는 신경계 뉴런 간 통신 및 신호 전달에 사용되지만, 대뇌 허혈 기전에서도 활성화될 수 있다(Iadecola 1998). NO 신경독성은 글루탐산 흥분독성의 중요성에 기반한다. NO는 글루탐산 매개 NMDA 활성화에 대한 반응으로 칼슘 의존적 방식으로 생성되며, 이는 글루탐산 흥분독성에서 증가된 비율로 발생한다.[47] NO는 뇌의 잠재적 허혈 부위로 혈류 증가를 촉진하지만, 산화 스트레스를 증가시키고,[115] DNA 손상과 세포자멸사를 유도할 수 있다.[116] 따라서 중추신경계(CNS) 허혈 부위에서 NO 존재량 증가는 상당한 독성 효과를 나타낼 수 있다.
글루탐산은 일산화질소와 마찬가지로 뉴런 기능에 사용되는 화합물이다.[117] 중추신경계 회백질 전체에 저농도로 존재하며,[117] 흥분성 신경전달물질로도 중요하다.[118] 글루탐산이 고농도가 되면 뉴런이 세포자멸사로 자가사멸하여 독성을 나타내는데, 이를 흥분독성이라고 한다. 헌팅턴병, 간질, 뇌졸중 등의 질환 및 합병증과 관련성이 높다.[119] 이처럼 체내 생성 물질이라도 농도에 따라 독성을 나타내는 경우가 있으며, 이러한 물질을 내인성 신경독이라고 부른다.
3. 2. 외인성 신경독
납,[127] 메탄올(산업용 알코올), 망가니즈,[128] 글루탐산염,[129] 산화질소(NO),[130] 보툴리눔 독소(예를 들면 보톡스),[131] 파상풍독소,[132] 테트로도톡신[133] 등은 흔히 발견되는 신경독의 예시이다. 이 중 산화질소나 글루탐산과 같이 신체 기능에 필수적인 물질도 과도하게 집중될 경우 신경독으로 작용할 수 있다.[133]
인류는 수천 년 전부터 신경독성 물질에 노출되어 왔는데, 로마 제국 시대에는 상수도망과 납 냄비에 포도주를 끓이는 습관으로 인해 상당한 납 노출이 있었을 것으로 추정된다.[18][19] 신경계는 교란에 매우 취약하며, 뇌, 척수, 말초 신경 조직은 복잡한 생물학적 시스템으로 구성되어 있어 작은 환경 변화에도 기능 장애가 발생할 수 있다.[20] 신경 조직의 취약성은 뉴런의 높은 표면적, 지용성 독소를 유지하는 높은 지질 함량, 뇌로의 높은 혈액 흐름, 뉴런의 지속성 등에서 기인한다.[20]
혈액-뇌 장벽(BBB)은 독소로부터 뇌를 보호하는 중요한 역할을 한다.[21] 뇌는 혈류를 통해 영양분을 공급받고 노폐물을 제거하는데, 혈액 속 독소가 신경 조직에 도달하면 뉴런 사멸을 유발할 수 있다. 성상교세포는 뇌의 모세혈관을 둘러싸 혈액에서 영양소를 흡수하여 뉴런에 전달함으로써 뇌를 화학적 손상으로부터 분리한다.[21] 혈액-뇌 장벽은 뇌 모세혈관 주위에 소수성 층을 형성하여 크거나 친수성 화합물의 이동을 억제한다.
맥락총은 뇌척수액(CSF) 합성에 관여하며, 이온과 영양소의 선택적 통과와 중금속을 가두는 기능을 통해 뇌와 척수를 보호한다.[21][22] 일부 신경독성 물질은 소수성이거나 크기가 작아 혈액-뇌 장벽을 통과하여 뇌에 손상을 일으킬 수 있다.
현대 의학은 신경독성 물질을 확인하고 치료하는 연구를 진행하고 있으며, 미국 환경보호청(EPA)은 신경독성 효과를 시험하기 위한 프로토콜을 개발했다.[20][23] 시험관 내 시스템은 전신 대사의 오염 효과를 제거하는 등 개선된 환경을 제공하지만, 신경계의 복잡성을 완전히 재현하기는 어렵다.[23][24] 신경독성과 세포독성을 구분하는 것도 과제인데, 산화 스트레스나 골격 변형과 같은 증상이 두 경우 모두에서 나타날 수 있기 때문이다.[25] 최근에는 돌기 성장이 신경독성과 세포독성을 구분하는 기준으로 제안되었으나, 정확성 문제로 널리 사용되지는 않는다.[26] 아세틸콜린에스터라제 억제와 같은 생화학적 메커니즘을 이용한 검사도 활용되고 있다. (여기에는 유기인계 화합물, 파라티온, 사린 가스가 포함된다.)[27]
신경독은 신경계에 다양한 방식으로 작용하며, 세포막 탈분극 기전 억제, 뉴런 간 정보 전달 방해 등이 그 예시이다. 신경독은 전신 신경계 마비나 신경 조직 사멸을 유발할 수 있으며, 증상 발현 시간은 독소에 따라 다르다.[12][29]

납은 강력한 신경독성 물질로, 발달 중인 뇌에 특히 취약하여 세포자멸사와 흥분독성을 유발할 수 있다.[96] 납은 칼슘 ATP가수분해효소 펌프를 통해 혈액-뇌 장벽을 통과하여 중추신경계 세포와 직접 접촉한다.[97] 납은 칼슘 이온과 유사하게 작용하여 세포 내 칼슘 항상성을 방해하고 세포자멸사를 유발하며, 프로테인 키나제 C(PKC)를 활성화하여 학습 장애를 일으키고, 인터뉴런 신호 전달을 억제한다.[44][98]
에탄올(알코올)은 신경계 손상을 유발하는 신경독으로, 장기적인 신경 발생 감소, 뇌 위축, 뇌 염증 등을 일으킬 수 있다.[99][100][101][102] 만성적인 에탄올 섭취는 세포막 재구성을 유발하여 신경망 기능을 저하시키고, NMDA 수용체를 억제하여 장기 강화 작용(LTP) 및 기억 형성을 감소시킨다.[45][46] 만성 에탄올 섭취는 중뇌변연계 도파민 뉴런에서 LTP 유도 감수성을 증가시켜 뉴런 세포독성을 초래할 수 있으며, NMDA 수용체 활동 억제를 통해 LTP 발생 가능성을 감소시킨다.[104][105]
임산부의 만성적인 에탄올 섭취는 태아알코올증후군을 유발할 수 있으며, 이는 형태 형성 이상, 두개안면 형성 결함, 사지 발달 결함, 심혈관 형성 결함 등을 특징으로 한다.[106] 태아의 뇌는 에탄올 노출에 취약하며, 활성산소종(ROS) 생성 증가로 인한 뉴런 사멸이 발생할 수 있다.[29][108] 비타민 E와 같은 항산화제는 태아의 에탄올 유도 신경독성 효과를 감소시킬 수 있다.[7][109]
n-헥산은 신경독으로, 중국 전자 제품 공장 노동자들의 중독을 야기한 사례가 있다.[110][111][112][113]
MPP+는 MPTP의 독성 대사산물로, 미토콘드리아의 산화적 인산화를 저해하여 ATP 고갈 및 세포 사멸을 유발하는 선택적 신경독소이다. 흑질의 도파민성 뉴런에서 주로 발생하며, 파킨슨병 증상을 유발한다.
외부 환경에서 섭취되는 독소는 외인성으로 분류되며, 가스, 금속, 액체, 고체 등 다양한 형태가 있다. 외인성 독소의 작용은 용량 의존적이며, 에탄올은 소량에서는 신경 독성을 나타내지만 장기간 노출 시 신경 세포를 손상시킨다. 에탄올 금단은 뇌의 흥분성 독성을 유발하며, 칸나비노이드 수용체 작용제는 보호 효과를 나타내는 반면, 수용체 길항제는 신경독성을 증폭시킬 수 있다.[120]
3. 3. 생물 유래 신경독
납,[127] 메탄올(산업용 알코올), 망가니즈,[128] 글루탐산염,[129] 산화질소(NO),[130] 보툴리눔 독소(예를 들면 보톡스),[131] 파상풍독소,[132] 테트로도톡신[133] 등이 신경독의 흔한 예시이다. 산화질소나 글루탐산과 같은 일부 물질들은 신체가 정상적으로 기능하는 데 필수적이며, 과도하게 집중될 때에만 신경독의 효과가 나타난다.1961년, 캐나다 서스캐처원 주의 호수에서 발생한 조류 대발생으로 인해 호수 물을 마신 소들이 폐사한 사건 이후, "매우 빠른 사망 인자(Very Fast Death Factor)"로도 알려진 아나톡신-''a''에 대한 조사가 시작되었다.[71][72] 아나톡신-''a''는 최소 네 종류의 시아노박테리아 속에서 생성되는 시아노톡신으로 북미, 유럽, 아프리카, 아시아, 뉴질랜드에서 보고되었다.[73]
아나톡신-''a''의 독성 효과는 신경 세포(뉴런)에 직접 작용하기 때문에 매우 빠르게 진행된다. 아나톡신-''a'' 노출의 진행성 증상은 협응력 상실, 근섬유연축(떨림), 경련, 그리고 호흡 마비에 의한 빠른 사망이다. 근육과 연결되는 신경 조직에는 니코틴성 아세틸콜린 수용체라는 수용체가 있는데, 이 수용체의 자극은 근육 수축을 일으킨다. 아나톡신-''a'' 분자는 이 수용체에 맞게 형성되어 수용체가 정상적으로 사용하는 천연 신경전달물질인 아세틸콜린을 모방한다. 일단 수축을 유발하면, 아나톡신-''a''는 정상적으로 이 기능을 수행하는 콜린에스터라제에 의해 분해되지 않기 때문에 뉴런이 휴지 상태로 돌아가는 것을 허용하지 않는다. 그 결과, 근육 세포는 영구적으로 수축하고, 뇌와 근육 사이의 의사소통이 방해받아 호흡이 멈춘다.[74][75]
처음 발견되었을 때, 이 독소는 마우스의 체강에 주사했을 때 몇 분 안에 진전, 마비 및 사망을 유발했기 때문에 매우 빠른 사망 인자(VFDF)라고 불렸다. 1977년, VFDF의 구조가 이차적인 이환식 아민 알칼로이드로 밝혀졌고, 아나톡신-''a''로 이름이 바뀌었다.[76][77] 구조적으로 코카인과 유사하다.[78] 레크리에이션 및 음용수에 대한 위험성, 그리고 신경계에서 아세틸콜린 수용체를 조사하는 데 특히 유용한 분자이기 때문에 아나톡신-''a''에 대한 지속적인 관심이 있다.[79] 이 독소의 치명성은 독소 무기로서 높은 군사적 잠재력을 가지고 있음을 의미한다.[80]
붕가로톡신(Bungarotoxin)은 신경전달물질 결합에 의해 활성화되는 이온 채널 계열인 니코틴성 아세틸콜린 수용체(nAChR)와 상호작용하는 것으로 알려진 화합물이다.[81] 붕가로톡신은 여러 가지 형태로 생성되지만, 일반적으로 사용되는 형태 중 하나는 띠무늬살무사에서 분리되는 장쇄 알파 형태인 α-붕가로톡신이다.[38] α-붕가로톡신은 섭취 시 매우 독성이 강하지만, 수용체에 대한 높은 친화력으로 nAChR을 특별히 잘 분리하기 때문에 신경과학에서 광범위하게 유용성을 보여주었다.[38] 붕가로톡신에는 여러 형태가 있으므로, 결합하는 nAChR의 형태도 다르며, α-붕가로톡신은 α7-nAChR에 특히 특이적이다.[82] 이 α7-nAChR은 세포 내로 칼슘 이온 유입을 허용하는 기능을 하며, 따라서 섭취된 붕가로톡신에 의해 차단되면 ACh 신호가 억제되어 손상 효과를 생성한다.[82] 마찬가지로, 다른 채널의 효과를 분리하기 위해 칼슘 유입을 차단하는 것이 바람직한 경우 α-붕가로톡신의 사용은 신경과학에서 매우 유용할 수 있다. 또한, 다른 형태의 붕가로톡신은 신체의 다양한 시스템에서 억제된 nAChR과 그에 따른 칼슘 이온 흐름을 연구하는 데 유용할 수 있다. 예를 들어, α-붕가로톡신은 근육에 존재하는 nAChR에 특이적이고, κ-붕가로톡신은 뉴런에 존재하는 nAChR에 특이적이다.[83]
뱀이나 전갈의 독, 그리고 다른 생물들이 척추동물에 대한 방어 수단으로 사용하는 독의 대부분은 신경독이다. 벌, 전갈, 거미, 그리고 뱀의 독에는 여러 종류의 서로 다른 독소가 포함되어 있을 수 있다. 파상풍균이 생성하는 테타누스톡신[123]도 신경독의 일종이다.
공작 등, 신경독에 내성이 있는 생물도 존재한다.
다음은 신경독을 생성하는 생물의 예시이다.
4. 신경독의 영향 및 질환
신경독은 세포 막을 건너는 이온의 농도에 대한 신경세포 조절을 막거나,[133] 시냅스를 건너는 신경세포 사이의 연락을 차단한다.[134] 신경독 노출의 국소 병리학적 소견으로는 신경세포 흥분독성이나 세포자살이 흔하며,[135] 신경교세포 손상을 포함하기도 한다.[136] 신경독 노출의 거시적인 징후로는 지적 장애와 같은 광범위한 중추신경계 손상,[126] 지속적인 기억력 장애,[137] 뇌전증, 치매 등이 있다.[138] 또한, 말초신경증이나 근육병증과 같이 신경독에 의한 말초신경계 손상도 흔하게 나타난다. 신경독으로 인한 손상 완화에는 항산화제[128]와 항독소[139] 투여 등 여러 치료 방법이 도움이 될 수 있다.
5. 신경독 연구 및 응용
사회에서 신경독성 물질에 노출되는 것은 새로운 현상이 아니다. 문명은 수천 년 동안 신경계를 파괴하는 화합물에 노출되어 왔다. 한 가지 주목할 만한 예로, 로마 제국 시대에는 광범위한 상수도망의 발달과 납으로 된 냄비에 식초를 넣은 포도주를 끓여 단맛을 내는 습관으로 인해 상당한 납 노출이 있었을 가능성이 있다.[19]
현대에 와서 과학자와 의사들은 신경독성 물질을 확인하고 치료하는 과제에 직면했으며, 이로 인해 신경독성학 연구와 임상 연구 모두에 대한 관심이 높아지고 있다.[23] 임상 신경독성학은 주로 발전하고 있는 분야이지만, 많은 환경 신경독성 물질의 확인에 상당한 진전이 이루어져 750~1000가지의 알려진 잠재적 신경독성 화합물이 분류되었다.[20]
미국 환경보호청(EPA)은 화합물의 신경독성 효과를 시험하고 결정하기 위한 특정 프로토콜을 개발했다(USEPA 1998). 또한, 시험관 내 시스템의 사용이 증가하고 있는데, 이는 과거에 더 일반적이었던 생체 내 시스템에 비해 상당한 개선을 제공하기 때문이다. 개선 사례로는 다루기 쉬운 균일한 환경과 전신 대사의 오염 효과 제거가 있다.[23] 그러나 시험관 내 시스템은 혈액-뇌 장벽 생성에서 성상교세포와 뉴런 간의 상호 작용과 같이 신경계의 복잡성을 제대로 복제하기 어렵다는 문제점을 제기했다.[24]
신경독성과 세포독성을 구분하기 어려울 수 있다는 점, 산화 스트레스 또는 골격 변형과 같은 증상이 신경독성과 세포독성 모두에 대한 반응으로 발생할 수 있다는 점[25] 등 시험관 내에서 신경독성 물질을 결정하는 과정을 더욱 복잡하게 만드는 여러 문제점들이 존재한다.
이러한 복잡한 문제를 해결하기 위해, 적용된 화합물에 대한 반응으로 돌기(축삭 또는 수상돌기)의 성장이 최근 시험관 내 시험 환경에서 진정한 신경독성 물질과 세포독성 물질을 구분하는 더 정확한 기준으로 제안되었다. 그러나 이 과정과 관련된 상당한 부정확성으로 인해 광범위한 지지를 얻는 데는 시간이 걸렸다.[26] 또한, 생화학적 메커니즘이 신경독성 물질 검사에 더 많이 사용되고 있으며, 화합물이 아세틸콜린에스터라제 용량 억제와 같은 세포 메커니즘 간섭을 유발하기에 충분한지 여부를 선별할 수 있다.(유기인계 화합물 포함, 파라티온 및 사린 가스 포함).[27]
신경독은 신경과학 분야에서 매우 유용하게 사용될 수 있다. 신경독은 표적 채널에 매우 특이적으로 진화하여 다른 표적에 쉽게 결합하지 않기 때문에,[28] 신경계의 특정 요소를 정확하고 효율적으로 표적으로 삼을 수 있는 효과적인 수단을 제공한다. 신경독 기반 표적화의 초기 사례로는 방사성 표지 테트로도톡신을 사용하여 나트륨 채널을 분석하고 신경 막을 따라 그 농도를 정확하게 측정한 것이 있다.[28] 마찬가지로 특정 채널 활동의 분리를 통해 신경독은 뉴런의 원래 Hodgkin-Huxley 모델을 개선하는 능력을 제공했다.[28]
6. 암살
맹독성 신경독은 극미량으로도 사람을 살해할 수 있으며, 타살 흔적이 남지 않는 것이 보통이다. 가는 바늘의 독침을 사용한 경우에는 시체에 바늘 자국도 남지 않아 외상 흔적이 전혀 없다.[140]
참조
[1]
논문
Toxins produced by cyanobacteria
[2]
웹사이트
Blue-Green Algae (Cyanobacteria) in Inland Waters: Assessment and Control of Risks to Public Health
http://www.scotland.[...]
Scottish Government
2011-12-15
[3]
서적
Dorland's Medical Dictionary for Health Consumers
[4]
논문
[5]
논문
[6]
논문
[7]
논문
Amelioration of Ethanol-Induced Neurotoxicity in the Neonatal Rat Central Nervous System by Antioxidant Therapy
[8]
논문
[9]
논문
[10]
논문
Extrafusal and Intrafusal Muscle Effects in Experimental Botulinum Toxin-A Injection
[11]
논문
[12]
논문
[13]
논문
[14]
논문
[15]
논문
[16]
논문
[17]
논문
[18]
웹사이트
Neurotoxins: Definition, Epidemiology, Etiology
https://file.io/JFxJ[...]
[19]
논문
[20]
논문
[21]
서적
Vander's Human Physiology: the Mechanisms of Body Function
McGraw-Hill Higher Education
[22]
논문
[23]
논문
[24]
논문
[25]
논문
[26]
논문
Developmental Neurotoxicity Testing in Vitro: Models for Assessing Chemical Effects on Neurite Out-growth
https://zenodo.org/r[...]
[27]
논문
[28]
논문
[29]
논문
[30]
논문
[31]
논문
[32]
논문
[33]
논문
[34]
논문
[35]
논문
[36]
논문
[37]
논문
[38]
논문
[39]
논문
[40]
논문
[41]
논문
[42]
논문
[43]
논문
[44]
논문
[45]
학술지
Ethanol Inhibits NMDA-activated Ion Current in Hippocampal Neurons
https://zenodo.org/r[...]
[46]
학술지
Is Ethanol a Neurotoxin?: the Effects of Ethanol on Neuronal Structure and Function
[47]
논문
[48]
논문
[49]
학술지
Dopamine neurotoxicity: inhibition of mitochondrial respiration
[50]
학술지
Tetrodotoxin Poisoning: a Clinical Analysis, Role of Neostigmine and Short-term Outcome of 53 Cases
[51]
논문
[52]
논문
[53]
논문
[54]
논문
[55]
논문
[56]
논문
[57]
논문
[58]
논문
[59]
논문
[60]
논문
[61]
논문
[62]
서적
Botulinum Toxin: Chemistry, Pharmacology, Toxicity, and Immunology
[63]
논문
[64]
논문
[65]
논문
[66]
논문
[67]
논문
[68]
논문
[69]
논문
[70]
논문
[71]
논문
Carmichael 1978
[72]
논문
Carmichael 1975
[73]
논문
Yang 2007
[74]
논문
Wood 2007
[75]
간행물
National Center for Environmental Assessment
[76]
논문
Devlin 1977
[77]
논문
Moore 1977
[78]
논문
Metcalf 2009
[79]
논문
Stewart 2008
[80]
논문
Dixit 2005
[81]
논문
Tsetlin 2003
[82]
논문
Liu 2008
[83]
논문
Hue 2007
[84]
논문
Elucidating the Neurotoxicity of the Star Fruit
[85]
논문
Bisset 1992
[86]
논문
Schlesinger 1946
[87]
논문
The Use Of Curare In General Anesthesia
[88]
논문
Matsuoka 1991
[89]
논문
Buzanska (2000)
[90]
논문
Norenberg 2004
[91]
논문
Liu 2009
2020-10-00
[92]
논문
Vahidnia 2007
[93]
논문
Rocha 2011
[94]
논문
Brender 2005
[95]
논문
DeFuria 2007
[96]
논문
Lidskey 2003
[97]
논문
Bradbury 1993
[98]
논문
Lasley 1999
[99]
논문
Taffe 2010
[100]
논문
Morris 2009
[101]
논문
Bleich 2003
[102]
논문
Blanco 2005
[103]
논문
Davis 1992
[104]
논문
Bernier 2011
[105]
논문
Takadera 1990
[106]
논문
Jones 1973
[107]
논문
Mitchell 1999
[108]
논문
Gil-Mohapel 2010
[109]
논문
Bergamini 2004
[110]
뉴스
Workers poisoned while making iPhones
http://www.abc.net.a[...]
ABC News
2010-10-25
[111]
뉴스
Dirty Secrets
http://www.abc.net.a[...]
ABC Foreign Correspondent
2010-10-26
[112]
웹사이트
Mr Daisey and the Apple Factory
http://www.thisameri[...]
2012-01-06
[113]
웹사이트
Occupational Safety and Health Guideline for n-Hexane
http://www.osha.gov/[...]
[114]
논문
Iadecola 1998
[115]
논문
Beckman 1990
[116]
논문
Bonfoco 1995
[117]
논문
Choi 1987
[118]
논문
Choi 1990
[119]
논문
Choi 1987
[120]
논문
Pharmacological activation/inhibition of the cannabinoid system affects alcohol withdrawal-induced neuronal hypersensitivity to excitotoxic insults.
http://journals.plos[...]
[121]
논문
Cannabinoid agonist WIN55,212-2 induces apoptosis in cerebellar granule cells via activation of the CB1 receptor and downregulation of bcl-xL gene expression.
http://onlinelibrary[...]
2006-05-01
[122]
문서
WIN 55,212-2는 신경보호작용을 겸비한다.
[123]
간행물
테타누스톡신
1984-12
[124]
서적
Dorland's Medical Dictionary for Health Consumers
[125]
논문
Spencer 2000
[126]
논문
Olney 2002
[127]
논문
Lidsky 2003
[128]
논문
Heaton 2000
[129]
논문
Choi 1987
[130]
논문
Zhang 1994
[131]
논문
Rosales 1996
[132]
논문
Simpson 1986
[133]
논문
Kiernan 2005
[134]
논문
Arnon 2001
[135]
논문
Dikranian 2001
[136]
논문
Deng 2003
[137]
논문
Jevtovic-Todorovic 2003
[138]
논문
Nadler 1978
[139]
논문
Thyagarajan 2009
[140]
뉴스
김정남, 독침으로 독살된 것...사인, 부검 통해 밝혀내기 거의 불가능
BBS
2017-02-22
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

