납
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
납은 수천 년 동안 사용된 탄소족 원소로, 고밀도, 낮은 융점, 연성, 부식 저항성을 특징으로 한다. 소아시아에서 기원전 7,000년경에 납 구슬이 발견되었으며, 고대 로마 시대에는 건축, 배관, 식기 등에 널리 사용되었으나, 납 중독의 원인이 되기도 했다. 납은 지구 지각에 널리 분포하지만, 인체에 유해하며, 흡입, 섭취, 피부 접촉을 통해 체내에 흡수되어 다양한 독성 증상을 유발한다. 현재는 납축전지, 방사선 차폐재 등으로 사용되며, 환경 규제로 인해 사용이 제한되고 있다.
더 읽어볼만한 페이지
- 납 - 산탄
산탄은 사냥이나 사격 연습에 주로 사용되는 다양한 크기의 둥근 탄환으로, 샷 타워 공정을 통해 대량 생산되기 시작했으며, 납탄의 경도는 첨가물을 통해 조절되고 크기는 숫자로 표기되며, 환경 문제로 인해 무연 납탄이 개발되고 있으며, 다양한 용도로 사용되지만 납 중독 문제로 사용이 제한되고 있다. - 납 - 연실법
연실법은 존 로벅이 기초 기술을 확립하고 니콜라 클레망과 샤를 데졸름이 완성한 후 게이뤼삭 탑과 글로버 탑 등의 설비 개선을 거쳐 산업화된 황산 제조 방법으로, 이산화황, 증기, 이산화 질소를 납으로 덮인 챔버에 주입하는 방식으로, 접촉법 개발로 대체되었으나 환경 오염과 낮은 농도 황산 생산의 단점을 가진다. - 전이후 금속 - 인듐
인듐은 은백색의 무른 금속 원소로, 낮은 경도와 뛰어난 전연성을 가지며, LCD 투명 전극, 반도체, 태양전지 등 다양한 산업 분야에서 사용되는 아연 광석의 부산물이다. - 전이후 금속 - 알루미늄
알루미늄은 은백색의 가볍고 가공성이 뛰어난 금속으로, 열 및 전기 전도성이 우수하여 다양한 산업 분야에서 합금 형태로 널리 사용되며, 보크사이트에서 추출되어 재활용 또한 활발히 이루어진다. - 신경독 - 이황화 탄소
이황화 탄소는 1796년 람파디우스가 합성한 무색 휘발성 액체로, 높은 굴절률과 우수한 용매 특성을 지니지만, 가연성과 독성으로 인해 건강 문제를 유발하여 사용량이 감소하고 법적 규제를 받고 있다. - 신경독 - 스트리크닌
스트리크닌은 마전과 스트리크노스속 식물에서 추출되는 맹독성 알칼로이드로, 신경 기능 억제 효과를 이용해 살서제 등으로 사용되며 유기화학 합성 연구의 대상이 되어 왔다.
2. 역사
"lead"라는 현대 영어 단어는 게르만어에서 유래했으며, 중세 영어의 leedenm와 고대 영어의 lēadang에서 왔다. 이 고대 영어 단어는 가설적으로 재구성된 원시 게르만어의 *lauda-mis('납')에서 파생되었다. 언어학 이론에 따르면, 이 단어는 여러 게르만어에서 정확히 같은 의미를 가진 파생어를 가지고 있었다.
원게르만어 *lauda-mis의 기원에 대해서는 의견이 일치하지 않는다. 한 가설은 이것이 원시 인도유럽어의 *lAudh-mis('납')에서 파생되었다고 주장한다. 다른 가설은 원시 켈트어의 *ɸloud-io-mis('납')에서 차용되었다고 제안한다. 이 단어는 라틴어의 plumbumla과 관련이 있으며, 여기서 원소의 원소 기호인 ''Pb''가 유래했다. *ɸloud-io-mis라는 단어는 원게르만어 *bliwa-mis('납'을 의미)의 기원으로 여겨지며, 독일어 Bleide가 여기서 파생되었다.
화학 원소의 이름은 같은 철자를 가진 동사와 관련이 없다. 동사는 원게르만어 *laidijan-mis('이끌다')에서 파생되었다.
신대륙에서는 유럽 정착민들이 도착한 직후 납 생산이 기록되었다. 가장 오래된 기록은 1621년 영국의 버지니아 식민지에서 나왔다. 호주에서는 식민지 개척자들이 1841년에 납 광산을 열었다. 아프리카에서는 베누에 분지와 콩고 분지 하류에서 납 채굴과 제련이 알려져 있었는데, 17세기에는 유럽인과의 무역과 통화로 사용되었다.
2. 1. 고대
납은 수천 년 동안 널리 사용되어 온 금속이다. 그 이유는 쉽게 추출하고 가공할 수 있기 때문이다. 소아시아에서는 기원전 7000~6500년경의 금속 납 구슬이 발견되었는데, 이는 금속 제련의 최초 사례를 보여줄 수 있다.[4] 당시 납은 부드럽고 광택이 없어 활용도가 낮았다.[4]납 생산이 확산된 주된 이유는 은과의 연관성 때문이었다. 납 광석을 태우면 은을 얻을 수 있었다. 고대 이집트인들은 화장품에 납 광물을 처음 사용했으며, 이는 고대 그리스를 넘어 널리 퍼졌다. 이집트인들은 어망 추, 유약, 유리, 에나멜, 장식품에 납을 사용했다. 비옥한 초승달 지대의 여러 문명들은 납을 필기 재료, 화폐, 그리고 건축 자재로 사용했다. 고대 중국인들은 납을 자극제, 통화, 피임약, 젓가락으로 사용했다. 인더스 문명과 중앙아메리카 사람들은 납으로 부적을 만들었고, 동아프리카와 남아프리카 사람들은 납을 선재 가공에 사용했다.
한국어 '납'이라는 명칭은 '나마리' = '부드러운 금속'에서 유래했다는 설이 있다. 원소 기호는 라틴어 명칭 ''plumbum''에서 유래한다. 고유어로는 "청금"이라고 한다.
2. 2. 고전 시대
은이 장식재료와 교환 매개체로 널리 사용되었기 때문에 기원전 3000년부터 소아시아에서 납 광산이 개발되었다. 이후 에게 해와 라우리온에서 납 광산이 개발되었다.[1] 이 세 지역은 기원전 1200년경까지 채굴된 납 생산을 지배했다.[2] 기원전 2000년경부터 페니키아인들은 이베리아 반도의 광상을 개발했고, 기원전 1600년까지 키프로스, 그리스, 사르데냐에서 납 채굴이 이루어졌다.[4]
로마 공화국이 유럽과 지중해 전역으로 영토를 확장하고 광산을 개발하면서 고전 시대 동안 최대 납 생산국이 되었으며, 연간 생산량은 최대 8만 톤에 달했다. 로마인들은 주로 은 제련의 부산물로 납을 얻었다.[6][7] 중앙 유럽, 브리타니아, 발칸 반도, 그리스, 아나톨리아, 히스파니아에서 납 채굴이 이루어졌으며, 히스파니아는 세계 생산량의 40%를 차지했다.[6]

납판은 편지의 재료로 흔히 사용되었다.[8] 고대 유대에서는 평평한 모래틀에 주조되고 사망자의 신앙에 맞는 교체 가능한 문양이 있는 납 관이 사용되었다.[9] 기원전 5세기부터 납은 돌팔매알을 만드는 데 사용되었다. 로마 시대에는 납제 돌팔매알이 널리 사용되었으며 100~150미터 거리에서 효과적이었다. 카르타고와 로마 군대에서 용병으로 사용된 발레아레스섬의 돌팔매꾼은 사격 거리와 정확도로 유명했다.[10]

납은 로마 제국에서 수도관을 만드는 데 사용되었다. 이 금속의 라틴어 이름인 plumbumla은 영어 단어 "배관"의 어원이다. 가공이 용이하고, 녹는점이 낮아 완벽하게 방수되는 용접 이음매를 쉽게 만들 수 있으며, 부식에 대한 저항성[11]이 뛰어나 의약품, 지붕, 화폐, 전쟁 등 다른 용도로 널리 사용되었다.[12][13][14] 카토, 콜루멜라, 플리니우스 등 당시의 저술가들은 포도주와 음식에 첨가되는 감미료와 방부제의 제조에 납(및 납 도금) 용기를 사용할 것을 권장했다. 납은 "납당"(아세트산납)의 생성으로 인해 기분 좋은 맛을 냈지만, 구리 용기는 녹청 생성을 통해 쓴맛을 냈다.[15]
로마 작가 비트루비우스는 납의 건강 위험을 보고했다.[3] 현대 작가들은 납 중독이 서로마 제국의 쇠퇴에 중요한 역할을 했다고 제안했지만,[17][18] 다른 연구자들은 모든 복통이 납 중독으로 인한 것이 아님을 지적하면서 이러한 주장을 비판했다.[20][21] 고고학 연구에 따르면 로마 납관은 수돗물의 납 수준을 높였지만 그러한 영향은 "진정으로 해로운 영향을 미쳤을 가능성은 적습니다".[22][23] 납 중독이 발생했을 때 희생자들은 신들의 음침한 아버지인 사투르누스를 따라 "사투르누스병에 걸린" 사람, 어둡고 냉소적인 사람이라고 불렸다. 연관하여 납은 모든 금속의 아버지로 여겨졌다.[24] 로마 사회에서 납의 지위는 쉽게 구할 수 있었고[25] 값이 쌌기 때문에 낮았다.[26]
청동기 시대부터 금속 세공사와 기술자들은 희귀하고 귀중한 주석(tin) – 구리와 합금하여 단단하고 부식에 강한 청동을 만드는 데 필수적인 원소 – 과 값싼 납(lead)의 차이를 이해해 왔다. 그러나 일부 언어에서는 명칭이 유사하다. 로마인들은 납을 plumbum nigrumla("검은 납")이라고 불렀고, 주석을 plumbum candidumla("밝은 납")이라고 불렀다. 납과 주석의 연관성은 다른 언어에서도 볼 수 있다. 체코어의 olovocs는 "납"으로 번역되지만, 러시아어에서는 그 어원인 оловоru ()가 "주석"을 의미한다.[27] 혼란을 더하는 것은 납이 안티모니와 밀접한 관련이 있다는 점이다. 두 원소 모두 황화물(방연석과 휘안석)로서, 종종 함께 발견된다. 플리니우스는 휘안석을 가열하면 안티모니 대신 납이 생성된다고 잘못 기록했다.[28] 터키와 인도와 같은 국가에서는 원래 페르시아어 이름인 가 황화 안티모니 또는 황화납을 가리키게 되었고,[29] 러시아어와 같은 일부 언어에서는 안티모니를 가리키는 이름이 되었다(сурьмаru).[30]
2. 3. 중세 및 르네상스
서유럽에서 납 채굴은 서로마 제국 멸망 후 감소하였고, 아랍 이베리아에서만 상당한 생산량을 보였다.[1][2] 남아시아와 동아시아, 특히 중국과 인도에서 납 생산이 크게 증가했다.[2]유럽에서는 11세기와 12세기에 납 생산이 다시 증가하여 지붕, 배관, 스테인드글라스 제작 등에 사용되었다.[3] 유럽과 아랍의 연금술사들은 납(기호 ♄)을 불순한 기본 금속으로 여겼고, 정제 과정을 통해 금으로 변환될 수 있다고 믿었다.[4][5]
이 시기 납은 포도주 첨가제로도 사용되었는데, 1498년 교황령에 의해 금지되었음에도 불구하고 18세기 후반까지 계속 사용되어 중독을 일으켰다.[6][7] 납은 인쇄기 부품의 주요 재료였으며, 인쇄 작업자들은 납 먼지를 흡입하여 납 중독에 걸리기도 했다.[8] 또한, 납은 화기의 탄환 재료로도 사용되었는데, 가격이 저렴하고 철제 총열에 손상을 덜 주며, 밀도가 높아 속도 유지에 유리했기 때문이다.[9]
베네치아 연백 형태의 납은 서유럽 귀족들이 화장품으로 널리 사용했는데, 하얀 얼굴이 겸손의 상징으로 여겨졌기 때문이다.[10][11] 이러한 관습은 18세기 후반 프랑스 혁명과 함께 사라졌다. 일본에서도 게이샤의 등장과 함께 비슷한 유행이 나타났으며, 미백제에 납이 흔히 사용되었다.[12][13] 잉글랜드의 엘리자베스 1세는 하얀 얼굴로 묘사되었는데, 미백제에 포함된 납이 그녀의 죽음에 영향을 주었을 것으로 추정된다.[14]

2. 4. 산업 혁명과 현대


18세기 후반, 영국에서 시작되어 유럽 대륙과 미국으로 확산된 산업혁명은 로마 시대를 뛰어넘는 납 생산량 증가를 가져왔다.[1] 영국은 납 생산을 주도했지만, 19세기 중반 광산 고갈과 독일, 스페인, 미국의 납 채굴 발전으로 그 지위를 잃었다.[2] 1900년에는 미국이 세계 납 생산의 선두 주자가 되었고, 캐나다, 멕시코, 오스트레일리아 등 다른 비유럽 국가들도 생산량을 늘리면서 유럽 이외 지역의 생산량이 유럽 내 생산량을 넘어섰다.[3]
납 수요의 증가는 배관 및 납 페인트의 사용 증가와 관련이 깊었다.[4] 이 때문에 (노동 계급) 사람들의 납 노출이 증가했고, 납 중독 사례가 늘어났다. 납 섭취의 영향에 대한 연구가 시작되면서 납이 고체보다 증기 형태일 때 더 위험하다는 사실이 밝혀졌다. 알프레드 배링 개로드는 납 중독과 통풍의 연관성을 지적하며, 통풍 환자 중 3분의 1이 배관공과 화가였다고 밝혔다. 19세기에는 정신 질환을 포함한 만성적인 납 섭취의 영향도 연구되었다. 1870년대와 1880년대 영국에서는 공장에서의 납 중독을 줄이기 위한 최초의 법률이 제정되었다.[4]
19세기 후반과 20세기 초, 납의 위험성에 대한 더 많은 증거가 발견되면서, 유해 메커니즘이 더 잘 이해되고 납 중독성 실명이 기록되었다. 미국과 유럽에서는 납의 공공 사용을 단계적으로 중단하기 시작했다. 영국은 1878년 의무적인 공장 검사를 도입하고 1898년 최초의 공장 의무 의사를 임명했다. 그 결과 1900년부터 1944년까지 납 중독 사고가 25배 감소했다.[5] 대부분의 유럽 국가들은 1930년까지 불투명도와 내수성 때문에 널리 사용되었던 납 페인트를 실내에서 금지했다.[6][7]
테트라에틸납은 1921년 미국에서 가솔린에 노크 방지제로 첨가되기 시작했다. 이는 2000년까지 미국과 유럽 연합에서 단계적으로 제거되었다.[4]
1970년대, 미국과 서유럽 국가들은 납 대기 오염을 줄이기 위한 법률을 도입했다.[8][9] 미국 질병통제예방센터의 연구에 따르면, 1976년~1980년에는 인구의 77.8%가 혈중 납 농도가 높았지만, 1991년~1994년에는 그 비율이 2.2%로 감소했다.[10] 20세기 말 납으로 만들어진 주요 제품은 납축전지였다.[11]
1960년부터 1990년까지 서방 진영의 납 생산량은 약 31% 증가했다.[12] 1950년부터 1990년까지 동방 진영의 세계 납 생산량 비중은 10%에서 30%로 증가했으며, 소련은 1970년대 중반과 1980년대에 세계 최대 생산국이었다. 중국은 20세기 후반에 대규모 납 생산을 시작하여,[13] 2004년에는 호주를 제치고 세계 최대 납 생산국이 되었다.[14] 유럽의 산업화 과정과 마찬가지로, 중국에서도 납이 건강에 부정적인 영향을 미쳤다.[15]
3. 특징
탄소족 원소 중 하나이다. 원자량은 약 207.19, 비중은 11.34이다. 녹이 슨 표면은 납색이라고 불리는 청회색이 된다. 인류 역사상 널리 사용되어 온 대표적인 중금속이다. 주로 납의 황화광물인 갈레나 형태로 산출된다.
비스무트가 모든 원소 중에서 가장 큰 질량수를 가진 안정 동위원소를 갖는 원소로 자주 언급되지만, 오랫동안 비스무트의 유일한 안정 동위원소로 여겨져 온 209Bi는 안정 동위원소가 아니라는 것이 확인되었다. 이 때문에 일반적으로 납이 가장 큰 질량수를 가진 안정 동위원소를 갖는 원소로 여겨지며, 납의 동위원소 중 하나인 208Pb가 가장 큰 질량수를 가진 안정 동위원소라고 알려져 있다. 또한, 우라늄이나 토륨과 같이 납보다 원자 번호가 큰 방사성 원소가 붕괴하면 일반적으로 최종적으로 206Pb, 207Pb 또는 208Pb를 생성하는 것으로 여겨진다. 하지만 납에도 안정 동위원소가 하나도 존재하지 않는다는 주장도 제기되기 시작했다. 실제로 오랫동안 안정 동위원소로 여겨져 온 204Pb도 사실 안정 동위원소가 아니었다.
원래의 모핵종에 따라 최종적으로 생성되는 납의 동위원소가 다르기 때문에(붕괴 계열 참조), 납의 동위원소 조성은 산지마다 다른 특징을 가진다. 우라늄이나 토륨이 모이기 쉬운 곳에서 생성된 납은 이들이 붕괴된 결과 생성되는 동위원소를 많이 포함한다. 이를 이용하여 출토품이나 오염 물질의 기원을 추정할 수 있다.
다른 금속에 비해 녹이 잘 슬고, 외관상 금세 검게 변하지만, 산화와 함께 표면에 산화피막이 형성되기 때문에 부식이 내부로 진행되기 어렵다. 또한, 많은 무기염이 물에 불용성이기 때문에 수중에서도 부식되기 어렵다.
할로겐이나 칼코겐 등과는 가열하면 직접 반응하여 화합물을 생성한다. 묽은 염산이나 묽은 황산과는 표면에 난용성염을 생성하여 반응하기 어렵지만, 질산과는 쉽게 반응한다. 초산 이온과의 친화력이 비교적 강하여, 공기(산소)의 존재 하에서 초산 수용액에도 용해되어 초산납을 생성한다.[29]
납은 무른 금속이며, 종이 등에 문지르면 글씨를 쓸 수 있기 때문에, 고대 로마인들은 양피지에 납으로 선이나 글씨를 썼고, 이것이 연필(lead pencil)의 명칭의 기원이 되었다.[30]
녹는점이 낮고 부드러워 가공이 용이하며, 비중이 크고, 비교적 제련이 용이하다는 등의 이유로 고대부터 널리 이용되어 왔다. 그러나 생물에 대한 독성과 축적성이 있기 때문에, 최근에는 사용이 기피되는 경향이 강하다. 이 문제를 해결하기 위해 RoHS 지령이 제정되어 제조자와 사용자의 보호를 확보하고 있다. 전기 회로에 사용되는 납땜 등에서도 RoHS 지령에 대응한 "무연"이라는 이름의 제품이 많이 시판되고 있다.
7.2K에서 초전도 전이를 나타내고, 이 전이 온도가 20GPa 정도까지의 인가 압력에 거의 비례하여 저하되기 때문에, 고압 물리학에서는 납의 초전도 전이 온도로부터 압력을 결정하는 데 사용되는 경우가 있다.
4. 물리적 성질
순수 납은 푸른 기운이 도는 밝고 윤기 있는 회색을 띤다.[1] 습한 공기와 접촉하면 광택이 사라지고 칙칙해진다.[2] 납은 밀도가 높고, 전성과 연성이 있으며, 수동화로 인해 내식성이 높다.[2]
납은 면심입방구조와 높은 원자량으로 인해 밀도가 11.34g/cm3로 매우 높다. 이는 철(7.87g/cm3), 구리(8.93g/cm3), 아연(7.14g/cm3)과 같은 일반적인 금속보다 높은 수치이다.[3] 이러한 밀도 때문에 "납덩이처럼 가라앉다"라는 관용구가 생겨났다.[4][5] 텅스텐과 금은 19.3g/cm3이고, 오스뮴은 22.59g/cm3로 납보다 밀도가 더 높다.[6]
납은 모스 경도가 1.5로 매우 물러서 손톱으로 긁을 수 있다.[7] 전성이 상당히 좋고 연성도 어느 정도 있다.[8] 납의 체적 탄성률은 45.8 GPa로, 알루미늄(75.2 GPa), 구리(137.8 GPa), 탄소강(160–169 GPa)보다 낮다.[9] 극한 인장 강도는 12~17 MPa로 낮은 편이지만, 소량의 구리나 안티몬을 첨가하여 강도를 높일 수 있다.[10]
납의 녹는점은 327.5°C로 대부분의 금속에 비해 매우 낮다.[11] 끓는점은 1749°C로 탄소족 원소 중 가장 낮다.[12] 20°C에서 납의 전기 저항률은 192 나노옴-미터로 다른 산업용 금속보다 거의 차수가 더 높다.[13] 납은 7,190보다 낮은 온도에서 초전도체가 되며, 이는 모든 제1종 초전도체 중 가장 높은 임계 온도이다.[14][15]
납은 자연 상태에서 질량수가 204, 206, 207, 208인 네 가지 안정 동위원소와 질량수가 209~214인 여섯 가지의 미량 방사성 동위원소로 구성되어 있다. 납은 원자 번호가 짝수이기 때문에 많은 수의 동위원소를 갖는다. 납은 마법수인 양성자 82개를 가지고 있으며, 핵껍질 모형을 통해 안정적인 원자핵을 예측할 수 있다. 납-208은 중성자 126개를 가지고 있어 매우 안정적이다.
납은 자연적으로 존재하는 동위원소가 안정적인 것으로 간주되는 가장 무거운 원소이며, 납-208은 가장 무거운 안정적인 핵이다. 과거에는 비스무트가 이 타이틀을 가졌었지만, 2003년 비스무트-209가 매우 느리게 붕괴한다는 사실이 밝혀졌다.[2] 납의 네 가지 안정 동위원소는 이론적으로 알파 붕괴를 통해 수은 동위원소로 붕괴할 수 있지만, 아직 관찰된 적은 없다.
납의 안정 동위원소 중 세 가지(납-206, 납-207, 납-208)는 우라늄-238, 우라늄-235, 토륨-232의 최종 붕괴 생성물이다.[4] 이러한 붕괴 계열은 각각 우라늄 계열, 악티늄 계열, 토륨 계열이라고 불린다.[5] 자연 암석 샘플에서 이들 동위원소의 농도는 우라늄 및 토륨 모원소의 존재 여부에 따라 달라진다. 예를 들어, 납-208의 상대적 풍부도는 일반적인 샘플에서는 52%이지만, 토륨 광석에서는 90%까지 올라갈 수 있다.[6] 시간이 지남에 따라 납-206과 납-207의 비율이 증가하는데, 이는 무거운 원소의 방사성 붕괴로 인해 보충되기 때문이다. 이를 통해 납-납 연대 측정이 가능하며, 우라늄-납 연대 측정의 기초가 된다.[8] 납-207은 핵 자기 공명을 나타내어 화합물 연구에 사용된다.[9][10]
안정 동위원소 외에도 소량의 방사성 동위원소가 존재한다. 납-210은 반감기가 22.2년이지만, 우라늄-238의 붕괴 계열에서 생성되기 때문에 자연적으로 존재한다. 납-211, -212, -214는 각각 우라늄-235, 토륨-232, 우라늄-238의 붕괴 계열에 존재하여 자연에서 발견된다. 납-209는 라듐-223의 클러스터 붕괴와 넵투늄-237의 붕괴 계열에서 발생하며, 우라늄 광석에서 중성자 포획으로 생성된다. 납-213도 넵투늄-237의 붕괴 계열에서 발생한다. 납-210은 납-206과의 비율을 통해 샘플의 연령을 확인하는 데 유용하다.[11]
총 43개의 납 동위원소가 합성되었으며, 질량수는 178~220이다. 납-205는 반감기가 약 1700만 년인 가장 안정적인 방사성 동위원소이다.[12] 두 번째로 안정적인 것은 납-202이며, 반감기는 약 52,500년이다.
4. 1. 원자
납(원자)은 82개의 전자를 가지고 있으며, [제논(Xe)]4f145d106s26p2의 전자 배열로 배열되어 있다. 납의 첫 번째와 두 번째 이온화 에너지의 합 — 두 개의 6p 전자를 제거하는 데 필요한 총 에너지 — 은 납의 주기율표 상위 이웃 원소인 주석과 거의 같다. 이는 특이한데, 일반적으로 원소의 바깥쪽 전자들이 핵으로부터 더 멀어지고, 더 작은 궤도에 의해 더 많이 차폐되기 때문에 주기율표의 같은 족(族)을 따라 내려갈수록 이온화 에너지는 감소하기 때문이다.납의 처음 네 개의 이온화 에너지의 합은 주석보다 크다.[1] 이는 주기적 경향이 예측하는 것과 반대된다. 이는 더 무거운 원자에서 중요해지는 상대론적 효과에 의해 설명된다.[2] 상대론적 효과는 s와 p 궤도를 수축시켜 납의 6s 전자가 5s 전자보다 더 큰 결합 에너지를 갖도록 한다.[3] 그 결과, 소위 비활성 전자쌍 효과가 발생한다. 즉, 납의 6s 전자는 결합에 참여하기를 꺼리고, +2 산화 상태를 안정화시키며 결정질 납에서 가장 가까운 원자 사이의 거리를 비정상적으로 길게 만든다.[4]
납보다 가벼운 탄소족(동족원소) 원소들은 사면체 배위 및 공유 결합된 다이아몬드 구조를 갖는 안정적이거나 준안정적인 동소체를 형성한다. 이들의 바깥쪽 s- 및 p-궤도의 에너지 준위는 네 개의 혼성 sp3 궤도로 혼합될 수 있을 만큼 충분히 가깝다. 납에서는 비활성 전자쌍 효과로 인해 s- 및 p-궤도 사이의 간격이 넓어지고, 이 간격은 혼성화 후 추가적인 결합으로 인해 방출되는 에너지로는 극복할 수 없다.[5] 납은 다이아몬드 구조를 가지는 대신, p-전자만이 비편재화되어 Pb2+ 이온 사이에서 공유되는 금속 결합을 형성한다. 따라서 납은 크기가 비슷한[6] 2가 금속인 칼슘과 스트론튬과 마찬가지로 면심입방 구조를 갖는다.[7][8]
4. 2. 동위원소
자연 상태의 납은 질량수가 204, 206, 207, 208인 네 가지 안정 동위원소와 질량수가 209~214인 여섯 가지의 미량 방사성 동위원소로 구성되어 있다. 납은 원자 번호가 짝수이기 때문에 많은 수의 동위원소를 갖는다. 납은 마법수인 양성자 82개를 가지고 있으며, 핵껍질 모형을 통해 안정적인 원자핵을 예측할 수 있다.[1] 납-208은 중성자 126개를 가지고 있어 매우 안정적이다.[1]납은 자연적으로 존재하는 동위원소가 안정적인 것으로 간주되는 가장 무거운 원소이며, 납-208은 가장 무거운 안정적인 핵이다. 과거에는 비스무트가 이 타이틀을 가졌었지만, 2003년 비스무트-209가 매우 느리게 붕괴한다는 사실이 밝혀졌다.[2] 납의 네 가지 안정 동위원소는 이론적으로 알파 붕괴를 통해 수은 동위원소로 붕괴할 수 있지만, 아직 관찰된 적은 없다. 예측된 반감기는 매우 길다.[3]
납의 안정 동위원소 중 세 가지(납-206, 납-207, 납-208)는 네 가지 주요 붕괴 계열 중 세 가지에서 발견된다. 이들은 각각 우라늄-238, 우라늄-235, 토륨-232의 최종 붕괴 생성물이다.[4] 이러한 붕괴 계열은 각각 우라늄 계열, 악티늄 계열, 토륨 계열이라고 불린다.[5] 자연 암석 샘플에서 이들 동위원소의 농도는 우라늄 및 토륨 모원소의 존재 여부에 따라 달라진다. 예를 들어, 납-208의 상대적 풍부도는 일반적인 샘플에서는 52%이지만, 토륨 광석에서는 90%까지 올라갈 수 있다.[6] 이러한 이유로 납의 표준 원자량은 소수점 첫째 자리까지만 제시된다.[7] 시간이 지남에 따라 납-206과 납-207의 비율이 증가하는데, 이는 무거운 원소의 방사성 붕괴로 인해 보충되기 때문이다. 이를 통해 납-납 연대 측정이 가능하며, 우라늄-납 연대 측정의 기초가 된다.[8] 납-207은 핵 자기 공명을 나타내어 화합물 연구에 사용된다.[9][10]
안정 동위원소 외에도 소량의 방사성 동위원소가 존재한다. 납-210은 반감기가 22.2년이지만, 우라늄-238의 붕괴 계열에서 생성되기 때문에 자연적으로 존재한다. 납-211, -212, -214는 각각 우라늄-235, 토륨-232, 우라늄-238의 붕괴 계열에 존재하여 자연에서 발견된다. 납-209는 라듐-223의 클러스터 붕괴와 넵투늄-237의 붕괴 계열에서 발생하며, 우라늄 광석에서 중성자 포획으로 생성된다. 납-213도 넵투늄-237의 붕괴 계열에서 발생한다. 납-210은 납-206과의 비율을 통해 샘플의 연령을 확인하는 데 유용하다.[11]
총 43개의 납 동위원소가 합성되었으며, 질량수는 178~220이다. 납-205는 반감기가 약 1700만 년인 가장 안정적인 방사성 동위원소이다.[12] 두 번째로 안정적인 것은 납-202이며, 반감기는 약 52,500년이다.
모든 원소 중에서 가장 큰 질량수를 가진 안정 동위원소를 갖는 원소는 납이며, 그중 208Pb가 가장 큰 질량수를 가진 안정 동위원소이다. 우라늄이나 토륨과 같이 납보다 원자 번호가 큰 방사성 원소가 붕괴하면 최종적으로 납의 동위원소(206Pb, 207Pb, 208Pb)를 생성한다. 납의 동위원소 조성은 산지마다 다르며, 이를 이용하여 출토품이나 오염 물질의 기원을 추정할 수 있다.
5. 화학적 성질

납은 습한 공기에 노출되면 다양한 조성의 보호층을 형성한다. 탄산납(II)가 일반적인 성분이며,[29] 도시나 해양 환경에서는 황산납(II) 또는 염화납(II)도 존재할 수 있다.[30] 이 층은 벌크 납(bulk lead)을 공기 중에서 효과적으로 화학적 불활성을 띄게 한다.[31] 미세하게 분쇄된 납은 발화성이 있으며,[32] 청백색 불꽃으로 연소한다.[33]
불소는 상온에서 납과 반응하여 플루오르화납(II)를 형성한다. 염소와 반응은 유사하지만 가열이 필요하며, 생성된 염화물 층은 원소의 반응성을 감소시킨다.[34] 용융된 납은 칼코겐과 반응하여 납(II) 칼코겐화물을 생성한다.[35]
납 금속은 황산과 인산에는 저항하지만, 염산이나 질산에는 저항하지 않는다. 그 결과는 생성된 염의 불용성과 그에 따른 수동화에 따라 달라진다.[36] 아세트산과 같은 유기산은 산소 존재 하에 납을 용해시킨다.[37] 진한 알칼리는 납을 용해시켜 플럼바이트를 형성한다.[38]
다른 금속에 비해 녹이 잘 슬고 외관상 금세 검게 변하지만, 산화와 함께 표면에 산화피막이 형성되기 때문에 부식이 내부로 진행되기 어렵다. 또한, 많은 무기염이 물에 불용성이기 때문에 수중에서도 부식되기 어렵다. 할로겐이나 칼코겐 등과는 가열하면 직접 반응하여 화합물을 생성한다. 묽은 염산이나 묽은 황산과는 표면에 난용성 염을 생성하여 반응하기 어렵지만, 질산과는 쉽게 반응한다. 초산 이온과 친화력이 비교적 강하여, 공기(산소)의 존재 하에서 초산 수용액에도 용해되어 초산납을 생성한다.[29]
5. 1. 무기 화합물
습한 공기에 노출된 납은 다양한 조성의 보호층을 형성하는데, 탄산납(II)가 일반적인 성분이다.[29] 도시 또는 해양 환경에서는 황산납(II) 또는 염화납(II)도 존재할 수 있다.[30] 이 층은 벌크 납을 공기 중에서 효과적으로 화학적으로 불활성화시킨다.[31] 미세하게 분쇄된 납은 발화성이 있으며,[32] 청백색 불꽃으로 연소한다.[33]불소는 상온에서 납과 반응하여 플루오르화납(II)를 형성한다. 염소와의 반응은 유사하지만 가열이 필요하며, 생성된 염화물 층은 원소의 반응성을 감소시킨다.[34] 용융된 납은 칼코겐과 반응하여 납(II) 칼코겐화물을 생성한다.[35]
납 금속은 황산과 인산에는 저항하지만 염산 또는 질산에는 저항하지 않는다. 결과는 생성된 염의 불용성과 그에 따른 수동화에 따라 달라진다.[36] 아세트산과 같은 유기산은 산소 존재 하에 납을 용해시킨다.[37] 진한 알칼리는 납을 용해시켜 플럼바이트를 형성한다.[38]
납은 주로 +4와 +2의 두 가지 산화 상태를 나타낸다. 납(II) 화합물은 납의 무기 화학을 특징짓는다. 플루오린이나 염소와 같은 강한 산화제조차도 납과 반응하여 PbF2와 PbCl2만을 생성한다.[39] 납(II) 이온은 용액에서 일반적으로 무색이며,[40] 부분적으로 가수분해되어 Pb(OH)+를 형성하고 최종적으로 [Pb4(OH)4]4+(여기서 히드록실 이온은 가교 리간드로 작용)를 형성하지만,[41] 환원제로는 작용하지 않는다. 물 속에 있는 Pb2+ 이온의 존재를 확인하는 기법은 일반적으로 묽은 염산을 사용하여 염화납(II)을 침전시키는 데 의존한다. 염화물 염은 물에 약간 용해되기 때문에 매우 묽은 용액에서는 용액을 통해 황화수소를 통과시켜 황화납(II)의 침전을 대신 얻는다.[42]
산화납은 다형체인 연단 α-PbO(적색)와 황단 β-PbO(황색) 두 가지가 존재하며, 후자는 약 488 °C 이상에서만 안정하다. 연단은 가장 일반적으로 사용되는 납의 무기 화합물이다.[43] 납(II) 수산화물은 존재하지 않는다. 납(II) 염 용액의 pH를 높이면 가수분해와 축합이 일어난다.[44] 납은 일반적으로 무거운 칼코겐과 반응한다. 황화납은 반도체, 광전도체이며 매우 민감한 적외선 방사 검출기이다. 다른 두 가지 칼코겐화물인 셀렌화납과 텔루르화납도 마찬가지로 광전도성을 띤다. 이들은 주기율표에서 아래로 내려갈수록 색이 밝아지는 특이한 성질을 지닌다.[45]
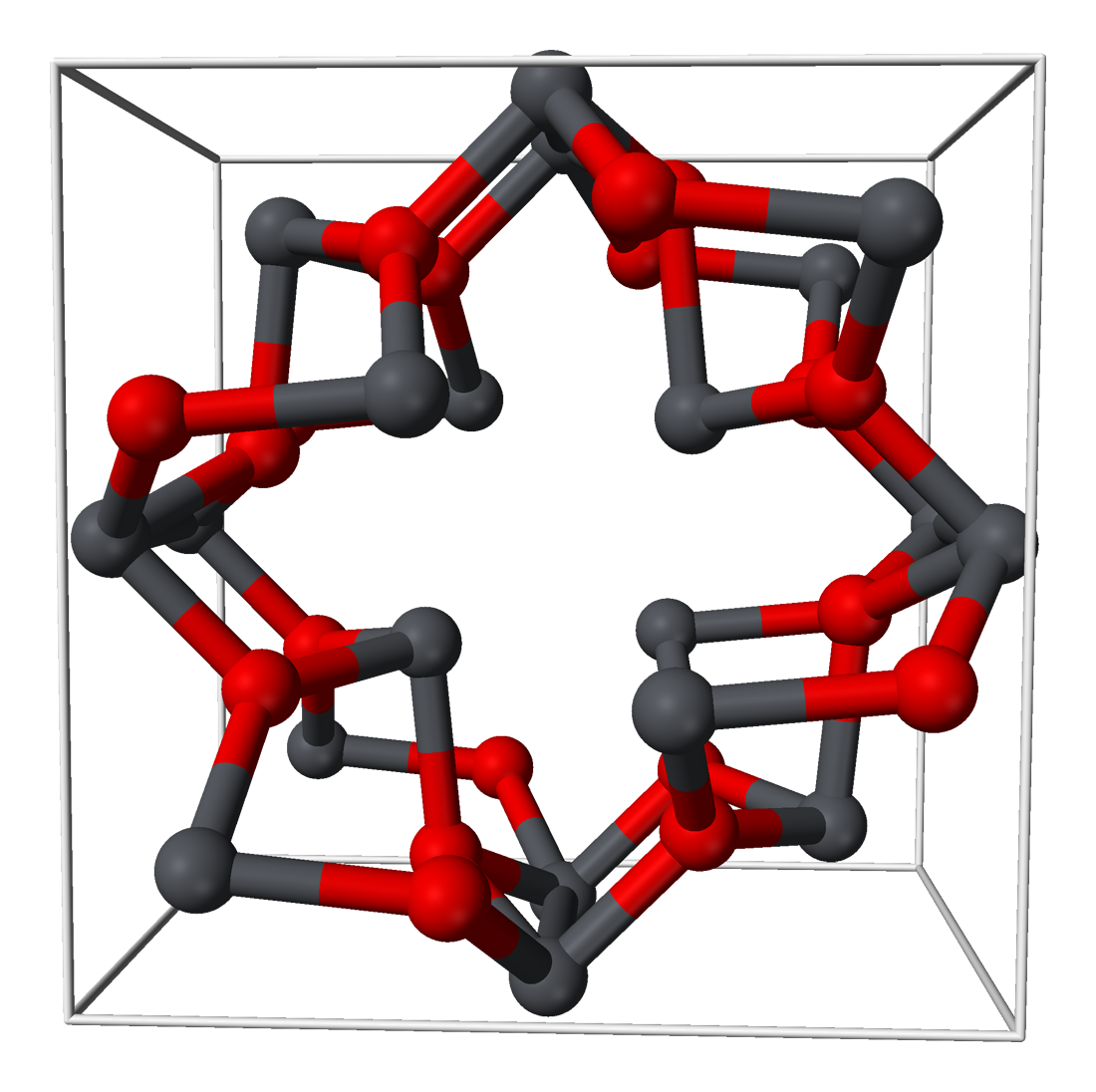
납 이할로겐화물은 잘 특징지어졌으며, 이에는 디아스타타이드[46]와 PbFCl과 같은 혼합 할로겐화물이 포함된다. 이플루오르화물은 1834년 마이클 패러데이에 의해 발견된 최초의 고체 이온 전도성 화합물이었다. 다른 이할로겐화물은 특히 디아이오다이드에 자외선이나 가시광선에 노출되면 분해된다. 시안화물, 시안산염 및 티오시안산염과 같은 많은 납(II) 슈도할로겐화물이 알려져 있다. 납(II)은 [PbCl4]2−, [PbCl6]4− 및 [Pb2Cl9]''n''5''n''− 사슬 음이온과 같은 광범위한 할로겐화물 배위 착물을 형성한다.
황산납(II)은 다른 무거운 2가 양이온의 황산염과 마찬가지로 물에 용해되지 않는다. 질산납(II)과 초산납(II)은 매우 잘 용해되며, 이는 다른 납 화합물의 합성에 이용된다.
무기 납(IV) 화합물은 몇 가지 알려져 있지만, 강한 산화 조건의 용액에서만 생성되며 일반적인 조건에서는 존재하지 않는다. 산화납(II)는 추가적인 산화를 통해 혼합 산화물인 Pb₃O₄를 생성한다. 이는 산화납(II,IV) 또는 2PbO·PbO₂의 구조로 설명되며, 가장 잘 알려진 혼합 원자가 납 화합물이다. 이산화납은 강한 산화제로, 염산을 염소 기체로 산화시킬 수 있다. 이는 생성될 것으로 예상되는 PbCl₄가 불안정하여 자발적으로 PbCl₂와 Cl₂로 분해되기 때문이다. 일산화납과 유사하게, 이산화납은 플럼베이트 음이온을 형성할 수 있다. 이황화납과 이셀렌화납은 고압에서만 안정하다. 노란색 결정성 분말인 사불화납은 안정하지만, 이불화납보다 안정성이 떨어진다. 사염화납(노란색 액체)는 상온에서 분해되고, 사브롬화납은 더욱 불안정하며, 사아이오드화납의 존재는 의문스럽다.

납 금속의 주요 용도 외에도, 납축전지는 납 화합물의 주요 소비처이기도 하다. 납축전지에서 사용되는 에너지 저장/방출 반응에는 황산납(II)과 이산화납이 포함된다.
:
납 화합물의 다른 용도는 매우 전문적이며 종종 사라지고 있다. 납 기반 색소는 특히 빨간색과 노란색 색조의 세라믹 유약과 유리에 사용된다. 납 페인트는 유럽과 북미에서 단계적으로 폐지되고 있지만, 중국, 인도, 인도네시아와 같은 저개발 국가에서는 여전히 사용되고 있다. 테트라아세트산납과 이산화납은 유기화학에서 산화제로 사용된다. 납은 전선의 폴리염화비닐 코팅에 자주 사용된다. 촛불 심지를 처리하여 더 길고 고른 연소를 보장하는 데 사용될 수 있다. 유독성 때문에 유럽과 북미 제조업체는 아연과 같은 대체재를 사용한다. 납 유리는 12~28%의 산화납으로 구성되어 광학적 특성을 변화시키고 이온화 방사선의 투과율을 감소시키는데, 이러한 특성은 구형 TV와 브라운관이 있는 컴퓨터 모니터에 사용되었다. 텔루르화납과 셀렌화납과 같은 납 기반 반도체는 광전지 및 적외선 검출기에 사용된다.
다른 금속에 비해 녹이 잘 슬고, 외관상 금세 검게 변하지만, 산화와 함께 표면에 산화피막이 형성되기 때문에 부식이 내부로 진행되기 어렵다. 또한, 많은 무기염이 물에 불용성이기 때문에 수중에서도 부식되기 어렵다.
할로겐이나 칼코겐 등과는 가열하면 직접 반응하여 화합물을 생성한다. 묽은 염산이나 묽은 황산과는 표면에 난용성염을 생성하여 반응하기 어렵지만, 질산과는 쉽게 반응한다. 초산 이온과의 친화력이 비교적 강하여, 공기(산소)의 존재 하에서 초산 수용액에도 용해되어 초산납을 생성한다.[29]
납은 무른 금속이며, 종이 등에 문지르면 글씨를 쓸 수 있기 때문에, 고대 로마인들은 양피지에 납으로 선이나 글씨를 썼고, 이것이 연필(lead pencil)의 명칭의 기원이 되었다.[30]
다음은 주요 무기 화합물 목록이다.
- 산화납(II)(PbO)
- 이산화납()
- 사산화삼납() - 붉은색 안료·연단(광명단)으로 사용된다.
- 크롬산납() - 노란색 안료·황연(크롬옐로우)로 사용된다.
- 티탄산지르콘산납() - 대표적인 압전재료
- 납 아지드 ()
- 초산납(II) ()
- 초산납(IV) ()
- 테트라에틸납 ()
- 비산납 ()
- 염화납 (, )
- 페로브스카이트 태양전지 ( 등)
5. 2. 유기납 화합물
납은 탄소족 원소로서 주로 +4, +2의 두 가지 산화 상태를 나타내는데, 유기 화합물에서는 +4 산화 상태가 일반적이다. 이는 납과 탄소의 전기음성도가 비슷하여 안정한 공유 결합을 형성하기 때문이다. 납은 탄소와 마찬가지로 유기 화합물에서 주로 4개의 결합을 형성한다.납(II) 화합물과 달리 유기납 화합물은 납(IV) 화합물이다. 대표적인 유기납 화합물로 테트라에틸납(Tetraethyllead영어, (C2H5)4Pb)이 있다. 이는 한때 휘발유의 옥탄가를 높이기 위해 사용되었던 안티노크제였다.
납은 할로겐, 칼코겐 등과 가열하면 직접 반응하여 화합물을 생성한다. 묽은 염산이나 묽은 황산과는 표면에 난용성 염을 생성하여 반응하기 어렵지만, 질산과는 쉽게 반응한다. 초산 이온과의 친화력이 비교적 강하여, 공기(산소)의 존재 하에서 초산 수용액에도 용해되어 초산납을 생성한다.[29][30]
6. 기원 및 존재
탄소족 원소 중 하나이다. 원자량은 약 207.19, 비중은 11.34이다. 녹이 슨 표면은 납색이라고 불리는 청회색이 된다. 인류 역사상 널리 사용되어 온 대표적인 중금속으로, 주로 납의 황화광물인 방연광 형태로 산출된다.
비스무트가 가장 큰 질량수를 가진 안정 동위원소를 갖는 원소로 자주 언급되지만, 209Bi는 안정 동위원소가 아니라는 것이 확인되었다. 따라서 납이 가장 큰 질량수를 가진 안정 동위원소를 갖는 원소로 여겨지며, 208Pb가 가장 큰 질량수를 가진 안정 동위원소이다. 납보다 원자 번호가 큰 우라늄이나 토륨 같은 방사성 원소가 붕괴하면 최종적으로 206Pb, 207Pb, 208Pb를 생성한다. 하지만 납에도 안정 동위원소가 없다는 주장도 있으며, 실제로 204Pb도 안정 동위원소가 아닌 것으로 밝혀졌다.
원래 모핵종에 따라 생성되는 납의 동위원소가 다르기 때문에(붕괴 계열 참조), 납의 동위원소 조성은 산지마다 다르다. 우라늄이나 토륨이 모이기 쉬운 곳에서 생성된 납은 이들이 붕괴된 결과 생성되는 동위원소를 많이 포함한다. 이를 이용하여 출토품이나 오염 물질의 기원을 추정할 수 있다.
지구 지각에서 납의 함량은 약 8ppm으로[31], 풍부하다고 할 수는 없다. 그러나 황화광물로 널리 존재하고 채굴 및 제련이 비교적 용이하여 아연과 마찬가지로 저렴한 금속이다.
순수한 자연납은 드물고, 황화물인 방연광으로 널리 분포하며, 흑광 광상 등 구리, 아연 등과 함께 존재하는 경우가 많다. 방연광이 산화된 황산납광, 탄산염인 백연광, 크롬산염인 홍연광 등도 산출된다. 화성암, 특히 화강암에 미량 포함되어 있으며, 이온 반지름이 비슷한 정장석 속의 칼륨을 치환하고 있다.[32]
6. 1. 우주
태양계에서 납의 입자당 존재비는 0.121 ppb(10억분율)이다.[1] 이 수치는 백금의 2.5배, 수은의 8배, 금의 17배에 달한다.[1] 우주에서 납의 양은 대부분의 무거운 원자(모두 불안정함)가 서서히 납으로 붕괴되면서 서서히 증가하고 있다.[2] 45억 년 전 태양계 형성 이후 태양계의 납 함량은 약 0.75% 증가했다.[3] 태양계 원소 존재비 표에 따르면 납은 원자 번호가 40보다 큰 다른 대부분의 원소보다 더 흔하다.[1]원시 납(납-204, 납-206, 납-207, 납-208 동위원소로 구성됨)은 대부분 별에서 일어나는 반복적인 중성자 포획 과정의 결과로 생성되었다. 두 가지 주요 포획 방식은 s-과정과 r-과정이다.[4]
s-과정(s는 "slow"의 약자)에서는 중성자 포획이 수년 또는 수십 년 간격으로 이루어지므로, 덜 안정적인 핵이 베타 붕괴를 할 수 있다.[5] 안정적인 탈륨-203 핵은 중성자를 포획하여 탈륨-204가 되고, 이는 베타 붕괴를 거쳐 안정적인 납-204를 생성한다. 다른 중성자를 포획하면 납-205가 되는데, 이는 약 1700만 년의 반감기를 가진다. 더 포획하면 납-206, 납-207, 납-208이 된다. 납-208이 다른 중성자를 포획하면 납-209가 되는데, 이는 빠르게 비스무트-209로 붕괴한다. 비스무트-209가 다른 중성자를 포획하면 비스무트-210이 되고, 이는 베타 붕괴하여 폴로늄-210이 되며, 이는 알파 붕괴하여 납-206이 된다. 따라서 이 순환은 납-206, 납-207, 납-208, 비스무트-209에서 끝난다.[6]

r-과정(r은 "rapid"의 약자)에서는 핵이 붕괴될 수 있는 것보다 더 빠르게 중성자 포획이 일어난다.[7] 이는 초신성 폭발이나 두 중성자별의 합병과 같이 중성자 밀도가 높은 환경에서 발생한다. 관련된 중성자 플럭스는 제곱센티미터당 초당 1022개의 중성자 정도일 수 있다.[8] r-과정은 s-과정만큼 많은 납을 생성하지 않는다.[9] 중성자가 풍부한 핵이 중성자 126개에 도달하면 중성자 포획이 중단되는 경향이 있다.[10] 이 시점에서 중성자는 원자핵에서 완전한 껍질로 배열되므로, 더 많은 중성자를 수용하기 어렵다.[11] 중성자 플럭스가 감소하면 이러한 핵은 오스뮴, 이리듐, 백금의 안정적인 동위원소로 베타 붕괴한다.[12]
비스무트가 모든 원소 중에서 가장 큰 질량수를 가진 안정 동위원소를 갖는 원소로 자주 언급되지만, 오랫동안 비스무트의 유일한 안정 동위원소로 여겨져 온 209Bi는 사실 안정 동위원소가 아니라는 것이 확인되었다. 따라서 일반적으로 납이 모든 원소 중에서 가장 큰 질량수를 가진 안정 동위원소를 갖는 원소로 여겨지며, 납의 동위원소 중 하나인 208Pb가 가장 큰 질량수를 가진 안정 동위원소라고 알려져 있다. 우라늄이나 토륨과 같이 납보다 원자 번호가 큰 방사성 원소가 붕괴하면 일반적으로 최종적으로 206Pb, 207Pb 또는 208Pb를 생성한다. 하지만 납에도 안정 동위원소가 하나도 존재하지 않는다는 주장도 제기되었다. 실제로 오랫동안 안정 동위원소로 여겨져 온 204Pb도 사실 안정 동위원소가 아니었다.
원래의 모핵종에 따라 최종적으로 생성되는 납의 동위원소가 다르기 때문에(붕괴 계열 참조), 납의 동위원소 조성은 산지마다 다른 특징을 가진다. 우라늄이나 토륨이 모이기 쉬운 곳에서 생성된 납은 이들이 붕괴된 결과 생성되는 동위원소를 많이 포함한다. 이를 이용하여 출토품이나 오염 물질의 기원을 추정할 수 있다.
6. 2. 지구
납은 골드슈미트 분류에서 친황석 원소로 분류되는데, 이는 황과 결합된 형태로 발견됨을 의미한다.[3] 납은 자연 상태의 금속 형태로 발견되는 경우가 드물다.[4] 많은 납 광물은 비교적 가볍기 때문에 지구 역사를 통해 지구 내부 깊숙이 가라앉는 대신 지각에 남아 있다. 이는 지각 내 납의 풍부도가 비교적 높은 14 ppm에 해당하는 이유이며, 지각에서 36번째로 풍부한 원소이다.[5]주요 납 함유 광물은 방연광(PbS)이며, 주로 아연 광석과 함께 발견된다.[4] 다른 대부분의 납 광물은 어떤 방식으로든 방연광과 관련이 있다. 불랑제라이트(Pb5Sb4S11)는 방연광에서 유래된 혼합 황화물이고, 황산납광(PbSO4)은 방연광의 산화 생성물이며, 백연광(PbCO3)은 방연광의 분해 생성물이다. 비소, 주석, 안티모니, 은, 금, 구리, 비스무트는 납 광물에서 흔히 발견되는 불순물이다.[4]

세계 납 매장량은 20억 톤을 초과한다. 호주, 중국, 아일랜드, 멕시코, 페루, 포르투갈, 러시아, 미국에 상당한 매장량이 있다. 2016년 경제적으로 채굴이 가능한 세계 매장량은 총 8800만 톤이었으며, 이 중 호주가 3500만 톤, 중국이 1700만 톤, 러시아가 640만 톤을 차지했다.[6]
대기 중 납의 일반적인 배경 농도는 0.1 μg/m3을 초과하지 않으며, 토양에서는 100 mg/kg, 식물에서는 4 mg/kg, 담수와 해수에서는 5 μg/L이다.[7]
지구 지각에서 납의 함량은 약 8 ppm으로 추정되며,[31] 결코 풍부하다고는 할 수 없다. 그러나 황화광물로 널리 존재하고 채굴 및 제련이 비교적 용이하기 때문에 아연과 마찬가지로 저렴한 금속이다.
순수한 자연납으로 존재하는 것은 드물고, 황화물인 방연광으로 널리 분포하며, 흑광 광상 등 구리, 아연 등과 함께 존재하는 경우가 많다. 또한 방연광이 산화된 황산납광, 탄산염인 백연광, 크로뮴산염인 홍연광 등도 산출된다. 또한 화성암, 특히 화강암에 미량 포함되어 있으며, 이온 반지름이 비슷한 정장석 속의 칼륨을 치환하고 있다.[32]
7. 생산
납 생산은 크게 광석에서 직접 납을 추출하는 1차 생산과 고철 등을 재활용하는 2차 생산으로 나뉜다. 19세기 후반과 20세기 초, 납의 유해성이 널리 알려지면서 미국과 유럽에서는 납 사용을 줄이려는 노력이 있었다. 영국에서는 공장 검사 의무화(1878년)와 공장 의무 의사 임명(1898년)으로 납 중독 사고가 감소했다.[21] 대부분의 유럽 국가들은 1930년까지 실내 납 페인트를 금지했다.[22][23]
테트라에틸납은 가솔린의 노크 방지제로 사용되었으나(미국, 1921년), 2000년까지 미국과 유럽 연합에서 단계적으로 제거되었다.[24] 1970년대, 미국과 서유럽 국가들은 납 대기 오염 감소 법률을 도입했다.[25][26] 미국 질병통제예방센터(CDC) 연구에 따르면, 1976~1980년 인구의 77.8%가 혈중 납 농도가 높았으나, 1991~1994년에는 2.2%로 감소했다.[27]
1960년부터 1990년까지 서방 진영의 납 생산량은 약 31% 증가했다.[28] 같은 기간 동방 진영의 세계 납 생산량 비중은 10%에서 30%로 증가했으며, 소련은 1970년대 중반과 1980년대에 세계 최대 생산국이었다. 중국은 20세기 후반에 대규모 납 생산을 시작하여 2004년에는 오스트레일리아를 제치고 세계 최대 생산국이 되었다.[29]
2016년 세계 주요 납 생산국은 다음과 같다.[30]
원료는 방연석(섬아연석)이 가장 중요하며, 로스팅 공정과 환원을 거쳐 조연(粗鉛)이 얻어지고, 이어서 습식법 또는 건식법으로 제련된다.[30]
보다 청정하고 에너지 소비가 적은 납 추출 공정에 대한 연구는 계속되고 있다. 그러나 폐기물로 손실되는 납이 많거나, 대안적인 방법을 사용하면 황 함량이 높아지는 등의 단점이 있다. 수전해야금 추출법은 잠재력이 있지만, 현재로서는 경제적이지 않다.[31]
7. 1. 1차 생산

2014년 기준, 납축전지 사용 증가로 전 세계 납 생산량이 증가하고 있다. 생산은 광석 채굴을 통한 1차 생산과 고철을 통한 2차 생산으로 나뉜다. 2014년 1차 생산량은 458만ton이었다.[30] 같은 해 납 정광 생산량 상위 3개국은 중국, 오스트레일리아, 미국이었다.[30] 2010년 사회 내 금속 재고 보고서에 따르면 전 세계적으로 사용, 비축, 폐기 또는 환경으로 유출된 납의 총량은 1인당 8kg이다. 이 중 상당 부분은 개발도상국(1~4kg/인)보다 선진국(20~150kg/인)에 집중되어 있다.[30]
1차 납 생산 공정은 크게 두 가지 방법으로 나뉜다. 첫 번째는 별도의 용기에서 로스팅(가열처리) 후 용광로 추출을 하는 2단계 공정이고, 두 번째는 농축물 추출이 단일 용기에서 이루어지는 직접 공정이다. 후자가 일반적이지만, 전자도 여전히 중요한 위치를 차지한다.[30]
2단계 공정에서는 먼저 황화물 정광을 공기 중에서 로스팅하여 황화납을 산화시킨다.[30]
: 2PbS(s) + 3O2(g) → 2PbO(s) + 2SO2(g)↑
원광이 순수한 황화납이 아니기 때문에, 로스팅 과정에서 원하는 산화납뿐만 아니라 납과 광석에 포함된 다른 금속의 산화물, 황산염, 규산염 혼합물이 생성된다.[30] 이 불순한 산화납은 코크스를 연료로 사용하는 용광로에서 환원되어 (다시 불순한) 금속 납이 된다.[30]
: 2PbO(s) + C(s) → 2Pb(s) + CO2(g)↑
직접 제련법에서는 로스팅으로 일부를 산화납으로 만들고, 이것을 남은 황화납과 반응시킨다. 이는 에너지적으로 유리한 반응이지만 선광의 정도를 높일 필요가 있다.
: 2PbO + PbS -> 3Pb + SO2
불순물은 주로 비소, 안티몬, 비스무트, 아연, 구리, 은, 금이다. 일반적으로 이들은 일련의 열 야금 공정을 통해 제거된다. 용융물은 공기, 수증기, 황을 사용하여 반사로에서 처리되는데, 이는 은, 금, 비스무트를 제외한 불순물을 산화시킨다. 산화된 불순물은 용융물의 표면으로 떠올라 제거된다.[30]
금속 은과 금은 아연을 납에 첨가하는 파크스 공정을 통해 경제적으로 분리 및 회수된다. 납과 섞이지 않는 아연은 은과 금을 용해시킨다. 아연 용액은 납으로부터 분리될 수 있으며, 은과 금은 회수된다.[30] 은이 제거된 납은 베터턴-크롤 공정을 통해 금속 칼슘과 마그네슘으로 처리하여 비스무트를 제거한다. 생성된 비스무트 제거재는 제거될 수 있다.[30]
열 야금 공정의 대안으로, 베츠 공정을 사용하여 용융 납을 전해 처리하여 매우 순수한 납을 얻을 수 있다. 불순한 납을 양극으로, 순수한 납을 음극으로 하여 납 플루오르규산염(PbSiF6) 전해액에 넣는다. 전위가 가해지면, 양극의 불순한 납이 용해되어 음극에 도금되고, 대부분의 불순물은 용액에 남는다.[30]
습식법은 전해정련 방식으로, 전해액에 헥사플루오로규산 수용액을 사용하고, 양극에는 조연(粗鉛), 음극에는 순연(純鉛)을 사용하여 전기분해를 수행한다. 납보다 이온화 경향이 작은 비소, 안티몬, 비스무트, 구리, 은, 금 등의 불순물은 슬라임 형태의 양극슬로 침전된다.
산화환원전위가 비슷한 불순물인 주석은 전해정련으로는 분리하기 어렵기 때문에, 용융 상태에서 수산화나트륨으로 처리하여 주석을 제거한다. 이를 통해 99.99% 정도의 순도를 가진 괴금속을 얻을 수 있다.
7. 2. 2차 생산
2014년 기준, 납축전지 사용 증가로 전 세계 납 생산량이 증가하고 있다.[14] 생산은 광석 채굴을 통한 1차 생산과 고철을 통한 2차 생산으로 나뉜다. 2014년 1차 생산량은 458만 톤, 2차 생산량은 564만 톤이었다. 같은 해 납 정광 생산량 상위 3개국은 중국, 오스트레일리아, 미국이었다.[15] 정제 납 생산량 상위 3개국은 중국, 미국, 인도였다.[16] 2010년 사회 내 금속 재고 보고서에 따르면 전 세계적으로 사용, 비축, 폐기 또는 환경으로 유출된 납의 총량은 1인당 8kg이다. 이 중 상당 부분은 개발도상국(1~4kg/인)보다 선진국(20~150kg/인)에 집중되어 있다.[17]
1차 및 2차 납 생산 공정은 유사하다. 일부 1차 생산 공장은 현재 고철 납을 활용하여 운영을 보충하고 있으며, 이러한 추세는 앞으로 더욱 증가할 것으로 예상된다. 적절한 기술이 적용될 경우 2차 공정을 통해 얻은 납은 1차 공정을 통해 얻은 납과 구별할 수 없다. 건축업에서 발생하는 고철 납은 일반적으로 상당히 깨끗하며 제련 없이 재용융될 수 있지만, 정제가 필요한 경우도 있다. 따라서 2차 납 생산은 에너지 요구량 측면에서 1차 생산보다 훨씬 저렴하며, 종종 50% 이상 저렴하다.[18]
제련은 1차 생산의 필수적인 부분이지만, 2차 생산에서는 종종 생략된다. 금속 납이 상당한 산화를 겪었을 때만 수행된다.[18] 이 과정은 용광로 또는 회전로에서 1차 생산과 유사하지만, 수율의 변동성이 더 크다는 점이 중요하다. 용광로는 경납(안티몬 10%)을 생산하는 반면, 반사로와 회전로는 반경납(안티몬 3~4%)을 생산한다.[19]
ISASMELT 공정은 1차 생산의 확장으로 작용할 수 있는 보다 최근의 제련 방법이다. 사용 후 납축전지(황산납과 산화납 포함)의 배터리 페이스트는 알칼리로 처리하여 황산염을 제거한 다음 산소 존재하에 석탄 연료로 가동되는 용광로에서 처리하여 불순물이 포함된 납을 얻는데, 안티몬이 가장 흔한 불순물이다.[20] 2차 납의 정제는 1차 납의 정제와 유사하다. 재활용되는 재료와 잠재적인 오염에 따라 일부 정제 공정은 생략될 수 있다.[20]
재활용을 위한 납의 원천 중 납축전지가 가장 중요하며, 납 파이프, 시트 및 케이블 피복도 중요하다.[18]
8. 용도
납은 밀도가 높고, 융점이 낮으며, 연성이 좋고, 상대적으로 불활성이란 여러 유용한 기계적 특성을 가지고 있다. 이러한 특성 때문에 다양한 용도로 사용되어 왔지만, 독성 문제로 인해 일부 용도에서는 사용이 줄어들고 있다.[4][5][6]
- 총알: 납은 저렴하고 융점이 낮아 소구경 탄약과 엽총 탄알 제조에 용이하다. 밀도가 높아 속도 유지력이 우수하며, 다른 금속과 합금하여 경도를 높일 수 있다. 그러나 납 탄환의 환경 오염 문제로 인해 사용이 제한되기도 한다.[4][5][6]
- 밸러스트 및 웨이트: 납의 높은 밀도는 요트 키일의 밸러스트나 스쿠버 다이빙 웨이트 벨트에 사용되어 부력을 조절하는 데 적합하다.
- 건축 자재: 납판은 지붕재, 외장재, 방수 처리, 빗물받이 등 건축 분야에서 활용된다. 조각상 제작과 조형물 지지대에도 사용된다.
- 합금 재료: 납은 황동 및 청동 등 구리 합금에 첨가되어 가공성과 윤활 특성을 향상시킨다. 높은 납 농도의 구리 합금은 베어링에 사용된다.
- 차폐재: 납은 소리, 진동, 방사선을 흡수하는 능력이 뛰어나 차음재, 방사선 차폐재로 사용된다.
- 기타: 오르간 파이프, 납축전지, 고전압 전력 케이블 외피, 땜납, 오디 시험, 납 유리, 세라믹 유약, 페인트 등 다양한 분야에서 활용된다.
- 안티모니: 납 80~90%에 안티몬 10~20%, 용도에 따라 주석을 약간 섞은 금속을 말하며, 작은 접시, 우승컵, 트로피, 메달 등에 사용된다.[33]


하지만, 납중독의 위험성이 알려지면서, 수도관이나 땜납, 화장품 등에 사용되던 안료들은 현재는 다른 재료로 대체되고 있다.
9. 생물학적 영향
납은 생물학적으로 확인된 역할이 없으며, 안전한 노출 수준도 확인되지 않았다.[7] 2009년 캐나다-미국 공동 연구에서는 매우 낮은 수준의 납 노출도 부정적인 정신 건강 결과를 초래할 수 있다고 결론지었다. 성인의 체내에는 평균 120mg의 납이 존재하는데, 이는 아연(2500mg)과 철(4000mg)에 이어 세 번째로 높은 수치이다. 납 염은 체내에서 매우 효율적으로 흡수된다. 소량의 납(1%)은 뼈에 저장되고 나머지는 몇 주 안에 소변과 대변으로 배설되지만, 어린이의 경우 약 3분의 1만 배설된다. 지속적인 노출은 납의 생물농축을 유발할 수 있다.
납은 흡입하거나 섭취하면 인체의 거의 모든 기관과 시스템에 영향을 미치는 매우 유독한 중금속이다.[7] 공기 중 농도가 100m3일 경우, 생명 및 건강에 즉각적인 위험을 초래한다.[7] 섭취된 납의 대부분은 혈류로 흡수된다. 납 독성의 주요 원인은 효소의 정상적인 기능을 방해하는 경향 때문이다. 납은 많은 효소에서 발견되는 술프히드릴기에 결합하거나, 효소 반응에서 보조 인자 역할을 하는 다른 금속(칼슘, 철, 아연 등)을 모방하여 대체한다. 높은 수준의 칼슘과 철은 납 중독으로부터 어느 정도 보호하지만, 낮은 수준은 감수성을 증가시킨다.
납은 뇌와 신장에 심각한 손상을 입히고 궁극적으로 사망에 이르게 할 수 있다. 칼슘을 모방하여 혈액-뇌 장벽을 통과하며, 수초를 손상시키고, 뉴런의 수를 감소시키며, 신경전달 경로를 방해하고, 뉴런 성장을 감소시킨다.[7] 납은 포르포빌리노겐 합성효소와 페로켈라타제를 억제하여 헤모글로빈 합성을 방해하고, 소적혈구 빈혈을 유발한다.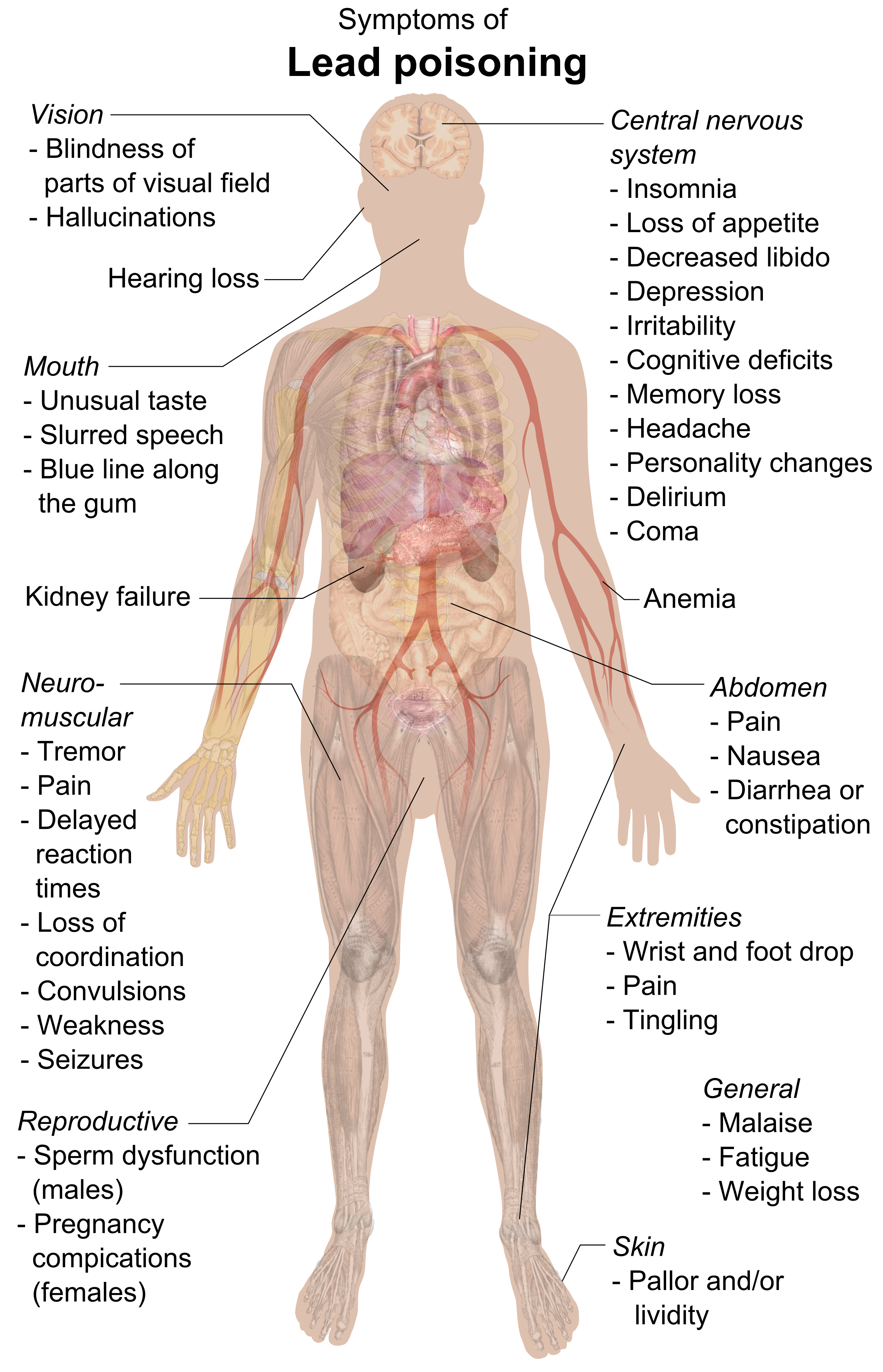
납 중독의 주요 증상, 노출 경로, 치료법 등은 납 중독 문서에서 더 자세히 다루고 있다.
납 중독과 관련된 역사적 기록은 다음과 같다.
- 납성통에 관한 최초의 기록: 고대 그리스의 히포크라테스[37]
- 고대 로마: 도자기 유약, 조리 기구, 배관 등에 납을 사용하여 사산, 기형, 뇌 손상 등 납 중독이 흔했다는 주장이 있지만, 현재는 속설로 간주된다.[37]
- 고대 로마 귀족: 납 잔으로 포도주를 마셔 납 중독자가 많았다고 알려져 있다.[37]
- 17세기: 포도주에 단맛을 내기 위해 납 아세트산염을 첨가하여 납 중독이 논의되기 시작했다.[38]
- 베토벤: 포도주를 즐겨 마셨으며, 머리카락에서 일반인의 100배에 가까운 납이 검출되어 납 중독이 청력 상실의 원인으로 유력하게 여겨진다.[39]
납 중독 문제 해결을 위한 대책은 다음과 같다.
- '''납땜''': 전기 회로 조립 등에 널리 사용되었으나, 최근에는 무연 납땜으로 대체되고 있다.
- '''유럽 연합(EU)''': RoHS 지령에 따라 2006년 7월 1일부터 고온 용융 납땜 등 예외를 제외하고 전기·전자 제품에 납 사용을 원칙적으로 금지했다.
- '''휘발유''': 옥탄가 향상 및 흡배기 밸브 보호를 위해 테트라에틸납이 첨가되었으나, 배기가스에 납이 포함되어 오염원으로 문제시되었다. 현재는 납을 포함하지 않는 첨가제가 사용되며, 선진국에서는 유연 휘발유 사용이 법적으로 규제된다. 하지만, 약 50개국에서 유연 휘발유 사용이 허용되고 있으며, 항공기 레시프로 엔진에도 유연 휘발유(Avgas)가 많이 사용된다.[40]
- '''도자기''': 유약에 납 유약이 널리 사용되었으나, 최근에는 납 등 중금속 용출 위험이 있는 저가품이 유통되기도 한다.
- '''사냥 및 클레이 사격''': 산탄에 납이 사용되어 환경 오염 및 조류 납 중독 문제가 발생하여, 철, 구리 산탄으로 전환이 진행되고 있다.
- '''권총 및 라이플 탄환''': 주로 경납이라는 납 합금으로 만들어져 사격장 등에서 납 오염 문제가 발생한다. 최근 폐탄 회수 및 사격장 개수 공사 등으로 대책이 마련되고 있지만, 저렴하고 고밀도인 납을 대체할 소재가 없어 규제나 대체 재료 전망이 오랫동안 불투명했다. 2012년부터 자위대는 89식 5.56mm 보통탄을 무연화했고, 미국 육군도 스틸 코어의 M855A1을 채용하는 등 무연화 움직임이 나타나고 있다.[41]
- '''수도관''': 납으로 만든 수도관은 2005년 기준 약 547만 세대에 남아있지만, 개인 소유인 인입관 교체 비용은 자비 부담이라 교체가 더디다.
- '''인쇄 활자''': 활자 합금의 주성분은 납이다. 고이시카와야나기초 납 중독 사건의 원인으로 인쇄 공장이 지목되기도 했다. 최근 인쇄 기술 혁신으로 활자 사용량이 감소하고 있다.
- '''액세서리''': 저렴한 주조 펜던트, 메달, 뱃지, 목걸이 등에 납을 포함하는 주석 합금(화이트 메탈)이 사용되기도 한다.[42] 금속 소품 베이스에 사용되는 황동에도 절삭성을 위해 납이 첨가된 것이 있다.[43] 최근 선진국에서는 규제가 강화되었지만, 저렴한 수입 완구에는 여전히 사용되어 어린이 건강 피해 가능성이 제기된다.
- '''산업 부산물 슬래그(광재)''': 납을 포함하는 경우가 있으며, 용출될 수 있다. 건재 시험 센터의 토목용 제강 슬래그 파쇄석 규격에는 용출량과 함유량을 규정한 환경 기준이 설정되어 있다.[44]
- '''농약 비산납''': 살충제로 널리 사용되었던 고전 농약이다. 일본에서는 1948년 농약으로 등록(등록 번호 1번)되었으나, 납 포함으로 안전성 문제가 제기되어 1956년 농약 잔류 허용량이 설정되고, 1968년 납 자체 잔류 기준도 설정되었다.[45],[46] 비산납 농약 등록은 1978년 실효되었지만, 21세기에도 10종 채소·과일에 대해 농약으로서 납 잔류 기준이 1.0 또는 5.0 ppm으로 설정되어 있다.
9. 1. 독성
납은 확인된 생물학적 역할이 없으며, 납 노출에 대한 안전한 수준 또한 확인되지 않았다.[7] 2009년 캐나다-미국 공동 연구에 따르면, 거의 위험이 없다고 여겨지는 수준에서조차도 납은 "부정적인 정신 건강 결과"를 초래할 수 있다고 한다. 성인의 경우 평균 120mg의 납이 체내에 존재하는데, 이는 중금속 중 아연(2500mg)과 철(4000mg)에 이어 세 번째로 높은 수치이다. 납 염은 체내에서 매우 효율적으로 흡수된다. 소량의 납(1%)은 뼈에 저장되고, 나머지는 노출 후 몇 주 이내에 소변과 대변으로 배설된다. 어린이의 경우 약 3분의 1만 배설된다. 지속적인 노출은 납의 생물농축을 초래할 수 있다.납은 흡입하거나 섭취할 경우 고도로 유독한 중금속으로, 인체의 거의 모든 기관과 시스템에 영향을 미친다. 공기 중 농도가 100m3일 경우, 생명 및 건강에 즉각적인 위험을 초래한다. 섭취된 납의 대부분은 혈류로 흡수된다. 납의 독성의 주요 원인은 효소의 정상적인 기능을 방해하는 경향 때문이다. 납은 많은 효소에서 발견되는 술프히드릴기에 결합하거나, 많은 효소 반응에서 보조 인자 역할을 하는 다른 금속을 모방하고 대체함으로써 이러한 작용을 한다. 납과 상호 작용하는 필수 금속에는 칼슘, 철 및 아연이 포함된다. 높은 수준의 칼슘과 철은 납 중독으로부터 어느 정도 보호하는 경향이 있지만, 낮은 수준은 감수성을 증가시킨다.
납은 뇌와 신장에 심각한 손상을 입히고 궁극적으로 사망에 이르게 할 수 있다. 납은 칼슘을 모방하여 혈액-뇌 장벽을 통과할 수 있다. 납은 수초를 손상시키고, 뉴런의 수를 감소시키며, 신경전달 경로를 방해하고, 뉴런의 성장을 감소시킨다. 인체에서 납은 포르포빌리노겐 합성효소와 페로켈라타제를 억제하여 포르포빌리노겐 형성과 프로토포르피린 IX에 철이 삽입되는 것을 방해하는데, 이는 헤모글로빈 합성의 마지막 단계이다. 이로 인해 비효율적인 헤모글로빈 합성과 소적혈구 빈혈이 발생한다.
납 중독 증상에는 신장병, 산통과 유사한 복통, 그리고 손가락, 손목 또는 발목의 쇠약이 포함될 수 있다. 특히 중년 및 노년층에서 혈압이 약간 상승할 수 있으며, 이는 빈혈을 유발할 수 있다. 임신부의 경우 고농도의 납 노출은 유산을 유발할 수 있다. 만성적이고 고농도의 노출은 남성의 생식능력을 감소시키는 것으로 나타났다.
어린이의 발달하는 뇌에서 납은 시냅스 형성을 방해하고, 대뇌 피질에서의 신경화학적 발달(신경전달물질 포함)과 이온 채널의 구성에 영향을 미친다. 유아기 노출은 후기 아동기에 수면 장애와 과도한 주간 졸음의 위험 증가와 관련이 있다. 고농도의 혈중 납 수치는 여자아이의 사춘기 지연과 관련이 있다. 20세기 동안 자동차 연료에 사용된 테트라에틸납 연소로 인한 공기 중 납 노출의 증감은 역사적으로 범죄율의 증가와 감소와 관련이 있다.
9. 2. 중독 증상
납은 흡입하거나 섭취할 경우 인체의 거의 모든 기관과 시스템에 영향을 미치는 고도로 유독한 중금속이다.[7] 납은 뇌와 신장에 심각한 손상을 입히고 궁극적으로 사망에 이르게 할 수 있다. 칼슘을 모방하여 혈액-뇌 장벽을 통과할 수 있으며, 수초를 손상시키고, 뉴런의 수를 감소시키며, 신경전달 경로를 방해하고, 뉴런의 성장을 감소시킨다.[7] 인체에서 납은 포르포빌리노겐 합성효소와 페로켈라타제를 억제하여 포르포빌리노겐 형성과 프로토포르피린 IX에 철이 삽입되는 것을 방해하는데, 이는 헤모글로빈 합성의 마지막 단계이다. 이로 인해 비효율적인 헤모글로빈 합성과 소적혈구 빈혈이 발생한다.[7]납 중독의 주요 증상은 다음과 같다.
어린이의 경우, 발달하는 뇌에 다음과 같은 영향을 미친다.
- 시냅스 형성 방해
- 대뇌 피질에서의 신경화학적 발달(신경전달물질 포함) 및 이온 채널 구성 방해
- 수면 장애 및 과도한 주간 졸음 (유아기 노출 시)
- 사춘기 지연 (여자아이의 경우, 고농도 혈중 납 수치)
9. 3. 노출 경로
납은 흡입, 섭취, 피부 흡수를 통해 체내로 들어올 수 있다. 흡입된 납은 거의 모두 체내에 흡수되며, 섭취 시 흡수율은 20~70%이고 어린이는 성인보다 흡수율이 높다.[7]납 중독은 주로 납으로 오염된 음식이나 물을 섭취하면서 발생하며, 오염된 토양, 먼지, 납 기반 페인트를 실수로 섭취하는 경우는 드물다.[7] 해산물은 인근 공업용수의 영향을 받는 경우 납을 포함할 수 있다.[7] 과일과 채소는 재배된 토양의 납 함량이 높으면 오염될 수 있으며, 토양은 파이프의 납, 납 페인트, 유연 휘발유의 잔류 배출물에서 나오는 미립자 축적으로 오염될 수 있다.[7]
수도관에 납을 사용하는 것은 연수(軟水) 또는 산성수가 있는 지역에서 문제가 된다.[7] 경수는 파이프 내면에 불용성 보호층을 형성하는 반면, 연수와 산성수는 납 파이프를 용해시킨다.[7] 용해된 이산화탄소가 물에 있으면 용해성 납 중탄산염을 형성할 수 있으며, 산소가 포함된 물은 수산화납(II)으로 납을 용해시킬 수 있다. 이러한 물을 장기간 마시면 용해된 납의 독성으로 인해 건강 문제가 발생할 수 있다.[7] 물이 경수(硬水)일수록 탄산수소칼슘과 황산염을 더 많이 함유하고 있으며, 파이프 내부가 탄산납 또는 황산납의 보호층으로 더 많이 코팅된다.[7]
납 기반 페인트 섭취는 어린이의 주요 노출 원인이다. 오래된 페인트칠된 창틀을 씹는 것이 직접적인 원인이다. 또한 표면의 납 페인트가 손상되면 벗겨지고 먼지로 분쇄된 후, 손과 입의 접촉이나 오염된 음식, 음료를 통해 체내로 들어간다. 특정 가정요법을 섭취하면 납 또는 그 화합물에 노출될 수 있다.[7]
흡연자와 납 관련 직종 근로자에게는 흡입이 두 번째 주요 노출 경로이다.[7] 담배 연기에는 다른 독성 물질 중에서 방사성 납-210이 포함되어 있다.[7] 유기 납 화합물을 취급하는 사람들에게는 피부 노출이 상당할 수 있다. 무기 납의 피부 흡수율은 더 낮다.[7]
식품에 납이 포함되는 경우는 토양의 납 함량이 높은 곳에서 재배된 식품, 공기 중 납이 작물을 오염시킨 경우, 동물이 사료를 통해 납을 섭취한 경우, 식품 저장이나 조리 과정에서 납이 유입된 경우 등이 있다.[7] 납 성분이 포함된 페인트나 건전지를 가축이 섭취하는 것 또한 노출 경로이며, 이는 이후 사람에게 영향을 미칠 수 있다.[7]
방글라데시에서는 울금에 납 화합물을 첨가하여 색깔을 더 노랗게 만들었는데, 이는 방글라데시의 높은 납 수치의 주요 원인 중 하나로 여겨진다.[7] 홍콩에서는 식품 내 납 허용 최대치가 고형물의 경우 1백만분의 6(ppm), 액체의 경우 1백만분의 1(ppm)이다.[7] 납이 포함된 먼지는 오염된 공장 근처에서 건조되는 카카오 콩에 달라붙을 수 있다.[7]
2024년 3월, 미국 식품의약국(FDA)은 아동의 납 중독 사례 500건이 보고된 후 납 오염으로 인해 6개 브랜드의 계피에 대한 자발적 리콜을 권고했다. FDA는 계피가 크롬산납으로 변질되었음을 확인했다.[7]
미국 질병통제예방센터(Centers for Disease Control and Prevention)에 따르면, 2024년 현재 플라스틱에서 납 사용은 금지되지 않았다. 납은 플라스틱을 부드럽게 하고 유연하게 만들어 원래 모양으로 돌아갈 수 있도록 한다. 플라스틱 장난감에 납이 사용될 수 있는데, 이는 열로부터 분자를 안정화시키기 위해서이다. 햇빛, 공기, 세제에 노출되면 플라스틱이 분해되어 납과 플라스틱 사이의 화학 결합이 끊어지면서 납 성분 먼지가 생성될 수 있다.[7]
9. 4. 치료
납 중독의 치료에는 일반적으로 디머카프롤과 숙시머를 투여한다.[7] 급성 환자의 경우에는 이칼슘 나트륨 에데테이트(EDTA 이칼슘 나트륨염)와 에틸렌디아민테트라아세트산(EDTA)의 이나트륨염을 사용할 수 있다. 이들은 칼슘보다 납에 대한 친화력이 더 커서 납 킬레이트 화합물을 형성하여 소변으로 배설시키고, 무해한 칼슘을 남긴다.[7]10. 환경 영향
납 노출은 전 세계적인 문제로, 납 채굴 및 제련, 배터리 제조, 폐기 및 재활용 과정에서 발생한다. 납은 흡입, 섭취, 피부 흡수를 통해 체내로 들어오며, 흡입된 납은 거의 모두 흡수된다. 섭취 시 흡수율은 20~70%이며, 어린이는 성인보다 흡수율이 높다.[7]
주로 납으로 오염된 음식이나 물을 섭취하여 중독이 발생하며, 오염된 토양, 먼지, 납 기반 페인트를 우연히 섭취하는 경우는 드물다.[8] 해산물은 인근 공업용수의 영향을 받을 수 있으며,[9] 과일과 채소는 토양의 납 함량이 높으면 오염될 수 있다. 토양은 파이프의 납, 납 페인트, 유연 휘발유 잔류 배출물에서 나오는 미립자 축적으로 오염될 수 있다.[10]
수도관에 납을 사용하는 것은 연수 또는 산성수가 있는 지역에서 문제가 된다.[11] 경수는 파이프 내면에 불용성 보호층을 형성하지만, 연수와 산성수는 납 파이프를 용해시킨다.[12] 물에 용해된 이산화탄소는 용해성 납 중탄산염을, 산소가 포함된 물은 수산화납(II)을 형성하여 납을 용해시킬 수 있다. 이러한 물을 장기간 마시면 건강 문제가 발생할 수 있다. 물이 경수일수록 탄산수소칼슘과 황산염을 더 많이 함유하여 파이프 내부가 탄산납 또는 황산납의 보호층으로 코팅된다.[13]
어린이의 주요 납 노출 원인은 납 기반 페인트 섭취이다. 오래된 페인트칠된 창틀을 씹거나, 손상된 표면의 납 페인트가 벗겨져 먼지로 분쇄된 후, 손과 입의 접촉이나 오염된 음식, 음료를 통해 체내로 들어간다. 특정 가정요법도 납 노출을 유발할 수 있다.[7]
흡연자와 납 관련 직종 근로자는 흡입을 통해 납에 노출될 수 있다.[14] 담배 연기에는 방사성 납-210이 포함되어 있다.[15] 미국에서는 규제 노력으로 2010년부터 2020년까지 공기 중 납 수치가 86% 감소했으며,[8] 2014년에는 국가 기준치 미만으로 떨어졌다.[9][10]
유기 납 화합물을 취급하는 사람들에게는 피부 노출이 상당할 수 있지만, 무기 납의 피부 흡수율은 낮다.[16]
식품에 납이 포함되는 경우는 토양의 납 함량이 높은 곳에서 재배된 식품, 공기 중 납이 작물을 오염시킨 경우, 동물이 사료를 통해 납을 섭취한 경우, 식품의 저장이나 조리 과정에서 납이 유입된 경우 등이다.[11] 가축이 납 성분이 포함된 페인트나 건전지를 섭취하는 것 또한 노출 경로이며, 이는 이후 사람에게 영향을 미칠 수 있다.[12] 오염된 소에서 생산된 우유는 납 농도를 낮추기 위해 희석하여 판매될 수 있다.[13]
방글라데시에서는 울금에 납 화합물을 첨가하여 색을 더 노랗게 만들기도 한다.[14] 이는 1980년대부터 시작되어 2019년 현재까지도 계속되고 있으며,[14] 방글라데시의 높은 납 수치의 주요 원인 중 하나로 여겨진다.[15] 홍콩에서는 식품 내 납 허용 최대치가 고형물의 경우 1백만분의 6(ppm), 액체의 경우 1백만분의 1(ppm)이다.[16]
납이 포함된 먼지는 오염된 공장 근처에서 건조되는 카카오 콩에 달라붙을 수 있다.[17] 2022년 12월, 컨슈머리포트는 28개의 다크초콜릿 브랜드를 검사하여 그중 23개가 유해 수준의 납, 카드뮴 또는 그 모두를 함유하고 있음을 밝혀냈다.[18]
2024년 3월, 미국 식품의약국(FDA)은 아동의 납 중독 사례 500건이 보고된 후 납 오염으로 인해 6개 브랜드의 계피에 대한 자발적 리콜을 권고했다.[19] FDA는 계피가 크롬산납으로 변질되었음을 확인했다.[21] 미국 질병통제예방센터(Centers for Disease Control and Prevention)에 따르면, 2024년 현재 플라스틱에서 납의 사용은 금지되지 않았다. 납은 플라스틱을 부드럽게 하고 유연하게 만들어 원래 모양으로 돌아갈 수 있도록 한다. 벗겨진 전선의 색깔 있는 플라스틱 절연체를 습관적으로 씹은 46세 남성에게서 납 수치가 상승한 것으로 나타났다.[22] 플라스틱 장난감에 납이 사용될 수 있는데, 이는 열로부터 분자를 안정화시키기 위해서이다. 햇빛, 공기 및 세제에 노출되면 플라스틱이 분해되어 납과 플라스틱 사이의 화학 결합이 끊어지면서 납 성분의 먼지가 생성될 수 있다.[23]
납과 납 제품의 채굴, 생산, 사용 및 폐기는 지구의 토양과 수질을 심각하게 오염시켰다. 대기 중 납 배출은 산업혁명과 20세기 후반의 무연 휘발유 시대에 최고조에 달했다.[24]
납 배출은 자연적 원인, 산업 생산, 소각 및 재활용, 이전에 매립된 납의 이동에서 비롯된다.[24] 개발도상국에서는 세계적 제조업에 사용되는 저렴한 납을 추출하기 위한 납 재활용 작업이 노출의 잘 알려진 원인이 되었다.[25] 산업화 이후 및 도시 지역의 토양과 퇴적물에는 높은 농도의 납이 남아 있다. 석탄 연소에서 발생하는 것을 포함한 산업 배출물[26]은 세계 여러 지역에서 계속되고 있다.[27]
납은 특히 유기물 함량이 높은 토양에 축적되어 수백 년에서 수천 년 동안 남아 있을 수 있다. 환경 납은 식물 표면에 존재하는 다른 금속과 경쟁하여 광합성을 억제할 수 있으며, 농도가 충분히 높으면 식물의 성장과 생존에 악영향을 미칠 수 있다. 토양과 식물의 오염은 납이 먹이 사슬을 타고 상승하여 미생물과 동물에 영향을 미칠 수 있다. 동물의 경우 납은 많은 기관에서 독성을 나타내며, 섭취, 흡입 또는 피부 흡수 후 신경계, 신장계, 생식계, 조혈계 및 심혈관계에 손상을 입힌다.[28] 어류는 물과 퇴적물 모두에서 납을 흡수하며,[29] 먹이 사슬에서의 생물 축적은 어류, 조류 및 해양 포유류에 위험을 초래한다.[30]
인위적 납에는 탄환과 추에서 나오는 납이 포함된다. 이것들은 납 생산 현장과 함께 가장 강력한 납 오염원 중 하나이다.[24] 미국에서는 2017년에 탄환과 추에 대한 납 사용이 금지되었지만,[31] 그 금지는 한 달 동안만 효력을 가졌으며,[32] 유럽 연합에서도 유사한 금지가 검토되고 있다.[33]
환경 내 납 측정을 위한 분석 방법에는 분광광도법, X선 형광 분석, 원자 분광법 및 전기화학적 방법이 포함된다. 이온 운반체 ''S'',''S'''-메틸렌비스(''N'',''N''-디이소부틸디티오카르바메이트)를 기반으로 특정 이온 선택성 전극이 개발되었다.[17] 납 중독에 대한 중요한 생체 지표 분석법은 혈장, 혈청 및 소변에서의 δ-아미노레불린산 수치이다.[18]
무기 납 화합물은 물에 잘 녹지 않아 급성중독을 일으키는 경우는 드물지만, 테트라에틸납과 같은 지용성 유기 물질은 세포막을 통과하여 직접 흡수되므로 매우 위험하다. 장기적으로 보면, 납은 자연 상태의 음식에도 미량 포함되어 있어 항상 섭취하고 있으며, 일정량은 소변 등으로 배설되므로 불필요하게 신경 쓸 필요는 없다고 여겨진다. 그러나 유기 납 화합물을 섭취하거나 배설량을 초과하는 납을 장기간 섭취하면 체내에 축적되어 독성을 나타낸다.
생물에 대한 독성으로는, 체표나 소화 기관에 노출(접촉·부착)되면 복통·구토·신근 마비·감각 이상증 등 다양한 중독 증상을 일으키며, 혈액에 작용하면 용혈성 빈혈·헤모글로빈 합성계 장애·면역계 억제·신장에 대한 영향 등을 일으킨다. 유전독성도 보고되고 있다. 주로 호흡기계로 흡입되거나, 수용성 납 화합물이 소화기계로 흡수되어 체내로 들어가 뼈에 가장 많이 축적된다. 생체에 흡수된 납의 생물학적 반감기는 자료에 따라 다르지만, 한 예로 생체 전체에서는 5년, 뼈에 주목하면 10년이라는 값이 제시되고 있다. 호흡기로의 흡입은 납을 취급하는 공장이나 납을 포함하는 페인트나 안료를 취급하는 작업 등에서 많으며, 직업병으로서의 측면이 있다.[34][35][36]
납 중독 문제 해결을 위한 대책은 다음과 같다.
- 납땜은 전기 회로 조립 등에 널리 사용되었지만, 최근에는 납을 포함하지 않는 무연 납땜으로 대체되고 있다.
- 유럽 연합(EU)에서는 RoHS 지령에 따라 2006년 7월 1일 이후 고온 용융 납땜 등의 예외를 제외하고 전기·전자 제품에 대한 납 사용이 원칙적으로 금지되었다. 이 때문에 일본 제조업체에서도 납을 포함하지 않는 부재의 사용을 원칙으로 하고 있지만, 대체 납땜의 강도 부족, 융점 상승 문제로 인한 전기 제품의 제조 불량(부품 중에는 열에 약한 것도 있어 융점이 상승한 만큼 납땜 시 더 고온에 노출되어 부품이 파손됨)이 문제가 되고 있다.
- 휘발유의 옥탄가 향상 및 흡배기 밸브와 주변 부품 보호를 위해 테트라에틸납이 첨가되었지만, 배기가스에 납이 포함되어 오염원이 되어 문제시되었다. 현재는 납을 포함하지 않는 첨가제에 의한 옥탄가 향상책이 선택되고 있으며, 일본 등 선진국에서는 법적 규제에 따라 유연 휘발유는 사용되지 않게 되었다. 하지만 일본자동차공업회[40]에 따르면, 약 50개국에서 유연 휘발유의 사용이 허용되고 있으며, 지금도 유연 휘발유 문제는 종결되지 않았다. 또한, 항공기의 레시프로 엔진에도 유연 휘발유(Avgas)가 많이 사용되고 있다.
- 도자기의 유약에는 근현대에도 납 유약이 널리 사용되어 왔다. 적절하게 소성된 것은 고화되어 불용체가 되지만, 최근의 중국산 등 저가품에는 납 등 중금속이 식품에 용출될 위험이 있는 것이 유통되는 경우가 있다.
- 납은 사냥이나 클레이 사격에 사용되는 산탄에도 사용되어 왔다. 환경 중에 납 입자를 흩뿌리는 것이며, 토양 오염을 일으키거나, 산탄을 맞았지만 도망치거나 발견되지 않아 회수되지 않은 것을 먹은 조류가 납 중독을 일으키는 등의 문제가 있었기에, 단점은 있지만 오염이 적은 철, 구리 산탄으로의 전환이 진행되고 있다.
- 권총이나 라이플의 탄환도 주로 경납이라고 불리는 납 합금으로 만들어져 있다. 사격장 등, 탄두부가 지면에 남기 쉬운 곳에 인접한 하천 등에서 고농도의 납 성분이 검출되는 경우가 많으며, 최근에는 폐탄의 회수나 사격장 개수 공사 등으로 주변에 납에 의한 피해가 발생하지 않도록 대책이 마련되고 있는 경우도 있지만, 군대나 법 집행 기관에도 방대한 수량이 배치되어 있는 이러한 탄환 자체에 대해서는, 납만큼 저렴하고 고밀도의 소재가 없으며, 더 가벼운 금속으로 대체하면 공기 저항의 영향을 강하게 받아 유효 사거리가 저하되기 때문에, 오랫동안 규제나 대체 재료의 전망이 서지 않았다. 2012년부터 자위대는 주력 소총탄인 89식 5.56mm 보통탄을 무연화했다. 이후 미국 육군도 스틸 코어의 M855A1을 채용하는 등, 무연화의 움직임이 보이기 시작했다.[41]
- 납으로 만든 수도관에 대해서는, 2005년 7월 시점의 후생노동성 조사에서 약 547만 세대에 남아 있지만, 본관에서 갈라진 인입관에 대해서는 수도 계량기를 제외하고 개인 소유로 되어 있기 때문에 교체 비용은 자비 부담이 되어 교체가 진행되지 않고 있다.
- 인쇄에 사용하는 활자의 재료(활자 합금)의 주성분은 납이다. 일본에서 유연 휘발유 규제의 계기가 된 고이시카와야나기초 납 중독 사건도 납 오염의 원인이 검사 장소로 지정된 인쇄 공장이었을 가능성이 지적되고 있다. 최근에는 인쇄 기술의 혁신에 따라 활자 자체의 사용량이 감소하고 있다.
- 저렴한 주조의 펜던트, 메달, 뱃지, 목걸이 등의 액세서리에는 저융점·저가격이라는 점에서 납을 포함하는 주석 합금(화이트 메탈이라고 통칭됨)이 사용되는 경우가 있다.[42] 또한, 금속 소품의 베이스에 사용되는 황동에는 절삭성을 좋게 하기 위해 납이 첨가된 것이 있다.[43] 최근 선진국에서는 납에 대한 규제가 강화되어 위와 같은 소재는 사용되는 경우가 적어졌지만, 저렴한 수입 완구에는 아직도 사용되는 경우가 있으며, 이것들을 어린이가 입에 넣는 것으로 건강 피해가 발생할 가능성이 지적되고 있다.
- 산업의 부산물인 슬래그(광재)에는 납을 포함하고 있는 것이 있으며, 슬래그에서 용출되는 경우가 있다. 따라서, 건재 시험 센터의 토목용 제강 슬래그 파쇄석의 규격에는 용출량과 함유량을 규정한 환경 기준이 설정되어 있다.[44]
- 납을 포함하는 농약, 비산납은 살충제로서 세계적으로 널리 사용된 고전적인 농약 중 하나이며, 일본에서도 1948년에 농약으로 등록(등록 번호 1번)되어 사용되어 왔다. 그러나 납을 포함하고 있다는 점에서 안전성에 의문이 제기되고 1956년에는 농약 잔류 허용량이 일본 국내에서 가장 빨리 설정된 것 외[45]에, 1968년에는 납 그 자체도 잔류 기준이 식품 4품목(사과, 포도, 오이, 토마토)에 대해 설정되었다.[46] 비산납 농약의 등록은 1978년에 실효되었지만, 21세기에도 10종의 채소·과일에 대해 농약으로서의 납의 잔류 기준이 1.0 또는 5.0 ppm으로 설정되어 있다.
11. 규제 및 정화
1980년대 중반까지 산업에서 납 사용이 크게 줄었다.[24] 미국에서는 환경 규제로 휘발유, 페인트, 땜납, 상수도 시스템 등 배터리 이외 제품의 납 사용이 줄거나 없어졌다. 석탄 화력 발전소에는 납 배출을 막기 위해 미립자 제어 장치가 설치되었다. 1992년 미국 의회는 환경보호청(EPA)에 전국 어린이의 혈중 납 수치를 줄이도록 요구했다. 유럽 연합의 2003년 위험물질 제한 지침(Restriction of Hazardous Substances Directive)에 따라 납 사용이 더욱 제한되었다. 네덜란드에서는 1993년 사냥 및 스포츠 사격용 납탄 사용 금지 이후 납 침착량이 크게 감소했다.
미국에서는 2012년 금속 납, 무기 납 화합물 및 납 비누를 포함한 작업장의 납 허용 노출 한계(permissible exposure limit)가 8시간 근무일에 50 μg/m3로, 혈중 납 수치(blood lead level) 한계는 혈액 100g당 5 μg로 설정되었다. 오래된 주택에는 여전히 납 페인트가 남아 있을 수 있다. 흰색 납 페인트는 산업화된 국가에서 판매 금지되었지만, 노란색 크롬산납(II)과 같은 다른 안료의 특수 용도는 특히 도로 포장 표시 페인트에서 여전히 남아 있다.[26] 낡은 페인트를 사포로 벗겨내면 먼지가 발생하여 흡입될 수 있다. 어린이가 사는 건물에서는 일부 당국이 납 제거(Lead abatement) 프로그램을 의무화하고 있다.
납 폐기물은 관할 구역과 폐기물의 성질에 따라 가정 쓰레기로 처리될 수도 있고(납 제거(Lead abatement) 활동을 용이하게 하기 위해), 또는 특수 처리 또는 보관이 필요한 잠재적 위험 폐기물로 간주될 수 있다. 사격장에서 납이 환경으로 방출되며, 납 오염을 방지하기 위해 여러 납 관리 방안이 개발되었다. 산성 토양에서는 납 이동이 증가할 수 있다. 이를 방지하기 위해 토양을 중화하고 납의 용출을 방지하기 위해 석회로 토양을 처리하는 것이 좋다.
생물학적 방법으로 생물 시스템에서 납을 제거하는 방법에 대한 연구가 진행되고 있다. 곰팡이 ''Aspergillus versicolor''는 수역에 방출되기 전에 산업 폐기물에서 납 이온을 효과적으로 흡수한다. 여러 박테리아가 환경에서 납을 제거하는 능력에 대해 연구되었는데, 여기에는 황산 환원 박테리아 ''Desulfovibrio''와 ''Desulfotomaculum''이 포함되며, 둘 다 수용액에서 매우 효과적이다. 기장 풀 ''Urochloa ramosa''는 납과 아연과 같은 금속을 줄기와 뿌리 조직에 상당량 축적할 수 있기 때문에 오염된 토양의 정화에 중요한 식물이다.[28]
12. 신비학
서양 점성술이나 연금술 등의 신비주의 철학에서는 토성을 상징하는데, 이는 (녹이 슬어) 검고 무거운 납이 육안으로 확인 가능한 행성 중에서 가장 어둡고 움직임이 느린 토성과 유사하다고 생각되었기 때문이다. 또한, 영혼의 감옥으로서의 육체, 노화, 둔함 등도 상징한다.
인도 연금술에서 가장 낮은 계층의 금속으로 여겨지는 납은 바수키의 정액으로 만들어졌다고 여겨지며, 나가(뱀)라고 불린다. 또한, 금이 사후에 환생한 것이 납이라고 여겨진다.
참조
[1]
서적
Selected Values of the Crystallographic Properties of Elements
ASM International
2018
[2]
웹사이트
When will we see unleaded AvGas?
https://www.flyingma[...]
2019-08-05
[3]
서적
De architectura
1914
[4]
웹사이트
Nontoxic Shot Regulations For Hunting Waterfowl and Coots in the U.S.
https://www.fws.gov/[...]
2022-04-19
[5]
웹사이트
Moving towards using more lead-free ammunition
https://www.canada.c[...]
2018-04-05
[6]
웹사이트
Regulation - 2021/57 - EN - EUR-Lex
https://eur-lex.euro[...]
[7]
웹사이트
Lead 695912
https://www.sigmaald[...]
[8]
웹사이트
Lead (Pb) Air Pollution
https://www.epa.gov/[...]
United States Environmental Protection Agency
2022-07-08
[9]
웹사이트
NAAQS Table
https://www.epa.gov/[...]
United States Environmental Protection Agency
2022-04-05
[10]
웹사이트
Lead Trends
https://www.epa.gov/[...]
United States Environmental Protection Agency
2022-06-01
[11]
서적
Inorganic Lead Exposure and Intoxications
https://books.google[...]
CRC Press
1994
[12]
학술지
Lead, zinc, and cadmium uptake, accumulation, and phytoremediation by plants growing around Tang-e Douzan lead–zinc mine, Iran
http://dx.doi.org/10[...]
2018-01-10
[13]
학술지
Soil Is an Important Pathway of Human Lead Exposure
1998-02-01
[14]
뉴스
Lead found in turmeric
https://news.stanfor[...]
2019-09-24
[15]
뉴스
Researchers find lead in turmeric
https://phys.org/new[...]
2019-09-24
[16]
웹사이트
Maximum Permitted Concentration of Certain Metals Present in Specified Foods
https://www.elegisla[...]
Hong Kong e-Legislation
[17]
웹사이트
Dark chocolate is high in cadmium and lead. How much is safe to eat?
https://www.wbur.org[...]
WBUR
2023-02-01
[18]
웹사이트
Consumer Reports urges dark chocolate makers to reduce lead, cadmium levels
https://www.yahoo.co[...]
2023-01-23
[19]
웹사이트
FDA Alert Concerning Certain Cinnamon Products Due to Presence of Elevated Levels of Lead
https://www.fda.gov/[...]
2024-03-06
[20]
뉴스
Lead-tainted cinnamon has been recalled. Here's what you should know
https://apnews.com/a[...]
2024-03-08
[21]
웹사이트
Investigation of Elevated Lead & Chromium Levels: Cinnamon Applesauce Pouches (November 2023)
https://www.fda.gov/[...]
2024-04-16
[22]
웹사이트
Lead Intoxication Associated with Chewing Plastic Wire Coating – Ohio
https://www.cdc.gov/[...]
[23]
웹사이트
About Lead in Consumer Products
https://www.cdc.gov/[...]
2024-04-16
[24]
웹사이트
Lead Poisoning: A Historical Perspective
https://www.epa.gov/[...]
[25]
웹사이트
Europe moves to ban lead in avgas
https://flyer.co.uk/[...]
2022-03-08
[26]
웹사이트
Lead Chromate: Why it is Banned in Most Industries Apart From Road Markings
https://www.roadtraf[...]
Verdict Media Limited
[27]
웹사이트
From 100LL to G100UL: What comes next for avgas and why today is historic
https://www.globalai[...]
2023-06-06
[28]
학술지
Assessment of metal accumulation capacity of Brachiaria ramosa collected from cement waste dumping area for the remediation of metal contaminated soil.
2013-11-01
[29]
서적
化学大辞典
共立出版
1993
[30]
서적
新版金属工学入門
アグネ技術センター
2001
[31]
서적
Taylor & McLennan
1985
[32]
서적
メイスン 一般地球化学
岩波書店
1970
[33]
웹사이트
アンチモニー産業の歴史と生産技術 - 外貨獲得に貢献した東京の地場産業 -
http://sokeizai.or.j[...]
一般財団法人素形材センター
[34]
서적
医学大辞典 第18版
南山堂
2004
[35]
웹사이트
化学物質安全性(ハザード)評価シート 酸化鉛
http://qsar.cerij.or[...]
[36]
웹사이트
環境保健クライテリア 165 無機鉛 (国立医薬品食品衛生研究所による日本語抄訳)
https://www.nihs.go.[...]
[37]
논문
Lead poisoning in a historical perspective
[38]
논문
Burton's line in lead poisoning
[39]
논문
Lead and the deafness of Ludwig van Beethoven
[40]
보도자료
世界主要自動車産業界による燃料品質に関する提言(WWFC)第3版
http://release.jama.[...]
社団法人 日本自動車工業会
2002-12-19
[41]
웹사이트
アメリカ海兵隊 陸軍のM855A1 5.56mm弾を2018年から導入
https://news.militar[...]
田村装備開発株式会社
2017-12-26
[42]
웹사이트
鉛含有金属製アクセサリー類等の安全対策に関する検討会報告書について
https://www.mhlw.go.[...]
厚生労働省
2007-02-16
[43]
웹사이트
有害物質問題への取組
https://www.daiomfg.[...]
株式会社大王製作所
[44]
웹사이트
-建材試験センター規格- JSTM H 8001(土工用製鋼スラグ砕石)の制定について
http://www.jtccm.or.[...]
建材試験センター
2008-11
[45]
웹사이트
ますます注目される食品中の鉛規制
http://www.mac.or.jp[...]
食品分析開発センター
2010-11
[46]
뉴스
残留農薬から食卓守る 四食品に許容量
朝日新聞
1968-03-21
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com




