SN2 반응
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
SN2 반응은 유기화학 반응의 한 종류로, 탄소 원자에 결합된 이탈기가 친핵체의 공격을 받아 치환되는 반응이다. 반응은 sp3 탄소에 전기음성도가 큰 이탈기가 결합된 경우에 잘 일어나며, 친핵체의 공격으로 5배위 전이상태를 거쳐 입체 배치가 반전되는 특징을 보인다. 반응 속도는 기질, 친핵체, 용매, 이탈기의 특성에 영향을 받으며, SN2 반응은 E2 반응과 경쟁 관계에 있다.
더 읽어볼만한 페이지
- 반응 메커니즘 - 양성자화
양성자화는 화학종이 양성자를 얻는 반응으로, 일반적으로 빠르고 가역적으로 진행되며, 효소 반응의 촉매 메커니즘에 관여한다. - 반응 메커니즘 - 탈양성자화
- 치환 반응 - 탈카복실화
탈카복실화는 유기화학 및 생화학에서 카복실산으로부터 이산화 탄소가 제거되는 반응으로, 유기화학에서는 수소 원자로 치환되며, 생화학에서는 아민 생합성 등 다양한 생체 반응에 관여한다. - 치환 반응 - 친전자성 방향족 치환
친전자성 방향족 치환은 방향족 고리의 수소 원자가 친전자체로 치환되는 유기 반응으로, 아레니움 이온 중간체를 거쳐 진행되며, 벤젠 고리의 치환기는 반응 속도와 치환 위치에 영향을 미쳐 다양한 화학 제품 생산에 활용된다. - 유기화학 - 유기 화합물
유기 화합물은 탄소를 포함하는 화합물로, 과거 생기론으로 여겨졌으나 뵐러의 요소 합성으로 폐기되었고, 이후 다양한 유기 화합물 합성 및 고분자 개발에 기여했지만 환경 친화적 접근이 과제로 남아 있으며, 구조, 용도 등으로 분류되고 천연물, 합성 화합물 등으로 연구된다. - 유기화학 - 유기물
유기물은 생물체 구성 성분으로서 생태계 내에서 영양분 순환, 토양의 물리화학적 성질 개선, pH 조절 등 중요한 역할을 수행하며, 탄소, 산소, 수소, 질소 등으로 구성된 유기 화합물의 혼합물이다.
2. 반응 메커니즘
이 반응은 지방족 화합물의 sp3 혼성 탄소에 전기 음성도가 큰 안정적인 이탈기 (X로 표기하며, 할로겐인 경우가 많음)가 결합되어 있을 때 주로 일어난다. SN2 반응에서는 친핵체 (Nu 또는 Y로 표기)가 탄소 원자를 공격하여 새로운 결합(C-Nu 또는 C-Y)을 형성하는 과정과 기존의 이탈기와의 결합(C-X)이 끊어지는 과정이 동시에 진행된다.[1]
친핵체는 이탈기가 붙어 있는 방향과 정확히 180° 반대쪽에서 탄소 원자를 공격한다. 이는 친핵체의 채워진 최고 점유 분자 궤도(HOMO)인 비공유 전자쌍 궤도와 탄소-이탈기 결합의 비어있는 최저 비점유 분자 궤도(LUMO)인 σ* 반결합 궤도 사이의 겹침을 최대로 하여 효과적인 화학 결합 형성을 가능하게 하기 때문이다.
이 과정에서 탄소 원자는 일시적으로 친핵체와 이탈기 모두와 약하게 결합된 5배위의 전이 상태를 거치게 된다. 이 전이 상태에서 탄소 원자는 평면 삼각형 구조에 가까운 sp2 혼성 궤도를 형성하며, 친핵체와 이탈기는 이 평면의 수직 방향으로 위치한다.
반응이 완결되면 이탈기는 전자를 가지고 떨어져 나가고, 친핵체는 탄소 원자와 완전한 결합을 형성한다. 이 결과 생성된 분자는 다시 사면체형 구조를 가지게 되지만, 친핵체가 이탈기의 반대편에서 공격했기 때문에 원래 분자의 입체 배치와 비교하여 점대칭 형태로 뒤집힌 구조를 갖는다.
만약 반응이 일어나는 탄소 원자가 카이랄 중심이라면, 이러한 구조적 뒤집힘은 생성물의 입체화학적 배치가 반응물과 반대가 되는 결과를 낳는다. 이를 발덴 반전이라고 한다. 예를 들어, (R)-형태의 카이랄 분자가 SN2 반응을 거치면 (S)-형태의 생성물이 얻어지거나, 그 반대의 경우가 된다.[3]
SN2 반응의 대표적인 예시로는 브로민화 이온(Br−, 친핵체)이 클로로에탄(CH3CH2Cl, 기질)과 반응하여 브로모에탄(CH3CH2Br)을 생성하고 염화 이온(Cl−)이 이탈하는 반응을 들 수 있다.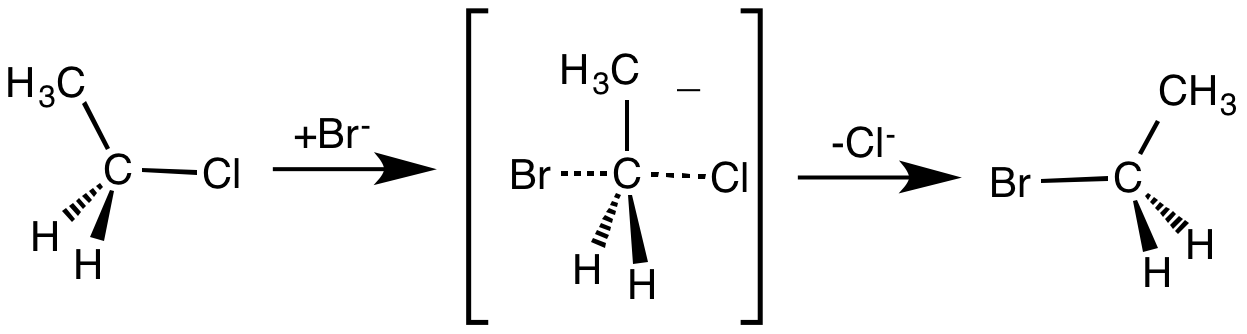
SN2 반응은 친핵체가 반응 중심 탄소의 뒤쪽으로 접근해야 하므로, 탄소 주변에 치환기가 많아 공간을 많이 차지하면(입체 장애가 크면) 반응이 일어나기 어렵다. 따라서 이 반응은 입체 장애가 가장 적은 메틸기나 1차 탄소에서 가장 빠르게 일어나며, 2차 탄소에서는 상대적으로 느리게 진행된다. 입체 장애가 매우 큰 3차 탄소에서는 SN2 반응이 거의 일어나지 않고, 대신 SN1 반응이 주로 일어난다. (이에 대한 자세한 내용은 #반응 속도 결정 요인 섹션 참고)
2. 1. 반응 속도 결정 요인
SN2 반응의 반응 속도를 결정하는 주요 요인은 크게 네 가지로 나눌 수 있다.[31][22] 이 요인들은 반응 속도에 미치는 영향력의 중요도 순서대로 기질의 구조, 친핵체의 성질, 이탈기의 능력, 그리고 용매의 종류이다.[4][5] 각 요인이 구체적으로 어떻게 반응 속도에 영향을 미치는지는 아래 하위 섹션에서 자세히 설명한다.2. 1. 1. 기질
기질은 SN2 반응 속도를 결정하는 데 가장 중요한 요인이다.[4][5] 이는 친핵체가 기질 분자의 뒤쪽에서 접근하여 이탈기와의 화학 결합을 끊고 동시에 새로운 결합을 형성하는 반응 메커니즘 때문이다. 따라서 SN2 반응 속도를 높이려면 친핵체가 공격하는 경로, 즉 반응 중심 탄소의 뒤쪽에 입체 장애가 적어야 한다. 입체적으로 방해하는 치환기가 적을수록 친핵체의 접근이 용이해져 반응이 빠르게 진행된다.일반적으로 기질의 차수에 따라 반응 속도가 크게 달라진다.
- 메틸 및 1차 기질: 반응 중심 탄소 주변의 입체 장애가 가장 적어 친핵체의 접근이 가장 쉽다. 따라서 SN2 반응이 가장 빠르게 일어난다.
- 2차 기질: 1차 기질보다 입체 장애가 커서 반응 속도가 상대적으로 느리다.
- 3차 기질: 반응 중심 탄소 주변에 3개의 치환기가 붙어 있어 입체 장애가 매우 크다. 이 때문에 친핵체가 뒤쪽에서 접근하는 것이 거의 불가능하여 SN2 반응은 거의 일어나지 않는다. 대신 SN1 반응이 주로 일어난다. 이는 이탈기가 먼저 떨어져 나가 탄소 양이온 중간체를 형성하는 경로가 더 유리하기 때문이다.

한편, 알릴 자리나 벤질 자리 할로젠화물처럼 반응 중심 탄소에 인접하여 파이 결합(C=C 또는 벤젠 고리) 시스템이 있는 기질은 SN1 반응과 SN2 반응 모두 유리할 수 있다.
- SN1 반응의 경우: 생성되는 알릴 또는 벤질 탄소 양이온이 공명을 통해 양전하를 비편재화하여 안정화되기 때문에 선호될 수 있다.
- SN2 반응의 경우: 반응 중심과 인접한 파이 시스템 사이의 공액이 전이 상태를 안정화시켜 반응 속도를 빠르게 할 수 있다. 즉, 친핵체가 접근하고 이탈기가 떠나는 과정에서 형성되는 전이 상태의 에너지를 낮춰 반응을 촉진한다.

또한, 기질에 전자 끌기 그룹이 있으면 SN1 반응의 중간체인 탄소 양이온을 불안정하게 만들어 SN2 반응을 선호하게 하는 경향이 있다. 반대로 전자 공여 그룹은 탄소 양이온을 안정화시켜 SN1 반응 경로를 더 선호하게 만든다.[1]
2. 1. 2. 친핵체
기질과 마찬가지로 친핵체의 세기도 여러 요인에 영향을 받는다. 주요 요인으로는 입체 장애, 전하, 전기음성도 등이 있다.[4][5]- 입체 장애: 친핵체 분자의 크기가 크거나 반응 중심 주변에 방해하는 원자단이 많을수록(즉, 입체 장애가 클수록) 기질에 접근하기 어려워 친핵성이 약해진다. 예를 들어, 메톡사이드 음이온(CH3O−)은 메틸기가 하나만 있어 입체 장애가 적으므로 강한 친핵체이다. 반면, ''tert''-뷰톡사이드 음이온((CH3)3CO−)은 중심 탄소에 메틸기가 3개나 결합되어 있어 입체 장애가 크기 때문에 약한 친핵체이다. 이 두 이온은 모두 강염기이지만, 입체 장애의 차이로 인해 친핵성에서 차이를 보인다.
- 전하 및 전기음성도: 일반적으로 친핵체는 음전하가 클수록, 전기음성도가 작을수록 강한 경향을 보인다. 예를 들어, OH−은 중성 분자인 물(H2O)보다 음전하를 가지고 있어 더 강한 친핵체이다. 또한, 극성 양성자성 용매(예: 물, 알코올)에서는 I−이 Br−보다 전기음성도가 작아 더 강한 친핵체로 작용한다. 이는 용매 분자가 친핵체를 둘러싸 안정화시키는 효과(용매화)가 크기가 작은 Br−보다 큰 I−에서 덜 효과적이기 때문이다.
- 용매 효과: 사용하는 용매의 종류도 친핵체의 세기에 영향을 미친다.
- 극성 양성자성 용매: 위에서 설명했듯이, 수소 결합이 가능한 용매에서는 크기가 크고 전기음성도가 작은 친핵체가 더 강하다 (예: I− > Br−).
- 비양성자성 극성 용매 (예: DMSO, 아세톤): 이 용매들은 수소 결합을 하지 않아 친핵체를 강하게 용매화하지 않는다. 따라서 이 환경에서는 친핵체의 세기가 염기의 세기와 비례하는 경향을 보인다. 주기율표의 같은 족에서는 위로 갈수록 전기음성도가 크고 염기성이 강해지므로 친핵성도 강해진다. 예를 들어, 비양성자성 극성 용매에서는 F− > Cl− > Br− > I− 순서로 친핵성이 강하며, 이는 염기성 세기 순서와 일치한다. 따라서 이 경우 I−는 Br−보다 약한 염기이므로 약한 친핵체가 된다.
결론적으로, 강한 친핵체나 음이온성 친핵체는 친핵성 치환 반응에서 SN2 메커니즘을 통해 반응하는 것을 선호한다.
2. 1. 3. 용매
용매는 친핵체 주위에 존재하며 탄소 원자에 대한 친핵체의 접근을 방해하거나 방해하지 않음으로써 SN2 반응의 속도에 영향을 미친다.[6]양성자성 용매는 친핵체와 수소 결합을 형성하여, 이탈기가 붙어 있는 탄소를 공격하는 것을 방해하기 때문에 SN2 반응에 불리하다.[4][5][7][8] 양성자성 용매 내에서는 용매와 친핵체 간의 강한 상호작용(용매화)으로 인해 친핵체의 반응성이 약해진다.[7][8]
반면, 테트라하이드로푸란(THF)과 같은 비양성자성 극성 용매는 친핵체와 약하게 상호작용하므로 친핵체의 반응성 감소가 적어 SN2 반응에 더 유리하다.[6][7][8] 유전율이 낮거나 입체 장애가 있는 쌍극자 말단을 가진 비양성자성 극성 용매는 SN2 반응을 선호한다.[6] 대표적인 예로는 다이메틸 설폭사이드(DMSO), 다이메틸폼아마이드(DMF), 아세톤 등이 있다.[4][5] 비양성자성 극성 용매에서는 친핵체의 세기가 그 염기로서의 세기와 비례하는 경향을 보인다.
2. 1. 4. 이탈기
SN2 반응 속도는 이탈기의 능력에 크게 영향을 받는다. 이탈기는 반응 과정에서 탄소 원자와의 결합을 끊고 공유 전자쌍을 가지고 떨어져 나가는 원자 또는 분자단을 의미한다. 이탈기의 능력을 결정하는 주요 요인은 다음과 같다.- 이탈기의 안정성: 이탈기가 음이온 형태로 떨어져 나갔을 때 얼마나 안정한지가 중요하다. 이탈기의 공액 염기가 안정할수록, 즉 약염기일수록 더 좋은 이탈기가 된다. 이는 이탈기의 짝산이 강산일수록 해당 이탈기가 더 안정하다는 의미와 같다. 이탈 능력은 해당 이탈기의 짝산의 p''K''a 값(p''K''aH)과 밀접한 관련이 있으며, p''K''aH 값이 낮을수록 (짝산이 강산일수록) 이탈하기 쉽다.
- 탄소-이탈기 결합 강도: 탄소 원자와 이탈기 사이의 결합이 약할수록 반응이 더 쉽게 일어난다.
이러한 요인에 따라 좋은 이탈기와 나쁜 이탈기를 구분할 수 있다.
좋은 이탈기
- 할로겐화물: Cl−, Br−, I−은 전기 음성도가 크고 음전하를 잘 안정화시켜 좋은 이탈기로 작용한다. 단, 플루오린화물(F−)은 탄소와의 결합이 매우 강해 좋은 이탈기가 아니다.
- 술폰산염: 알코올의 수산기(-OH) 자체는 좋지 않은 이탈기이지만, 토실레이트(-OTs), 트리플레이트(-OTf), 메실레이트(-OMs)와 같은 술폰산염 에스터 형태로 만들면 매우 좋은 이탈기가 된다. 이들은 공명 구조를 통해 음전하를 효과적으로 분산시켜 안정화할 수 있다.
- 중성 분자: 물(H2O), 알코올(ROH), 아민(RNH2) 등은 이탈기로 떨어져 나갈 때 양전하를 띠게 되어 비교적 안정해질 수 있으므로 좋은 이탈기가 될 수 있다.
나쁜 이탈기
- 수산화물 이온(HO−), 알콕사이드 이온(RO−), 아미드 이온(R2N−) 등은 매우 강한 염기이므로 안정성이 낮아 좋은 이탈기가 아니다.
핀켈슈타인 반응과 같이 특정 조건에서는 이탈기가 친핵체로 작용하기도 한다. 이 반응에서는 할로겐화물 이온이 이탈기인 동시에 친핵체로 작용하여 다른 할로겐 원자를 치환한다.
2. 2. 반응 속도론
SN2 반응은 2차 반응이며, 속도 결정 단계의 반응 속도 ''r''은 친핵체의 농도 [Nu−]와 기질의 농도 [RX]에 모두 의존한다.[1]''r'' = k[RX][Nu−]
여기서 ''k''는 반응 속도 상수이다.
이는 SN1 반응과 SN2 반응의 중요한 차이점이다. SN1 반응에서는 속도 결정 단계에서 탄소 양이온 중간체가 생성된 후, 친핵체가 공격하므로 반응 속도는 기질 [RX]의 농도에만 의존한다. 반면, SN2 반응에서는 친핵체가 기질의 탄소 원자를 공격함과 동시에 이탈기가 떨어져 나가는 단일 단계가 속도 결정 단계이므로, 반응 속도는 기질 [RX]와 친핵체 [Nu−] 양쪽의 농도에 모두 영향을 받는다.[2]
어떤 반응 메커니즘이 우세할지는 반응 조건에 따라 달라진다. 예를 들어, 반응하는 탄소 원자가 2차 탄소일 경우, SN1과 SN2 반응이 경쟁적으로 일어날 수 있으며, 이때 실제 반응 경로는 용매, 온도, 친핵체의 농도 및 종류, 이탈기의 성질 등에 의해 결정된다.
일반적으로 SN2 반응은 1차 할로젠화 알킬에서 잘 일어나며, 2차 할로젠화 알킬의 경우 비양성자성 용매 조건에서 일어나기 쉽다. 3차 할로젠화 알킬은 중심 탄소 주변의 입체 장애가 크기 때문에 SN2 반응이 거의 일어나지 않는다.[9]
또한, α-할로케톤은 일반적인 할로젠화 알킬보다 SN2 반응 속도가 더 빠르다.[32] 이는 인접한 아실기가 반응을 촉진하기 때문이다.[33]
2차 기질의 반응 메커니즘을 판단할 때는 몇 가지 복잡한 요인이 고려될 수 있다. 예를 들어, 용매 자체가 친핵체로 작용하는 용매 분해 반응의 경우, 용매의 농도는 반응 동안 거의 일정하게 유지되므로 전체 반응은 2차 반응이지만 속도론적으로는 1차 반응처럼 보일 수 있다 (유사 1차 반응). 또한, 이탈기가 좋은 친핵체(예: 브로민화 이온 Br−)일 경우, 이탈기가 다시 기질을 공격하는 SN2 반응이 일어나 라세미화를 유발할 수 있으며, 이는 SN1 반응의 결과와 유사하게 보일 수 있다.[10] 이러한 복잡성 때문에 과거에는 2차 기질의 반응 메커니즘 해석에 혼란이 있었으나[14][3], 2-아다만틸 시스템 연구,[11] 아자이드화 이온(azide) 사용,[12][13] 설폰산염 이탈기 개발 등 여러 연구를 통해 현재는 특별한 경우를 제외하고 2차 기질은 주로 SN2 메커니즘을 따른다고 본다.
3. E2 반응과의 경쟁
SN2 반응과 흔히 경쟁하는 부반응으로 E2 반응이 있다. 이 반응은 공격하는 음이온이 친핵체로 작용하는 대신 염기로 작용하여 기질 분자에서 양성자를 제거하고 이중 결합을 형성하여 알켄을 만드는 경로이다.
E2 반응은 다음과 같은 조건에서 SN2 반응보다 우세하게 일어난다.
- 입체 장애: 친핵체(염기)나 기질의 반응 중심 탄소 주변에 입체 장애가 클수록, 즉 주변에 부피가 큰 작용기들이 많아 친핵체가 접근하기 어려울수록 SN2 반응이 방해받아 E2 반응이 선호된다.
- 염기의 세기: 강한 염기를 사용하면 기질에서 양성자를 더 쉽게 제거할 수 있으므로 E2 반응이 촉진된다.
- 온도: 일반적으로 온도가 높을수록 엔트로피 증가 효과로 인해 분자 수가 증가하는 제거 반응(E2)이 치환 반응(SN2)보다 유리해진다.[15]
예를 들어, 브로모에탄(에틸 브로마이드)과 같은 1차 할로젠화 알킬은 입체 장애가 작아 주로 SN2 반응을 통해 치환 생성물을 만든다. 그러나 친전자체인 탄소 주변의 입체 장애가 더 큰 이소부틸 브로마이드의 경우, SN2 반응이 어려워져 E2 반응이 우세하게 일어나 제거 생성물이 주로 만들어진다. 염기의 세기 또한 중요한데, 상대적으로 약한 염기인 벤조산 염(벤조에이트)과 2-브로모프로판(이소프로필 브로마이드)을 반응시키면, SN2 반응이 약 55%를 차지하며 E2 반응과 경쟁한다.
이러한 반응 경향성은 질량 분석기를 이용한 기체 상태 반응에서도 관찰될 수 있으며[16][17], 일반적으로 용매 효과가 없는 기체 상태 반응과 용액 상태 반응에서 유사한 경향성을 보인다.

4. 라운드어바웃 메커니즘
2008년, 염화 이온과 아이오딘화 메틸 사이의 기체 상태 반응에서 SN2 반응의 특이한 경로인 '''라운드어바웃 메커니즘'''(roundabout mechanism영어)이 관찰되었다.[18][19][20][28][29][30] 이 현상은 '교차 분자선법'(crossed molecular beam imaging영어)이라는 특수한 실험 기법을 통해 확인되었다.[18][19][20]
이 메커니즘은 충분히 높은 운동 에너지를 가진 염화 이온이 아이오딘화 메틸 분자에 충돌할 때 나타난다. 염화 이온과의 충돌 후, 아이오딘화 메틸 분자는 염소 원자와 아이오딘 원자가 치환되는 일반적인 SN2 반응이 일어나기 전에, 메틸기를 중심으로 한 바퀴 회전하는 과정을 거친다.[18][19][20] 이 회전 과정에서 에너지가 소모되기 때문에, 반응 결과 생성되는 아이오딘화물 이온의 운동 에너지는 이론적인 예측값보다 낮게 측정된다. 이러한 에너지 차이가 라운드어바웃 메커니즘의 존재를 시사하는 중요한 실험적 증거가 되었다.[28][29][30]
참조
[1]
서적
Organic chemistry
Oxford University Press
2012
[2]
학술지
Synthesis of the Bioherbicidal Fungus Metabolite Macrocidin A
https://doi.org/10.1[...]
2016-11-28
[3]
서적
Edexcel international a level chemistry student book.
https://www.worldcat[...]
EDEXCEL Limited
2019
[4]
논문
Advanced Organic Chemistry: Reactions, Mechanisms, and Structure
https://books.google[...]
Wiley-Interscience
2007
[5]
학술지
Nucleophilic Substitution (SN2): Dependence on Nucleophile, Leaving Group, Central Atom, Substituents, and Solvent
2018
[6]
학술지
Nucleophilic Substitution in Solution: Activation Strain Analysis of Weak and Strong Solvent Effects
2018
[7]
학술지
How Solvation Influences the S N 2 versus E2 Competition
2022-02-04
[8]
학술지
A Unified Framework for Understanding Nucleophilicity and Protophilicity in the S N 2/E2 Competition
2020-12
[9]
학술지
Absence of SN1 Involvement in the Solvolysis of Secondary Alkyl Compounds
2009
[10]
학술지
Relation of Steric orientation to Mechanism in Substitution Involving Halogen Atoms and Simple or Substituted Hydroxyl Groups
[11]
학술지
The 2-Adamantyl System, a Standard for Limiting Solvolysis in a Secondary Substrate
1970
[12]
학술지
A Clarification of the Mechanism of Solvolysis of 2-Octyl Sulfonates. Stereochemical Considerations
1965
[13]
학술지
A Clarification of the Mechanism of Solvolysis of 2-Octyl Sulfonates. Kinetic Considerations
1965
[14]
학술지
Homogeneous Hydrolysis and Alcoholysis of β-n-Octyl halides
1937
[15]
웹사이트
Elimination Reactions Are Favored By Heat — Master Organic Chemistry
http://www.masterorg[...]
2018-04-13
[16]
학술지
Gas Phase Studies of the Competition between Substitution and Elimination Reactions
2003
[17]
문서
[18]
학술지
Imaging Nucleophilic Substitution Dynamics
2008
[19]
학술지
PERSPECTIVES CHEMISTRY: Not So Simple
2008-01-11
[20]
뉴스
Surprise From SN2 Snapshots Ion velocity measurements unveil additional unforeseen mechanism
https://pubsapp.acs.[...]
2008-01-14
[21]
문서
[22]
논문
Advanced Organic Chemistry: Reactions, Mechanisms, and Structure
http://books.google.[...]
Wiley-Interscience
[23]
학술지
フェナシルクロリドとアルコキシドイオンとの反応における生成物比への置換基効果
[24]
학술지
シルクロロメタン類のSN2反応の経路に関する実験的研究
[25]
웹사이트
Elimination Reactions Are Favored By Heat
http://www.masterorg[...]
Master Organic Chemistry
2017-02-21
[26]
학술지
Gas Phase Studies of the Competition between Substitution and Elimination Reactions
[27]
문서
[28]
학술지
Imaging Nucleophilic Substitution Dynamics
[29]
학술지
PERSPECTIVES CHEMISTRY: Not So Simple
[30]
학술지
Surprise From SN2 Snapshots Ion velocity measurements unveil additional unforeseen mechanism
https://pubs.acs.org[...]
2008-01-14
[31]
서적
March's advanced organic chemistry : reactions, mechanisms, and structure.
https://www.worldcat[...]
[32]
학술지
フェナシルクロリドとアルコキシドイオンとの反応における生成物比への置換基効果
https://www.jstage.j[...]
[33]
학술지
アシル化合物のSN2反応の機構に関する実験的研究
https://www.jstage.j[...]
[34]
학술지
Gas Phase Studies of the Competition between Substitution and Elimination Reactions
https://pubs.acs.org[...]
[35]
학술지
Photochemical nucleophile–olefin combination, aromatic substitution (photo-NOCAS) reaction, Part 15. Investigations involving fluoride anion as the nucleophile and the effect of fluorine substitution on the relative stability of the reaction intermediates
http://dx.doi.org/10[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com



