역전사효소 억제제
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
역전사 효소 억제제는 HIV가 세포를 감염시키는 과정에서 바이러스 DNA 합성을 억제하여 HIV 증식을 막는 약물이다. 역전사 효소 억제제는 뉴클레오사이드/뉴클레오타이드 유사 역전사 효소 억제제(NRTIs/NtRTIs), 비뉴클레오사이드 역전사 효소 억제제(NNRTIs) 등으로 분류되며, 바이러스의 작용 기전을 방해하여 항바이러스 효과를 나타낸다. NRTIs/NtRTIs는 바이러스 DNA에 통합되어 사슬 종결자 역할을 하며, NNRTI는 역전사 효소에 직접 결합하여 효소의 작용을 막는다. HIV는 약물에 대한 내성을 획득할 수 있으며, 이는 역전사 효소의 변이, 약물 결합 방해, 또는 약물 절제 등의 기전을 통해 발생한다.
더 읽어볼만한 페이지
- 항레트로바이러스제 - 마라비록
마라비록은 CCR5-트로픽 HIV-1 감염 치료에 사용되는 진입 억제제 계열의 항레트로바이러스 약물로, CCR5 수용체 결합을 통해 HIV의 세포 진입을 막고 CYP3A에 의해 대사되며, 심각한 간 질환 등의 부작용이 있을 수 있고, 백혈병 환자의 이식편대숙주병 감소 효과에 대한 연구가 진행 중이며, 화이자에 의해 개발되어 2007년 미국 FDA와 유럽 연합에서 승인받았다. - 항레트로바이러스제 - 잘시타빈
잘시타빈은 제롬 호르비츠가 합성한 피리미딘 유사체 항레트로바이러스제로, HIV 치료제로 FDA 승인을 받았으나, 뉴클레오시드 유사체 역전사효소 저해제 병용 요법의 등장으로 2006년 판매 및 유통이 중단되었다.
2. 작용 기전
HIV가 세포를 감염시킬 때 역전사 효소는 바이러스 단일 가닥 RNA 게놈을 이중 가닥 바이러스 DNA로 합성한다. 그런 다음 바이러스 DNA는 숙주 염색체 DNA에 통합되어 전사 및 번역과 같은 숙주 세포 과정을 통해 바이러스를 복제할 수 있다. 역전사 효소 억제제(RTIs)는 역전사 효소의 효소 기능을 차단하고 이중 가닥 바이러스 DNA 합성을 방지하여 HIV 증식을 막는다.
다른 종류의 바이러스에서도 유사한 과정이 발생한다. 예를 들어 B형 간염 바이러스(HBV)는 DNA 형태의 유전 물질을 운반하고 복제를 위해 RNA 의존성 DNA 중합 효소를 사용한다. RTIs로 사용되는 일부 화합물은 HBV 복제를 차단할 수도 있는데, 이러한 경우 중합 효소 억제제라고 한다.
2. 1. 뉴클레오사이드/뉴클레오타이드 유사 역전사 효소 억제제 (NRTIs/NtRTIs)
HIV가 세포에 감염되면 역전사 효소는 바이러스의 단일 가닥 RNA 유전체를 이중 가닥 바이러스 DNA로 복사한다. 바이러스 DNA는 숙주 염색체 DNA에 통합된 다음 전사 및 번역과 같은 숙주 세포 과정을 통해 바이러스를 재현할 수 있게 된다. 역전사 효소 억제제는 역전사 효소의 효소 기능을 차단하고 이중 가닥 바이러스 DNA의 합성을 완료하는 것을 방지하여 HIV가 증식하는 것을 막는다.[24]뉴클레오사이드 유사 역전사 효소 억제제(NARTIs 또는 NRTIs)와 뉴클레오티드 유사 역전사 효소 억제제(NtARTIs 또는 NtRTIs)의 항바이러스 효과는 본질적으로 동일하다. 이들은 바이러스 DNA를 합성하는 데 필요한 천연 데옥시뉴클레오티드 유사체이며, 성장 중인 바이러스 DNA 사슬에 통합되기 위해 천연 데옥시뉴클레오티드와 경쟁한다. 그러나 천연 데옥시뉴클레오티드 기질과는 달리, NRTIs 및 NtRTIs에는 데옥시리보스 부분에 3'-히드록실기가 없다. 결과적으로 NRTIs 또는 NtRTIs 섭취 후, 다음 데옥시뉴클레오티드는 DNA 사슬을 연장하기 위해 필요한 다음 5'-3' 포스포디에스터 결합을 형성할 수 없다. 따라서 NRTIs 또는 NtRTIs가 결합되면 바이러스 DNA 합성이 중단된다. 이는 연쇄 종결(chain termination)로 알려진 과정이다. 모든 NRTIs 및 NtRTIs는 경쟁적 기질 억제제로 분류된다. NRTIs/NtRTIs는 바이러스뿐만 아니라 숙주 DNA 합성의 기질로도 경쟁하며, 두 연쇄 종결제로서 작용한다. 전자는 NRTIs/NtRTIs의 항바이러스 효과를 설명하고, 후자는 약물 독성/부작용을 설명하는 기전이다.[24]
2. 2. 비뉴클레오사이드 역전사 효소 억제제 (NNRTIs)
비뉴클레오사이드계 역전사 효소 억제제(NNRTIs)는 역전사 효소에 직접 결합하여 그 기능을 차단한다. NNRTIs는 뉴클레오사이드 유사 역전사 효소 억제제(NRTIs)나 뉴클레오타이드 유사 역전사 효소 억제제(NtRTIs)와는 달리 바이러스 DNA에 통합되지 않는다.[24] 대신, DNA 합성에 필요한 역전사 효소 단백질 도메인의 움직임을 억제한다. 이러한 작동 방식 때문에 NNRTIs는 역전사 효소의 비경쟁적 억제제로 분류된다.3. 종류
역전사 효소 억제제(RTIs)는 크게 네 가지 종류로 나뉜다.[24]
- 뉴클레오사이드 유사 역전사 효소 억제제 (NARTIs 또는 NRTIs)
- 뉴클레오타이드 유사 역전사 효소 억제제 (NtARTIs 또는 NtRTIs)
- 비뉴클레오사이드 역전사 효소 억제제 (NNRTIs)
- 뉴클레오사이드 역전사 효소 전좌 억제제 (NRTTIs)
NRTIs와 NtRTIs는 항바이러스 효과가 기본적으로 같다. 이들은 바이러스 DNA 합성에 필요한 천연 데옥시뉴클레오티드와 유사하게 생겼으며, 바이러스 DNA 사슬에 끼어들어가기 위해 천연 데옥시뉴클레오티드와 경쟁한다. 그러나 NRTIs와 NtRTIs는 천연 데옥시뉴클레오티드와 달리 디옥시리보스에 3'-하이드록실기가 없어서, DNA 사슬을 늘리는 데 필요한 5'-3' 포스포디에스터 결합을 만들 수 없다. 그래서 NRTIs나 NtRTIs가 결합하면 바이러스 DNA 합성이 멈추게 된다. 이를 사슬 종결(chain termination)이라고 한다. NRTIs와 NtRTIs는 모두 경쟁적 기질 억제제로 작동한다.
하지만 NRTIs/NtRTIs는 바이러스뿐만 아니라 숙주의 DNA 합성에도 경쟁적으로 작용하여, 둘 모두에게 사슬 종결을 일으킨다. 이것이 NRTIs/NtRTIs의 항바이러스 효과와 약물 독성/부작용을 설명하는 원리이다.
반면, NNRTIs는 완전히 다른 방식으로 작동한다. NNRTIs는 역전사 효소에 직접 결합하여 효소를 억제한다. NNRTIs는 NRTIs처럼 바이러스 DNA에 끼어들어가는 것이 아니라, DNA 합성에 필요한 역전사 효소의 단백질 도메인이 움직이는 것을 막는다. 따라서 NNRTIs는 역전사 효소의 비경쟁적 억제제로 분류된다.[24]
3. 1. 뉴클레오사이드 유사 역전사 효소 억제제 (NRTIs)
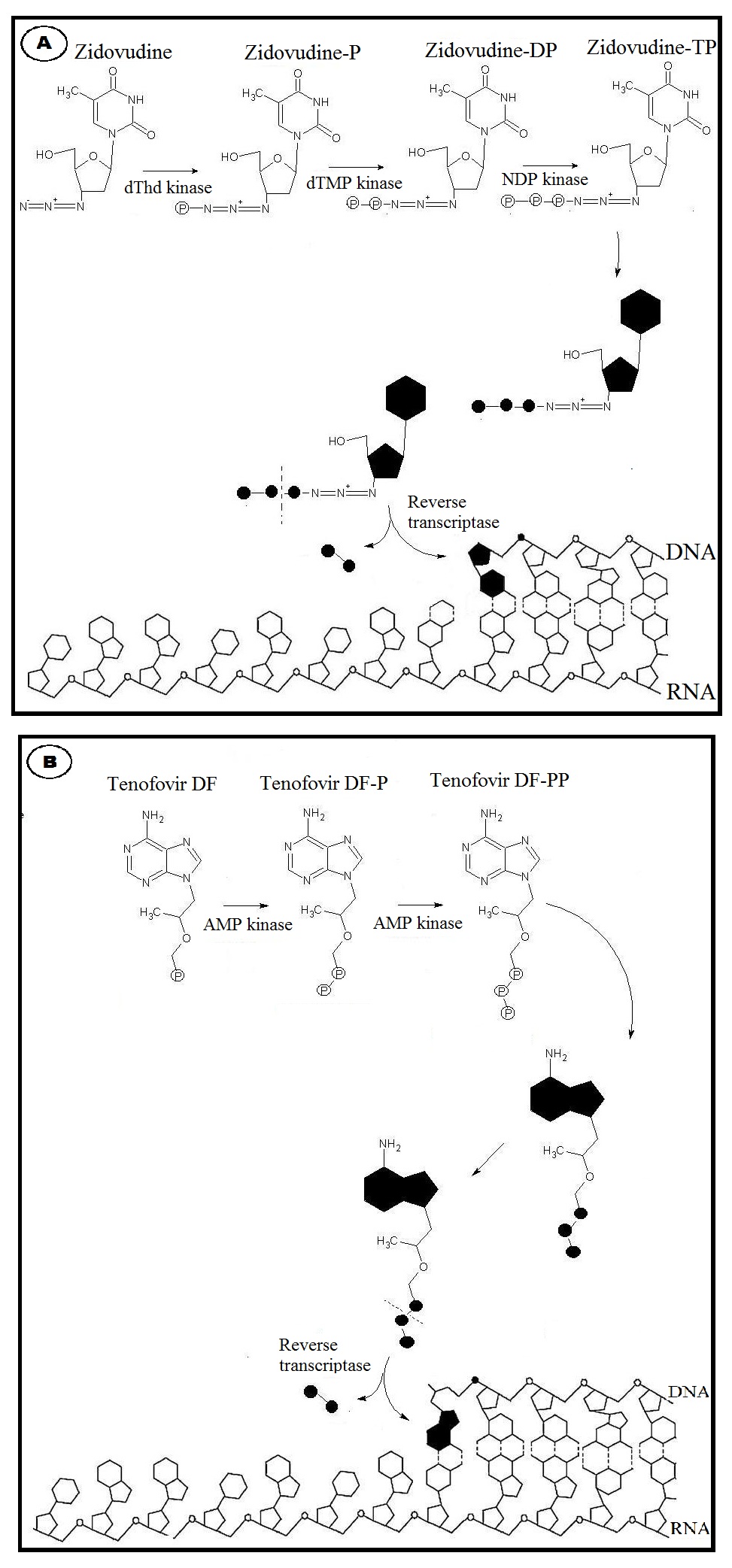
뉴클레오사이드 유사 역전사 효소 억제제(NRTIs)는 최초로 개발된 항레트로바이러스 약물이다. NRTIs는 디옥시리보스에 3개의 인산기를 첨가하여 NRTI 3인산을 형성해야 세포에서 활성화되어 바이러스 DNA에 통합될 수 있다. 이 인산화 단계는 세포 인산화효소에 의해 수행된다.[44]
NRTIs와 뉴클레오타이드 유사 역전사 효소 억제제(NtRTIs)는 항바이러스 효과가 본질적으로 동일하다. 이들은 바이러스 DNA 합성에 필요한 디옥시뉴클레오티드의 유사체이며, 성장하는 바이러스 DNA 사슬에 통합되기 위해 자연 디옥시뉴클레오티드와 경쟁한다. 그러나 자연 디옥시뉴클레오타이드와 달리 NRTIs와 NtRTIs는 디옥시 리보스에 3'-OH기가 없다. 따라서 NRTIs 또는 NtRTIs가 결합하면, DNA 사슬을 연장하는데 필요한 5'-3 인산 이에스테르 결합을 형성 할 수 없어 바이러스 DNA 합성이 중단된다. (사슬 종결) 모든 NRTIs 및 NtRTIs는 경쟁 기질 억제제로 분류된다.
NRTIs/NtRTIs는 바이러스뿐만 아니라 숙주 DNA 합성에도 경쟁하며, 둘 다(바이러스, 숙주)에 대한 사슬 종결자 역할을 한다. 바이러스에게는 NRTIs/NtRTIs가 항바이러스 효과를 나타내고, 숙주에게는 약물 독성/부작용을 나타낸다. NRTI는 증상이 있는 젖산 산증을 포함하여 많은 부작용을 일으키는 미토콘드리아 장애를 유발할 수 있다.[2]
3. 2. 뉴클레오타이드 유사 역전사 효소 억제제 (NtRTIs)
뉴클레오사이드 유사 역전사효소 억제제(NRTI)와 뉴클레오타이드 유사 역전사효소 억제제(NtRTI)는 항바이러스 효과가 본질적으로 동일하다. 이들은 바이러스 DNA 합성에 필요한 디옥시뉴클레오티드의 유사체이며, 성장하는 바이러스 DNA 사슬에 통합되기 위해 자연 디옥시뉴클레오티드와 경쟁한다. 그러나 자연 디옥시뉴클레오타이드 기질과 달리 NRTI 및 NtRTI는 디옥시 리보스에 3'-OH기가 없어, NRTI 또는 NtRTI가 결합하면 바이러스 DNA 합성이 중단된다. (사슬 종결) 모든 NRTI 및 NtRTI는 경쟁 기질 억제제로 분류된다.[24]숙주 세포는 인산화를 통해 뉴클레오시드 유사체를 뉴클레오타이드 유사체로 변환한다. 뉴클레오타이드 유사 역전사효소 억제제 (NtARTI 또는 NtRTI)를 복용하면 초기 인산화 단계를 직접적으로 제거할 수 있지만, 숙주 효소는 항바이러스 활성을 위해 뉴클레오타이드 이인산 유사체를 인산화해야 한다. 이 분자들은 체코 과학 아카데미의 안토닌 홀리에 의해 처음 합성되었고 길리어드에 의해 상업화되었다.[24]
3. 3. 비뉴클레오사이드 역전사 효소 억제제 (NNRTIs)
NNRTIs는 효소에 직접 결합하여 역전사 효소를 차단한다. NNRTIs는 DNA 합성을 수행하는 데 필요한 역전사 효소의 단백질 도메인 이동을 억제한다. 따라서 NNRTIs는 역전사 효소의 비경쟁적 억제로 분류된다.[24]NNRTIs는 세 번째로 개발된 항레트로바이러스제 종류이다. 이 종류의 약물은 벨기에의 레가 의학 연구소에서 처음 기술되었다.
3. 4. 뉴클레오사이드 역전사 효소 전좌 억제제 (NRTTIs)
이슬라트라비르(MK-8591)는 새로운 종류의 항바이러스제이다. 머크에서 개발하였으며, HIV-1에 대항하여 ART로 시험되고 있는 구강, 장기 작용 항바이러스제이다.[5] 이 계열의 첫 번째 약물이다.4. 내성 기전
역전사 효소 중합효소 도메인의 아스파르트산 잔기 110, 185 및 186은 뉴클레오티드의 결합 및 삽입에 중요하다. 잔기 K65, R72 및 Q151의 측쇄는 다음에 들어오는 뉴클레오티드와 상호 작용한다. L74는 템플릿 가닥과 상호 작용하여 뉴클레오티드와의 염기쌍 형성을 위해 위치시키는 데 중요하다. 이러한 주요 아미노산의 돌연변이는 핵산유사체(약물)의 유전체 통합을 감소시킨다.
NRTI와 NNRTI는 모두 DNA 합성과 HIV 복제를 억제하는 데 효과적이지만, HIV는 약물에 대한 바이러스 내성 기전을 획득한다. HIV-1 역전사 효소는 교정 능력이 없다. 이는 약물로부터의 선택적 압력과 결합하여 역전사 효소에 변이를 유발하고, 바이러스가 NRTI 및 NNRTI에 대한 감수성을 낮아지게 한다.
4. 1. NRTI/NtRTI 내성
NRTI 내성에는 두 가지 주요 기전이 있다.첫 번째는 정상 뉴클레오티드보다 뉴클레오티드 유사체의 DNA 내 삽입이 감소하는 것이다. 이는 역전사 효소의 N-말단 중합효소 도메인에 돌연변이가 발생하여 효소의 친화력, 즉 약물 결합 능력이 감소하기 때문에 발생한다. 이러한 기전의 대표적인 예는 라미부딘(3TC) 및 엠트리시타빈(FTC)에 대한 내성을 부여하는 M184V 돌연변이이다.[45][46] 또 다른 잘 알려진 돌연변이 세트는 다제 내성 HIV에서 발견되는 Q151M 복합체로, NRTI의 삽입 효율을 감소시키지만 자연 뉴클레오티드 삽입에는 영향을 미치지 않는다. 이 복합체는 Q151M 돌연변이와 함께 A62V, V75I, F77L 및 F116Y를 포함한다.[47][48] Q151M만 포함된 바이러스는 지도부딘(AZT), 디다노신(ddI), 잘시타빈(ddC), 스타부딘(d4T)에 대해 중간 정도의 내성을 보이며, 아바카비르(ABC)에 약간의 내성을 보인다.[49][50] 다른 4가지 돌연변이와 결합된 Q151M을 가진 바이러스는 위에 언급된 약물에 대해 높은 내성을 가지며, 추가로 라미부딘(3TC) 및 엠트리시타빈(FTC)에 대한 내성을 보인다.
두 번째 기전은 삽입된 약물의 절제, 즉 가수분해적 제거 또는 피로인산분해이다. 이는 뉴클레오티드 삽입 중에 방출된 피로인산/PPI가 삽입된 약물(모노인산)과 반응하여 삼인산 약물을 방출하는 중합효소 반응의 역반응이다. 이 과정은 DNA 사슬을 '차단 해제'하여 확장하고 복제를 계속할 수 있도록 한다. 절제 강화 돌연변이(일반적으로 M41L, D67N, K70R, L210W, T215Y/F 및 K219E/Q)는 티미딘 유사체 AZT 및 D4T에 의해 선택되므로 티미딘 유사체 돌연변이(TAM)라고 한다.[51][52][53] 위 돌연변이의 배경에서 삽입 및 결실을 포함하는 다른 돌연변이도 강화된 절제를 통해 내성을 부여한다.[50]
4. 2. NNRTI 내성
NNRTI는 중합 효소의 활성 부위에 결합하지 않고, p66 하위 도메인(subunit)의 활성 부위 근처에 덜 보존된 포켓에 결합한다. 이들의 결합은 DNA에 결합하는 잔기의 위치를 왜곡하여 역전사 효소의 형태 변화를 초래한다.[54] NNRTI에 대한 반응으로 돌연변이는 약물이 주머니에 결합하는 것을 감소시킨다. 에파비렌츠 (EFV) 및 네비라핀 (NVP)을 포함하는 요법으로 치료하면 일반적으로 L100I, Y181C/I, K103N, V106A/M, V108I, Y188C/H/L 및 G190A/S 돌연변이가 발생한다.[17]NNRTI 내성에는 세 가지 주요 메커니즘이 있다.
1) NNRTI 돌연변이는 억제제와 NNRTI 결합 포켓 사이의 특정 접촉을 방해한다. 이것의 예는 주머니 입구에 앉아 약물의 유입 / 결합을 차단하는 K103N 및 K101E이다.[55][56]
2) 주머니 내부의 중요한 상호 작용을 방해한다. 예를 들어, Y181C 및 Y188L은 NNRTI 결합과 관련된 중요한 방향족 고리의 손실을 초래한다.[57][58]
3) NNRTI 결합 포켓의 전체적인 형태 또는 크기의 변화를 초래한다. 예를 들어 G190E는 주머니에 입체적인 덩어리를 생성하여 NNRTI가 단단히 묶일 공간을 거의 또는 전혀 남기지 않는다.[59][60]
NRTI와 NNRTI는 모두 DNA 합성을 종결시키고 HIV 복제를 억제하는 데 효과적이지만, HIV는 결국 약물에 대한 내성을 부여하는 기전을 개발한다. HIV-1 역전사 효소(RT)는 교정 활성이 없다. 이는 약물로 인한 선택적 압력과 결합하여 바이러스를 NRTI 및 NNRTI에 덜 민감하게 만드는 역전사 효소의 돌연변이를 유발한다.
5. 한국의 HIV/AIDS 현황 및 정책 (추가 제안)
(이전 출력이 없으므로 수정할 내용이 없습니다. 원본 소스와 함께 이전 출력을 제공해주시면 수정 작업을 진행하겠습니다.)
참조
[1]
문서
Islatravir
[2]
학술지
Bench-to-bedside review: Severe lactic acidosis in HIV patients treated with nucleoside analogue reverse transcriptase inhibitors
2003
[3]
학술지
Elsulfavirine: First Global Approval
https://link.springe[...]
2017-10
[4]
웹사이트
Elpida Combi (tenofovir+elsulfavirine+emtricitabine) Film-Coated Tablets. Full Prescribing Information.
https://grls.rosminz[...]
[5]
학술지
Role of islatravir in HIV treatment and prevention: an update
https://pubmed.ncbi.[...]
2022-07-01
[6]
학술지
K70Q adds high-level tenofovir resistance to "Q151M complex" HIV reverse transcriptase through the enhanced discrimination mechanism
[7]
학술지
Lamivudine (3TC) resistance in HIV-1 reverse transcriptase involves steric hindrance with beta-branched amino acids
[8]
학술지
Combination therapy with zidovudine and didanosine selects for drug-resistant human immunodeficiency virus type 1 strains with unique patterns of ''pol'' gene mutations
[9]
학술지
Multidrug-resistant human immunodeficiency virus type 1 strains resulting from combination antiretroviral therapy
[10]
학술지
Altered drug sensitivity, fitness, and evolution of human immunodeficiency virus type 1 with pol gene mutations conferring multi-dideoxynucleoside resistance
[11]
학술지
Pathways for the emergence of multi-dideoxynucleoside-resistant HIV-1 variants
[12]
학술지
The role of steric hindrance in 3TC resistance of human immunodeficiency virus type-1 reverse transcriptase
https://zenodo.org/r[...]
[13]
학술지
A mechanism of AZT resistance: an increase in nucleotide-dependent primer unblocking by mutant HIV-1 reverse transcriptase
[14]
학술지
Selective excision of AZTMP by drug-resistant human immunodeficiency virus reverse transcriptase
[15]
학술지
Phenotypic mechanism of HIV-1 resistance to 3'-azido-3'-deoxythymidine (AZT): increased polymerization processivity and enhanced sensitivity to pyrophosphate of the mutant viral reverse transcriptase
[16]
학술지
The role of non-nucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV-1 infection
[17]
학술지
Update of the drug resistance mutations in HIV-1: December 2009
[18]
학술지
Crystal structures of clinically relevant Lys103Asn/Tyr181Cys double mutant HIV-1 reverse transcriptase in complexes with ATP and non-nucleoside inhibitor HBY 097
[19]
학술지
The Lys103Asn mutation of HIV-1 RT: a novel mechanism of drug resistance
[20]
학술지
Structural mechanisms of drug resistance for mutations at codons 181 and 188 in HIV-1 reverse transcriptase and the improved resilience of second generation non-nucleoside inhibitors
[21]
학술지
Crystal structures of 8-Cl and 9-Cl TIBO complexed with wild-type HIV-1 RT and 8-Cl TIBO complexed with the Tyr181Cys HIV-1 RT drug-resistant mutant
[22]
학술지
Structures of Tyr188Leu mutant and wild-type HIV-1 reverse transcriptase complexed with the non-nucleoside inhibitor HBY 097: inhibitor flexibility is a useful design feature for reducing drug resistance
[23]
학술지
High resolution structures of HIV-1 RT from four RT-inhibitor complexes
[24]
문서
Islatravir
[25]
학술지
K70Q adds high-level tenofovir resistance to "Q151M complex" HIV reverse transcriptase through the enhanced discrimination mechanism
null
[26]
학술지
Lamivudine (3TC) resistance in HIV-1 reverse transcriptase involves steric hindrance with beta-branched amino acids
[27]
학술지
Combination therapy with zidovudine and didanosine selects for drug-resistant human immunodeficiency virus type 1 strains with unique patterns of pol gene mutations
[28]
학술지
Multidrug-resistant human immunodeficiency virus type 1 strains resulting from combination antiretroviral therapy
[29]
학술지
Altered drug sensitivity, fitness, and evolution of human immunodeficiency virus type 1 with pol gene mutations conferring multi-dideoxynucleoside resistance
[30]
학술지
Pathways for the emergence of multi-dideoxynucleoside-resistant HIV-1 variants
[31]
학술지
The role of steric hindrance in 3TC resistance of human immunodeficiency virus type-1 reverse transcriptase
https://zenodo.org/r[...]
[32]
학술지
A mechanism of AZT resistance: an increase in nucleotide-dependent primer unblocking by mutant HIV-1 reverse transcriptase
[33]
학술지
Selective excision of AZTMP by drug-resistant human immunodeficiency virus reverse transcriptase
[34]
학술지
Phenotypic mechanism of HIV-1 resistance to 3'-azido-3'-deoxythymidine (AZT): increased polymerization processivity and enhanced sensitivity to pyrophosphate of the mutant viral reverse transcriptase
[35]
학술지
Pathways for the emergence of multi-dideoxynucleoside-resistant HIV-1 variants
[36]
논문
The role of non-nucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV-1 infection
[37]
논문
Update of the drug resistance mutations in HIV-1: December 2009
[38]
논문
Crystal structures of clinically relevant Lys103Asn/Tyr181Cys double mutant HIV-1 reverse transcriptase in complexes with ATP and non-nucleoside inhibitor HBY 097
null
[39]
논문
The Lys103Asn mutation of HIV-1 RT: a novel mechanism of drug resistance
https://semanticscho[...]
[40]
논문
Structural mechanisms of drug resistance for mutations at codons 181 and 188 in HIV-1 reverse transcriptase and the improved resilience of second generation non-nucleoside inhibitors
[41]
논문
Crystal structures of 8-Cl and 9-Cl TIBO complexed with wild-type HIV-1 RT and 8-Cl TIBO complexed with the Tyr181Cys HIV-1 RT drug-resistant mutant
[42]
논문
Structures of Tyr188Leu mutant and wild-type HIV-1 reverse transcriptase complexed with the non-nucleoside inhibitor HBY 097: inhibitor flexibility is a useful design feature for reducing drug resistance
[43]
논문
High resolution structures of HIV-1 RT from four RT-inhibitor complexes
[44]
저널
Bench-to-bedside review: Severe lactic acidosis in HIV patients treated with nucleoside analogue reverse transcriptase inhibitors
2003
[45]
저널
K70Q adds high-level tenofovir resistance to "Q151M complex" HIV reverse transcriptase through the enhanced discrimination mechanism
[46]
저널
Lamivudine (3TC) resistance in HIV-1 reverse transcriptase involves steric hindrance with beta-branched amino acids
[47]
저널
Combination therapy with zidovudine and didanosine selects for drug-resistant human immunodeficiency virus type 1 strains with unique patterns of pol gene mutations
https://archive.org/[...]
[48]
저널
Multidrug-resistant human immunodeficiency virus type 1 strains resulting from combination antiretroviral therapy
[49]
저널
Altered drug sensitivity, fitness, and evolution of human immunodeficiency virus type 1 with pol gene mutations conferring multi-dideoxynucleoside resistance
https://archive.org/[...]
[50]
저널
Pathways for the emergence of multi-dideoxynucleoside-resistant HIV-1 variants
[51]
저널
A mechanism of AZT resistance: an increase in nucleotide-dependent primer unblocking by mutant HIV-1 reverse transcriptase
[52]
저널
Selective excision of AZTMP by drug-resistant human immunodeficiency virus reverse transcriptase
[53]
저널
Phenotypic mechanism of HIV-1 resistance to 3'-azido-3'-deoxythymidine (AZT): increased polymerization processivity and enhanced sensitivity to pyrophosphate of the mutant viral reverse transcriptase
[54]
저널
The role of non-nucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV-1 infection
[55]
저널
Crystal structures of clinically relevant Lys103Asn/Tyr181Cys double mutant HIV-1 reverse transcriptase in complexes with ATP and non-nucleoside inhibitor HBY 097
[56]
저널
The Lys103Asn mutation of HIV-1 RT: a novel mechanism of drug resistance
https://semanticscho[...]
[57]
저널
Structural mechanisms of drug resistance for mutations at codons 181 and 188 in HIV-1 reverse transcriptase and the improved resilience of second generation non-nucleoside inhibitors
[58]
저널
Crystal structures of 8-Cl and 9-Cl TIBO complexed with wild-type HIV-1 RT and 8-Cl TIBO complexed with the Tyr181Cys HIV-1 RT drug-resistant mutant
[59]
저널
Structures of Tyr188Leu mutant and wild-type HIV-1 reverse transcriptase complexed with the non-nucleoside inhibitor HBY 097: inhibitor flexibility is a useful design feature for reducing drug resistance
[60]
저널
High resolution structures of HIV-1 RT from four RT-inhibitor complexes
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
