골수이형성증후군
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
골수이형성증후군은 다양한 원인에 의해 발생하며, 혈액 세포의 생성에 이상이 생기는 질환이다. 화학 요법, 방사선 노출, 특정 산업 종사자, 다운 증후군 등이 위험 요인으로 작용할 수 있으며, 유전적 요인도 관련될 수 있다. MDS는 빈혈, 호중구 감소증, 혈소판 감소증 등의 증상을 보이며, 진단은 혈액 검사, 골수 검사, 세포 유전학적 검사 등을 통해 이루어진다. 1970년대에 분류가 시작되어, 2000년대 이후 세계보건기구(WHO) 분류 체계를 따르고 있으며, 다양한 아형으로 분류된다. 치료 목표는 증상 조절, 삶의 질 개선, 급성 골수성 백혈병(AML)으로의 진행 억제이며, 저위험군에는 지지 요법, 고위험군에는 저메틸화제, 레날리도마이드 등이 사용된다. 예후는 환자의 위험도, 염색체 이상, blast 수 등에 따라 다르며, 약 30%는 AML로 진행될 수 있다.
더 읽어볼만한 페이지
- 골수성 신생물 - 진성적혈구증가증
진성적혈구증가증은 골수에서 적혈구, 백혈구, 혈소판이 과도하게 생성되어 혈액량이 증가하는 만성 골수 증식성 종양으로, 두통, 현기증, 가려움증, 비장 비대 등의 증상이 나타날 수 있으며, JAK2 유전자 변이가 원인으로 작용하고, 약물 치료, 사혈 요법 등을 통해 질병 진행 억제 및 합병증 예방을 목표로 한다. - 골수성 신생물 - 본태성혈소판증가증
본태성 혈소판 증가증은 골수에서 혈소판이 과도하게 생성되어 혈소판 수치가 비정상적으로 증가하는 만성 골수 증식성 종양 질환으로, JAK2, CALR, MPL 유전자 돌연변이가 원인이며, 약물 치료와 혈소판 채집술로 치료한다. - 혈액 질환 - 저혈량증
저혈량증은 순환혈액량 감소로 인해 조직 관류가 저하되는 상태로, 출혈, 위장관 문제, 과도한 발한, 신장 기능 장애 등의 다양한 원인으로 발생하며 두통, 피로, 저혈압, 빈맥 등의 증상을 유발하고 심각한 경우 쇼크로 이어질 수 있다. - 혈액 질환 - 혈색소병증
혈색소병증은 헤모글로빈 이상으로 발생하는 질환군으로, Hb 변이체와 지중해빈혈을 포함하며 빈혈, 적혈구 증가증, 청색증 등을 유발하고 전기영동 분석으로 진단하며 조혈모세포 이식 등으로 치료한다. - 증후군 - 쇼그렌 증후군
쇼그렌 증후군은 자가면역 반응으로 발생하는 만성 염증성 질환으로, 침샘과 눈물샘 등에서 분비물 감소를 유발하여 건성안, 구강건조증 등 다양한 증상을 나타낸다. - 증후군 - 수근관 증후군
수근관 증후군은 손목터널 내 정중신경 압박으로 인해 저림, 통증을 유발하며 유전적 요인, 당뇨병, 반복적인 손목 사용 등이 원인이 될 수 있고, 보존적 치료나 수술적 치료를 고려한다.
2. 원인
골수 내 조혈모세포의 문제로 인해 비정상적인 세포가 생성되거나 혈액 세포 생성이 멈추는 현상을 골수이형성증후군이라고 한다. 이는 감염, 백혈병, 빈혈, 과다출혈 등 여러 합병증을 유발할 수 있다.
골수 내 조혈모세포의 문제로 인해 비정상적인 세포가 생성되거나 혈액 세포 생성이 멈추는 현상을 골수이형성증후군(MDS)이라 한다. 이는 감염, 백혈병, 빈혈, 과다출혈 등 여러 합병증을 유발할 수 있다. MDS는 대부분 원인을 알 수 없으나, 방사선, 벤젠, 특정 항암 화학요법 등 DNA 손상을 일으키는 물질 노출이 위험 요인으로 알려져 있다. 이차성 MDS는 암 치료의 후기 독성으로 발생할 수 있다.
골수 내 조혈모세포의 문제로 인해 비정상적인 세포가 생성되거나 혈액 세포 생성이 멈추면서 감염, 백혈병, 빈혈, 과다출혈 등 여러 합병증이 발생할 수 있다.[6][7][8][9] 징후와 증상은 비특이적이며 일반적으로 혈구감소증과 관련이 있다.
골수이형성증후군 환자 중 일부는 멜팔란(멜팔란), 사이클로포스파마이드(사이클로포스파마이드), 부술판(부술판), 클로람부실(클로람부실)과 같은 알킬화제나 방사선 치료, 또는 이 두 가지 모두에 노출된 병력이 있다(예: 다른 질병에 대한 줄기세포 이식).[12] 석유 산업과 같이 탄화수소에 많이 노출되는 일부 산업 종사자는 일반인보다 발병 위험이 약간 높으며, 크실렌(크실렌)과 벤젠(벤젠) 노출은 골수이형성증후군과 관련이 있다.[12] 베트남 전쟁 참전 용사 중 고엽제에 노출된 사람들은 골수이형성증후군 발생 위험이 있다.[12] 제2차 세계 대전 중 히로시마와 나가사키에 투하된 원자폭탄에 근접했던 원자폭탄 생존자들에게서 "방사선 노출 후 40~60년 동안" 골수이형성증후군 발생과의 연관성이 있을 수 있다.[13]
다운 증후군 어린이는 골수이형성증후군에 취약하며, 가족력은 유전성 철분 과잉 적혈구 빈혈(철분 과잉 적혈구 빈혈) 또는 판코니 빈혈(판코니 빈혈)을 나타낼 수 있다.[14] GATA2 결핍증과 SAMD9/9L 증후군은 각각 소아 골수이형성증후군의 약 15%를 차지한다.[15]
골수이형성증후군은 방사선이나 벤젠과 같은 환경적 노출에 의해 발생할 수 있다. 이차성 골수이형성증후군은 암 치료, 특히 방사선 치료와 부술판, 니트로소우레아, 프로카르바진과 같은 방사선 모방 알킬화제 병용(잠복기 5~7년) 또는 DNA 토포이소머라제 저해제 병용(잠복기 2년)의 후기 독성으로 발생한다. 면역억제 치료 후 후천성 재생 불량성 빈혈과 판코니 빈혈은 모두 골수이형성증후군으로 진행될 수 있다.
골수이형성증후군은 다능성 골수줄기세포의 돌연변이에 기인하는 것으로 생각되지만, 혈액 전구세포의 분화가 손상되어 있고, 골수세포에서의 세포 자멸이 현저하게 증가하며, 이상 세포의 클론성 증식에 의해 분화능을 잃은 세포가 생성된다. 골수아세포의 총 비율이 특정 값(WHO에서는 20%)을 초과하면 급성 골수성 백혈병(AML)으로의 이행이 발생한 것으로 진단된다. 골수이형성증후군에서 급성 골수성 백혈병으로의 진행은, 처음에는 정상 세포에서 일련의 돌연변이가 발생하여 암세포로 전환된다는 크누드손 가설의 예시이다.
3. 병태 생리
MDS는 다능성 골수 줄기세포의 돌연변이로 인해 발생하며, 혈액 전구 세포의 분화가 손상되고 세포자멸사가 증가한다. 비정상 세포의 클론 증식은 분화 능력을 상실한 세포를 생성하며, 골수아세포 비율이 일정 기준( WHO 20%, FAB 30%)을 넘으면 급성골수성백혈병(AML)으로 전환된다. MDS에서 AML로의 진행은 다단계 발암 이론의 예시이다.[16]
MDS 환자의 상당수는 AML로의 전환보다는 혈구감소증으로 인해 이환율과 사망률을 보인다. 빈혈이 가장 흔하지만, 수혈로 인해 심각한 손상은 드물다. 혈구감소증으로 인한 주요 합병증은 출혈(혈소판 부족)과 감염(백혈구 부족)이다. 장기간 수혈은 철 과부하를 유발한다.[17]
MDS에서 DNA 구조의 후성유전적 변화는 미국 식품의약국(FDA)에서 승인된 약물(5-아자시티딘, 데시타빈, 레날리도마이드) 중 5-아자시티딘과 데시타빈 두 약물의 성공을 설명한다. DNA 메틸화 조절 상실은 세포 성장 및 혈구감소증을 유발하며, DNA 메틸전이효소 억제제는 DNA 메틸화를 정상화하여 혈구 수치를 회복시키고 AML 진행을 지연시킨다.[18]
미토콘드리아 기능 상실이 DNA 돌연변이 축적을 초래하여 고령 환자의 MDS 발생률 증가를 설명한다는 연구도 있다. 고리철아세포에서 미토콘드리아 철 침착물 축적이 미토콘드리아 기능 장애의 증거로 제시된다.[19]
조혈줄기세포 노화는 유전적, 후생유전적 이상 축적으로 이어져 MDS가 DNA 손상 대처 능력 부족과 관련 있음을 시사한다.[20] 손상된 DNA 복구 경로 결함이 MDS의 근본 메커니즘일 수 있다는 새로운 관점도 제시된다.[21] MDS에서는 염색체 파손 빈도가 증가하고, DNA 복구 과정 결함을 나타낸다.[22]
1974년부터 5번 염색체 장완 결손이 조혈 줄기세포 이형성 이상과 관련이 있다고 알려져 왔다.[23][24] 2005년 레날리도마이드가 5q- 증후군 환자에게 효과적임이 밝혀졌고,[25] 미국 FDA는 이를 승인했다. 레날리도마이드는 5q- 단독, 낮은 IPSS 위험, 수혈 의존성 환자에게 효과적이며, 악성 클론 수를 감소시키고 건강한 적혈구 생성 세포 분화를 유도한다.
스플라이싱 인자 돌연변이는 MDS 환자의 40~80%에서 발견되며, 환상철분모세포가 더 많은 환자에게서 돌연변이가 더 많이 검출된다.[26]
이소시트르산 탈수소효소(IDH1 및 IDH2) 유전자 돌연변이는 MDS 환자의 10~20%에서 발생하며,[27] 저위험군 MDS 환자의 예후를 악화시킨다.[28] IDH1/2 돌연변이 발생률은 질병 악성도 증가에 따라 증가하여, IDH1/2 돌연변이가 MDS의 악성 질환 진행에 중요 원인임을 시사한다.[28]
GATA2 결핍증은 ''GATA2'' 유전자 중 하나의 불활성 돌연변이 결함으로 발생하는 질환군이다. 상염색체 우성 돌연변이는 GATA2 단백질 (전사 인자) 세포 수준을 감소시켜 혈액 생성, 림프 생성 및 기타 조직 생성 줄기세포의 배아 발생, 유지 및 기능에 문제를 일으킨다. 이로 인해 혈액학적, 면역학적, 림프계 증상이 나타나며, MDS (급성 골수성 백혈병으로 진행) 또는 만성 골수단핵구 백혈병이 발생할 수 있다.[29][30]
일과성 골수 증식성 질환(일과성 비정상 골수증식증, TAM)은[31] 간과 골수에서 비암성 거대핵구아세포 클론의 비정상적 증식을 특징으로 한다. 다운증후군 환자 또는 유사 유전적 변화를 가진 개인에게 발생하며, 임신 중 또는 출생 직후 발생하여 3개월 내 소실되거나 급성 거대핵구성 백혈병으로 진행된다.[32][29][33]
골수에서 조혈모세포의 전암세포인 이형 클론이 정상 조혈모세포를 능가하여 증식하고, 정상 조혈을 억제한다. 이형 클론에서 생성되는 혈구세포는 비정상 세포로 말초혈액으로 나가기 전 분해되는 무효 조혈이 발생한다. 생성 혈구는 형태가 비정상적이고 수명이 짧다. MDS 이상 클론은 세포자멸사가 항진되어 골수는 과형성이지만 혈구 감소를 일으킨다. 이상 클론 유전자에 손상이 더해져 세포자멸사 저항성을 획득하면 급성골수성백혈병이 된다. 이러한 이유로 MDS를 전백혈병 상태라고도 한다.
4. 증상
많은 환자들이 무증상이며, 혈구감소증 또는 다른 문제는 정기적인 혈액 검사에서 확인된다.[10] MDS 환자는 급성 골수성 백혈병이 발생할 위험이 거의 30%이다.
빈혈이 초기 경과를 지배한다. 대부분의 증상이 있는 환자는 피로와 무력감, 호흡곤란, 그리고 창백의 점진적인 발병을 호소하지만, 적어도 절반의 환자는 무증상이며, MDS는 정기적인 혈액 검사에서 우연히 발견된다. 발열, 체중 감소 및 비장 비대는 순수 골수이형성 과정보다는 골수이형성/골수증식성 신생물(MDS/MPN)을 가리킬 수 있다.[11] 발병 시 증상은 미미하며 무증상이거나 적혈구 생성이 저하되어 만성 빈혈을 일으킨다. 백혈구 감소가 심한 경우 감염증 합병, 혈소판 감소가 심한 경우 출혈 경향이 나타나지만, 혈액 검사에서 백혈구 감소, 혈소판 감소, 범혈구 감소가 우연히 발견되는 경우도 많다. 고위험군으로 분류되는 유형에서는 급성 백혈병(특히 급성골수성백혈병)으로 이행하는 비율이 높다. 백혈구 감소를 수반하는 감염증도 중요한 것 중 하나이다.
;철과다증
: 골수이형성증후군의 치료에서 적혈구 수혈을 받아 철이 과잉으로 체내에 축적됨으로써 발생한다. 특유의 자각 증상은 없으며, 진행되면 간 손상이나 심부전 등의 장기 손상을 일으킬 위험이 있다. 수혈량이 40단위를 초과하면 발병 위험이 높아진다. 1년 이상의 예후가 예상되는 경우에는 철 킬레이트 요법도 시행된다.
5. 진단
말초혈액검사 및 혈액 도말 검사를 포함한 전형적인 진단 검사들을 통해 혈액 도말 형태는 용혈성빈혈, 가성 혈소판감소증으로 이어지는 혈소판 응집 또는 백혈병에 대한 단서를 제공받을 수 있다.[34] 또한, 루푸스(전신성 홍반 루푸스), 간염, B12, 엽산 또는 기타 비타민 결핍, 신부전 또는 심부전, HIV, 용혈성빈혈, 단일클론 감마병증 등 혈구감소증의 다른 일반적인 원인을 배제하기 위한 혈액 검사도 진행한다. 모든 빈혈 환자에게 연령에 적합한 암 검진을 고려해야 한다.[34]
혈액병리학자에 의한 골수 검사는 필수적이다. 모든 혈액병리학자는 이형성 골수를 골수이형성증후군의 주요 특징으로 간주하기 때문이다.[35] 세포유전학 또는 염색체 연구는 이상적으로는 골수 천자액에서 수행된다. 살아있는 세포가 중기에 들어가도록 유도하여 염색체를 관찰할 수 있도록 하기 때문에 기존 세포유전학에는 신선한 검체가 필요하다. 간기 형광제자리부합법 검사는 기존 세포유전자 검사와 함께 진행되며 del 5q, −7, +8 및 del 20q를 포함한 MDS와 관련된 여러 가지 염색체 이상을 신속하게 검출한다. 또한, MDS에 대해 가상핵형 분석을 수행할 수 있다.[36] 이 방법은 계산 도구를 사용하여 손상된 DNA로부터 핵형을 구성하며, 세포 배양이 필요하지 않고 기존 세포유전학보다 해상도가 훨씬 높지만 균형전좌는 검출할 수 없다. 유세포 분석은 아형성구, 비정상 골수 성숙 및 골수에 림프증식성 질환이 있는지 여부를 확인하는 데 도움이 된다.
골수 생검에서 형태학적으로 MDS와 유사하게 보일 수 있으므로 구리 결핍 검사를 간과해서는 안 된다.[37] 구리 결핍의 위험 요인에는 위 우회술, 아연 보충제 및 셀리악병이 포함된다.[38]
일반적으로 MDS를 정의하는 데 사용되는 특징은 혈구감소증, 비효율적인 조혈, 이형적혈구증, 이형과립구증, 이형거대핵판구증 및 골수아세포 증가이다. 이형성은 골수에서 관찰되는 세 가지 계열 모두에 영향을 미칠 수 있다.
이형성을 진단하는 가장 좋은 방법은 골수 천자액과 말초 혈액 도말에 사용되는 형태 및 특수 염색(PAS)이며, 골수계열의 이형성은 다음과 같이 정의된다.
- 과립구 계열:
- 과분절된 호중구(비타민 B12/엽산 결핍에서도 관찰됨)
- 저분절 호중구(가성 펠거-휴엣)
- 저과립 호중구 또는 가성 쉐디악-히가시(큰 아주르 친화성 과립)
- 오이어 로드 – 자동적으로 AML(말초혈액에서 아형성구 수가 5% 미만이고 골수 천자액에서 10% 미만인 경우). t(8;21) 전좌가 있는 AML의 성숙 호중구에서도 관찰될 수 있음
- 호산구 내의 이형 과립(염기성 및 호산성 과립)
- 적혈구 계열:
- 이핵 적혈구 전구체 및 핵붕괴
- 적혈구 핵 발아
- 적혈구 핵 사슬 또는 핵간 연결(선천성 이형적혈구증에서 관찰됨)
- normoblast에서 e-카드헤린의 손실
- 골수 천자액에서 적혈구 전구체 내 PAS(소포 내 구상 또는 확산 세포질 염색)(파라핀 고정 골수 생검에는 영향을 미치지 않음). L1 및 L2 아형성구(FAB 분류; L1 및 L2 명명법은 WHO 분류에서는 사용되지 않음)에서 PAS 소포 양성이 관찰될 수 있음
- 고리형 철분 과립구(퍼얼스 프러시안 블루 철 염색에서 관찰)(핵의 3분의 1 이상을 둘러싸는 10개 이상의 철 과립)(고리형 철분 과립구를 동반한 불응성 빈혈) 적혈구 전구체 중에서 계산했을 때 고리형 철분 과립구가 15% 이상인 경우
- 거대핵판구 계열:
- 혈소판 생성 거대핵판구의 저분절 핵 특징(엽상 결핍)
- 과분절된(파골세포 모양) 거대핵판구
- 혈소판의 팽창(간섭 대비 현미경으로 관찰됨)
골수 생검에서 고등급 이형성(RAEB-I 및 RAEB-II)은 미성숙 전구세포 세포(골수아세포 및 전골수아세포)의 섬으로 구성된 비정형적인 미성숙 전구세포의 국재화를 보일 수 있으며, 이는 골격대주 주변이나 주변 소동맥이 아닌 골격대주 간 공간의 중앙에 국재화되어 있다. 이러한 형태는 치료된 백혈병과 회복 중인 미성숙 정상 골수 요소와 구별하기 어려울 수 있다. 초기 골수이형성증후군(RA 및 RARS)에서는 정상 간질 공간에 위치한 적혈구 섬을 형성하는 대신 골성 골격대주 옆에 적혈구가 관찰되는 등 핵이 있는 적혈구의 지형적 변화가 관찰될 수 있다.
대부분의 경우 WHO가 제시하는 골수이형성증후군(MDS) 진단 및 분류 기준이 적용된다. 그러나 드물게는 하나 이상의 드문 특징으로 인해 정의된 범주에 분류하기 어려운 경우가 있는데, 다음과 같다.
- 오구리체가 관찰되는 아구가 5% 미만인 드문 경우. 이러한 경우는 대부분 다계열 이형성을 동반한 불응성 빈혈(RAMD)의 특징을 가지고 있다.
- 빈혈을 보이지 않고, 단독 과립구 감소증 또는 단독 혈소판 감소증을 보이며, 단일 계열에 국한된 이형성 변화를 보이는 MDS의 드문 경우. 불응성 과립구 감소증 및 불응성 혈소판 감소증이라는 용어가 이러한 경우를 설명하는 데 사용될 수 있다. 빈혈을 동반하지 않는 과립구 감소증 또는 혈소판 감소증 환자에서 MDS 진단은 신중하게 이루어져야 한다.
- 때때로 정상적인 혈구 감소 대신 백혈구 증가 또는 혈소판 증가를 보일 수 있는 RA 또는 RAEB 환자.
말초혈액 도말염색 표본 검사에서는 조혈 감소와 무효 조혈에 의해 범혈구감소증 또는 2계열 감소를 보인다. 정구성 또는 대구성 빈혈이 관찰된다. RARS에서는 예외적으로 소구성 저색소성 적혈구가 혼재한다. 골수 도말메이-김자 염색 표본 검사에서는 원칙적으로 정형성 또는 무효 조혈 등에 의해 과형성이 관찰된다. 일부 저형성이 관찰되는 경우도 있다. 도말 표본과 골수 생검에서 이형성이 없는지 관찰한다. 염색체 검사에서는 다양한 염색체 이상이 관찰된다. MDS 진단용 유세포 분석은 진단이 어려운 경우에 유용하지만, 일부 병원에서만 시행한다.
전혈구 감소가 관찰될 경우, 우선 골수이형성증후군을 염두에 둔다. 다음으로 종양이나 결합조직 질환 등을 제외하고, 그 후 골수 도말 표본에서 형태 이상을 확인하여 진단한다. 그러나 형태 이상의 확인에는 검사자의 주관이 개입되기 쉽고, 정확성이 부족할 수 있다. 이를 보완하기 위해 골수천자 시 염색체 검사를 실시하여 염색체 이상이 발견되면 정확도가 높아진다. 또한, 일부 병원에서는 MDS 진단용 유세포 분석 검사가 가능하며, 골수이형성증후군에 특징적인 이상이 검출되면 진단의 정확성이 높아진다.
6. 분류
1990년대 후반, 세계보건기구(WHO) 산하 병리학자 및 임상의 그룹은 이 분류 체계를 수정하여 여러 새로운 질병 범주를 추가하고 일부는 제외했다. 2008년, 2016년, 그리고 2022년에 WHO는 말초혈액과 골수 세포의 형태학과 함께 유전체 발견(5q-)을 통합한 새로운 분류 체계를 개발했다. 2024년 현재 WHO 5차 개정판과 국제 합의 분류(ICC)[39] 시스템이 모두 활발하게 사용되고 있다.[40]
2008년 WHO 시스템에서 골수형성이상증후군으로 분류된 질환 목록은 다음과 같다.
MDS는 빈혈 없이 단핵구감소증 또는 혈소판감소증만 나타나고, 이형성 변화가 단일 계열에 국한될 수 있다. 이는 WHO 5판에서 저위험군 골수이형성증후군(MDS-Low Blasts)으로 분류된다. 골수이형성증후군 환자는 때때로 흔히 나타나는 혈구감소증 대신 백혈구증가증 또는 혈소판증가증을 보일 수 있다. 이는 골수증식성 신생물과의 중첩 증후군을 나타낼 수 있다.
2008년 WHO 분류 기준에서 분류 불가능한 골수이형성증후군(MDS)의 대부분은 WHO 제5판 기준에서는 원인불명 클론성 혈소판감소증(CCUS)으로 간주된다. CCUS는[41] 다음과 같이 정의된다.
- 골수 또는 말초혈액 세포에서 ≥2%의 대립유전자 부담으로 골수증식성 신생물 환자에서 발견되는 하나 이상의 체세포 돌연변이 검출
- 하나 이상의 말초혈액 세포 계열에서 지속적인 혈구감소증(≥ 4개월)
- 골수증식성 신생물의 진단 기준 충족되지 않음
- 혈구감소증 및 분자 이상의 다른 모든 원인 배제
저형성 골수이형성증후군(Hypoplastic MDS), 섬유화를 동반한 골수이형성증후군(MDS with fibrosis), 이형접합성 TP53 불활성화를 동반한 골수이형성증후군(MDS with bi-allelic TP53 inactivation), 그리고 만성골수단핵구백혈병(CCUS)이 WHO 5차 분류에 추가되었다. 또 다른 아형인 생식세포계열 소인 및 장기 기능 장애를 동반한 골수종양(Myeloid neoplasms with germ line predisposition and organ dysfunction)에는 CEBPA/DDX41/RUNX1 장애, GATA2 결핍 및 SAMD9/9L 증후군이 포함된다.
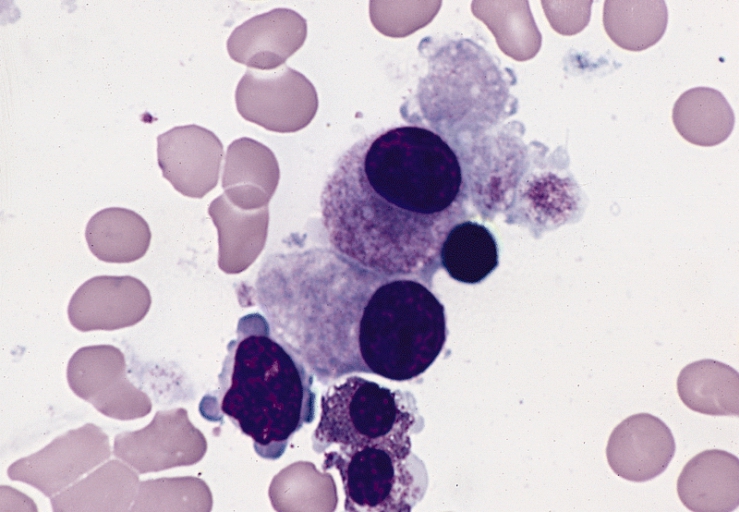
2000년 이전에는 FAB 분류가 사용되었다.
- 재생불량성빈혈 (RA)
- 환상철아구를 동반한 재생불량성빈혈 (RARS)
- 아구증가를 동반한 재생불량성빈혈 (RAEB)
- 이행기의 아구증가를 동반한 재생불량성빈혈 (RAEB-t)
- 만성골수단구성백혈병 (CMML)
그 후, 1999년부터 2001년에 걸쳐 WHO에서 제창되어 WHO 분류 제3판으로 출판된 분류에서는, 만성골수단구성백혈병 (CMML)은 골수이형성/골수증식성질환 (MDS/MPD)군에 분류되었다. 2000년에 WHO에 의해 확립된 새로운 WHO 분류가 가장 일반적이다.
최소 1974년 이후로, Chromosome 5 (human)|label=5번 염색체영어 장완(長腕)의 결손이 조혈모세포의 이형성 이상과 관련이 있다는 것이 알려져 있다.[71][72]
6. 1. WHO 분류 (2016년 개정)
2016년에 개정된 WHO 분류는 2008년 분류를 기반으로 유전학적 발견을 통합하여 발전시킨 것이다. 골수형성이상증후군은 다음과 같이 분류된다.[69]- MDS-SLD: 단일혈구계통 이형성을 동반한 골수이형성증후군
- MDS-MLD: 다혈구계통 이형성을 동반한 골수이형성증후군
- MDS-RS-SLD: 단일혈구계통 이형성 및 고리철적모구를 동반한 골수이형성증후군
- MDS-RS-MLD: 다혈구계통 이형성 및 고리철적모구를 동반한 골수이형성증후군
- MDS del(5q): 5q- 증후군. 5번 염색체 장완 결손을 가지는 유형[71][72]
- MDS-EB-1: 아세포 과다 골수이형성증후군-1
- MDS-EB-2: 아세포 과다 골수이형성증후군-2
- MDS-U: 분류 불가능한 골수이형성증후군
- RCC: 소아기 불응성 혈구감소증
5q- 증후군은 일반적으로 고령 여성에게서 나타나며, 혈소판 수치가 정상이거나 높고, 골수 세포에 5번 염색체 장완의 결손이 있는 경우이다. 레날리도마이드가 5q- 증후군 환자에게 효과적이며, 2005년 미국 FDA에서 승인되었다.[73]
7. 치료
골수이형성증후군(MDS) 치료의 목표는 증상을 조절하고, 삶의 질을 개선하며, 생존율을 높이고, 급성골수성백혈병(AML)으로 진행되는 것을 막는 것이다.
국제 예후 점수화 시스템(IPSS) 점수는 MDS 환자의 치료 방향을 결정하는 데 도움이 된다.[42][43] 저위험군 MDS (IPSS 점수 3.5 미만) 환자의 경우, 질병 특이적 치료는 효과적이지 않으므로, 혈구 수치를 유지하는 지지 요법에 중점을 둔다.[54] 다베포에틴 알파나 에리스로포이에틴과 같은 적혈구 생성 촉진제를 사용하여 적혈구 수치를 높일 수 있다. 적혈구 생성 촉진제에 대한 반응률은 약 39%이며, 평균 지속 기간은 8~23개월이다. (반응은 헤모글로빈 수치가 1mg/dL 증가하거나 수혈이 필요 없을 때로 정의된다.)[54]
로밉로스팀과 엘트롬보파그는 혈소판 전구세포인 거대핵구에 작용하여 혈소판 생성을 증가시키는 트롬보포이에틴 수용체 작용제이다. 이 약물들은 혈소판 수치를 높이고 혈소판 수혈 필요성을 줄이는 것으로 나타났다.[54] 그러나 과다한 폭발세포를 동반하는 MDS에는 AML로의 진행 위험을 증가시키므로 사용되지 않는다.[54]
고위험군 MDS (IPSS 점수 3.5 초과) 환자의 경우, 저메틸화제인 아자시티딘은 표준 치료(지지 요법, 시타라빈 또는 화학 요법)에 비해 생존율을 높이는 것으로 나타나 표준 치료로 간주된다.[54][44] 아자시티딘은 기존 치료에 비해 생존율(24개월 대 15개월)과 부분적 또는 완전한 치료 반응률(29% 대 12%)이 더 높았다.[29] 데시타빈은 아자시티딘과 유사한 생존율 향상 효과를 보였으며, 반응률은 최대 43%에 달한다.[54][45][46][47] 데시타빈은 세다주리딘과 병용하여 데시타빈/세다주리딘(Inqovi)으로 제공되며, MDS와 만성골수단핵구백혈병(CMML) 성인 환자 치료를 위한 고정 용량의 병용 약물이다.[48]
레날리도마이드는 5q 염색체 결손 아형(5q- 증후군) MDS 환자의 적혈구 수혈 요구량 감소에 효과적이며, 반응의 중앙값 지속 기간은 2년 이상이다.[49][54]
루스파터셉트는 TGFβ 리간드로서 적혈구 생성에 관여하는 SMAD2 및 SMAD3 신호 전달을 감소시키는 작용을 하며, 적혈구 생성 촉진제에 반응하지 않는 빈혈이 있는 MDS 또는 고리철세포를 동반한 경증 MDS에 사용될 수 있다. 루스파터셉트는 수혈 필요성을 감소시키는 것으로 나타났으며, 이 효과는 중앙값 30.6주 동안 지속되었다.[50][54][51]
특히 젊은(40세 미만) 환자 및 중증 환자의 경우, HLA 일치형 동종이계 줄기세포 이식은 치료 가능성을 제공한다. 골수 이식의 성공률은 IPSS 점수에 따라 결정되는 MDS의 중증도와 상관관계가 있으며, IPSS 점수가 더 유리한 환자는 이식 결과가 더 유리한 경향이 있다.[52]
MDS에서는 빈혈이 있는 환자의 지지 치료의 주요 부분인 반복적인 적혈구 수혈의 결과로 철 과부하가 발생할 수 있다. 많은 MDS 환자는 치료에 반응하지 않아 반복적인 수혈로 인한 철 과부하로 인해 이차성 헤모크로마토시스가 발생할 수 있다. 만성적인 철 과부하가 있는 환자는 간, 심장 및 내분비샘에 철이 축적될 수 있다.
수혈이 많이 필요한 환자의 경우, 철 수치를 결정하기 위해 혈청 페리틴 수치, 받은 수혈 횟수 및 관련 장기 기능 장애(심장, 간 및 췌장)를 모니터링해야 한다. 목표는 페리틴 수치를 1000 µg/L 미만으로 유지하는 것이다. 현재 미국에서는 정맥 투여용 데페록사민과 경구 투여용 데페라시록스의 두 가지 철 킬레이트제가 사용 가능하다. 세 번째 킬레이트제인 데페리프론도 있지만, 중성구 감소증이라는 주요 부작용 때문에 MDS 환자에게는 사용이 제한적이다.[53]
철 킬레이션 요법을 통해 MDS에서 철 과부하의 일부 결과를 역전시킬 수 있음이 입증되었다. 철 과부하는 장기 손상을 초래할 뿐만 아니라 유전체 불안정성을 유도하고 조혈 틈새를 변형시켜 급성 백혈병으로의 진행을 촉진한다. 선택된 MDS 환자의 철 과부하를 줄이기 위해 킬레이션 요법을 고려해야 한다.[53]
1974년 이후로, 5번 염색체 장완(長腕)의 결손이 조혈모세포의 이형성 이상과 관련이 있다는 것이 알려져 있다.[71][72] 2005년까지 항암제 레날리도마이드가 5q- 증후군 MDS 환자에게 효과적이라는 것이 인지되었고,[73] 2005년 12월 미국 FDA는 이 질환에 대해 레날리도마이드를 승인했다. 단독 5q-, 낮은 IPSS 위험, 수혈 의존성 환자가 레날리도마이드에 가장 잘 반응한다. 일반적으로 이러한 환자의 예후는 좋으며, 생존 기간 중앙값은 63개월이다. 레날리도마이드는 이중 작용을 하는데, 하나는 5q- 환자에서 악성 클론 수를 감소시키는 작용이고, 다른 하나는 5q 결손이 없는 환자에서 볼 수 있듯이 건강한 적혈구 계열 세포의 양호한 분화를 유도하는 작용이다.
경증의 경우 경과 관찰이 되며, 기본적으로 대증요법이 중심이 된다. 호중구 감소의 경우 과립구 콜로니 자극 인자(G-CSF)를 투여하고, 적혈구 감소의 경우 에리스로포이에틴(EPO)을 투여하며, 각각 극단적인 감소의 경우 수혈 요법으로 대처한다.
중증의 경우에는 근치 요법으로 조혈모세포 이식을 실시한다. 이상 클론을 근절하고 정상 조혈을 회복시키는 것이 목적이다.
또한, 약물 치료로는 다음이 사용된다.
8. 예후
골수이형성증후군(MDS)의 예후는 다양하며, 환자의 약 30%는 불응성 급성골수성백혈병(AML)으로 진행한다. 저위험군 MDS는 3~10년의 생존 기대 수명을 가지는 반면, 고위험군 MDS는 3년 미만의 생존 기대 수명을 가진다.[54] 줄기세포 이식은 가능한 치료법으로 3년 생존율이 50%이지만, 고령 환자는 예후가 좋지 않다.[55]
예후 지표
세포유전학적 이상은 기존 세포유전학, MDS를 위한 FISH 패널 또는 가상 카리오타입(virtual karyotype)을 통해 검출할 수 있다.
RA 및 RARS는 가장 좋은 예후를 보이며, 일부 비이식 환자는 10년 이상 생존한다(일반적으로 3~5년). RAEB-T는 가장 나쁜 예후를 보이며 평균 생존 기대 수명은 1년 미만이다. 환자의 약 1/4은 명백한 백혈병이 발생한다. 국제 예후 점수 시스템(International Prognostic Scoring System, IPSS)은 MDS의 예후를 결정하는 데 가장 일반적으로 사용되는 도구이며,[57] 이후 IPSS-R 및 IPSS-M으로 개정되었다. 다른 예후 도구로는 2007년 WHO 예후 점수 시스템(WPSS), MDA-LR(MD Anderson 저위험 MDS 예후 점수 시스템) 등이 있다.[58]
IPSS-M은 31개의 체세포 유전자를 통합하여 위험도를 계층화한다. IPSS-M은 TP53 유전자의 다중 돌연변이 등이 불량한 예후를 예측하는 강력한 지표임을 밝혔다. 저위험 MDS에서는 IDH1 및 IDH2 돌연변이가 생존율 악화와 관련이 있다.[28]
5번 염색체 장완(長腕)의 결손은 조혈모세포의 이형성 이상과 관련이 있다.[71][72] 레날리도마이드는 5q- 증후군 MDS 환자에게 효과적이며, 이러한 환자의 예후는 좋으며, 생존 기간 중앙값은 63개월이다.
이소시트르산 탈수소효소 1 및 2(IDH1 및 IDH2)를 암호화하는 유전자의 변이는 MDS 환자의 10~20%에서 발생하며,[75] 저위험군 MDS에서 예후 악화 인자이다.[76]
가장 중요한 것은 백혈병으로의 이행이다. 특히 급성골수성백혈병으로 이행하는 비율이 높다.
다른 것으로는, 백혈구 감소를 수반하는 감염증도 중요하다.
;철과다증
: 골수이형성증후군의 치료에서 적혈구 수혈을 받아 철이 과잉으로 체내에 축적됨으로써 발생한다. 진행되면 간 손상이나 심부전 등의 장기 손상을 일으킬 위험이 있다. 1년 이상의 예후가 예상되는 경우에는 철 킬레이트 요법도 시행된다.
예후불량이다. 예후가 좋은 불응성 빈혈의 경우 생존 기간은 약 5년이며, 예후가 불량한 유형의 경우 1년 정도이다. 골수이식 시행 사례에서 장기 생존율은 불응성 빈혈의 경우 40%~60%, RAEB(급성골수성백혈병 관련 골수이형성증후군)의 경우 20%~30% 정도이다.
9. 한국의 현황 및 정책
10. 역사
20세기 초부터 일부 급성 골수성 백혈병 환자들에게는 그 이전에 빈혈과 비정상적인 혈구 생성 기간이 있었던 것으로 인식되기 시작했다. 이러한 상태들은 다른 질병들과 함께 "난치성 빈혈"이라는 용어 아래 묶였다. 특정 질병으로서 "백혈병 전 단계 질환(preleukemia)"에 대한 최초의 설명은 1953년 Block 등에 의해 발표되었다.[60] 1976년 FAB 분류가 발표되어 MDS라는 용어가 널리 사용될 때까지 이 증후군은 여러 이름으로 불렸다.
1974년과 1975년, 프랑스, 미국, 영국의 병리학자 그룹이 이 질병들에 대한 최초로 널리 사용된 분류를 만들었다. 이 프랑스-미국-영국 분류법(French-American-British classification)은 1976년에 발표[61]되었고, 1982년에 개정되었다. 병리학자와 임상의들이 거의 20년 동안 사용했다. 사례는 다섯 가지 범주로 분류되었다.
(클리블랜드 클리닉(Cleveland Clinic)에서 이들에 대한 비교표를 확인할 수 있다.[62])
이러한 병태를 보이는 조혈장애의 존재는 오래전부터 알려져 있었지만, 골수이형성증후군으로 확립된 것은 1982년이다.
참조
[1]
웹사이트
Myelodysplasia
https://seer.cancer.[...]
2016-10-27
[2]
웹사이트
Myelodysplastic Syndromes
https://rarediseases[...]
2019-05-23
[3]
웹사이트
Myelodysplastic Syndromes Treatment (PDQ®) – Patient Version
https://www.cancer.g[...]
NCI
2015-08-12
[4]
논문
Myelodysplastic syndromes: diagnosis, prognosis, and treatment
2013-11-00
[5]
서적
Holland-Frei Cancer Medicine
https://books.google[...]
PMPH-USA
2010-00-00
[6]
웹사이트
Anemia: Overview
https://www.lecturio[...]
2021-08-15
[7]
웹사이트
Neutropenia
https://www.lecturio[...]
2021-08-15
[8]
서적
Myelodysplastic Syndrome
The Leukemia & Lymphoma Society
2001-00-00
[9]
웹사이트
Thrombocytopenia
https://www.lecturio[...]
2021-08-15
[10]
웹사이트
Myelodysplastic Syndromes
https://www.lecturio[...]
2021-08-11
[11]
논문
Evidence-Based Minireview: Myelodysplastic syndrome/myeloproliferative neoplasm overlap syndromes: a focused review
https://doi.org/10.1[...]
2020-12-04
[12]
논문
Myelodysplastic syndromes (MDS) occurring in Agent Orange exposed individuals carry a mutational spectrum similar to that of ''de novo'' MDS
2020-03-00
[13]
논문
Risk of myelodysplastic syndromes in people exposed to ionizing radiation: a retrospective cohort study of Nagasaki atomic bomb survivors
2011-02-00
[14]
논문
Inherited bone marrow failure syndromes
2010-08-00
[15]
논문
Malignant progression of preleukemic disorders
2024-05-00
[16]
논문
What biologic factors predict for transformation to AML?
https://pubmed.ncbi.[...]
2018-12-00
[17]
간행물
Transfusion Iron Overload
http://www.ncbi.nlm.[...]
StatPearls Publishing
2022-02-03
[18]
논문
How I treat mixed-phenotype acute leukemia
[19]
논문
Mitochondrial ferritin expression in erythroid cells from patients with sideroblastic anemia
2003-03-00
[20]
논문
Potential relationship between inadequate response to DNA damage and development of myelodysplastic syndrome
2015-01-00
[21]
논문
Myelodysplastic syndrome: an inability to appropriately respond to damaged DNA?
2013-08-00
[22]
논문
Base excision repair dysfunction in a subgroup of patients with myelodysplastic syndrome
2008-03-00
[23]
논문
5q- and disordered haematopoiesis
1986-11-00
[24]
논문
Distinct haematological disorder with deletion of long arm of no. 5 chromosome
1974-10-00
[25]
논문
Efficacy of lenalidomide in myelodysplastic syndromes
2005-02-00
[26]
논문
The significance of spliceosome mutations in chronic lymphocytic leukemia
2013-07-00
[27]
논문
The driver and passenger effects of isocitrate dehydrogenase 1 and 2 mutations in oncogenesis and survival prolongation
2014-12-00
[28]
논문
Clinical and biological implications of ancestral and non-ancestral IDH1 and IDH2 mutations in myeloid neoplasms
2015-11-00
[29]
논문
GATA factor mutations in hematologic disease
2017-04-00
[30]
논문
Heterogeneity of GATA2-related myeloid neoplasms
2017-08-00
[31]
서적
Transcription factors in blood cell development
2024-00-00
[32]
논문
Transient Abnormal Myelopoiesis and AML in Down Syndrome: an Update
2016-10-00
[33]
논문
Acute leukemias in children with Down syndrome
2012-09-00
[34]
논문
Severe B12 Deficiency Causing a Maturation Defect Mimicking Myelodysplastic Syndrome With Excess Blasts
2024-05-00
[35]
웹사이트
Rudhiram Hematology Clinic - Google Search
https://www.google.c[...]
[36]
논문
Chromosomal lesions and uniparental disomy detected by SNP arrays in MDS, MDS/MPD, and MDS-derived AML
2008-02-01
[37]
논문
Copper deficiency causes reversible myelodysplasia
2007-07-01
[38]
논문
Mimicking Myelodysplastic Syndrome: Importance of Differential Diagnosis
2021-01-01
[39]
논문
International Consensus Classification of Myeloid Neoplasms and Acute Leukemias: integrating morphologic, clinical, and genomic data
2022-09-01
[40]
논문
Diagnosis and classification of myelodysplastic syndromes
2023-12-01
[41]
논문
CHIP, CCUS, and Other Acronyms: Definition, Implications, and Impact on Practice
2019-01-01
[42]
논문
A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low-risk myelodysplasia is associated with improved outcome
2004-07-01
[43]
논문
Molecular International Prognostic Scoring System for Myelodysplastic Syndromes
2022-07-01
[44]
논문
Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study
2009-03-01
[45]
논문
Update of the decitabine experience in higher risk myelodysplastic syndrome and analysis of prognostic factors associated with outcome
2007-01-01
[46]
논문
Decitabine improves patient outcomes in myelodysplastic syndromes: results of a phase III randomized study
2006-04-01
[47]
논문
Results of a randomized study of 3 schedules of low-dose decitabine in higher-risk myelodysplastic syndrome and chronic myelomonocytic leukemia
2007-01-01
[48]
보도자료
FDA Approves New Therapy for Myelodysplastic Syndromes (MDS) That Can Be Taken at Home
https://www.fda.gov/[...]
2020-07-07
[49]
논문
Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion
2006-10-01
[50]
논문
Luspatercept in Patients with Lower-Risk Myelodysplastic Syndromes
2020-01-09
[51]
논문
Clinical decision-making and treatment of myelodysplastic syndromes
2023-12-01
[52]
논문
The impact of intensive antileukaemic treatment strategies on prognosis of myelodysplastic syndrome patients aged less than 61 years according to International Prognostic Scoring System risk groups
2003-10-01
[53]
논문
Prognostic Factors and Clinical Considerations for Iron Chelation Therapy in Myelodysplastic Syndrome Patients
2021-12-01
[54]
논문
Diagnosis and Treatment of Myelodysplastic Syndromes: A Review
2022-09-06
[55]
서적
Harrison's Principles of Internal Medicine
https://archive.org/[...]
McGraw-Hill
[56]
논문
Incidence, characterization and prognostic significance of chromosomal abnormalities in 640 patients with primary myelodysplastic syndromes. Grupo Cooperativo Español de Citogenética Hematológica
2000-02-01
[57]
논문
International scoring system for evaluating prognosis in myelodysplastic syndromes
1997-03-01
[58]
논문
The trajectory of prognostication and risk stratification for patients with myelodysplastic syndromes
2023-12-01
[59]
논문
Epidemiological features of myelodysplastic syndromes: results from regional cancer surveys and hospital-based statistics
2001-06-01
[60]
논문
Preleukemic acute human leukemia
1953-07-01
[61]
논문
Proposals for the classification of the acute leukaemias. French-American-British (FAB) co-operative group
1976-08-01
[62]
웹사이트
Table 1: French-American-British (FAB) Classification of MDS
http://www.cleveland[...]
[63]
뉴스
Saxophonist Brecker dies from MDS
https://variety.com/[...]
2007-01-14
[64]
뉴스
Panama says President Cortizo still in remission from rare blood disorder
https://www.reuters.[...]
2023-12-06
[65]
뉴스
Veteran actor Pat Hingle dies at 84 in NC home
https://www.journaln[...]
2009-01-04
[66]
뉴스
Paul Motian dies at 80; jazz drummer and composer
https://www.latimes.[...]
2011-11-24
[67]
뉴스
Remembering Carl Sagan
http://www.universet[...]
2012-11-09
[68]
뉴스
Illness as More Than Metaphor
https://www.nytimes.[...]
2005-12-04
[69]
서적
WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues
IARC
[70]
논문
Mitochondrial ferritin expression in erythroid cells from patients with sideroblastic anemia
[71]
논문
5q- and disordered haematopoiesis
[72]
논문
Distinct haematological disorder with deletion of long arm of no. 5 chromosome
[73]
논문
Efficacy of lenalidomide in myelodysplastic syndromes
[74]
논문
The significance of spliceosome mutations in chronic lymphocytic leukemia
[75]
논문
The driver and passenger effects of isocitrate dehydrogenase 1 and 2 mutations in oncogenesis and survival prolongation
http://www.sciencedi[...]
2014-12-01
[76]
논문
Clinical and biological implications of ancestral and non-ancestral IDH1 and IDH2 mutations in myeloid neoplasms
http://www.nature.co[...]
[77]
간행물
造血器腫瘍診療ガイドライン
http://www.jshem.or.[...]
日本血液学会
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com