브로민
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
브로민(Bromine)은 원자 번호 35번의 화학 원소로, 짙은 적갈색 액체 상태로 존재하며 염소와 유사한 불쾌한 냄새가 나는 기체를 생성한다. 1825년과 1826년에 각각 칼 야코프 뢰비히와 앙투안 제롬 발라르에 의해 독립적으로 발견되었다. 브로민은 강한 산화제이며, 다양한 금속 및 유기 화합물과 반응한다. 과거에는 사진, 살충제, 휘발유 첨가제, 의약품 등 다양한 용도로 사용되었으나, 환경 및 건강 문제로 인해 사용이 제한되거나 대체되었다. 현재는 방염제, 소독제, 광학 기구 등에 활용되며, 생물학적 역할도 밝혀져 필수 원소로 간주된다. 브로민은 두 종류의 안정 동위 원소를 가지며, 다양한 무기 및 유기 브롬 화합물을 형성한다.
브로민은 1825년 독일의 화학자 카를 뢰비히(Carl Jacob Löwig)와 1826년 프랑스의 화학자 앙투안 발라르(Antoine Jérôme Balard)가 각각 독립적으로 발견했다.[1] 뢰비히는 1825년 그의 고향인 바트 크로이츠나흐(Bad Kreuznach)의 광천수에서 브로민을 분리했다.[82] 그는 염소로 포화된 광물 염 용액을 사용하여 다이에틸 에테르로 브로민을 추출했다. 에테르를 증발시킨 후 갈색 액체가 남았으며, 이 액체를 자신의 연구 샘플로 사용했다. 그러나 연구 결과 발표가 지연되는 동안 발라르가 먼저 연구 결과를 발표했다.
2. 역사

발라르는 몽펠리에(Montpellier)의 염생습지에서 채취한 해조류 재에서 브로민 화합물을 발견했다.[81] 해조류는 아이오딘을 생산하는 데 사용되었지만 브로민도 함유하고 있었다. 발라르는 염소로 포화된 해조류 재 용액에서 브로민을 증류했다. 생성된 물질의 특성은 염소와 아이오딘의 중간이었고, 처음에는 그 물질이 일염화 아이오딘(ICl)이라고 생각했으나, 실험 결과 새로운 원소임을 확신하고 라틴어 단어 muriala("소금물")에서 유래한 "무리드(muride)"라는 이름을 붙였다.[3][2]
이후 프랑스 화학자 루이 니콜라 보클랭(Louis Nicolas Vauquelin), 루이 자크 테나르(Louis Jacques Thénard), 조제프 루이 게이뤼삭(Joseph-Louis Gay-Lussac)이 발라르의 실험을 승인한 후, 프랑스 과학 아카데미(Académie des Sciences) 강연에서 발표하고 ''Annales de Chimie et Physique''에 게재되었다. 발라르는 앙글라다 씨의 제안에 따라 이름을 "무리드(muride)"에서 "브롬(brôme)"으로 변경했다고 밝혔다. "브롬(brôme)"(브롬)이라는 이름은 그리스어 βρῶμοςgrc (, "악취")에서 유래한다.[3][4]
19세기 말에서 20세기 초에는 브롬화칼륨과 브롬화나트륨이 항경련제 및 진정제로 쓰였으나, 브롬 중독 등 독성 문제로 인해 점차 클로랄하이드레이트로, 그 후에는 바르비투르산염으로 대체되었다.[11] 제1차 세계 대전 초기에는 독일군이 러시아군에게 크실릴 브로마이드와 같은 브로민 화합물을 독가스로 사용하였으나, 전투 당시 기온이 낮아 모두 얼어버리는 일이 발생하기도 하였다.[12]
3. 특성

브로민은 플루오린, 염소, 아이오딘과 함께 할로젠 원소에 속하며, 주기율표에서 17족에 위치한다. 염소와 아이오딘의 중간 정도 성질을 가지며, 반응성도 그 중간이다. 전자 배치는 [Ar]4s²3d¹⁰4p⁵이며, 바깥 껍질에 7개의 원자가전자를 가지고 있어 모든 할로젠 원소처럼 옥텟 규칙을 만족하기 위해 전자가 하나 부족하므로 강한 산화제로 작용한다.[13]
상온에서 짙은 적갈색 액체로 존재하며, 쉽게 증발하여 염소와 비슷한 냄새의 주황색 기체가 된다. 물에는 약간 용해되며, 이황화 탄소, 사염화 탄소, 아세트산 등의 유기 용매에는 잘 용해된다. -1에서 +7까지의 다양한 산화수를 가질 수 있으나, 산화 상태가 –1인 것이 가장 안정적이다. 브로민은 대부분의 금속 원소와 아이오딘을 산화시킨다.[79]
55GPa(약 54만 기압) 이상의 압력을 가하면 금속성을 띠며, 75GPa(약 74만 기압)에서 면심 사방정계 구조, 100GPa에서 체심 사방정계 구조를 갖는 단원자 분자 형태로 분해된다.[79]
앙금 생성 반응으로 생성되는 브로민화 은은 연노란색을 띠므로, 브로민 이온(Br-) 검출에 유용하다.[79]
브로민은 강한 산화제이기 때문에 대부분의 유기 화합물과 무기 화합물을 산화시킨다. 운송할 때는 강철 용기에 담아 조심스럽게 취급해야 한다. 브로민 증기 흡입은 눈, 코, 점막 등에 손상을 줄 수 있으며, 노출 시 즉시 맑은 공기를 마셔야 한다. 다량의 브로민 증기는 눈, 코, 기도, 폐에 손상을 주고, 피부 얼룩, 호흡기 및 중추 신경계에 악영향을 줄 수 있으므로 주의해야 한다.[80]
3. 1. 물리적 성질
브로민 분자(Br₂)는 상온에서 액체 상태로 존재하는 유일한 비금속 원소이다.[70][71] 짙은 붉은색을 띠며, 상온에서 쉽게 증발하여 붉은색 기체가 된다. 염소와 같이 강하고 불쾌한 냄새를 풍긴다. 물에는 약간 녹지만, 이황화탄소, 지방족 알코올, 아세트산에는 잘 녹는다. 여러 원소와 쉽게 결합하며 강력한 표백 작용을 한다. 피부에 닿으면 부식을 일으키므로 주의해야 한다.[16]
분자 간 반데르발스 힘 때문에 녹는점(-7.2 °C)과 끓는점(58.8 °C)은 염소와 아이오딘의 중간 정도이다. 할로젠 원소의 분자량이 족을 따라 내려갈수록 증가하므로, 브로민의 밀도, 융해열, 증발열 역시 염소와 아이오딘의 중간값을 가진다. 다만, 이원자 분자 구조로 인해 증발열은 상당히 낮아 높은 휘발성을 보인다.[13] 할로젠 원소의 색은 족을 따라 내려갈수록 짙어진다. 플루오린은 매우 옅은 노란색 기체, 염소는 녹황색, 브로민은 적갈색 액체이며, 아이오딘은 광택이 있는 검은색 고체이다. 이는 할로젠 원소가 흡수하는 가시광선의 파장이 족을 따라 내려갈수록 증가하기 때문이다.[13] 특히, 할로젠 원소의 색은 가장 높이 채워진 반결합 πg 분자 궤도와 가장 낮은 비어있는 반결합 σu 분자 궤도 사이의 전자 전이에 의해 나타난다.[17] 온도가 낮아지면 색이 옅어져, −195 °C에서 고체 브로민은 연한 노란색을 띤다.[13]
고체 브로민은 사방정계 결정계에서 Br₂ 분자가 층을 이루어 배열된 결정 구조를 가진다. Br-Br 거리는 227 pm(기체 상태의 Br-Br 거리 228 pm와 유사)이며, 같은 층에 있는 분자 내 Br···Br 거리는 331 pm, 층 사이의 거리는 399 pm이다(브로민의 반데르발스 반지름은 195 pm). 이러한 구조로 인해 브로민은 전기 전도도가 매우 낮다. 녹는점 부근에서 전기 전도도는 약 5 × 10⁻¹³ Ω⁻¹ cm⁻¹ 정도인데, 이는 염소의 매우 낮은 전기 전도도보다는 높은 수치이다.[13]
55 GPa(대기압의 약 54만 배)에서 브로민은 절연체에서 금속으로 전이된다. 75 GPa에서는 면심 사방정계 구조로, 100 GPa에서는 체심 사방정계 단원자 형태로 바뀐다.[18]
다음 표는 할로젠 원소들의 결합 에너지(kJ/mol)를 나타낸다.[17]
3. 2. 화학적 성질
브로민은 대부분의 금속 원소와 반응하여 브로민화 염을 만든다. 유기 화합물과도 잘 반응하며, 특히 이원자 분자 형태에서 라디칼로 분해되기 쉬운 조건에서 반응성이 높다.[79] 브로민은 염소와 아이오딘 사이의 중간 정도 반응성을 갖는다.[79] 주기적 경향에 따라, 염소와 아이오딘 사이의 전기음성도 중간값을 갖는다 (F: 3.98, Cl: 3.16, Br: 2.96, I: 2.66). 염소보다 반응성이 낮고 아이오딘보다 반응성이 높으며, 염소보다 산화력이 약하고 아이오딘보다 산화력이 강하다. 반대로, 브롬화물 이온은 아이오딘화물 이온보다 환원력이 약하고 염화물 이온보다 환원력이 강하다.[13]
유기 화학에서 브로민은 다른 할로젠 원소와 마찬가지로 탄화수소의 수소를 대체하는 치환 반응을 할 수 있다. 일반적으로 반응하는 탄화수소가 무색이면 치환된 탄화수소 또한 무색을 띠며, 치환된 물질은 밀도와 녹는점이 증가한다. 유기 브로민 화합물은 고온이나 태양광에 노출될 때 쉽게 브로민 원자를 방출하여 라디칼의 화학적 연쇄 반응을 막는 효과가 있어 방염 물질로 사용되기도 한다. 브로민수는 알켄, 페놀, 아닐린 등과 반응하여 적갈색의 브로민수가 무색으로 변하는 탈색 반응을 일으키므로, 이러한 물질의 존재 여부를 확인하는 데 사용된다.[79]
앙금 생성 반응을 통해 생성되는 브로민화 은은 연노란색을 띠므로, 브로민 이온(Br-) 검출에 유용하다.[79]
4. 동위 원소
브로민은 ⁷⁹Br(50.69%)과 ⁸¹Br(49.31%) 두 가지 안정 동위 원소로 이루어져 있다.[13] 두 동위 원소 모두 핵 스핀이 3/2-이므로 핵자기공명에 사용될 수 있지만, ⁸¹Br이 더 유리하다.[13] 자연 상태에서 두 동위 원소의 비율이 거의 1:1로 나타나는 것은 질량 분석법을 통해 브로민을 포함하는 화합물을 식별하는 데 유용하다.[13]
이 외에도 원자량 67에서 98 사이에 23종류의 방사성 동위 원소가 알려져 있다.[13] 이들은 모두 반감기가 짧아 자연계에는 존재하지 않는다.[13] 이들 중 가장 중요한 동위 원소와 반감기는 다음과 같다.
- ⁷⁷Br (57.04 시간)
- ⁸⁰Br (17.7 분)
- ⁸⁰ᵐBr (4.421 시간)
- ⁸²Br (35.28 시간)
⁷⁹Br보다 가벼운 동위 원소는 주로 전자 포획을 통해 셀레늄 동위 원소로 붕괴하며, ⁸¹Br보다 무거운 동위 원소는 주로 베타 붕괴를 통해 크립톤 동위 원소로 붕괴한다.[19] ⁸⁰Br은 안정한 ⁸⁰Se 또는 ⁸⁰Kr로 붕괴할 수 있다.[19] ⁷⁷Br은 반감기가 2.376일로 비교적 긴 편이다.[13] ⁸⁷Br과 그보다 무거운 Br 동위 원소는 중성자 방출을 동반하는 베타 붕괴를 하며, 핵분열 생성물이기 때문에 실용적으로 중요하다.[19]
5. 존재
브로민은 자연에서 이원자 분자 형태(Br2)나 유기 브로민 화합물로는 거의 존재하지 않고 지각의 암석 속에 브롬화 염 형태로 널리 존재한다. 바다로 흘러드는 물이 이러한 화합물을 끊임없이 운반하기 때문에 해수 속에는 약 65ppm 정도의 브로민이 용해되어 있다.[35] 브로민은 바닷물에서 열 번째로 풍부한 원소이다.[39] 지각 속에는 약 0.4ppm 정도의 농도로 들어 있으며, 62번째로 많은 원소이다. 토양에는 지역에 따라 5~40ppm까지 다양하지만 일부 화산 지역에서는 500ppm가량 함유되어 있기도 하다. 대기 중에는 극미량 들어있다.
주요 생산 지역은 미국의 아칸소주, 중국의 산둥성, 이스라엘과 요르단에 걸쳐 있는 사해 등이다.[35][36][37][38]
브롬 생산의 주요 공급원은 이스라엘과 요르단이다.[40]
공업적으로는 브롬화 이온을 포함하는 수용액을 산성 조건 하에서 염소를 불어넣어 산화된 브롬 단체를 증류 정제한다. 일본에서는 해수에 염소를 불어넣어 브롬을 유리시키는 해수법과 간수에 포함된 MgBr₂에 염소를 불어넣어 브롬을 유리시키는 간수법으로 생산되며, 2007년 생산량은 26,000톤(추정)이다.[72]
미국 지질조사국의 2005년판 통계[73]에 따르면, 전 세계 브롬 생산량은 약 590,000톤이다. 그 내역은 1위 미국이 222,000톤, 2위 이스라엘이 206,000톤이며, 이 두 국가가 세계 생산량의 8할을 차지한다.
6. 용도
브로민은 다양한 산업 분야에서 유용하게 사용되지만, 환경 문제로 인해 일부 용도는 제한되거나 대체되고 있다.
다른 탄소-할로겐 결합과 마찬가지로 C-Br 결합은 유기화학의 핵심적인 작용기이다. 브로민(2.96)과 탄소(2.55)의 전기 음성도 차이로 인해 C-Br 결합에서 탄소 원자는 친전자성을 띤다. 유기브롬 화합물의 반응성은 유기염소 화합물과 유기요오드 화합물의 반응성 중간 정도이다.[32] 유기브롬화물은 일반적으로 다른 유기 전구체의 첨가 또는 치환 브롬화에 의해 생성된다. 브롬 자체를 사용할 수 있지만, 그 독성과 휘발성으로 인해 N-브로모숙신이미드와 같은 더 안전한 브롬화 시약이 일반적으로 사용된다.[32]
upright=1.8
알켄에 브롬 수용액을 첨가하면 브롬히드린을 형성하며, 이 과정에서 수용액의 갈색이 무색으로 변한다. 이 반응은 할로겐 첨가 반응의 한 예시이다.[34]
바닷물에서 브롬화물의 농도가 염화물의 0.3%에 불과함에도 불구하고 유기브롬화물은 자연계에서 가장 흔한 유기할로겐화물인데, 이는 브롬화물의 쉬운 산화 때문이다. 브롬퍼옥시다제 효소가 이 반응을 촉매한다.[33] 해양은 매년 100만~200만 톤의 브롬포름과 56,000톤의 브롬메탄을 방출하는 것으로 추산된다.[59]
과거에는 무연 휘발유 첨가제인 디브로모에탄, 소화에 사용하는 CBrClF₂, CBrF₃ 등의 할론 등이 주요 용도로 사용되었다. 그러나, 모두 환경에 미치는 영향이 크다고 여겨져 생산·소비량은 감소하고 있다.
사진의 감광재로 브롬 화합물인 브롬화은이 사용되었다. 인화지를 영어로는 bromide paper라고 부르는데, 이것이 브로마이드의 어원이 되었다.
고온에서 다양한 무기물·유기물을 포함하는 온천수의 소독에는 염소제만으로는 불충분한 경우가 있어, BCDMH(브로모클로로디메틸히단토인)를 주성분으로 하는 염소브롬제가 사용된다.[75]
6. 1. 방염제
브롬계 난연제는 중요성이 커지고 있으며, 브롬의 가장 큰 상업적 용도이다. 브롬화 물질이 연소될 때, 난연제는 브롬화수소산을 생성하는데, 이는 불의 산화 반응의 라디칼 연쇄 반응을 방해한다. 그 작용 메커니즘은, 매우 반응성이 높은 수소 라디칼, 산소 라디칼 및 하이드록실 라디칼이 브롬화수소산과 반응하여 반응성이 낮은 브롬 라디칼(즉, 자유 브롬 원자)을 형성하는 것이다. 브롬 원자는 다른 라디칼과 직접 반응하여 연소를 특징짓는 자유 라디칼 연쇄 반응을 종결하는 데에도 기여할 수 있다.[44][45]브롬화 중합체 및 플라스틱을 제조하기 위해, 브롬 함유 화합물을 중합 과정 동안 중합체에 혼입시킬 수 있다. 한 가지 방법은 중합 과정 중에 상대적으로 소량의 브롬화 단량체를 포함시키는 것이다. 예를 들어, 브롬화비닐을 폴리에틸렌, 폴리염화비닐 또는 폴리프로필렌 생산에 사용할 수 있다. 중합 과정에 참여하는 특정한 고브롬화 분자를 첨가할 수도 있다. 예를 들어, 테트라브로모비스페놀 A를 폴리에스터 또는 에폭시 수지에 첨가할 수 있는데, 이 경우 중합체의 일부가 된다. 인쇄 회로 기판에 사용되는 에폭시는 일반적으로 이러한 난연성 수지로 만들어지며, 제품 약어 (FR-4 및 FR-2)의 FR로 표시된다. 경우에 따라 브롬 함유 화합물을 중합 후에 첨가할 수도 있다. 예를 들어, 데카브로모디페닐 에테르를 최종 중합체에 첨가할 수 있다.[46]

여러 가지 기체 또는 휘발성이 높은 브롬화 할로메탄 화합물은 무독성이며 동일한 메커니즘으로 우수한 소화제 역할을 하며, 잠수함, 비행기, 우주선과 같은 밀폐된 공간에서 특히 효과적이다. 그러나 이들은 비싸며, 오존층 파괴 물질로서의 영향으로 인해 생산 및 사용이 크게 줄었다. 이들은 더 이상 일반적인 소화기에 사용되지 않지만, 항공 우주 및 군사 자동 소화 응용 분야에서 틈새 시장을 유지하고 있다. 여기에는 브롬클로로메탄(Halon 1011, CH₂BrCl), 브롬클로로디플루오로메탄(Halon 1211, CBrClF₂), 및 브롬트리플루오로메탄(Halon 1301, CBrF₃)이 포함된다.[47]
6. 2. 살충제
브로민화 메틸과 브로민화 에틸렌은 독성이 강해 가정용 및 야외용 살충제로 사용되었다. 그러나 오존층 파괴에 영향을 줄 수 있다는 사실이 알려지면서, 2005년까지 오존층 파괴 물질을 없애기로 한 몬트리올 의정서에 따라 더 이상 사용되지 않는다. 몬트리올 의정서가 채택된 1991년 이전까지 35,000톤 이상의 브로민 계통 살충제가 사용된 것으로 추정된다.[26]6. 3. 휘발유 첨가물
브로민화 에틸렌은 자동차 엔진의 노킹 현상을 방지하기 위해 테트라에틸 납을 첨가한 휘발유에 첨가물로 사용되었다. 그러나 1970년대 이후 환경오염 문제 때문에 더 이상 사용하지 않는다.[23]6. 4. 의료용
브롬화칼륨과 브롬화나트륨은 19세기와 20세기 초반에 진정제와 항경련제로 사용되었다. 그러나 이러한 브롬 화합물을 장기간 복용하면 브롬 중독을 일으킬 수 있고 중추 신경계와 피부에 악영향을 줄 수 있어 현재는 거의 사용되지 않는다.[80] 일부 국가에서는 단순 브롬화 염이 항경련제로 이용되기도 한다.19세기에는 브롬화칼륨 등의 브롬화물이 흥분성 정신병 치료제, 진정제, 성욕 억제제로 사용되었으나, 장기간 사용 시 체내 브롬 축적으로 인한 브롬 중독 등 독성 문제로 현재는 거의 사용되지 않는다.
6. 5. 기타 용도
- 굴절률이 높은 브롬 화합물은 광학 기구에 사용되기도 한다.[79]
- 염소와 함께 물의 소독 및 정화에 사용된다. BCDMH(브로모클로로디메틸히단토인)를 주성분으로 하는 염소브롬제가 사용되는데,[75] 해외에서는 "Bromine Tablets"이라는 일반명으로 시판되고 있다.
- 과거 사진 촬영에 화합물 형태로 사용되었다. 사진의 감광재로서, 브롬의 화합물 브롬화은이 사용되었다.[79] 인화지를 영어로는 bromide paper라고 부르는데, 이것은 브로마이드의 어원이 되었다.
- 자주빛갯고둥(''Bolinus brandaris'', 구 학명: ''Murex brandaris'')이 분비하는 무색 액체가 공기 중에서 산화되면, 보라색(제국 자주색) 성분인 6,6'-디브로모인디고가 얻어진다.[47] 이 고둥은 레바논 연안 티루스에서 서식했기 때문에, 이 염료는 티리안 퍼플(Tyrian purple)이라고도 불렸다. 19세기에 아닐린 염료(마젠타 등)가 개발될 때까지, 가장 우수한 보라색 염료로 사용되었다.
7. 생물학적 역할 및 독성
2014년 연구에 따르면, 브로민(브롬 이온 형태)은 IV형 콜라겐 생합성에 필요한 보조인자로, 동물의 기저막 구조와 조직 발달에 필수적인 원소이다.[70][71] 호산구 퍼옥시다제는 브롬 이온을 이용하여 기생충 및 세균을 죽이는 할로퍼옥시다제의 일종이다. 해양 생물은 유기브롬 화합물의 주요 공급원이며, 특히 조류는 많은 양의 브롬화메틸(CH₃Br)을 생산한다.
브롬 이온 자체는 독성이 강하지 않지만, 고농도에 노출되면 브롬 중독을 일으킬 수 있다. 원소 브롬(Br₂)은 독성이 강하며, 피부에 닿으면 화학적 화상을 유발하고, 흡입 시 호흡기를 자극한다.[80] 미국 직업안전보건청(OSHA)은 브롬의 허용 노출 한계를 0.1ppm으로 설정했다.
8. 화합물
브로민은 다양한 무기 화합물과 유기 화합물을 형성한다.
무기 화합물 중 가장 간단한 것은 브롬화수소(HBr)이며, 주로 무기 브롬화물 및 알킬브롬화물 생산과 유기화학 반응의 촉매로 사용된다. 브롬화수소산은 브롬화수소의 수용액으로 강산이다.
유기 브롬 화합물은 탄화수소의 수소를 브로민으로 치환하여 얻을 수 있으며, 브롬계 난연제와 같이 화재를 예방하는 데 사용되기도 한다. 브롬수는 알켄, 페놀 등의 물질을 확인하는 데 사용되는 시약이다.
브로민의 옥소산에는 하이포브롬산(HBrO), 브롬산(HBrO₃), 과브롬산(HBrO₄) 등이 있다.
8. 1. 무기 브롬 화합물
브롬화수소(HBr)는 브로민의 가장 간단한 화합물로, 주로 무기 브롬화물 및 알킬브롬화물 생산에 사용되며 유기화학 반응의 촉매로도 쓰인다. 산업적으로는 백금 촉매를 사용하여 200~400 °C에서 수소 기체와 브롬 기체를 반응시켜 생산한다. 실험실에서는 브롬을 적린으로 환원시켜 브롬화수소를 만들기도 한다.[20]: 2 P + 6 H₂O + 3 Br₂ → 6 HBr + 2 H₃PO₃
: H₃PO₃ + H₂O + Br₂ → 2 HBr + H₃PO₄
상온에서 브롬화수소는 무색 기체이며, 저온의 고체 결정 상태에서는 약한 수소 결합이 존재한다.[20] 브롬화수소의 수용액은 브롬화수소산으로 알려져 있으며 강산(pKa = −9)이다.[21]
플루오르화수소와 달리 무수 액체 브롬화수소는 낮은 비점, 작은 액체 상태 범위, 낮은 유전상수를 가지며, 용매로 사용하기 어렵다.[21]

주기율표 상의 거의 모든 원소는 이원화 브롬화물을 형성한다. 예외는 극히 드물다.[22]
Br₂를 사용한 금속의 브롬화는 염소화보다 낮은 산화 상태를 생성하는 경향이 있다. 브롬화물은 원소, 산화물, 수산화물, 탄산염을 브롬화수소산과 반응시킨 후 탈수시켜 만들 수 있다. 다른 방법으로는 고온에서 원소의 산화적 브롬화, 금속 산화물 또는 다른 할로겐화물의 브롬화 등이 있다.[22]
낮은 산화 상태(+1 ~ +3)의 금속을 포함하는 대부분의 금속 브롬화물은 이온성이다. 비금속은 공유 분자 브롬화물을 형성하는 경향이 있다. 브롬화은은 물에 잘 녹지 않아 브롬의 정성 분석 시험에 사용된다.[22]
- Potassium bromide|브롬화칼륨영어(KBr)
- Silver bromide|브롬화은영어(AgBr) - 사진의 감광 재료
- Hydrogen bromide|브롬화수소영어(HBr)
- Magnesium bromide|브롬화마그네슘영어(MgBr₂
8. 2. 유기 브롬 화합물
유기 브롬 화합물은 다른 할로젠 원소와 마찬가지로 탄화수소의 수소를 대체할 수 있다(치환 반응). 일반적으로 반응하는 탄화수소가 무색이면 치환된 탄화수소 또한 무색을 띠며 치환된 물질은 밀도와 녹는점이 증가한다. 유기 브롬 화합물은 고온이나 태양광이 있을 때 쉽게 브롬 원자를 내놓아 라디칼의 화학적 연쇄 반응을 막는 효과가 있으므로 방염 물질로 사용되기도 한다. 브롬수는 알켄, 페놀, 아닐린 등의 물질과 반응하면 적갈색의 브롬수가 무색이 되는 탈색 반응을 일으키므로 그러한 물질의 존재 여부를 판단하는 시약으로 사용된다.[80]브롬계 난연제는 중요성이 증가하는 상품이며, 브롬의 가장 큰 상업적 용도를 차지한다. 브롬화 물질이 연소될 때, 난연제는 브롬화수소산을 생성하는데, 이는 불의 산화 반응의 라디칼 연쇄 반응을 방해한다. 그 작용 메커니즘은, 매우 반응성이 높은 수소 라디칼, 산소 라디칼 및 하이드록실 라디칼이 브롬화수소산과 반응하여 반응성이 낮은 브롬 라디칼(즉, 자유 브롬 원자)을 형성하는 것이다. 브롬 원자는 다른 라디칼과 직접 반응하여 연소를 특징짓는 자유 라디칼 연쇄 반응을 종결하는 데에도 기여할 수 있다.[44][45]
브롬화 중합체 및 플라스틱을 제조하기 위해, 브롬 함유 화합물을 중합 과정 동안 중합체에 혼입시킬 수 있다. 한 가지 방법은 중합 과정 중에 상대적으로 소량의 브롬화 단량체를 포함시키는 것이다. 예를 들어, 브롬화비닐을 폴리에틸렌, 폴리염화비닐 또는 폴리프로필렌 생산에 사용할 수 있다. 중합 과정에 참여하는 특정한 고브롬화 분자를 첨가할 수도 있다. 예를 들어, 테트라브로모비스페놀 A를 폴리에스터 또는 에폭시 수지에 첨가할 수 있는데, 이 경우 중합체의 일부가 된다. 인쇄 회로 기판에 사용되는 에폭시는 일반적으로 이러한 난연성 수지로 만들어지며, 제품 약어(FR-4 및 FR-2)의 FR로 표시된다. 경우에 따라 브롬 함유 화합물을 중합 후에 첨가할 수도 있다. 예를 들어, 데카브로모디페닐 에테르를 최종 중합체에 첨가할 수 있다.[46]
여러 가지 기체 또는 휘발성이 높은 브롬화 할로메탄 화합물은 무독성이며 동일한 메커니즘으로 우수한 소화제 역할을 하며, 잠수함, 비행기 및 우주선과 같은 밀폐된 공간에서 특히 효과적이다. 그러나 이들은 비싸며, 오존층 파괴 물질로서의 영향으로 인해 생산 및 사용이 크게 줄었다. 이들은 더 이상 일반적인 소화기에 사용되지 않지만, 항공 우주 및 군사 자동 소화 응용 분야에서 틈새 시장을 유지하고 있다. 여기에는 브롬클로로메탄(Halon 1011, CH₂BrCl), 브롬클로로디플루오로메탄(Halon 1211, CBrClF₂), 및 브롬트리플루오로메탄(Halon 1301, CBrF₃)이 포함된다.[47]
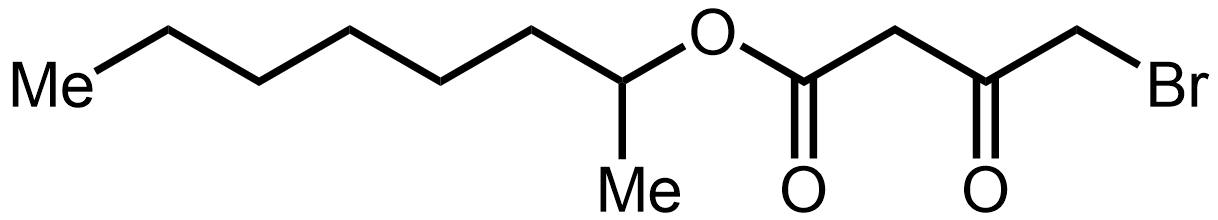
α-할로에스터는 일반적으로 유기 합성에서 매우 반응성이 높고 따라서 독성이 있는 중간체로 간주된다. 그럼에도 불구하고 인간, 고양이 및 쥐를 포함한 포유류는 α-브로모에스터인 2-옥틸 4-브로모-3-옥소부타노에이트의 미량을 생합성하는 것으로 보이며, 이는 뇌척수액에서 발견되며 REM 수면 유도에서 아직 명확하지 않은 역할을 하는 것으로 보입니다.[59]
해양 생물은 유기브롬 화합물의 주요 공급원이며, 브롬이 더 확실하게 필수적인 것으로 나타나는 것은 바로 이러한 생물체이다. 1999년까지 1600종 이상의 이러한 유기브롬 화합물이 확인되었다. 가장 풍부한 것은 브롬화메틸(CHBr)이며, 매년 해양 조류가 약 56,000톤을 생산하는 것으로 추정된다.[59] 하와이 조류 ''Asparagopsis taxiformis''의 정유는 80%가 브로모포름으로 구성되어 있다.[60] 해양의 이러한 유기브롬 화합물 대부분은 독
8. 3. 브롬의 옥소산
하이포브롬산(HBrO)은 불안정한 화합물로, 주로 하이포브롬산염 형태로 존재한다. 브롬산(HBrO₃)은 강산이며, 브롬산염은 위험물 제1류로 분류된다. 과브롬산(HBrO₄)은 매우 강한 산화제이다.[20][21]브롬의 옥소산과 그 염은 아래 표와 같다.
참조
[1]
논문
The discovery of the elements: XVII. The halogen family
1932
[2]
문서
muria
[3]
문서
bromine
[4]
문서
βρῶμος
[5]
서적
Greenwood and Earnshaw
[6]
웹사이트
Bromine
https://www.vanderkr[...]
vanderkrogt.net
[7]
서적
The Daguerreotype: Nineteenth-century Technology and Modern Science
JHU Press
2000
[8]
웹사이트
Hospital Gangrene - Erysipelas. Bromine (Bromum) Treatment
https://chestofbooks[...]
[9]
웹사이트
Hospital Gangrene in the Civil War
https://www.civilwar[...]
2023-07-19
[10]
논문
Treatment of War Wounds: A Historical Review
2009
[11]
서적
A History of Psychiatry: From the Era of the Asylum to the Age of Prozac
John Wiley and Sons
1997
[12]
서적
Medical Aspects of Chemical Warfare
Borden Institute
2016-11-20
[13]
서적
Greenwood and Earnshaw
[14]
웹사이트
Johann Wolfgang Dobereiner
https://chemed.chem.[...]
Purdue University
2008-03-08
[15]
웹사이트
A Historic Overview: Mendeleev and the Periodic Table
https://genesismissi[...]
NASA
2008-03-08
[16]
서적
Greenwood and Earnshaw
[17]
서적
Greenwood and Earnshaw
[18]
논문
Ab initio studies of solid bromine under high pressure
2007-09-26
[19]
논문
The NUBASE evaluation of nuclear and decay properties
https://hal.archives[...]
[20]
서적
Greenwood and Earnshaw
[21]
서적
Greenwood and Earnshaw
[22]
서적
Greenwood and Earnshaw
[23]
서적
Greenwood and Earnshaw
[24]
서적
Greenwood and Earnshaw
[25]
서적
Greenwood and Earnshaw
[26]
서적
Greenwood and Earnshaw
[27]
서적
Handbook of Inorganic Compounds
https://books.google[...]
CRC Press
2015-08-25
[28]
서적
Greenwood and Earnshaw
[29]
서적
Greenwood and Earnshaw
[30]
서적
Greenwood and Earnshaw
[31]
서적
Greenwood and Earnshaw
[32]
서적
Bromine, Organic Compounds
John Wiley & Sons
[33]
논문
Vanadium Bromoperoxidase-Catalyzed Biosynthesis of Halogenated Marine Natural Products
[34]
서적
Organic Chemistry
Oxford University Press
2012
[35]
서적
Greenwood and Earnshaw
[36]
논문
Minerals From Sea Salt
1964
[37]
논문
Climatotherapy at the Dead Sea in Jordan
1996
[38]
논문
The water balance of the Dead Sea: an integrated approach
2008
[39]
웹사이트
Get the Facts About the Element Bromine
https://www.thoughtc[...]
2024-08-10
[40]
웹사이트
Major countries in worldwide bromine production from 2018 to 2022
https://www.statista[...]
Statista
2023-04-26
[41]
웹사이트
Process operations at Octel Amlwch
https://www.octelaml[...]
2021-07-27
[42]
서적
Greenwood and Earnshaw
[43]
서적
Bromine: in Ullmann's Encyclopedia of Chemical Technology
Wiley-VCH Verlag
2002
[44]
논문
Mechanisms for Flame Retardancy and Smoke suppression – A Review
1996
[45]
논문
Fire retardant mechanism of aliphatic bromine compounds in polystyrene and polypropylene
2002
[46]
논문
A Review of Current Flame Retardant Systems for Epoxy Resins
2004
[47]
서적
Fluorine Compounds, Organic
Wiley-VCH
2002
[48]
논문
An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release
2003
[49]
웹사이트
Alternatives to Methyl Bromide for the Control of Soil-Borne Diseases and Pests in California
https://web.archive.[...]
Pest Management Analysis and Planning Program
2008-11-17
[50]
논문
Economics of the "Critical Use" of Methyl bromide under the Montreal Protocol
2008
[51]
서적
The Great American fraud
https://archive.org/[...]
Press of the American Medical Association
1905
[52]
웹사이트
Choose the Right Cooling Tower Chemicals
https://www.power-en[...]
Power Engineering
1998-01-07
[53]
논문
A Comparative Study Of Chlorine And Bromine For Swimming Pool Disinfection
https://www.jstor.or[...]
1948
[54]
서적
Pool Care For Dummies
John Wiley and Sons
2023
[55]
논문
Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture
2014
[56]
서적
Clinical Nutrition of the Essential Trace Elements and Minerals
[57]
논문
Eosinophils preferentially use bromide to generate halogenating agents
1989
[58]
논문
Production of brominating intermediates by myeloperoxidase.
2001
[59]
논문
The diversity of naturally occurring organobromine compounds
1999
[60]
논문
Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta)
1976
[61]
논문
The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products
2004
[62]
서적
Poisoning & drug overdose
https://books.google[...]
Appleton & Lange
2016-11-05
[63]
서적
The American Psychiatric Publishing Textbook of Substance Abuse Treatment
https://books.google[...]
American Psychiatric Publishing Inc
2016-11-05
[64]
웹사이트
Bromine 207888
https://www.sigmaald[...]
Sigma-Aldrich
2021-12-21
[65]
웹사이트
Msds – 207888
https://www.sigmaald[...]
Sigma Aldrich
2018-10-03
[66]
웹사이트
Material Safety Data Sheet: Bromine MSDS
https://web.archive.[...]
2016-10-27
[67]
문서
PGCH
[68]
웹사이트
40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities
https://web.archive.[...]
Government Printing Office
2011-10-29
[69]
서적
Magnetic susceptibility of the elements and inorganic compounds
http://www-d0.fnal.g[...]
CRC press
[70]
웹사이트
VU investigators confirm bromine's critical role in tissue development
http://news.vanderbi[...]
Vanderbilt University
2014-06-25
[71]
간행물
精留塔
http://www.kagakukog[...]
化学工業日報社
2014-06-25
[72]
서적
15509の化学商品
化学工業日報社
2009-02
[73]
웹사이트
Mineral Commodity Summaries
http://minerals.usgs[...]
[74]
웹사이트
Commodity Trade Statistics Database
http://unstats.un.or[...]
[75]
간행물
浴場施設のレジオネラ対策指針
http://www.shasej.or[...]
社団法人空気調和・衛生工学会
[76]
서적
Magnetic susceptibility of the elements and inorganic compounds
http://www-d0.fnal.g[...]
CRC press
[77]
웹인용
Commodity Report 2007: Bromine
http://minerals.usgs[...]
United States Geological Survey
2008-09-03
[78]
웹인용
Acute Exposure Guideline Levels for Selected Airborne Chemicals, Volume 9
http://www.epa.gov/o[...]
2013-01-17
[79]
논문
Ab initio studies of solid bromine under high pressure
2007-09-26
[80]
웹인용
Occupational Safety & Health Administration :Bromine
https://www.osha.gov[...]
2014-07-24
[81]
논문
Mémoire sur une substance particulière contenue dans l'eau de la mer
http://books.google.[...]
[82]
서적
Das Brom und seine chemischen Verhältnisse
http://books.google.[...]
Carl Winter
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
