나이트릴
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
나이트릴은 시아노기 또는 니트릴기로 불리는 −C≡N 작용기를 갖는 유기 화합물로, 선형 구조와 높은 극성을 특징으로 한다. IUPAC 명명법에 따라 명명되며, 1782년 시안화 수소 합성을 시작으로 다양한 합성법이 개발되었다. 산업적으로는 암모산화와 하이드로시아노화 반응을 통해 생산되며, 실험실에서는 다양한 유기 반응을 통해 합성할 수 있다. 나이트릴은 가수분해, 환원, 친핵성 첨가 반응 등 다양한 반응을 보이며, 의약품, 용매, 고분자 등 다양한 분야에서 활용된다. 또한, 자연계에서도 발견되며, 일부 식물에서는 시안 배당체의 형태로 존재하여 독성을 나타내기도 한다.
더 읽어볼만한 페이지
- 나이트릴 - 에스시탈로프람
에스시탈로프람은 주요 우울 장애, 불안 장애 등 정신 질환 치료에 사용되는 항우울제이며, 세로토닌 재흡수 억제 기전을 통해 효과를 나타내고, 렉사프로라는 상품명으로 판매된다. - 나이트릴 - CS 가스
CS 가스는 군중 통제용 최루 가스로, 피부와 눈의 습기와 반응하여 작열감, 눈물, 기침 등을 유발하며 화학 무기 금지 조약에 의해 전쟁에서의 사용은 금지되었으나 일부 국가에서 사용되고 독성 및 윤리적 논란이 있다. - 작용기 - 황화물
황화물은 황이 다른 원소와 결합한 화합물로, 금속 황화물, 황화광물, 유기 황화물 등 다양한 형태로 존재하며 반도체 특성, 안료, 촉매 등으로 활용되지만 부식성과 유해성을 지니기도 한다. - 작용기 - 에스터
에스터는 옥소산의 수산화기에서 수소 원자가 유기 원자단으로 치환된 화합물로, 카복실산 에스터가 대표적이며, 자연계에 널리 분포하고 향료 및 향수 산업에 사용되며 폴리에스터와 같은 중합체에서도 발견된다.
2. 구조 및 기본 성질
나이트릴(R-C≡N)은 탄소와 질소 원자 사이에 삼중 결합을 갖는 것이 특징이다.[3] N-C-C 기하구조는 선형이며, C-N 거리는 1.16 Å으로 짧다. 액체 상태에서 나이트릴은 높은 쌍극자 모멘트를 가지고, 30 이상으로 높은 상대 유전율을 갖는다.
2. 1. 구조
N−C−C 기하구조는 니트릴에서 선형이며, 삼중 결합된 탄소의 sp 혼성화를 반영한다. C−N 거리는 1.16 Å로 짧으며, 이는 삼중 결합과 일치한다.[3] 니트릴은 높은 쌍극자 모멘트에서 알 수 있듯이 극성이다. 액체 상태에서 니트릴은 30 이상으로 높은 상대 유전율을 갖는다.니트릴이 갖는 −C≡N으로 표시되는 1가의 작용기는 '''시아노기''' 또는 '''니트릴기'''라고 불린다. 탄소는 sp 혼성을 가지며, 직선형 분자 구조를 갖는다. 시아노기는 강한 전자 끌개이다.
2. 2. 극성 및 유전율
나이트릴에서 N−C−C 기하구조는 선형이며, 삼중 결합된 탄소의 sp 혼성화를 반영한다. C−N 거리는 1.16 Å로 짧으며, 이는 삼중 결합과 일치한다.[3] 나이트릴은 높은 쌍극자 모멘트에서 알 수 있듯이 극성 분자이다. 액체 상태에서 나이트릴은 30 이상으로 높은 상대 유전율을 갖는다.3. 명명법
IUPAC 명명법에서는 탄소 수가 같은 알칸의 어미에 '-니트릴'(-nitrile)을 붙여 명명한다. 또는, 모체가 되는 카르복실산의 어미(-oic acid 또는 -ic acid)를 -onitrile로 바꾼다. 접두사로 '시아노-'(cyano-)를 사용하기도 한다.
4. 역사
폼산의 니트릴인 니트릴 계열 화합물의 첫 번째 화합물인 시안화 수소는 1782년 칼 빌헬름 셸레에 의해 처음 합성되었다.[4][5] 1811년 조제프 루이 게이뤼삭은 매우 독성이 강하고 휘발성이 강한 순수한 산을 제조할 수 있었다.[6]
1832년경 벤조산의 니트릴인 벤조니트릴이 프리드리히 뵐러와 유스투스 폰 리비히에 의해 제조되었지만, 합성 수율이 매우 낮아 물리적 또는 화학적 특성이 결정되지 않았고 구조도 제시되지 않았다. 1834년 테오필-쥘 펠루즈는 프로피오니트릴을 합성하여 프로피온 알코올과 시안산의 에테르라고 제안했다.[7] 1844년 헤르만 폰 펠링이 벤조산을 가열하여 벤조니트릴을 합성한 것은 화학 연구에 충분한 양의 물질을 얻는 최초의 방법이었다. 펠링은 자신의 결과를 암모늄 폼산염을 가열하여 시안화 수소를 합성하는 이미 알려진 방법과 비교하여 구조를 결정했다. 그는 새롭게 발견된 물질에 "니트릴"이라는 이름을 붙였고, 이 이름이 이 화합물 그룹의 이름이 되었다.[8]
5. 합성
나이트릴은 다양한 방법으로 합성될 수 있다.
할로젠화 알킬과 시안화 칼륨을 반응시키거나, 토실산 에스터와 같은 설폰산 에스터를 기질로 사용하여 나이트릴을 합성할 수 있다. 할로젠화 아릴을 시아노화할 때는 시안화 구리를 첨가하고 가열한다 (로젠문트-폰 브라운 반응).[48]
:
:(X=Cl,Br,I,OS(=O)R,etc.)
알데하이드나 케톤 등의 카르보닐 화합물에 시안화 칼륨이나 시안화 수소를 첨가하면 시아노하이드린이 생성된다.
:
슈트레커 반응은 알데하이드에서 이민을 생성하고 시안화물 이온을 부가하는 반응이 핵심 단계이다. 이렇게 얻어진 α-아미노나이트릴을 가수분해하면 α-아미노산이 된다.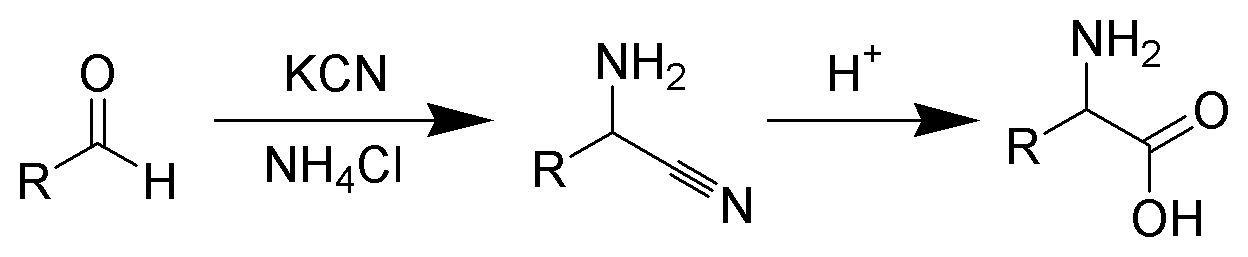
알독심(R−CH=NOH)이나 카바모일기(R−CONH2)에 트라이포스젠, 오염화 인 등의 탈수제를 사용해도 나이트릴을 얻을 수 있다.
2016년 이화학연구소는 4개의 타이타늄을 포함하는 타이타늄 화합물로부터 특수 시약 없이 질소 분자를 절단하고, 절단된 질소종과 쉽게 구할 수 있는 산 염화물로부터 함질소 유기 화합물인 나이트릴을 직접 합성하는 방법을 발표했다.[48]
5. 1. 산업적 합성
암모산화는 탄화수소를 암모니아와 함께 부분적으로 산화시켜 나이트릴을 생성하는 방법이다. 이 반응은 아크릴로나이트릴 합성에 대규모로 적용된다.[9]:CH3CH=CH2 + 3/2 O2 + NH3 → N≡CCH=CH2 + 3 H2O영어
아크릴로나이트릴 생산 과정에서 아세토나이트릴이 부산물로 생성된다. 벤조나이트릴, 프탈로나이트릴, 이소부티로나이트릴 등 다양한 유도체도 산업적으로 암모산화 방법을 통해 제조된다. 이 반응은 금속 산화물 촉매를 사용하며, 이민을 거쳐 진행되는 것으로 알려져 있다.
하이드로사이안화는 사이안화 수소와 알켄을 반응시켜 나이트릴을 생성하는 방법이다. 이 반응에는 균일 촉매가 필요하다. 아디포나이트릴은 1,3-뷰타다이엔에 사이안화 수소를 첨가하는 하이드로사이안화 반응을 통해 생산되며, 이는 나일론 6,6의 전구체이다.
:CH2=CH-CH=CH2 + 2 HC≡N → NC(CH2)4C≡N영어
산업적으로 나이트릴을 생산하는 주요 방법은 암모산화와 하이드로사이안화이며, 두 방법 모두 당량의 염을 생성하지 않아 친환경적이다.[9]
5. 2. 실험실적 합성
콜베 니트릴 합성에서 알킬 할라이드는 알칼리 금속 시안화물과 친핵성 지방족 치환 반응을 거친다. 아릴 니트릴은 로젠문트-폰 브라운 합성으로 제조된다.[5]일반적으로 금속 시안화물은 알킬 할라이드와 결합하여 니트릴과 아이소니트릴의 혼합물을 생성하지만, 적절한 반대 이온 및 온도 선택을 통해 후자를 최소화할 수 있다. 알킬 설페이트는 특히 비수성 조건에서 이 문제를 완전히 해결한다(펠루즈 합성).
시아노하이드린은 특별한 종류의 니트릴이다. 전통적으로 이들은 시아노하이드린 반응에서 알칼리 금속 시안화물을 알데히드에 첨가하여 생성된다. 유기 카르보닐의 극성으로 인해, 이 반응은 알켄의 하이드로시아네이션과는 달리 촉매가 필요하지 않다. O-실릴 시아노하이드린은 촉매 존재 하에 트리메틸실릴 시안화물을 첨가하여 생성된다(실릴시아네이션). 시아노하이드린은 또한 예를 들어 HCN의 공급원으로서 아세톤 시아노하이드린으로 시작하는 트랜스시아노하이드린 반응으로도 제조된다.[10]
니트릴은 1차 아미드의 탈수 반응으로 제조할 수 있다. 이를 위한 일반적인 시약으로는 오산화 인(P2O5)과 염화 티오닐(SOCl2)이 있다. 유사한 탈수 반응에서 2차 아미드는 폰 브라운 아미드 분해를 통해 니트릴을 생성한다. 이 경우, C-N 결합 하나가 절단된다.
다수의 전통적인 방법이 아민의 산화를 통해 니트릴을 제조하는 데 존재한다.[13] 또한, 지난 수십 년 동안 전기화학적 공정을 위한 여러 선택적 방법들이 개발되었다.[14]
알데히드를 알독심을 거쳐 니트릴로 전환하는 것은 널리 사용되는 실험실 방법이다. 알데히드는 때때로 상온과 같이 낮은 온도에서도 하이드록실아민 염과 쉽게 반응하여 알독심을 생성한다. 이들은 단순한 가열로 니트릴로 탈수될 수 있지만,[15] 트리에틸아민/이산화황, 제올라이트 또는 염화설퓨릴을 포함한 다양한 시약이 이를 돕는다. 관련 하이드록실아민-O-설폰산도 유사하게 반응한다.[16]
특수한 경우에는 반 로이젠 반응을 사용할 수 있다. 지방족 알독심 탈수소 효소와 같은 생물 촉매도 효과적이다.
방향족 니트릴은 종종 디아조늄 화합물을 통해 아닐린으로부터 실험실에서 제조된다. 이것은 샌드마이어 반응이다. 이는 전이 금속 시안화물을 필요로 한다.[17]
ArN2+ + CuCN → ArCN + N2 + Cu+
- 시안화물 그룹의 상업적 공급원은 트리에틸알루미늄과 시안화 수소로부터 제조할 수 있는 디에틸알루미늄 시아나이드(Et2AlCN)이다.[18] 이는 친핵성 첨가 반응에 케톤을 사용해 왔다.[19] 사용 예는 쿠와지마 택솔 전합성을 참조하라.
- 시안화물 이온은 디브로마이드의 결합을 촉진한다. α,α′-디브로모아디프산과 시안화 나트륨을 에탄올에서 반응시키면 시아노사이클로부탄이 생성된다:[20]
- -
- 방향족 니트릴은 Houben-Fischer 합성을 통해 트리클로로메틸 아릴 케티민(RC(CCl3)=NH)의 염기 가수분해로 제조할 수 있다.[21]
- 니트릴은 1차 아민의 산화를 통해 얻을 수 있다. 일반적인 방법으로는 과황산칼륨,[22] 트리클로로아이소시아누르산,[23] 또는 양극 전기 합성을 사용한다.[24]
- 알파 탄소-아미노산은 다양한 방법의 산화적 탈카복실화를 통해 니트릴과 이산화 탄소를 형성한다.[25][26] 헨리 드라이스데일 데이킨은 1916년에 이 산화를 발견했다.[27]
- 아릴 카르복실산으로부터 (렛츠 니트릴 합성)
니트릴은 할로젠화 알킬과 시안화 칼륨을 반응시켜 합성할 수 있다. 토실산 에스터 등 설폰산 에스터를 기질로 사용할 수도 있다. 할로젠화 아릴을 시아노화하는 경우에는 시안화 구리를 첨가하여 가열한다 (로젠문트-폰 브라운 반응).
RX + KCN → RCN + KX
(X=Cl, Br, I, OS(=O)2R 등)
알데히드나 케톤 등의 카르보닐 화합물에 시안화 칼륨 또는 시안화 수소를 부가하면 시아노하이드린이 얻어진다.
RC(=O)R' + HCN → RC(CN)(OH)R'
슈트레커 반응에서는 알데히드로부터 이민을 발생시켜 시안화물 이온을 부가하는 반응이 핵심 단계이다. 얻어진 α-아미노니트릴을 가수분해하여 α-아미노산으로 한다.
또한, 알독심 (R−CH=NOH)이나 카바모일기 (R−CONH2)에 트리포스겐, 오염화 인 등의 탈수제를 작용시켜도 얻을 수 있다.
2016년 이화학연구소에서 4개의 티타늄을 포함하는 티타늄 화합물로부터 특수한 시약을 사용하지 않고 질소 분자를 절단하고, 절단된 질소종과 입수가 용이한 산 염화물로부터 함질소 유기 화합물인 니트릴을 직접 합성하는 방법이 발표되었다.[48]
6. 반응
유기 화합물의 나이트릴 그룹은 반응물이나 조건에 따라 다양한 반응을 겪을 수 있다. 나이트릴 그룹은 가수 분해되거나, 환원되거나, 시안화 이온으로 분자에서 방출될 수 있다.
나이트릴은 강한 산성 조건 또는 염기성 조건에서 가수분해하면 카르복실산이 된다. 가수분해 조건을 적절히 조정하여 1급 아마이드로 유도하는 것도 가능하다.[28]
수소화 알루미늄 리튬 등으로 환원하면 제1급 아민이 생성된다. 이 방법은 제1급 아민을 만드는 데 유용한 방법이다.
:
수소화 디이소부틸알루미늄(DIBALH)으로 환원 후, 이어서 가수분해하면, 대응하는 알데하이드를 얻을 수 있다.
:
시아노기는 전자 흡인성을 가지므로, α위에 수소를 가진 나이트릴에 강 염기를 작용시키면 카르바니온이 생성된다. 여기에 친전자체를 반응시키면 탄소-탄소 결합이 생성된다. 말로노나이트릴(NC-CH2-CN)이나 시아노 아세트산 에틸(NC-CH2-COOEt) 등은 활성 메틸렌 화합물로 작용한다.
시아노기는 또한 α탄소상의 라디칼을 안정화시키는 작용도 있으며, 예를 들어 아조비스아이소뷰티로나이트릴(AIBN)의 라디칼 개시제로서의 특징에 나타난다.
유기 아자이드와 [3+2] 고리형 첨가 반응을 수행하여 테트라졸을 생성한다.
나이트릴에 탄소 양이온을 작용시키면 질소 원자에 부가되어 생성된 나이트릴륨 이온이 가수분해를 거쳐 N-치환 아마이드를 생성한다 (리터 반응).
6. 1. 가수분해
니트릴의 가수분해는 산 또는 염기 조건에서 서로 다른 단계로 진행되어 먼저 아마이드(RC(O)NH2)를 생성하고 그 다음 카복실산(RC(O)OH)을 생성한다. 니트릴의 카복실산으로의 가수분해는 효율적이다. 산 또는 염기에서의 균형 반응식은 다음과 같다.[28]:RC≡N + 2 H2O + HCl → RC(O)OH + NH4Cl
:RC≡N + H2O + NaOH → RC(O)ONa + NH3
엄밀히 말하면, 이러한 반응은 산 또는 염기에 의해 매개된다(''촉매''와 반대). 산 또는 염기의 1당량이 각각 암모늄 또는 카복실레이트 염을 형성하기 위해 소비되기 때문이다.
속도론 연구에 따르면 아세토니트릴의 아세트아마이드로의 수산화 이온 촉매 가수분해에 대한 2차 속도 상수는 1.6×10−6 M−1 s−1인데, 이는 아마이드의 카복실레이트로의 가수분해(7.4×10−5 M−1 s−1)보다 느리다. 따라서 염기 가수분해 경로는 카복실레이트(또는 카복실레이트로 오염된 아마이드)를 제공한다. 반면에, 산 촉매 반응은 가수분해의 발열성으로 인해 촉진되는 중합체의 형성을 피하기 위해 온도와 시약 비율을 신중하게 제어해야 한다.[28] 니트릴을 해당 1급 아마이드로 전환하는 고전적인 절차는 차가운 농축된 황산에 니트릴을 첨가하는 것이다.[29] 카복실산으로의 추가 전환은 낮은 온도와 낮은 물 농도에 의해 방해받는다.
:RC≡N + H2O → RC(O)NH2
두 종류의 효소가 니트릴의 가수분해를 촉매한다. 니트릴라아제는 니트릴을 카복실산으로 가수분해한다.
:RC≡N + 2 H2O → RC(O)OH + NH3
니트릴 수화 효소는 니트릴을 아마이드로 가수분해하는 금속 효소이다.
:RC≡N + H2O → RC(O)NH2
이러한 효소는 아크릴아마이드를 생산하는 데 상업적으로 사용된다.
니트릴의 아마이드로의 "무수 수화"는 옥심을 물 공급원으로 사용하여 입증되었다:[30]
:RC≡N + R'C(H)=NOH → RC(O)NH2 + R'C≡N
6. 2. 환원
나이트릴은 다양한 금속 촉매를 사용하여 수소화 반응을 잘 일으킨다. 반응 조건에 따라 1차 아민 (RCH2NH2) 또는 3차 아민 ((RCH2)3N)을 생성할 수 있다.[31] 유기 환원 반응에서, 나이트릴은 수소화 알루미늄 리튬을 사용하여 아민으로 환원된다. 이미드로 환원 후 알데히드로 가수분해하는 반응은 산성 조건에서 염화 주석을 사용하는 스티븐 알데히드 합성에서 일어난다.수소화 알루미늄 리튬 등으로 환원하면 제1급 아민이 생성된다. 이 방법은 제1급 아민을 만드는 데 유용한 방법이다.
: R-CN + LiAlH4 → R-CH2NH2
수소화 디이소부틸알루미늄(DIBALH)으로 환원 후, 이어서 가수분해하면, 대응하는 알데히드를 얻을 수 있다.
: R-CN + HAl(i-Bu)2 → R-CHO (가수분해 후)
6. 3. 탈양성자화
알킬 나이트릴은 다이아이소프로필아미드 리튬과 부틸리튬과 같은 강염기를 사용하여 C≡N영어기에 인접한 C-H 결합의 탈 양성자화 반응을 일으킬 수 있다.[32][33] 생성물은 나이트릴 음이온이라고 하며, 다양한 친전자체와 반응하여 알킬화된다. 이러한 반응은 C≡N영어 단위의 작은 입체적 요구와 유도 안정화 덕분에 입체적으로 까다로운 환경에서 새로운 탄소-탄소 결합을 생성하는 데 유용하다.시아노기는 전자 흡인성을 가지므로, α위에 수소를 가진 나이트릴에 강 염기를 작용시키면 카르바니온이 생성된다. 여기에 친전자체를 반응시키면 탄소-탄소 결합이 생성된다. 말로노나이트릴(NC-CH2-CN)이나 시아노 아세트산 에틸(NC-CH2-COOEt) 등은 활성 메틸렌 화합물로 작용한다.
6. 4. 친핵성 첨가 반응
나이트릴의 탄소 중심은 친전자성을 띠므로, 다음과 같은 친핵성 첨가 반응에 취약하다.- 블레이즈 반응에서 유기아연 화합물과 반응[34]
- 피너 반응에서 알코올과 반응[34]
- 아민과 반응. 예를 들어, 아민인 사르코신이 시아나미드와 반응하여 크레아틴을 생성한다.[34]
- 이민 중간체를 거쳐 후벤-호에쉬 반응에서 아렌과 반응하여 케톤을 형성[34]
- 그리냐르 시약과 반응하여 1차 케티민을 생성하는 무로-미뇽냐크 케티민 합성.[35] 이는 고전적인 그리냐르 반응은 아니지만, 현대적 정의에서는 더 넓은 의미의 그리냐르 반응으로 간주될 수 있다.[35]
6. 5. 기타 반응
- 환원적 탈시아노화 반응에서 시아노기는 양성자로 치환된다.[36] 탈시아노화는 용해 금속 환원(예: HMPA와 칼륨 금속을 tert-부탄올에 용해) 또는 융해를 통해 시아노기를 KOH에서 녹여 수행할 수 있다.[37] 마찬가지로, α-아미노니트릴은 수소화 알루미늄 리튬과 같은 다른 환원제로 탈시아노화될 수 있다.[36]
- 1872년 벨기에 박사 과정 학생인 앙투안 폴 니콜라 프랑쉬몽(Antoine Paul Nicolas Franchimont, 1844-1919)이 개발한 프랑쉬몽 반응에서 산성 조건에서 가열된 α-시아노카르복실산은 가수분해되어 탈카르복실화되어 이합체를 형성한다.[38]
- 니트릴은 토프 반응에서 염기의 존재 하에 자체 반응하여 친핵성 첨가 반응을 일으킨다.
- 유기금속 화학에서 니트릴은 카보시아노화 반응으로 알킨에 첨가되는 것으로 알려져 있다.[39]
7. 니트릴 유도체
시아나미드는 일반적인 구조 R1R2N-C≡N을 가지는 *N*-시아노 화합물이며, 모체 화합물인 시아나미드와 관련이 있다.[41]
니트릴 옥사이드(Nitrile oxides)는 화학식 RCNO를 갖는다. 일반적인 구조는 R-C≡N+-O-이다. 여기서 R은 임의의 유기기를 나타내며, 예를 들어 아세토니트릴 옥사이드(acetonitrile oxide)는 CH3-C≡N+-O−와 같이 나타낼 수 있다. 풀민산(fulminic acid) H-C≡N+-O−의 경우처럼 수소를 나타내거나, 할로젠을 나타낼 수 있다(예: 염소 풀민산염(chlorine fulminate) Cl-C≡N+-O−).[44]
니트릴 옥사이드는 니트릴과는 상당히 다르다. 이들은 반응성이 매우 높은 1,3-쌍극자이며, 니트릴의 직접적인 산화로는 합성할 수 없다.[42] 대신, 옥심(oxime)의 탈수소화 또는 니트로알칸(nitroalkane)의 탈수로 합성할 수 있다.[43] 이들은 1,3-쌍극자 고리 부가 반응에 사용되며, 예를 들어 아이소옥사졸(isoxazole)을 생성하는 데 사용된다.[43] 또한, 1형 이상변이 재배열을 거쳐 아이소사이아네이트(isocyanate)로 변환된다.[44]
무거운 니트릴 설파이드(nitrile sulfides)는 반응성이 극도로 높고 드물지만, 옥사티아졸론(oxathiazolones)의 열분해 중에 일시적으로 형성된다. 이들은 니트릴 옥사이드와 유사하게 반응한다.[45]
8. 존재 및 응용
니트릴은 다양한 식물과 동물에서 자연적으로 생성된다. 120종 이상의 천연 니트릴이 육상 및 해양에서 분리되었다. 니트릴은 과일 씨앗, 특히 아몬드에서 흔히 발견되며, 양배추, 브뤼셀 콩나물, 콜리플라워 등 브라시카 작물을 요리하는 동안 가수분해를 통해 생성되기도 한다. 아몬드나 일부 과일 씨앗을 섭취할 때 생성되는 만델로니트릴은 시아노히드린으로, 시안 배당체의 독성을 유발하는 사이안화 수소를 방출한다.[46]
니트릴 작용기는 여러 의약품에서 발견된다. 예를 들어 항당뇨병 약물인 빌다글립틴과 유방암 치료에 사용되는 아나스트로졸이 있다.[47] 어떤 경우에는 니트릴이 효소 기질에 있는 기능을 모방하고, 또 어떤 경우에는 수용성을 증가시키거나 간에서 산화 대사에 대한 민감성을 감소시킨다.[47]
아크릴로니트릴은 폴리아크릴로니트릴의 원료로 공업적으로 중요하다. 아세토니트릴은 비양성자성 극성 용매로 사용된다.
8. 1. 천연 존재
니트릴은 다양한 식물과 동물에서 자연적으로 발생한다. 120종 이상의 자연 발생 니트릴이 육상 및 해양에서 분리되었다. 니트릴은 과일 씨앗, 특히 아몬드에서 흔히 발견되며, 양배추, 브뤼셀 콩나물, 콜리플라워 등 브라시카 작물을 요리하는 동안에도 발생하는데, 이들은 가수분해를 통해 니트릴을 방출한다. 아몬드나 일부 과일 씨앗을 섭취하여 생성되는 만델로니트릴은 시아노히드린으로, 시안 배당체의 독성을 유발하는 사이안화 수소를 방출한다.[46]8. 2. 의약품
니트릴 작용기는 여러 의약품에서 발견된다. 예를 들어 항당뇨병 약물인 빌다글립틴과 유방암 치료에 사용되는 아나스트로졸이 있다.[47] 어떤 경우에는 니트릴이 효소 기질에 있는 기능을 모방하고, 또 어떤 경우에는 수용성을 증가시키거나 간에서 산화 대사에 대한 민감성을 감소시킨다.[47]8. 3. 산업적 응용
아크릴로니트릴은 폴리아크릴로니트릴의 원료로 공업적으로 중요하다. 아세토니트릴은 비양성자성 극성 용매로 사용된다.참조
[1]
IUPAC Gold Book
nitriles
http://goldbook.iupa[...]
[2]
NCBI-MeSH
Nitriles
https://www.ncbi.nlm[...]
[3]
논문
Molecular Structures of Hydrogen Cyanide and Acetonitrile as Studied by Gas Electron Diffraction
[4]
서적
Försök, beträffande det färgande ämnet uti Berlinerblå
https://books.google[...]
1782
[5]
논문
The Preparation of Nitriles
[6]
논문
"Note sur l'acide prussique" (Note on prussic acid)
https://books.google[...]
[7]
논문
Notiz über einen neuen Cyanäther
https://books.google[...]
[8]
논문
Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme (On the decomposition of ammonium benzoate by heat)
https://books.google[...]
[9]
Ullmann
[10]
논문
Cyanohydrins in Nature and the Laboratory: Biology, Preparations, and Synthetic Applications
[11]
논문
ISOBUTYRONITRILE
1945
[12]
논문
2-ETHYLHEXANONITRILE
1952
[13]
논문
Developments in the Aerobic Oxidation of Amines
2021
[14]
논문
Beyond traditional synthesis: Electrochemical approaches to amine oxidation for nitriles and imines
2024
[15]
논문
A Facile One-Pot Conversion of Aldehydes into Nitriles
2009-09-18
[16]
논문
Hydroxylamine-''O''-sulfonic acid: A convenient reagent for the oxidative conversion of aldehydes into nitriles
[17]
문서
"''o''-Tolunitrile and ''p''-Tolunitrile"
1941
[18]
OrgSynth
Diethylaluminum cyanide
[19]
OrgSynth
Preparation of cyano compounds using alkylaluminum intermediates: 1-cyano-6-methoxy-3,4-dihydronaphthalene
[20]
논문
Ring Closures in the Cyclobutane Series. II. Cyclization Of α,α′-Dibromo-Adipic Esters
[21]
문서
"Über eine neue Methode zur Darstellung cyclischer Nitrile durch katalytischen Abbau (I. Mitteil.),"
1930
[22]
논문
Nickel-catalyzed dehydrogenation of amines to nitriles
1990
[23]
논문
A Selective and Mild Oxidation of Primary Amines to Nitriles with Trichloroisocyanuric Acid
2003
[24]
논문
Oxidation of Primary Aliphatic Amines to Nitriles at the Nickel Hydroxide Electrode
1982
[25]
논문
Conversion of α-Amino Acids into Nitriles by Oxidative Decarboxylation with Trichloroisocyanuric Acid
2004
[26]
논문
The oxidation of amino compounds at anodic silver
1972
[27]
논문
The Oxidation of Amino-Acids to Cyanides
1916
[28]
논문
Metal-mediated and metal-catalyzed hydrolysis of nitriles
2005
[29]
논문
Substituent Effects on the Hydrolysis of p-Substituted Benzonitriles in Sulfuric Acid Solutions at (25.0± 0.1) °C
2008-01-01
[30]
논문
Anhydrous Hydration of Nitriles to Amides: ''p''-Carbomethoxybenzamide
[31]
논문
Catalytic Amination Reactions: Synthesis of fatty amines. Selectivity control in presence of multifunctional catalysts
1997
[32]
서적
Organic Reactions
[33]
논문
C- and N-Metalated Nitriles: The Relationship between Structure and Selectivity
[34]
논문
Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment
[35]
Cite book
Comprehensive Organic Name Reactions and Reagents
John Wiley & Sons, Inc.
2010-09-15
[36]
논문
The reductive decyanation reaction: chemical methods and synthetic applications
http://www.arkat-usa[...]
[37]
논문
The Reductive Decyanation of Nitriles by Alkali Fusion
1980
[38]
논문
Ueber die Dibenzyldicarbonsäure
https://babel.hathit[...]
1872
[39]
논문
A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes
[40]
논문
Nitrile Ligated Transition Metal Complexes with Weakly Coordinating Counteranions and Their Catalytic Applications
[41]
간행물
March4th
[42]
서적
The Chemistry of the Cyano Group
[43]
서적
Organic Chemistry
Oxford University Press
2001
[44]
서적
March's Advanced Organic Chemistry
John Wiley & Sons
[45]
서적
Comprehensive Heterocyclic Chemistry
[46]
간행물
Nitrile-containing natural products
http://pubs.rsc.org/[...]
[47]
논문
Nitrile-containing pharmaceuticals: efficacious roles of the nitrile pharmacophore
2010-11
[48]
웹사이트
窒素分子から直接ニトリルを合成-アンモニアを用いない省資源・省エネ型合成法-
http://www.riken.jp/[...]
[49]
웹사이트
nitriles
http://goldbook.iupa[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com



