생물학에서의 영생
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
생물학에서의 영생은 생물체가 겪는 노화 현상과 수명에 대한 연구를 다룬다. 단세포 생물은 세포 분열을 통해 개체 수를 늘리며, 환경 조건이 맞지 않으면 죽지만, 노화에 의한 죽음은 나타나지 않는다. 그러나 최근 연구에서는 단세포 생물도 노화 현상을 겪는다는 사실이 밝혀졌다. 다세포 생물은 수명에 의해 생명이 제한되며, 불로불사를 위해서는 노화를 없애는 연구가 필요하다. 노화의 원인으로는 프로그램설, 에러설, 활성산소설 등이 제시되며, 작은보호탑해파리와 같은 일부 생물은 생물학적 불멸에 가까운 특징을 보인다. 세포 수준에서는 HeLa 세포와 같은 불멸화된 세포주가 연구에 활용되며, 약학적 수명 연장 연구를 통해 시롤리무스, 메트포르민 등과 같은 물질의 항노화 효과가 연구되고 있다.
더 읽어볼만한 페이지
- 불로장생 - 텔로머레이스
텔로머레이스는 진핵세포 염색체 말단의 텔로미어 DNA 반복 서열을 연장하는 역전사 효소로, 세포 분열 시 텔로미어 단축을 막아 세포 수명 유지에 중요한 역할을 하며, RNA 구성 요소(TERC)와 역전사 효소(TERT) 복합체로 구성되어 세포 노화, 암, 유전 질환 연구와 관련이 있고, 텔로미어와 텔로머레이스 기능 연구로 엘리자베스 블랙번, 캐럴 W. 그리더, 잭 W. 쇼스택이 2009년 노벨 생리학·의학상을 수상했다. - 불로장생 - 젊음의 샘
젊음의 샘은 늙지 않게 해준다는 전설 속의 샘으로, 불로장생에 대한 인류의 염원을 반영하며 다양한 문헌과 대중문화에서 영원한 젊음의 상징으로 나타난다. - 노쇠 - 죽음
죽음은 생명 활동의 영구적 종식으로 의학, 법, 사회, 종교, 심리, 생물학 등 다양한 관점에서 해석되며, 전통적인 심폐사 외에 뇌사도 죽음으로 인정되고, 개발도상국은 전염병, 선진국은 노화 관련 질병이 주요 사망 원인이며, 문화와 종교에 따라 다양한 이해와 관습이 존재하고, 수명 연장, 냉동 보존술, 존엄사, 안락사 등에 대한 논의가 이루어지고 있다. - 노쇠 - 미토콘드리아 DNA
미토콘드리아 DNA(mtDNA)는 세포 호흡에 필수적인 유전 정보를 담고 있는 미토콘드리아 내의 이중 가닥 환상 DNA로서, 동물의 경우 약 16,000개의 염기쌍과 37개의 유전자로 구성되며, 모계 유전, 높은 돌연변이율, 질병 및 노화와의 연관성 등의 특징을 가진다. - 노화 - 고령화
고령화는 한 국가 또는 지역에서 65세 이상 인구 비율이 증가하는 현상으로, 유엔은 그 비율에 따라 고령화 사회, 고령 사회, 초고령 사회로 분류하며, 출산율 저하와 평균 수명 증가의 복합적인 결과로 나타나 사회, 경제, 정치 등 다양한 분야에 영향을 미친다. - 노화 - 출생률
출생률은 특정 기간 동안의 출생아 수를 나타내는 지표이며, 사회, 경제, 문화, 정책 등 다양한 요인에 영향을 받아 세계적으로 감소 추세에 있고, 한국은 심각한 저출산 문제를 겪고 있다.
2. 단세포 생물의 경우
세균 같은 단세포 생물에게는 수명(노화)에 의한 죽음이라는 개념이 없다. 사람과 같은 다세포 생물에서는 텔로미어에 의해서 세포의 분열 횟수가 제한되고 세포분열 능력 상실이 노화를 가져오지만, 단세포생물은 세포분열의 횟수에 한계가 없다. 즉 단세포생물은 세포분열을 거듭하면서 더 많은 수의 개체(유전적으로는 분열 전과 동일)로 변신한다. 그리고 그 변신의 횟수에는 한계가 없다. 가령 대장균을 배양하면 20분 뒤에 2마리로 분열하는데, 이를 두고 이전 대장균이 죽고 새로운 2마리가 출생했다고 말할 수는 없다. 죽었다면 사체가 있어야 할텐데, 사체가 없기 때문이다. 따라서 이전 대장균이 2마리의 대장균으로 모습을 바꾸었다고 표현하는 것이 적절하다. 그리고 이러한 변신 과정은 제 아무리 긴 시간이 흘러도 계속해서 일어나기 때문에 대장균 같은 단세포생물에서는 수명을 논할 수가 없는 것이다. 그렇다고 단세포 생물이 죽지 않는 것은 아니다. 영양, 온도, 습도 등의 환경조건이 적절치 않을 경우 죽을 수 있다. 단지 수명(노화)에 의한 죽음이라는 것이 단세포생물에서는 없다는 것 뿐이다.
최근의 연구 결과에 의하면 단세포 생물도 노화 현상을 일으킨다. 세균의 노화 (bacterial senescence 또는 bacterial aging) 문서 참조.
단세포 생물은 노화 과정을 거친다. 시간이 지남에 따라 분열 속도가 느려지고 결국에는 죽음에 이른다. 비대칭적으로 분열하는 세균과 효모 역시 노화한다. 하지만 대칭적으로 분열하는 세균과 효모는 이상적인 배양 조건 하에서 생물학적으로 불멸할 수 있다.[13] 이러한 조건에서 세포가 대칭적으로 분열하여 두 개의 딸세포를 생성할 때, 세포 분열 과정을 통해 세포는 젊은 상태로 되돌아갈 수 있다. 하지만 모세포가 비대칭적으로 딸세포를 분출하는 경우, 딸세포만 젊은 상태로 되돌아가고 모세포는 회복되지 않아 노화하고 죽음에 이른다. 이와 유사하게 줄기 세포와 생식 세포 역시 "불멸"하다고 간주될 수 있다.
일반적으로 진핵 세포 생물 외에는 수명(노화)에 의한 죽음이라는 현상은 인정되지 않는다.
2. 1. 세균의 수명
세균 같은 단세포 생물에게는 수명(노화)에 의한 죽음이라는 개념이 없다. 사람과 같은 다세포 생물에서는 텔로미어에 의해서 세포의 분열 횟수가 제한되고 세포분열 능력 상실이 노화를 가져오지만, 단세포생물은 세포분열의 횟수에 한계가 없다.[13] 즉 단세포생물은 세포분열을 거듭하면서 더 많은 수의 개체(유전적으로는 분열 전과 동일)로 변신한다. 그리고 그 변신의 횟수에는 한계가 없다. 가령 대장균을 배양하면 20분 뒤에 2마리로 분열하는데, 이를 두고 이전 대장균이 죽고 새로운 2마리가 출생했다고 말할 수는 없다. 죽었다면 사체가 있어야 할텐데, 사체가 없기 때문이다. 따라서 이전 대장균이 2마리의 대장균으로 모습을 바꾸었다고 표현하는 것이 적절하다. 그리고 이러한 변신 과정은 제 아무리 긴 시간이 흘러도 계속해서 일어나기 때문에 대장균 같은 단세포생물에서는 수명을 논할 수가 없는 것이다.[13] 그렇다고 단세포 생물이 죽지 않는 것은 아니다. 영양, 온도, 습도 등의 환경조건이 적절치 않을 경우 죽을 수 있다. 단지 수명(노화)에 의한 죽음이라는 것이 단세포생물에서는 없다는 것 뿐이다.하지만 최근 연구에 따르면 단세포 생물도 노화 현상을 겪는다는 사실이 밝혀졌다. 대칭적으로 분열하는 세균과 효모는 이상적인 배양 조건 하에서 생물학적으로 불멸할 수 있지만, 모세포가 비대칭적으로 딸세포를 분출하는 경우, 딸세포만 젊은 상태로 되돌아가고 모세포는 회복되지 않아 노화하고 죽음에 이른다.[13]
3. 다세포 생물의 경우
다세포 생물의 경우, 그 개체의 생명은 이른바 수명에 의해서 생리적으로 제한되고 있다. 불로불사를 실현하기 위해서는, 노화·수명을 없앨 필요가 있다. 현재, 노화·수명의 원인으로서는 이하와 같은 가설이 이루어지고 있다.[50]
많은 동물을 포함한 일부 진핵생물에서는 개체의 생명 활동 기간이 소위 수명에 의해 생리적으로 제한되는 종이 있다. 이러한 생물에서 불로불사를 실현하기 위해서는 노화로 생명 활동이 쇠퇴하는 노화 현상을 제거할 필요가 있다. 흔히 오해되지만, 동물 이외의 대다수 다세포 생물에는 소위 노화나 수명과 같은 현상이 인정되지 않으며, 노화 현상은 생물의 필연적인 것이 아니라 진화적으로 획득된 것으로 생각된다. 동물에서도 강장동물이나 편형동물 등 속하는 대부분의 종에 노화 현상은 존재하지 않고, 명확한 수명이 인정되지 않는다 (덧붙여 홍해파리의 특이성은 해파리(유성 생식 상태: 수명 있음)에서 폴립(영양 상태·무성 증식 상태: 수명이 인정되지 않음)으로 돌아가는 것이며, 불로성 그 자체는 아니다). 동물 이외에는 짚신벌레나 효모 등에서 동물의 노화와 매우 유사한 현상이 인정되지만, 그 과정은 다양하다.
3. 1. 노화의 원인
노화의 원인에 대해서는 여러 가설이 존재한다.프로그램설: 세포 분열 횟수가 유전적으로 정해져 있다는 가설이다. 세포는 분열할 수 있는 한계가 처음부터 설정되어 있으며, 그 횟수를 채우면 분열을 멈추고 노화가 발생한다는 것이다. 이 한계는 종에 따라 다르지만, 대체로 그 종의 수명과 비례한다는 것이 현재 유력한 설 중 하나이다.[50] 텔로미어는 세포 분열할 때마다 짧아지는데,[51] 이는 프로그램설의 기전을 설명하는 핵심 요소이다. 텔로머레이스는 암세포에서 고활성화되어 세포를 불사화하는[52] 것으로 알려져 있어, 줄기 세포의 텔로머레이스 활성 조절을 통해 불로불사를 실현할 수 있을 것이라는 기대가 있다.
에러설: 세포 분열 시 발생하는 돌연변이가 점차 축적되어 결국 세포 기능이 파탄나 노화가 일어난다는 가설이다. 베르너 증후군을 비롯한 조로증 환자에게서 헬리케이스와 같은 DNA 수선 관련 유전자에 이상이 발견되면서[53] 이 가설이 제기되었다. DNA 분자 손상은 하루에 세포 하나당 최대 50만 회 정도 발생하며, DNA 수선 속도가 느려지거나 환경 요인으로 DNA 손상이 증가하면 DNA 수선이 이를 따라잡지 못하게 된다. 그 결과, 세포는
중 하나의 경로를 밟게 된다. 인체에서는 대부분의 세포가 세포 노화 상태에 이르지만, DNA 손상이 심하게 축적된 세포는 아포토시스를 통해 제거된다. 아포토시스는 DNA 손상으로 인한 암 발생을 막고 생명을 유지하기 위한 중요한 방어 기전으로 작용한다.[54] 이 가설에 따르면, DNA 수선 유전자를 활성화하여 수선 속도를 높이는 것이 해결책이 될 수 있다.
활성산소설: 대사 과정에서 발생하는 활성산소가 신체에 손상을 입혀 노화를 유발한다는 가설이다. 대사율이 높은 생물일수록 수명이 짧은 경향이 있다는 점[55], 그리고 활성산소가 텔로미어 단축에 영향을 준다는 연구 결과[56]는 이 가설을 뒷받침한다. 이 가설에 따른 해결책으로는 비타민 C와 같은 항산화작용이 강한 식품을 섭취하거나, 활성산소를 감소시키는 스파오키시드디슴타제 유전자를 도입하는 방법 등이 제시된다.
이 외에도 다양한 가설들이 노화의 원인을 설명하기 위해 제시되고 있다.
3. 2. 노화 연구의 한국적 의의 (한국의 관점)
4. 영생의 생물
일부 생물은 노화를 겪지 않거나, 노화 이전 상태로 되돌아가는 능력을 가지고 있어 생물학적 불멸에 가까운 것으로 여겨진다.
작은보호탑해파리는 해파리가 노화한 후, 위축해 다시 유생인 포리프로 돌아오는 것이 판명됐다.[57] 이것을 반복하는 것으로 이론상 불로불사라고 생각되어 진다. 즉 노화하고는 젊어지는 것이다. 같은 현상은, 야와라크라게로도 알려져 있다.[57]
곤충의 변태와 관련된 호르몬 중 유약 호르몬은 곤충의 변태를 멈추고 유충 상태로 계속 있게 하는 효과가 있어, 실험적으로 유충 기간을 연장할 수 있다.
동물 노화 및 수명 데이터베이스에 따르면, 노화가 무시할 수 있는 동물은 다음과 같다.[12]
- 블랜딩거북(''Emydoidea blandingii'') – 77년
- 올름(''Proteus anguinus'') – 102년
- 동부상자거북(''Terrapene carolina'') – 138년
- 붉은 해담치 (''Strongylocentrotus franciscanus'') – 200년
- 거친눈바리 (''Sebastes aleutianus'') – 205년
- 대서양 퀘이호그 조개 (''Arctica islandica'') – 507년
- 그린란드 상어 (''Somniosus microcephalus'') - 250~500년
많은 동물을 포함한 일부 진핵생물에서는 개체의 생명 활동 기간이 소위 수명에 의해 생리적으로 제한되는 종이 있다. 이러한 생물에서 불로불사를 실현하기 위해서는 노화로 생명 활동이 쇠퇴하는 노화 현상을 제거할 필요가 있다. 흔히 오해되지만, 동물 이외의 대다수 다세포 생물에는 소위 노화나 수명과 같은 현상이 인정되지 않으며, 노화 현상은 생물의 필연적인 것이 아니라 진화적으로 획득된 것으로 생각된다. 동물에서도 강장동물이나 편형동물 등 속하는 대부분의 종에 노화 현상은 존재하지 않고, 명확한 수명이 인정되지 않는다 (덧붙여 홍해파리의 특이성은 해파리(유성 생식 상태: 수명 있음)에서 폴립(영양 상태·무성 증식 상태: 수명이 인정되지 않음)으로 돌아가는 것이며, 불로성 그 자체는 아니다). 동물 이외에는 짚신벌레나 효모 등에서 동물의 노화와 매우 유사한 현상이 인정되지만, 그 과정은 다양하다.
4. 1. 작은보호탑해파리
작은보호탑해파리는 해파리가 노화한 후, 위축해 다시 유생인 포리프로 돌아오는 것이 판명됐다.[57] 이것을 반복하는 것으로 이론상 불로불사라고 생각되어 진다. 즉 노화하고는 젊어지는 것이다. 같은 현상은, 야와라크라게로도 알려져 있다.[57]Turritopsis nutricula는 작은(5mm) 해파리 종으로, 성적 생식 후 세포를 보충하기 위해 세포 변환을 사용한다. 이 주기는 무한정 반복될 수 있으며, 잠재적으로 생물학적으로 영생할 수 있게 한다.[17][18] 이 생물은 카리브해에서 기원했지만 현재 전 세계로 확산되었다. 비교 유전체학 연구에 따르면, 이 해파리의 회춘의 핵심 분자 메커니즘은 DNA 복제 및 수선, 그리고 줄기 세포 갱신과 관련이 있는 것으로 보인다.
유사한 사례로는 히드로충 ''Laodicea undulata'',[19] 관해파리 ''Aurelia'' sp.1[20] 그리고 유촉수강 ''Mnemiopsis Leiydi''가 있다.[21][22]
4. 2. 히드라

히드라는 자포동물문에 속하는 속이다. 모든 자포동물은 재생 능력이 있어 부상으로부터 회복하고 무성생식을 할 수 있다. 히드라는 방사대칭을 가진 단순한 담수 동물이며, 말단 부위에만 후분열 세포(다시 분열하지 않는 세포)를 가지고 있다.[14] 모든 히드라 세포는 지속적으로 분열한다.[15] 히드라는 노화를 겪지 않으며, 따라서 생물학적으로 불멸이라는 주장이 제기되었다. 4년간의 연구에서 3개의 히드라 집단은 나이가 들어감에 따라 사망률 증가를 보이지 않았다. 이 동물들은 5~10일 만에 성숙기에 도달하는 것을 고려할 때 훨씬 더 오래 살 수 있다.[16]
4. 3. 플라나리아 편형동물
플라나리아는 무한한 재생 능력을 가진 것으로 알려져 노화 연구에 중요한 모델 생물로 활용된다.[29] Schmidtea mediterranea 속에 대한 연구에 따르면, 무성 생식 플라나리아는 "고도로 증식하는 성체 줄기 세포 집단에 의해 유지되는, 겉보기에 무한한 텔로미어 재생 능력을 가지고 있다"고 한다.[29] 유성 생식 플라나리아는 네오블라스트가 노화된 세포를 지속적으로 대체하는 능력 때문에 최대 3년까지 살 수 있으며, 무성 생식 플라나리아는 분열로 복제되어 15년 이상 유지된 사례가 보고되었다.[30][31]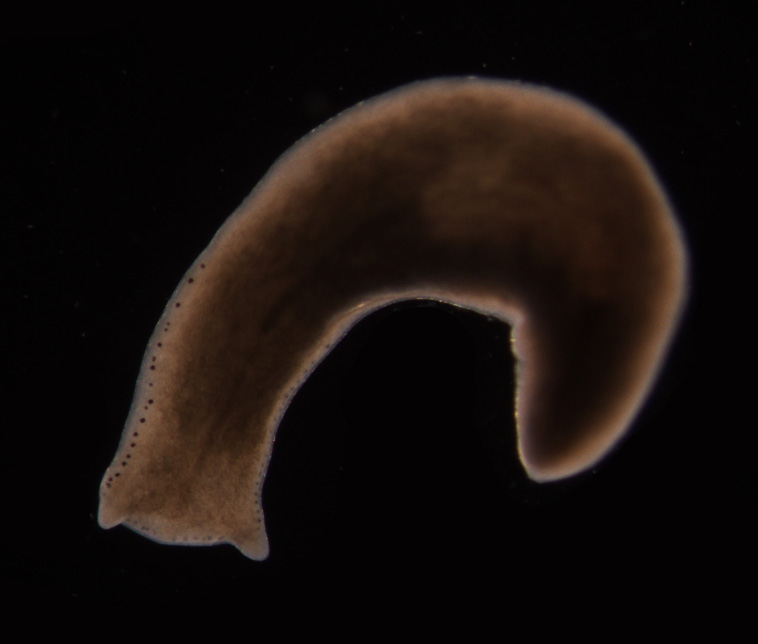
4. 4. 기타 생물
바닷가재는 나이가 들어도 쇠약해지거나 생식 능력을 잃지 않으며, 오히려 나이가 많은 바닷가재가 더 번식력이 좋을 수 있다. 그러나 이는 전통적인 의미의 불멸을 뜻하는 것은 아니며, 탈피 과정에서 사망할 가능성이 더 높다.[27] 바닷가재의 장수는 텔로머레이스라는 효소 덕분일 수 있는데, 이 효소는 염색체 끝부분의 DNA 서열인 텔로미어를 복구한다.[24][25][26] 대부분의 척추동물은 배아 단계에서만 텔로머레이스를 발현하지만, 바닷가재는 성체가 되어서도 대부분의 조직에서 텔로머레이스를 발현한다.[23] 하지만 바닷가재는 탈피를 통해 성장하는데, 큰 껍질일수록 더 많은 에너지가 필요하여 탈진으로 죽게 된다.[27] 늙은 바닷가재는 탈피를 멈추기도 하는데, 껍질이 손상되거나 감염되어 죽음에 이르기도 한다.[28] 유럽 바닷가재의 평균 수명은 수컷이 31년, 암컷이 54년이다.곤충의 변태와 관련된 호르몬 중 유약 호르몬은 곤충의 변태를 멈추고 유충 상태로 계속 있게 하는 효과가 있어, 실험적으로 유충 기간을 연장할 수 있다.
동물 노화 및 수명 데이터베이스에 따르면, 노화가 무시할 수 있는 동물은 다음과 같다.[12]
- 블랜딩거북(''Emydoidea blandingii'') – 77년
- 올름(''Proteus anguinus'') – 102년
- 동부상자거북(''Terrapene carolina'') – 138년
- 붉은 해담치(''Strongylocentrotus franciscanus'') – 200년
- 거친눈바리(''Sebastes aleutianus'') – 205년
- 대서양조개(''Arctica islandica'') – 507년
- 그린란드 상어(''Somniosus microcephalus'') - 250~500년
5. 세포 수준의 불멸성
세포는 분열을 반복해 그 계통을 존속하지만, 실제로는 다세포 생물의 세포는 무한히 분열을 반복하는 것은 아니다. 이것은 보통 개체의 수명이 유한하기 때문이다. 그러나 그 일부의 세포를 채취하여 배양하는 경우, 이 제약은 사라진다. 그러한 방법으로, 무한하게 분열을 반복하여 계통을 유지할 수 있을 것 같은 세포가 얻어지는 경우가 있다. 인간 세포에서 그러한 세포주의 첫 번째 예가 HeLa 세포였다.[4]
생물학자들은 헤이플릭 한계의 영향을 받지 않는 세포, 즉 DNA 손상이나 짧아진 텔로미어로 인해 더 이상 분열할 수 없는 세포를 지칭하기 위해 "불멸"이라는 단어를 선택했다. 레너드 헤이플릭의 이론 이전에는 알렉시 카렐이 모든 정상적인 체세포는 불멸이라고 가설을 세웠다.
"불멸화"라는 용어는 처음에는 텔로미어 연장 효소인 텔로머라아제를 발현하여 세포 자멸사를 피하는 암 세포에 적용되었다. 가장 일반적으로 사용되는 세포주 중에는 불멸화된 암 세포주인 HeLa와 Jurkat가 있다. 배아 줄기 세포와 생식 세포도 불멸로 묘사되어 왔다.[8][9]
암 세포의 불멸 세포주는 암유전자 유도 또는 종양 억제 유전자의 손실을 통해 생성될 수 있다. 불멸성을 유도하는 한 가지 방법은 바이러스 매개 large T-항원의 유도이며, 일반적으로 원숭이 바이러스 40 (SV-40)을 통해 도입된다.[10][11]
5. 1. HeLa 세포
HeLa 세포는 최초로 확립된 인간 세포주이다.[4] 이 세포들은 소아마비 백신 개발,[5] 성 호르몬 스테로이드 연구,[6] 및 세포 대사[7]와 같은 생물학적 연구에 널리 사용되었으며, 지금도 사용되고 있다. 세포는 분열을 반복하여 그 계통을 존속시키지만, 실제로는 다세포 생물의 세포는 무한히 분열을 반복하지 않는다. 그러나 그 일부의 세포를 채취하여 배양하는 경우, 이 제약은 사라진다. 인간 세포에서 그러한 세포주의 첫 번째 예가 HeLa 세포였다.5. 2. 불멸화 세포주
세포는 분열을 반복해 그 계통을 존속하지만, 실제로는 다세포 생물의 세포는 무한히 분열을 반복하는 것은 아니다. 이것은 보통 개체의 수명이 유한하기 때문이다. 그러나, 그 일부의 세포를 꺼내 배양했을 경우, 이 제약은 없어진다.[3] 그러한 방법으로, 무한하게 분열을 반복해 계통을 유지할 수 있을 것 같은 세포를 얻을 수 있는 경우가 있다. 사람의 세포로의 그러한 세포주의 최초의 예가 헬라 세포다.[4]생물학자들은 헤이플릭 한계의 영향을 받지 않는 세포, 즉 DNA 손상이나 짧아진 텔로미어로 인해 더 이상 분열할 수 없는 세포를 지칭하기 위해 "불멸"이라는 단어를 선택했다. 레너드 헤이플릭의 이론 이전에는 알렉시 카렐이 모든 정상적인 체세포는 불멸이라고 가설을 세웠다.
"불멸화"라는 용어는 처음에는 텔로미어 연장 효소인 텔로머라아제를 발현하여 세포 자멸사를 피하는 암 세포에 적용되었다. 가장 일반적으로 사용되는 세포주 중에는 불멸화된 암 세포주인 HeLa와 Jurkat가 있다. 배아 줄기 세포와 생식 세포도 불멸로 묘사되어 왔다.[8][9]
암 세포의 불멸 세포주는 암유전자 유도 또는 종양 억제 유전자의 손실을 통해 생성될 수 있다. 불멸성을 유도하는 한 가지 방법은 바이러스 매개 large T-항원의 유도이며, 일반적으로 원숭이 바이러스 40 (SV-40)을 통해 도입된다.[10][11]
6. 약학적 수명 연장 연구
지금까지, 생물의 수명을 연장시키는 약물은 과학적으로 입증된 형태에서는 존재하지 않았다. 그러나, 2009년의 연구에서, 시롤리무스라 불리는 면역억제제가 생쥐의 수명을 신장시켰던 것이 입증되어[58], 이른바 수명을 늘리는 약품이 개발되었다.
시롤리무스(라파마이신)는 면역억제제의 일종으로, 2009년의 연구에서 생쥐의 수명을 연장시킨 것이 입증되었다.[58][32] 그러나 시롤리무스는 강한 면역 억제 작용을 가지고 있어 항노화 약품으로 실용화되지는 않았다.
메트포르민, 레스베라트롤, 니코틴아미드 모노뉴클레오티드(NMN) 등도 항노화 작용이 인정되어 임상 시험이 진행되고 있다.[33]
6. 1. 시롤리무스 (라파마이신)
시롤리무스(라파마이신)는 면역억제제의 일종으로, 2009년의 연구에서 생쥐의 수명을 연장시킨 것이 입증되었다.[58][32] 그러나 시롤리무스는 강한 면역 억제 작용을 가지고 있어 항노화 약품으로 실용화되지는 않았다.6. 2. 기타 연구 물질
메트포르민, 레스베라트롤, 니코틴아미드 모노뉴클레오티드(NMN) 등도 항노화 작용이 인정되어 임상 시험이 진행되고 있다.[33]7. 노화 연구 관련 인물 및 기업 (한국 중심)
7. 1. 주요 연구자
나카니시 마코토(中西真)는 세포 노화 연구를 진행하고 있다.[34][35] 야마나카 신야(山中伸弥)는 유도만능줄기세포(iPS 세포) 개발로 노화 연구에 기여했다.[36][37] 요시모리 타모츠(吉森保)는 오토파지 연구를 통해 노화 기전을 밝히고 있다.[38] 하라 에이지(原英二)는 노화와 암 발생 간의 관계를 연구한다.[39]카게야마 류이치로(影山龍一郎)는 뇌 신경줄기세포 연구를 통해 노화 과정을 연구한다.[40][41] 이마이 신이치로(今井眞一郎)는 서투인과 NAD+ 연구를 통해 노화 및 수명 조절 기전을 연구한다.[42] 미나미노 토오루(南野徹)는 혈관 노화 및 심혈관 질환 연구를 진행하고 있다.[43][44]
박상철은 서울대학교 노화고령사회연구소장을 역임했으며, 노화 연구의 권위자이다. 유룡은 한국과학기술원(KAIST) 화학과 교수로 노화 관련 연구를 진행하고 있다. 김빛내리는 서울대학교 생명과학부 교수로, RNA 연구를 통해 노화 기전을 연구한다.
:en:David A. Sinclair는 노화 연구의 세계적인 권위자 중 한 명이다.[45] :en:Cynthia Kenyon은 예쁜꼬마선충을 이용한 수명 연장 연구로 유명하다.[46]
7. 2. 관련 기업
칼리코 (기업), 알토스 연구소, 유니티 바이오테크놀로지, 레트로 바이오사이언시스 등이 생물학적 불로장생 연구를 진행하고 있다.참조
[1]
서적
Handbook of the Biology of Aging
Academic Press
[2]
논문
Late life: a new frontier for physiology
http://www.escholars[...]
2005-11
[3]
논문
Hayflick, his limit, and cellular ageing
[4]
서적
The Immortal Life of Henrietta Lacks
Crown/Random House
[5]
뉴스
The Life, Death, and Life After Death of Henrietta Lacks, Unwitting Heroine of Modern Medical Science.
http://www.citypaper[...]
Baltimore City Paper
2010-03-02
[6]
웹사이트
The Pro-apoptotic Effect of Quercetin in Cancer Cell Lines Requires ERβ-Dependant Signals.
Cellular Physiology
2012
[7]
간행물
Evidence That Glutamine, Not Sugar, Is the Major Energy Source for Cultured HeLa Cells
[8]
웹사이트
On the immortality of stem cells
https://www.scienced[...]
2020-09-17
[9]
웹사이트
Germ cells: the route to immortality
https://www.cam.ac.u[...]
2020-09-17
[10]
논문
Expression of the Large T Protein of Polyoma Virus Promotes the Establishment in Culture of "Normal" Rodent Fibroblast Cell Lines
[11]
논문
Immortality of cell lines: Challenges and advantages of establishment
[12]
웹사이트
Species with Negligible Senescence
http://genomics.sene[...]
2015-04-17
[13]
웹사이트
Fission Yeast Does Not Age under Favorable Conditions, but Does So after Stress.
Current Biology
2013-10-07
[14]
논문
Hydra as a tractable, long-lived model system for senescence
2015-01-30
[15]
논문
Impact of cycling cells and cell cycle regulation on Hydra regeneration
2018-01-15
[16]
논문
Mortality patterns suggest lack of senescence in Hydra
http://www.biochem.u[...]
[17]
뉴스
This Jellyfish Can Live Forever. Its Genes May Tell Us How.
https://www.nytimes.[...]
2022-09-22
[18]
논문
Comparative genomics of mortal and immortal cnidarians unveils novel keys behind rejuvenation
2022-09-06
[19]
논문
Evidence of reverse development in Leptomedusae (Cnidaria, Hydrozoa): the case of Laodicea undulata (Forbes and Goodsir 1851)
2006
[20]
논문
Life Cycle Reversal in Aurelia sp.1 (Cnidaria, Scyphozoa)
2015-12-21
[21]
논문
Reverse development in the ctenophore Mnemiopsis leidyi
https://pnas.org/doi[...]
2024-11-05
[22]
웹사이트
Wild Discovery Reveals That Comb Jellies Can Age in Reverse
https://www.sciencea[...]
2024-11-11
[23]
논문
Human Telomerase and Its Regulation
2002
[24]
논문
Longevity of lobsters is linked to ubiquitous telomerase expression
[25]
웹사이트
Is there a 400 pound lobster out there?
http://animals.howst[...]
howstuffworks
2007-07-05
[26]
서적
Consider the Lobster and Other Essays
Little, Brown & Company
[27]
웹사이트
Biotemp
http://www.lobsters.[...]
2015-02-10
[28]
웹사이트
Don't Listen to the Buzz: Lobsters Aren't Actually Immortal
http://www.smithsoni[...]
[29]
논문
Telomere maintenance and telomerase activity are differentially regulated in asexual and sexual worms
http://www.pnas.org/[...]
2012-02
[30]
웹사이트
Schmidtea , model planarian
http://www.geochembi[...]
[31]
웹사이트
What Bodies Think About: Bioelectric Computation Outside the Nervous System - NeurIPS 2018
https://www.youtube.[...]
2018-12-05
[32]
간행물
Rapamycin fed late in life extends lifespan in genetically heterogeneous mice
http://elegans.uky.e[...]
ネイチャー
2009-07-16
[33]
웹사이트
"寿命120歳"不老薬に現実味 実は安価な糖尿病薬 米で臨床試験許可
https://www.sankei.c[...]
[34]
웹사이트
老化を治療できる時代が目前に 生成AIの活用で予防医学の革命に挑むGMOと東大
https://news.mynavi.[...]
2023-12-15
[35]
웹사이트
"老化とがんは関係しているのか"東大教授の最新研究で分かってきた"老いの正体"
https://president.jp[...]
2023-12-23
[36]
웹사이트
山中教授、iPSで「若返り」研究 国の支援継続も要望
https://www.asahi.co[...]
2023-12-14
[37]
웹사이트
藤井聡太と山中伸弥が考える「将棋棋士」と「研究者」の全盛期…知能のピークは何歳までなのか 脳細胞を若返らせる
https://gendai.media[...]
2023-12-16
[38]
웹사이트
人類の夢「不老」を可能にする?オートファジーの機構解明
https://www.sciences[...]
2024-01-04
[39]
웹사이트
老化細胞(ゾンビ細胞)の謎が分かった 老化細胞を除去する薬の開発も進行中
https://project.nikk[...]
2023-12-20
[40]
웹사이트
神経の元になる細胞「60代から10代に」 マウスで若返りに成功
https://www.asahi.co[...]
2023-12-29
[41]
웹사이트
“老化する脳を若返らせる —神経幹細胞の活性化と記憶力回復”
https://www.riken.jp[...]
2023-12-30
[42]
웹사이트
老化抑える脳細胞特定、マウス実験で寿命延長も成功…5年以内に人への応用目指す
https://www.yomiuri.[...]
2024-01-17
[43]
웹사이트
「老化細胞除去ワクチン」の開発に成功、マウス実験で 順天堂大
https://www.asahi.co[...]
2024-01-25
[44]
웹사이트
注射するだけで老化の進行を遅らせられる? 順天堂大チームが開発した「老化細胞除去ワクチン」
https://www.dailyshi[...]
2024-01-25
[45]
웹사이트
「若返り薬」を実現か――ハーバード大、細胞を若返らせる化学薬品を発見
https://engineer.fab[...]
2024-01-01
[46]
웹사이트
老化は「治癒」できる 研究者たちの相次ぐ挑戦
https://www.nikkei.c[...]
2024-01-01
[47]
웹사이트
山中伸弥教授がAltos Labs社の上級科学アドバイザーに就任しました
https://www.cira.kyo[...]
2023-12-16
[48]
웹사이트
Altos Labsとの受託研究契約締結について
https://www.cira.kyo[...]
2024-01-02
[49]
웹사이트
チャットGPTの開発者が次に狙う、人間に寿命200年もたらす新薬
https://news.biglobe[...]
2024-01-07
[50]
간행물
bioscience에서 본 노화와 수명
인간 종합 과학 대학
2001-03-31
[51]
간행물
텔로미어의 측정과 건강과의 관계
세이센 여자 대학
2006-12-26
[52]
간행물
폐암에 있어서의 텔로미어장의 변화
일본 폐암 학회
1997-04-20
[53]
논문
Mutation-causing mutations
1996
[54]
문서
DNA 수선
[55]
간행물
활성 산소와 노화・성인병
사단법인 니혼화섬 학회
1997-07-20
[56]
간행물
환경 인자에 의한 산화적 DNA 손상과 암, 노화: 제12회 공개 심포지엄: 활성 산소의 분자 병태학
일본 환경 변이원학회
2001-12-22
[57]
웹사이트
불사의 베니크라게와 요절의 카이야드리히드라크라게
http://www.benikurag[...]
[58]
논문
Rapamycin fed late in life extends lifespan in genetically heterogeneous mice
http://elegans.uky.e[...]
2009-07-16
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com