플라빈 아데닌 다이뉴클레오타이드
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
플라빈 아데닌 다이뉴클레오타이드(FAD)는 아데노신 일인산(AMP)과 플라빈 모노뉴클레오타이드(FMN)가 인산기를 통해 연결된 조효소이다. 1879년 우유에서 처음 발견되었으며, 산화환원 반응의 촉매 작용에 필수적인 역할을 한다. FAD는 두 개의 수소 이온과 두 개의 전자를 얻어 FADH₂로 환원될 수 있으며, 산화 상태에 따라 수용액에서 특정 색상을 띤다. FAD는 생체 내에서 전자를 수용하거나 공여하는 역할을 하며, 다양한 효소의 보조 인자로서 작용하여 전자 전달, DNA 복구, 대사 경로 등에 관여한다. FAD는 리보플라빈(비타민 B₂)에서 유래하며, FAD를 사용하는 플라보단백질은 약물 설계, 광유전학, 치료 모니터링 등 다양한 임상적 중요성을 가진다.
더 읽어볼만한 페이지
- 플라빈 - 플라빈 모노뉴클레오타이드
플라빈 모노뉴클레오타이드는 식품의 색상을 개선하는 데 사용되는 오렌지-레드색의 식품 첨가 색소로, 아이소알록사진 고리와 인산기를 포함하는 구조를 가지며, 섭취 후 리보플라빈으로 전환되는 나트륨 염은 아기 및 어린이를 위한 식품 등에 사용된다. - 플라빈 - 리보플라빈
리보플라빈은 비타민 B2라고도 불리는 수용성 비타민 B군으로, 에너지 대사, 세포 호흡, 항체 생산 및 성장과 발달에 필수적인 플라빈 모노뉴클레오티드(FMN)와 플라빈 아데닌 디뉴클레오티드(FAD)의 합성에 사용되는 조효소의 시작 화합물이다. - 폴리올 - 트리스(히드록시메틸)아미노메테인
트리스(히드록시메틸)아미노메테인은 생화학 및 분자생물학 실험에서 완충액의 주요 성분으로 널리 사용되며, pH 7-9 범위에서 유용한 완충 능력을 가지고 TE, TAE, TBE 완충액 제조 및 COVID-19 백신 구성 성분으로도 활용되지만, 온도와 농도에 따라 pH가 민감하게 변하고 일부 효소를 억제하는 단점도 가진다. - 폴리올 - 3-메톡시-4-하이드록시페닐글리콜
- 보조 인자 - 피롤로퀴놀린 퀴논
피롤로퀴놀린 퀴논(PQQ)은 세균에서 발견되는 산화환원 반응 보조 인자로서, 여러 효소 활성에 관여하고 단백질과 결합하여 퀴노프로테인을 형성하며, 항산화 및 신경 보호 작용을 하는 것으로 알려졌지만 포유류 필수 영양소 여부는 불확실하고 코코아, 모유, 낫토 등에 존재한다. - 보조 인자 - 필로퀴논
필로퀴논은 비타민 K₁이라고도 불리는 지용성 비타민으로, 동물에서는 혈액 응고와 뼈 형성에, 식물과 시아노박테리아에서는 광합성에 중요한 역할을 하며, 의학적으로는 출혈 장애 치료와 비타민 K 결핍증 예방에 사용된다.
2. 역사
플라보단백질은 1879년 우유 성분을 분리하면서 처음 발견되었다. 처음에는 우유에서 나왔고 노란색 색소를 띠었기 때문에 락토크롬(lactochrome)이라고 불렸다.[55] 과학계가 이 노란색 색소의 원인이 되는 분자를 확인하는 데 50년이 걸렸다. 1930년대에는 여러 플라빈과 니코틴아마이드 유도체의 구조가 발표되고, 산화환원반응의 촉매 작용에 필수적인 역할을 하는 조효소 연구가 시작되었다. 독일 과학자 오토 하인리히 바르부르크와 발터 크리스티안은 1932년 세포 호흡에 필요한 효모 유래의 노란색 단백질을 발견했다. 그들의 동료 휴고 테오렐은 이 노란색 효소를 주효소와 노란색 색소로 분리했고, 주효소나 색소만으로는 NADH를 산화시킬 수 없지만, 이 둘을 다시 섞으면 NADH 산화 효소 활성이 회복된다는 것을 보였다. 1937년 테오렐은 이 색소가 리보플라빈 인산 에스터인 플라빈 모노뉴클레오타이드(FMN)이며, 효소의 보조 인자에 대한 최초의 직접적인 증거임을 확인했다.[36] 1938년 바르부르크와 크리스티안은 비슷한 실험을 통해 FAD가 D-아미노산 산화효소의 보조 인자임을 발견했다.[37] 바르부르크가 니코틴아마이드와 수소화물 전달을 연결하고 플라빈을 발견한 연구는 1940년대와 1950년대에 많은 과학자들이 수많은 생화학 산화환원반응을 발견하고, 시트르산 회로와 ATP 합성 같은 대사 경로에 연결하는 길을 열었다.
플라빈 아데닌 다이뉴클레오타이드(FAD)는 아데닌 뉴클레오타이드(아데노신 일인산, AMP)와 플라빈 모노뉴클레오타이드(FMN)가 인산기를 통해 결합된 구조이다. 아데닌은 리보스의 1' 탄소에, 인산은 리보스의 5' 탄소에 결합하여 아데닌 뉴클레오타이드를 형성한다. 리보플라빈은 아이소알록사진과 리비톨 사이의 탄소-질소(C-N) 결합으로 형성되며, 이후 인산기가 리비톨 말단 탄소에 결합하여 FMN을 형성한다. 아이소알록사진과 리비톨 사이의 결합은 글리코사이드 결합이 아니므로 FMN은 엄밀히 말해 뉴클레오타이드가 아니며,[38] 이 때문에 다이뉴클레오타이드라는 명칭은 오해의 소지가 있지만, FMN은 구조 및 화학적 특성에서 뉴클레오타이드와 매우 유사하다.
생물체에서 완전히 산화된 형태인 FAD는 H− 및 e−의 수용체로, FADH는 수용체나 공여체로, 환원된 FADH2는 공여체로 작용한다. 아래의 도표는 일어날 수 있는 위치 에너지의 변화를 요약한 것이다.
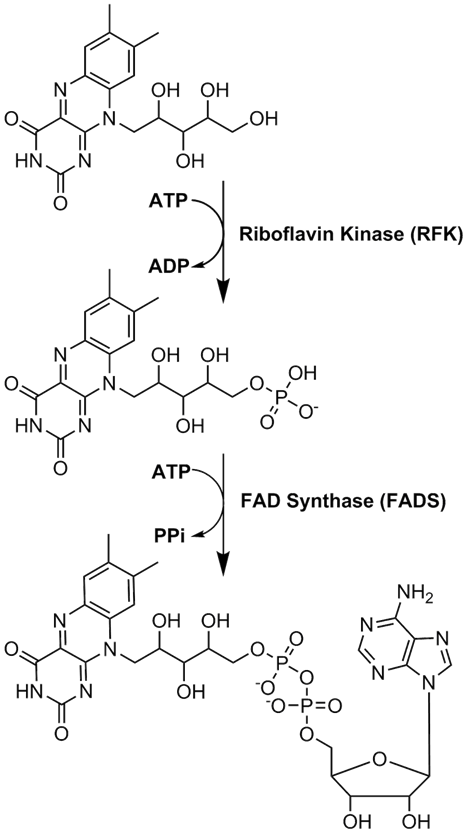
FAD는 리보플라빈에서 유래하는 또 다른 분자인 플라빈 모노뉴클레오타이드와 함께 효소 보조 인자로서 중요한 역할을 한다.[39] 세균, 균류, 식물은 리보플라빈을 생성할 수 있지만, 사람과 같은 다른 진핵생물들은 리보플라빈을 만드는 능력을 상실했다.[43] 그러므로 사람은 비타민 B2로도 알려진 리보플라빈을 음식물에서 섭취해야 한다.[57] 리보플라빈은 일반적으로 소장에서 흡수되고, 운반 단백질을 통해 세포로 운반된다.[43] 리보플라빈 키네이스(EC 2.7.1.26)가 리보플라빈에 인산기를 추가하여 플라빈 모노뉴클레오타이드를 생성한 다음, FAD 합성효소가 아데닌 뉴클레오타이드를 부착시키는데 두 효소 모두 ATP를 필요로 한다.[43] 세균은 일반적으로 한 개의 이기능성 효소를 가지고 있지만, 고균과 진핵생물은 보통 2개의 다른 효소를 사용한다.[43] 최근의 연구는 세포기질과 미토콘드리아에 다른 아이소자임이 존재한다는 것을 보여준다.[43] FAD는 세포기질과 미토콘드리아에서 모두 합성되고 필요한 곳으로 운반될 수 있는 것으로 보인다.[41]
플라보단백질은 플라빈 잔기의 다양하고 독특한 구조를 이용하여 산화환원 반응을 촉매한다. 플라빈은 여러 산화환원 상태를 가지기 때문에, 한 개 또는 두 개의 전자, 수소 원자, 하이드로늄 이온(H3O+) 전달을 포함하는 과정에 참여할 수 있다. 완전히 산화된 플라빈 고리의 N5와 C4a는 친핵성 공격을 받기 쉽다.[44] FAD 잔기의 이온화와 변형의 다양성은 아이소알록사진 고리 시스템과 FAD를 포함하여 결합시 플라빈의 반응속도 매개변수를 크게 교란시키는 플라보단백질의 능력에 기인할 수 있다.
플라보단백질은 FMN 또는 FAD를 보결분자단으로 갖는 단백질이다. 이 보결분자단은 플라보단백질과 강하게 결합하거나 공유 결합으로 연결될 수 있다. 플라보단백질 중 약 5~10% 만이 FAD와 공유 결합으로 연결되어 있는데, 이들은 더 강력한 산화환원력을 갖는다.[41] FAD는 경우에 따라 활성 부위에 대한 구조적 지지를 제공하거나 촉매 작용 동안 중간생성물의 안정화를 제공할 수 있다.[49] 알려진 FAD 결합 부위는 200개 이상으로 분류될 수 있다.[51]
3. 특성
FAD는 2 H+ 및 2 e−를 얻어 FADH2로 환원될 수 있다. FADH2는 1 H+ 와 1 e−를 잃어 FADH로 산화될 수 있으며, FADH는 추가로 1 H+ 와 1 e−를 잃어 FAD로 산화될 수 있다. FAD는 플라빈-N(5)-옥사이드의 환원 및 탈수를 통해서도 생성될 수 있다.[39]
산화 상태에 따라 플라빈은 수용액에서 특정 색상을 띤다. 플라빈-N(5)-옥사이드(초과산화)는 노란-오렌지색, FAD(완전히 산화)는 노란색, FADH(반쯤 환원)는 pH에 따라 파란색 또는 빨간색, 완전히 환원된 형태는 무색이다.[43][40] 산화환원 형태 변화는 화학적 특성에 큰 영향을 미치는데, 예를 들어 FAD는 친핵성 공격의 대상이고, FADH2는 높은 분극률을 가지며, 반쯤 환원된 형태는 수용액에서 불안정하다.[41] FAD는 방향족 고리 시스템이지만, FADH2는 그렇지 않다. 이는 FADH2가 방향족 구조의 공명 안정화 없이 에너지가 높아, 산화 시 방향족성을 회복하며 에너지를 방출하는 에너지 운반 분자임을 의미한다.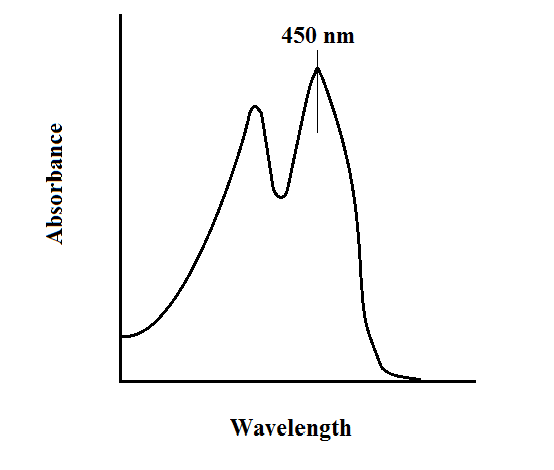
FAD 및 그 변이체의 분광학적 특성은 자외선 가시광선 분광법 및 형광 분광법으로 조사할 수 있다. FAD의 각 형태는 흡광도 스펙트럼이 다르므로 산화 상태 변화를 쉽게 관찰할 수 있다.[41] FAD의 주요 국소 흡광도 최대치는 450 nm에서 관찰되며, 흡광 계수는 11,300 M−1 cm−1이다.[42] 플라빈은 비결합 시 형광 활성을 가지며(플라빈 핵산 유도체 결합 단백질은 플라보단백질이라 함), 결합 상태에서 형광 활성 소실을 관찰하여 단백질 결합 검사에 활용할 수 있다.[41] 산화된 플라빈은 약 450 nm에서 높은 흡광도를, 약 515~520 nm에서 형광을 낸다.[43]
4. 화학적 상태
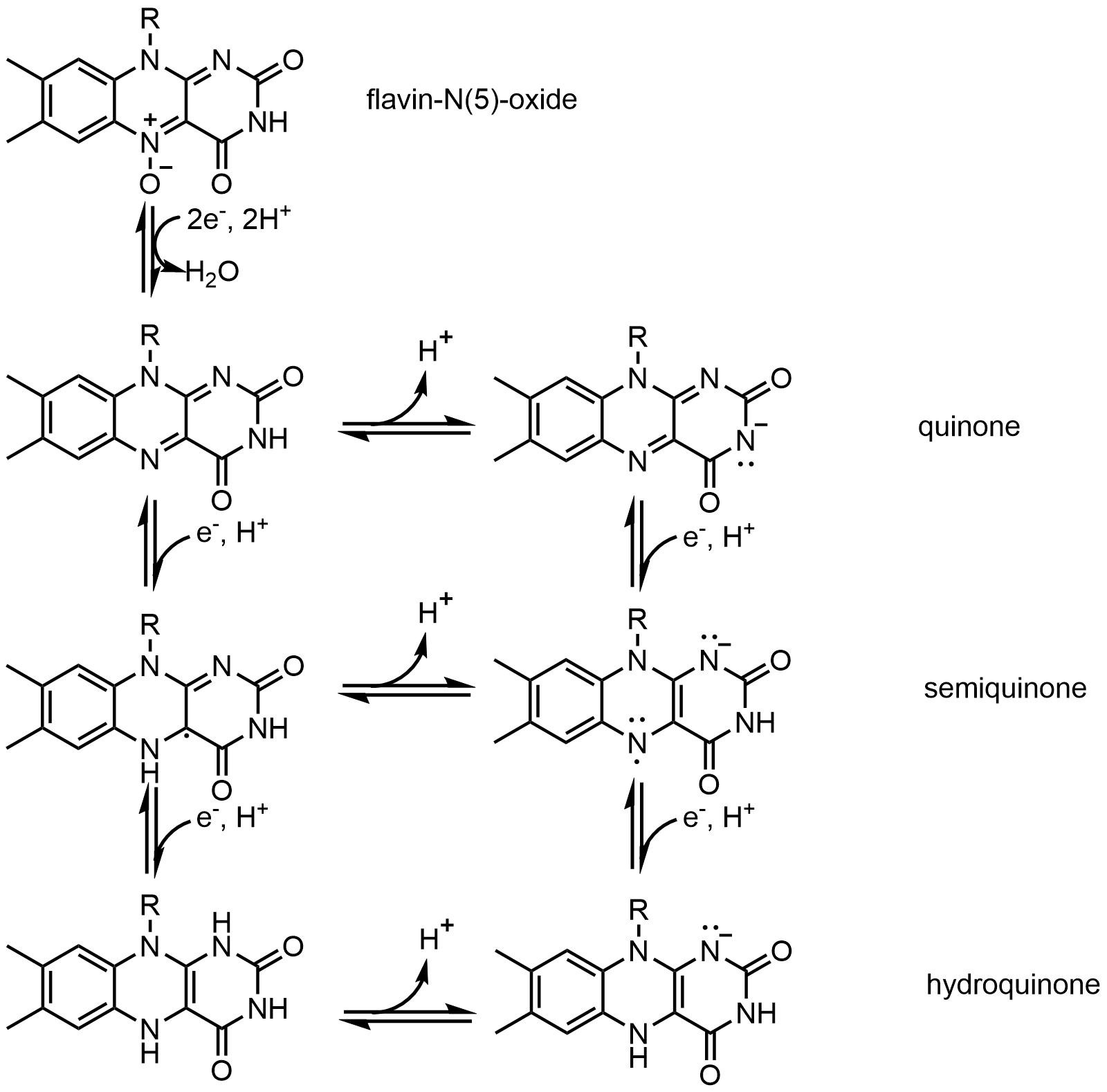
위의 도표처럼 FAD의 다른 반응 형태들이 형성되고 소비될 수 있다. 이러한 반응들은 전자의 전달과 화학 결합의 생성/분해를 포함한다. 반응 메커니즘을 통해 FAD는 생물체 내에서의 화학 반응에 기여할 수 있다.
메커니즘 1과 2는 하이드라이드를 얻는 것을 나타내며, 분자는 1개의 하이드라이드 이온에 해당하는 양을 얻는다. 메커니즘 3과 4는 라디칼의 형성 및 하이드라이드의 소실 과정이다. 라디칼은 전자쌍을 이루고 있지 않은 전자를 가진 원자를 포함하며, 화학적으로 반응성이 매우 크다. 하이드라이드의 소실은 이전의 하이드라이드를 얻는 과정의 역과정이다. 메커니즘 5와 6은 친핵성 첨가반응과 탄소 라디칼을 이용한 반응을 보여준다.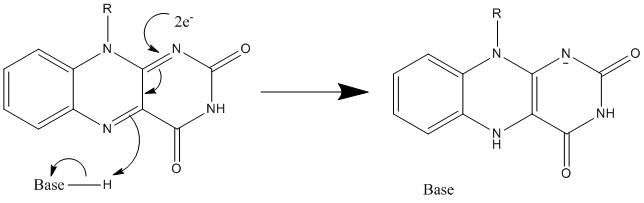
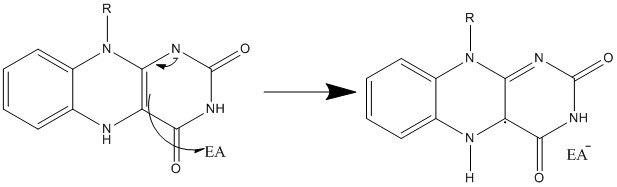
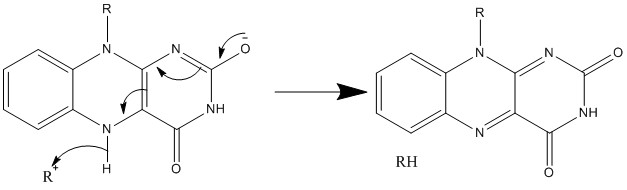
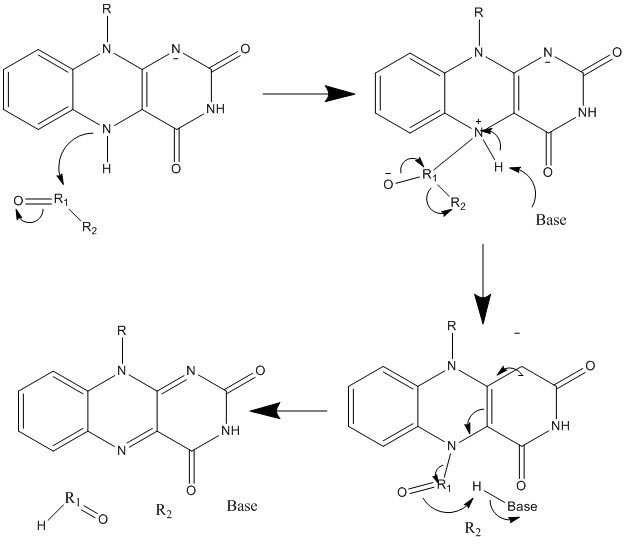
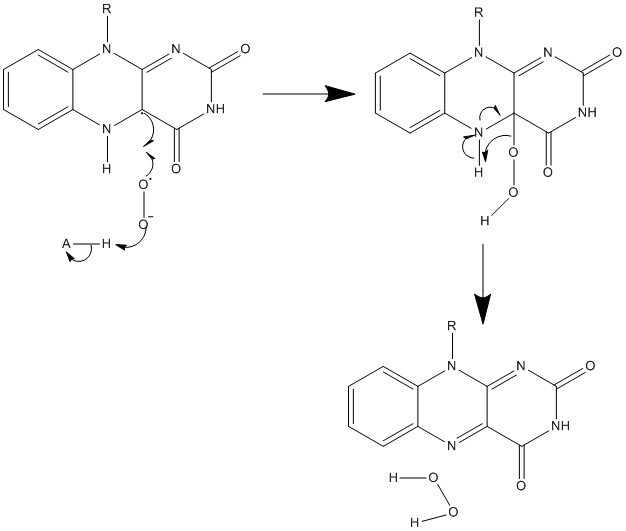
5. 생합성
6. 기능
게놈(플라보프로테옴)에서 플라빈 의존성 단백질을 암호화하고 있는 유전자의 수는 생물 종에 따라 다르며, 0.1%~3.5%의 범위일 수 있으며, 사람은 90개의 플라보단백질을 암호화하고 있는 유전자를 가지고 있다.[45] FAD는 플라빈의 보다 복잡하고 풍부한 형태이며, 전체 플라보프로테옴의 75%[45] 및 사람에서 발현되는 플라보단백질들의 84%에 결합하는 것으로 보고되었다.[46] 포유류의 다양한 배양 세포주에서 유리 플라빈 또는 비공유결합 플라빈의 세포 내 농도는 FAD(2.2~17.0 amol/세포), FMN(0.46~3.4 amol/세포)로 보고되었다.[47]
FAD는 NAD+보다 더 큰 환원전위를 가지며, 매우 강력한 산화제이다. 세포는 C-C 결합을 알켄으로 탈수소화하는 것과 같은 에너지적으로 어려운 많은 산화반응에 FAD를 이용한다. FAD-의존성 단백질은 전자전달, DNA 복구, 뉴클레오타이드 생합성, 지방산의 베타 산화, 아미노산의 이화작용, CoA, CoQ, 헴기와 같은 보조 인자의 합성을 포함한 다양한 대사 경로에서 기능을 한다.
잘 알려진 반응 중 하나는 시트르산 회로의 일부이다. 석신산 탈수소효소(전자전달계의 복합체 II)는 유비퀴논을 유비퀴놀로 환원시키는 것과 석신산을 푸마르산으로 산화시키는 것을 짝지어 촉매하기 위해 효소에 공유결합된 FAD를 필요로 한다.[41] 이러한 산화로부터 나오는 고에너지 전자는 FAD를 FADH2로 환원시킴으로써 저장된다. FADH2는 전자전달계를 통해 두 개의 고에너지 전자를 전달하고 다시 FAD로 산화된다. FADH2의 에너지는 산화적 인산화에 의해 1.5 당량의 ATP를 생성하기에 충분하다.[48]
FAD와 비공유결합을 하는 플라보단백질에는 지방산의 베타 산화 및 류신(아이소발레릴-CoA 탈수소효소), 아이소류신(짧은/가지사슬 아실-CoA 탈수소효소), 발린(아이소뷰티릴-CoA 탈수소효소), 리신(글루타릴-CoA 탈수소효소)과 같은 아미노산의 분해와 관련이 있는 아실-CoA 탈수소효소가 있다.[49] 물질대사를 조절하는 FAD-의존성 효소의 또 다른 예로는 글리세롤 3-인산 탈수소효소와 퓨린 뉴클레오타이드의 분해에 관여하는 잔틴 산화효소가 있다.[50]
FAD의 다른 비촉매적 역할로는 플라보단백질에서 구조적 역할을 수행하거나, 생물 발광을 하는 세균에서 생체 시계, 성장, 빛의 발생을 조절하는 청색광 수용체와 관련된 역할도 있다.[49]
7. 플라보단백질
사람에는 90종의 플라보단백질이 있으며, 이 중 약 84%는 FAD를, 약 16%는 FMN을 필요로 한다. 5가지 단백질은 FAD와 FMN 둘 다를 필요로 한다.[46] 플라보단백질은 주로 미토콘드리아에 위치하는데, 이는 자신의 산화환원력 때문이다.[46] 전체 플라보단백질 중 90%는 산화환원효소로 산화환원반응을 수행하고, 나머지 10%는 전이효소, 분해효소, 이성질화효소, 연결효소이다.[45]
7. 1. 탄소-헤테로 원자 결합의 산화
플라보단백질은 FMN 또는 FAD 분자를 보결 분자단으로 가지는 효소로, 탄소-헤테로 원자 결합의 산화 반응을 촉매한다. 플라보단백질의 약 5-10%만이 공유 결합된 FAD를 가지지만, 이러한 효소는 더 강력한 산화 환원력을 가진다.[9] FAD는 활성 부위에 대한 구조적 지지 역할을 하거나 촉매 작용 중 중간체를 안정화할 수 있다.[18]
인간 게놈에는 90개의 플라보단백질이 암호화되어 있으며, 약 84%는 FAD, 약 16%는 FMN을 필요로 하고, 5개의 단백질은 둘 다 필요로 한다.[15] 플라보단백질은 주로 미토콘드리아에 위치하며,[15] 90%는 산화 환원 반응을, 나머지 10%는 전이 효소, 분해 효소, 이성질화 효소, 결합 효소 반응을 수행한다.[14]
탄소-헤테로 원자 결합 산화 반응에는 탄소-질소 결합, 탄소-산소 결합, 탄소-황 결합의 산화가 있다.
7. 1. 1. 탄소-질소
모노아민 산화효소(MAO)는 노르에피네프린, 세로토닌, 도파민의 이화작용에 중요한 역할을 하는 플라보효소(flavoenzyme)이다. 모노아민 산화효소는 1차 아민, 2차 아민, 3차 아민을 산화시킨 후, 이민에서 알데하이드 또는 케톤으로 비효소적 가수분해를 일으킨다.[52] 이 효소의 작용 메커니즘은 라디칼 메커니즘과 친핵성 메커니즘 두 가지가 제안되었으나, 라디칼 중간생성물의 증거가 부족하여 일반적으로 친핵성 메커니즘이 더 선호된다. 친핵성 메커니즘은 기질의 친핵성을 증가시키는 두 개의 티로신 잔기를 돌연변이시킨 부위 특이적 돌연변이 유발 연구에 의해 지지된다.[52]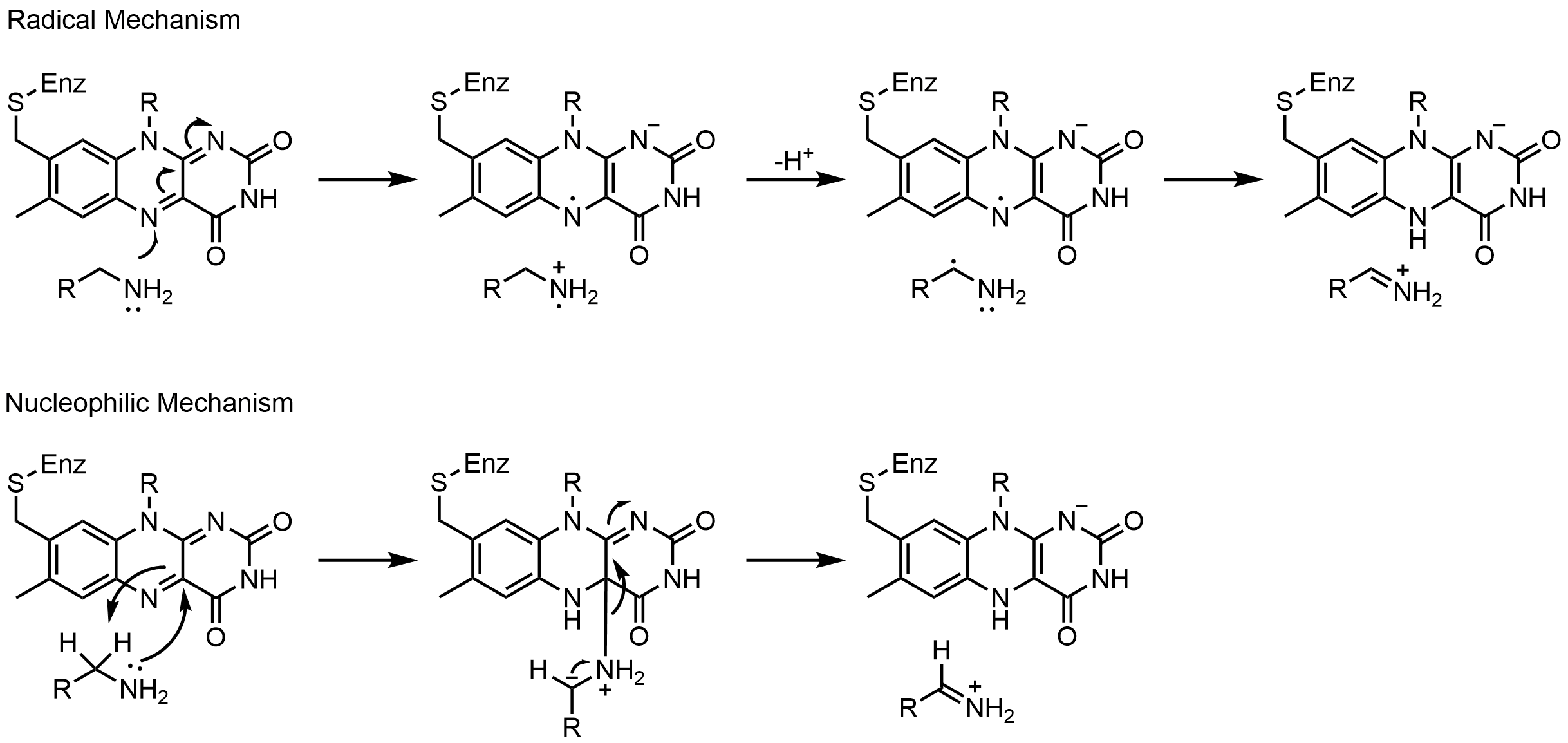
7. 1. 2. 탄소-산소
글루코스 산화효소(GOX)는 β-D-글루코스를 D-글루코노-δ-락톤으로 산화시키는 반응을 촉매하며, 이 과정에서 효소에 결합된 플라빈을 환원시킨다. 글루코스 산화효소는 각 소단위체가 하나의 FAD 분자와 결합하는 호모다이머(homodimer) 형태로 존재한다. 결정 구조를 통해 FAD가 이량체 경계면 근처 효소 깊숙한 곳에 결합한다는 사실이 밝혀졌다. 연구에 따르면 FAD를 8-하이드록시-5-카바-5-데자 FAD(8-hydroxy-5-carba-5-deaza FAD)로 대체했을 때, 반응의 입체화학은 플라빈의 전면과 반응하여 결정된다. 이 회전 과정에서 라디칼 메커니즘을 나타내는 중성 및 음이온 세미퀴논이 관찰된다.[52]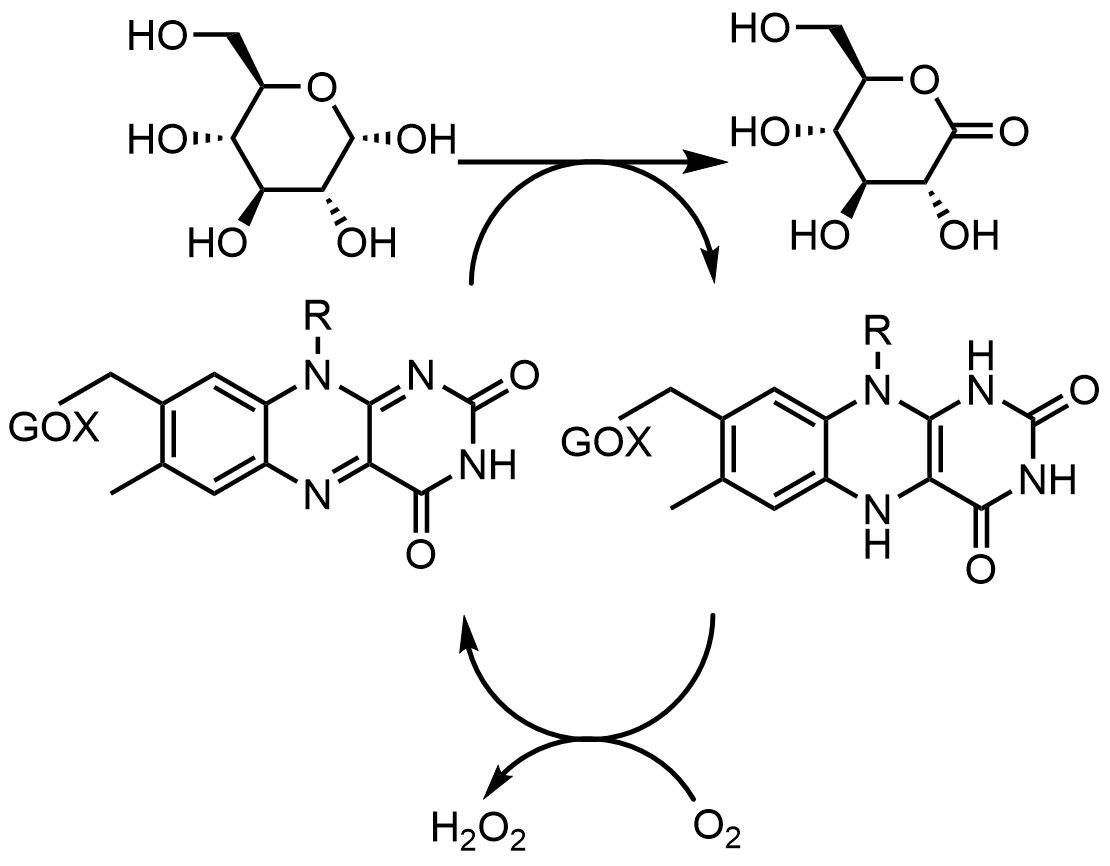
7. 1. 3. 탄소-황
프레닐시스테인 분해효소(PCLase)는 프레닐시스테인(단백질 변형)의 분해를 촉매하여 아이소프레노이드 알데하이드와 유리된 시스테인 잔기를 단백질 표적에 형성한다. FAD는 프레닐시스테인 분해효소에 비공유결합되어 있다. 플라빈 반응에 대한 메커니즘 연구는 많이 이루어지지 않았지만, 제안된 메커니즘은 다음과 같다. 프레닐 잔기의 C1에서 FAD로 수소화물이 전달되면 플라빈이 FADH2로 환원되고 이웃하는 황 원자에 의해 안정화된 탄소 양이온이 형성될 것으로 제안되었다. FADH2는 산소 분자와 반응하여 산화된 효소를 회복시킨다.[52]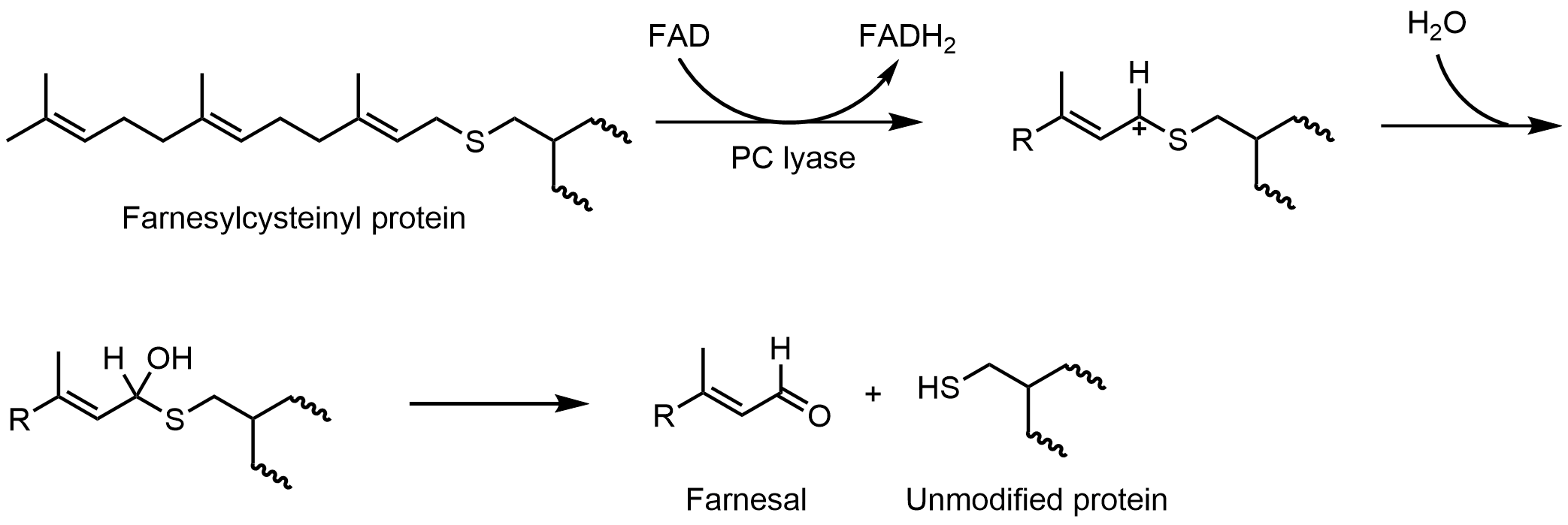
7. 2. 탄소-탄소
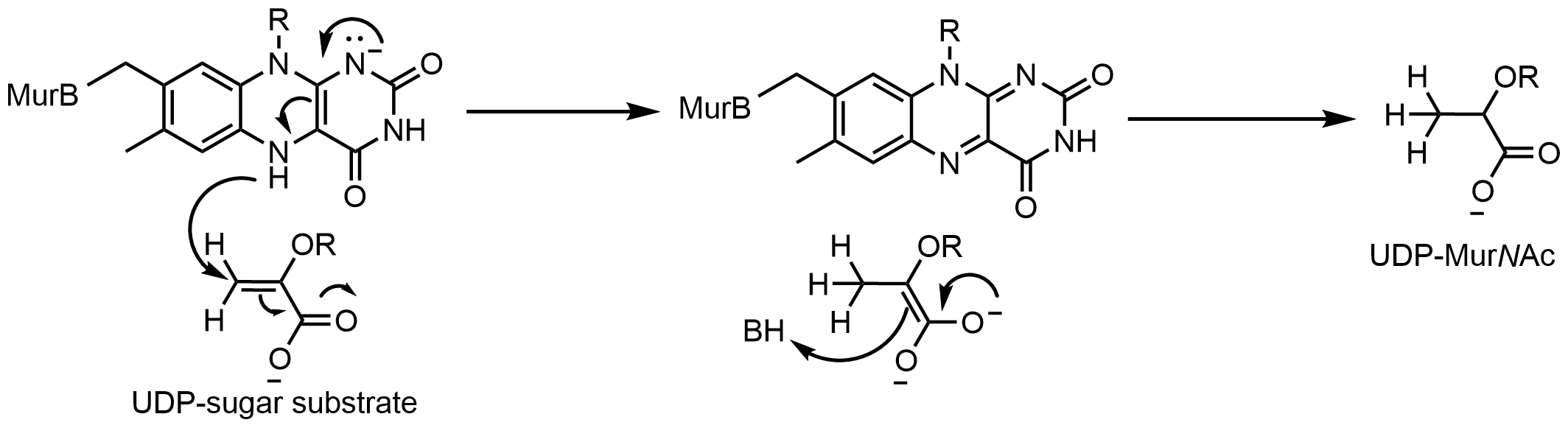
UDP-N-아세틸에놀피루빌글루코사민 환원효소(MurB)는 에놀피루빌-UDP-N-아세틸글루코사민(기질)을 UDP-N-아세틸무람산(생성물)으로 NADPH 의존성 환원을 촉매하는 효소이다. UDP-N-아세틸에놀피루빌글루코사민 환원효소는 단량체이며, FAD 한 분자를 포함하고 있다. 기질이 생성물로 전환되기 전에 NADPH는 먼저 FAD를 환원시켜야 한다. 일단 NADP+가 해리되면, 기질이 결합할 수 있고, 환원된 플라빈은 생성물을 환원시킬 수 있다.[52]
7. 3. 티올/이황화물 화학
글루타티온 환원효소(GR)는 글루타티온 이황화물(GSSG)을 글루타티온(GSH)으로 환원시키는 반응을 촉매한다. 글루타티온 환원효소는 이 반응을 촉진하기 위해 FAD와 NADPH를 필요로 한다. 먼저 NADPH에서 FAD로 하이드라이드를 전달해야 한다. 환원된 플라빈은 이황화물을 공격하기 위한 친핵체로써 작용할 수 있으며, 이는 C4a-시스테인 부가물을 생성한다. 이 부가물을 제거하면 플라빈-티올레이트 전하이동 복합체가 생성된다.[52]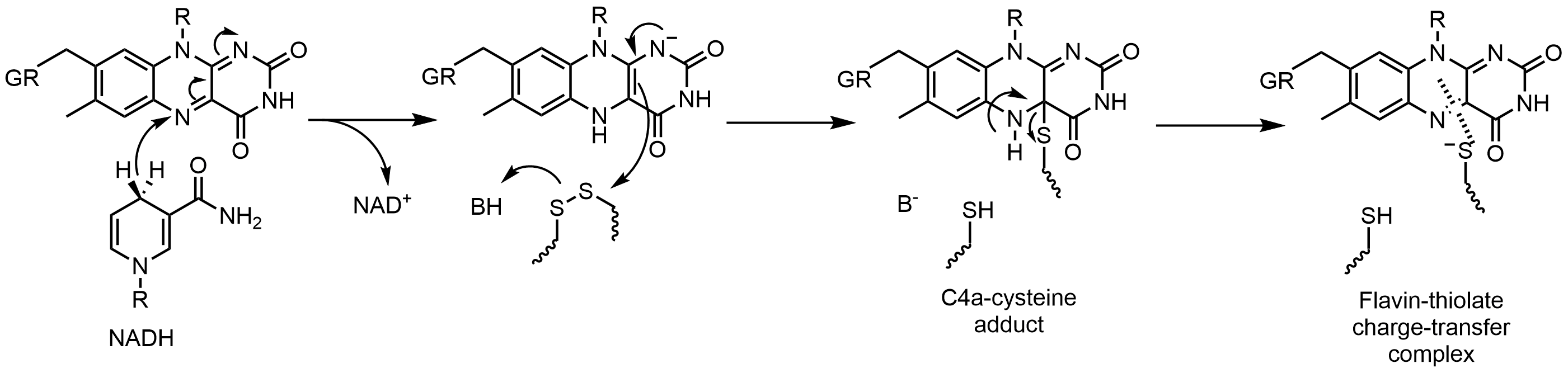
7. 4. 전자전달 반응
사이토크롬 P450 환원효소에는 FMN과 FAD가 모두 포함되어 있다. 전자는 NADPH에서 사이토크롬 P450 환원효소의 FAD로 전달된 다음 FMN으로 전달되고, 마지막으로 사이토크롬 P450의 헴 보조 인자로 전달된다. 환원 적정에서 FMN과 FAD는 모두 중성 세미퀴논으로 존재할 수 있는 것으로 밝혀졌다. 플라빈들은 단지 약 4Å 떨어져 있는데, 이는 전자가 그들 사이에서 직접적으로 전달된다는 것을 시사하고 있다.[52]
아드레노독신 환원효소는 효소의 FAD-결합 도메인에 박혀있는 FAD를 포함한다.[53] 아드레노독신 환원효소는 NADP-결합 도메인에서 NADPH와 결합한다. 아드레노독신 환원효소의 구조는 효율적인 전자전달을 위해 전자공여체인 NADPH와 전자수용체인 FAD의 정렬을 정확하게 유지하는 것으로 보아 확실하게 보존된다.[53]
마이크로솜의 환원효소의 구조와 미토콘드리아 P450 시스템의 환원효소의 구조는 완전히 다르며, 어떠한 상동성도 보이지 않는다.[54]
7. 5. 산화환원반응
''p''-하이드록시벤조에이트 하이드록실레이스(PHBH)는 ''p''-하이드록시벤조에이트(''p''OHB)를 3,4-다이하이드록시벤조에이트(3,4-diOHB)로 산소첨가하는 반응을 촉매한다. FAD, NADPH 및 산소 분자가 모두 이 산소첨가 반응에 필요하다. NADPH는 먼저 FAD로 하이드라이드를 전달하여 FADH−를 생성하고, 이후 NADP+는 효소로부터 분리된다. 환원된 ''p''-하이드록시벤조에이트 하이드록실레이스는 산소 분자와 반응하여 플라빈-C(4a)-하이드로퍼옥사이드를 생성한다. 플라빈 하이드로퍼옥사이드는 ''p''-하이드록시벤조에이트를 빠르게 하이드록실화한 다음, 물을 제거하여 산화된 플라빈을 재생한다.[52] 플라빈 매개 산소 첨가 메커니즘은 플라빈-C(4a)-(하이드로)퍼옥사이드보다는 플라빈-N(5)-옥사이드를 사용하는 대체 메커니즘이다.[34][35]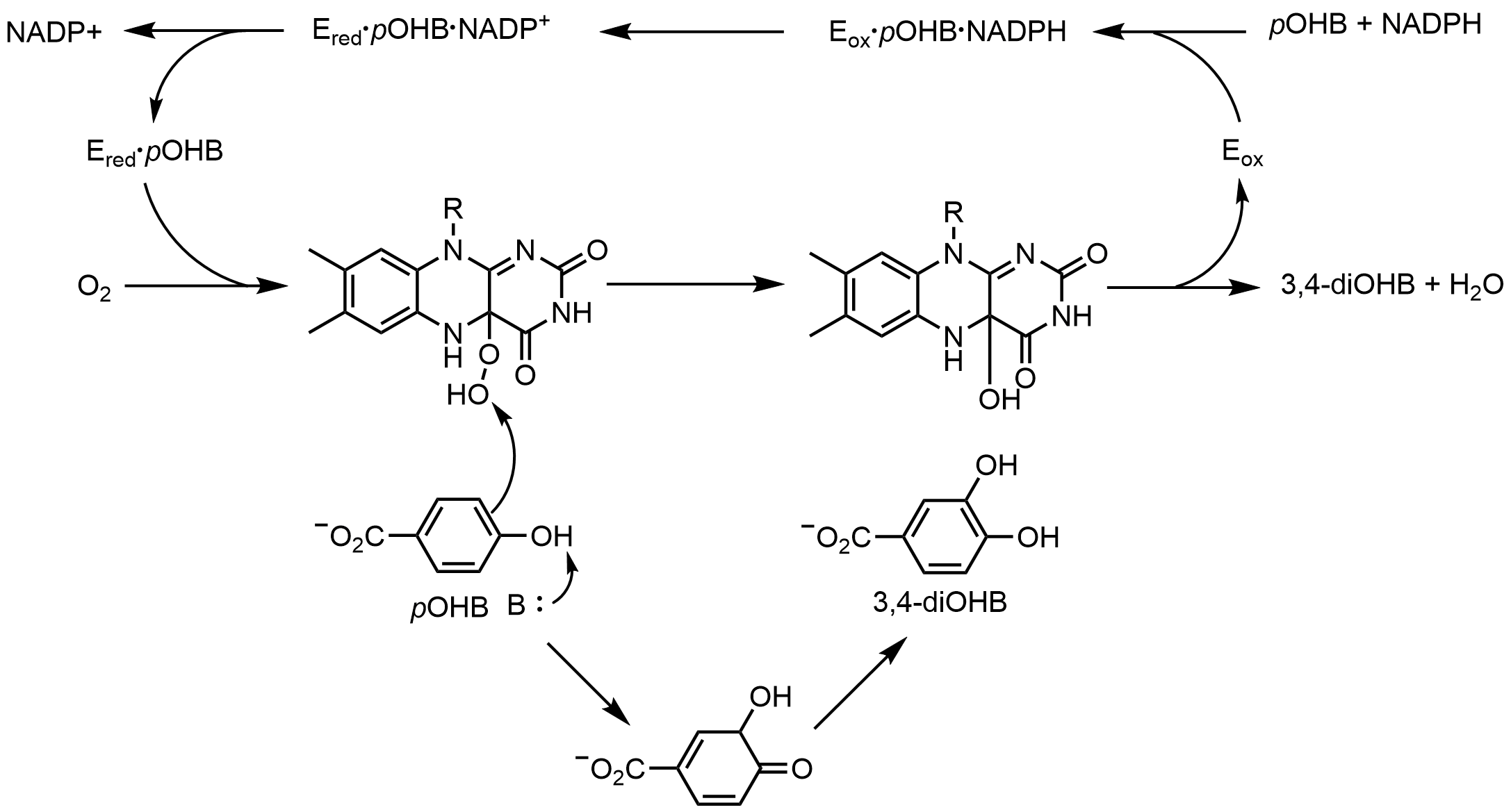
7. 6. 비산화환원반응
코리슴산 생성효소(CS)는 시킴산 경로의 마지막 단계인 코리슴산의 생성을 촉매한다. 코리슴산 생성효소에는 두 가지 부류가 있는데, 둘 다 FMN을 필요로 하지만, 환원제로써 NADPH를 필요로 하는 부류와 필요로 하지 않는 부류가 있다. 코리슴산 생성효소에 대해 제안된 메커니즘은 라디칼들을 포함한다. 라디칼 플라빈은 기질 유사체를 사용하지 않고, 분광학적으로 검출되지 않기 때문에 수명이 짧을 것으로 제안되었다. 그러나 플루오린화 기질을 사용시 중성 플라빈 세미퀴논이 검출되었다.[52]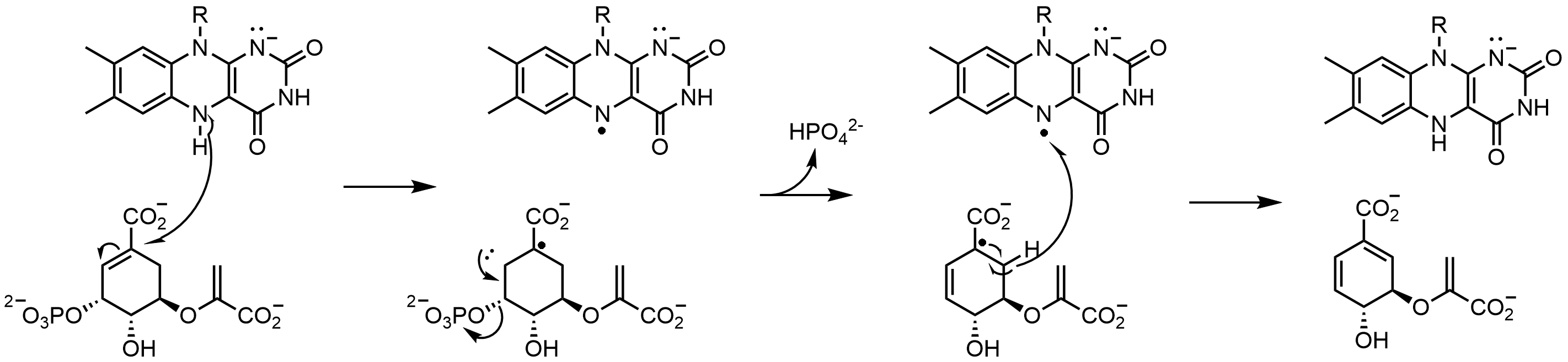
8. 임상적 중요성
플라보단백질은 인체에서 중요한 역할을 하며, 이 단백질의 돌연변이는 다양한 질병을 유발할 수 있다.[46] FAD 또는 FMN에 대한 친화력이 감소하면 리보플라빈 과다 섭취로 글루타르산혈증 2형 등의 질병 증상을 완화할 수 있다.[43] 근위축성 측색 경화증 환자는 FAD 합성 수준이 감소하며,[43] 리보플라빈 결핍은 발달 이상, 위장관 이상, 빈혈, 신경학적 문제, 암, 심혈관계 질환, 편두통 등 다양한 문제를 일으킬 수 있다.[43]
제약 업계에서는 이러한 문제를 해결하기 위해 리보플라빈을 생산하여 식단 보충제로 제공한다. 2008년 기준 리보플라빈의 전 세계 수요는 연간 6,000톤, 생산 능력은 10,000톤에 달했다.[55] 1.5억달러~5억달러 규모의 이 시장은 의료용뿐만 아니라 농업 분야에서 동물 사료 보충제 및 식품 착색제로 사용된다.[55]
항생제 내성 증가에 따라 새로운 항생제 설계는 과학 연구에서 중요한 문제이다. 세균 독성에 필수적인 FAD 사용 대사 단백질(석신산 탈수소효소)을 표적으로 하거나 FAD 유사체를 만드는 것이 유용한 연구 분야가 될 수 있다.[56] 과학자들은 FAD의 2가지 구조(확장 입체구조, 나비형 입체 구조)를 활용하여, 단백질 기능은 억제하면서 세균 감염을 막는 FAD 유사 모방 분자 개발이 가능하다.[57] 사람과 세균의 FAD 합성 효소가 매우 다르기 때문에, 세균의 FAD 생성효소를 표적으로 하는 약물 개발도 유망하다.[58]
광유전학은 비침습적인 방법으로 생물학적 사건들을 조절할 수 있도록 한다.[59] 이 분야는 최근 몇 년간 청색광 이용 FAD 도메인(Blue-Light-Utilizing FAD domains, BLUF)과 같은 빛의 감도를 유발하는 도구를 포함하여 여러 가지 새로운 도구들을 활용해 발전했다. 청색광 이용 FAD 도메인은 빛에 대한 감도를 유발하고, 이를 통해 단백질 구조 변화를 유도하여 생체 반응을 조절할 수 있다.[59]
8. 1. 플라보단백질 관련 질병
플라보단백질은 인체에서 중요한 역할을 담당하며, 이 단백질의 약 60%는 돌연변이가 발생하면 질병을 유발할 수 있다.[46] FAD 또는 FMN에 대한 친화력이 감소하는 경우, 리보플라빈을 과다 섭취하면 글루타르산혈증 2형(다중 아실 조효소 A 탈수소효소 결핍증)과 같은 질병 증상을 완화할 수 있다.[43] 리보플라빈 결핍(FAD 및 FMN 결핍)은 건강 문제를 일으키며, 근위축성 측색 경화증 환자는 FAD 합성 수준이 감소한다.[43]이러한 결핍은 발달 이상, 위장관 이상, 지방 분해 결합, 빈혈, 신경학적 문제, 암, 심혈관계 질환, 편두통, 시력 악화, 피부 병변 악화 등 다양한 증상을 유발할 수 있다.[43] 따라서 제약 업계에서는 특정 경우 식단 보충을 위해 리보플라빈을 생산한다. 2008년 기준 리보플라빈의 전 세계 수요는 연간 6,000톤, 생산 능력은 10,000톤에 달했다.[55] 1.5억달러~5억달러 규모의 이 시장은 의료용뿐만 아니라 농업 분야에서 동물 사료 보충제 및 식품 착색제로 사용된다.[55]
8. 2. 의약품 설계
일반적인 항생제에 대한 세균의 항생제 내성이 증가함에 따라 새로운 항생제 설계는 과학 연구에서 중요한 문제이다. FAD를 사용하는 특정 대사 단백질(석신산 탈수소효소)은 세균의 독성에 필수적이기 때문에 FAD 합성을 목표로 하거나 FAD 유사체를 만드는 것이 유용한 연구 분야가 될 수 있다.[56] 과학자들은 FAD의 2가지 구조를 결정했는데, 분자가 반으로 접혀서 아데닌과 아이소알록사진 고리가 쌓이는 확장 입체구조와 나비형 입체 구조가 그것이다.[57] 유사한 방식으로 결합할 수 있지만 단백질 기능을 허용하지 않는 FAD 유사 모방 분자는 세균 감염을 억제하는 유용한 메커니즘이 될 수 있다.[57] 또는 FAD 합성을 차단하는 약물이 동일한 목표를 달성할 수 있다. 사람과 세균의 FAD 합성은 매우 다른 효소들에 의존하기 때문에 세균의 FAD 생성효소를 표적으로 하는 약물은 사람의 FAD 생성효소에 영향을 주지 않을 것이다.[58]8. 3. 광유전학
광유전학은 비침습적인 방법으로 생물학적 사건들을 조절할 수 있도록 한다.[59] 이 분야는 최근 몇 년간 청색광 이용 FAD 도메인(Blue-Light-Utilizing FAD domains, BLUF)과 같은 빛의 감도를 유발하는 도구를 포함하여 여러 가지 새로운 도구들을 활용해 발전했다. 청색광 이용 FAD 도메인은 식물과 세균의 광수용체로부터 유래한 100~140개의 아미노산 서열을 가지고 있다.[59] 다른 광수용체들과 마찬가지로, 빛은 청색광 이용 FAD 도메인의 구조적인 변화를 야기하여 다운스트림 상호작용을 방해한다.[59] 현재의 연구는 청색광 이용 FAD 도메인이 추가된 단백질들과 다른 외부 요인들이 단백질에 어떻게 영향을 미칠 수 있는지를 연구한다.[59]참조
[1]
논문
Unusual flavoenzyme catalysis in marine bacteria
2016-04-01
[2]
논문
Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement.
2013-11-28
[3]
논문
Biochemical Establishment and Characterization of EncM's Flavin-N5-oxide Cofactor
2015-07-01
[4]
서적
B Vitamins and Folate: Chemistry, Analysis, Function and Effects
The Royal Society of Chemistry
2013
[5]
논문
Isolation of the prosthetic group of the amino acid oxidase
1938
[6]
서적
Biochemistry
https://archive.org/[...]
Harcourt, Academic Press
2003
[7]
서적
Textbook of Biochemistry: with Clinical Correlations
John Wiley & Sons
2011
[8]
논문
Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement
2013-11-28
[9]
논문
Emerging concepts in the flavinylation of succinate dehydrogenase
2013-05
[10]
서적
Bioprocess Engineering: Kinetics, Sustainability, and Reactor Design
https://books.google[...]
Newnes
2012
[11]
논문
The FAD-dependent tricarballylate dehydrogenase (TcuA) enzyme of Salmonella enterica converts tricarballylate into cis-aconitate
2006-08
[12]
논문
Biosynthesis of flavin cofactors in man: implications in health and disease
2013
[13]
서적
B Vitamins and Folate: Chemistry, Analysis, Function and Effects
The Royal Society of Chemistry
2013
[14]
논문
Flavogenomics--a genomic and structural view of flavin-dependent proteins
2011-08
[15]
논문
The human flavoproteome
2013-07
[16]
논문
Quantification of riboflavin, flavin mononucleotide, and flavin adenine dinucleotide in mammalian model cells by CE with LED-induced fluorescence detection
2015-02
[17]
서적
Biochemistry
https://archive.org/[...]
Freeman
2007
[18]
논문
The diverse roles of flavin coenzymes--nature's most versatile thespians
2007-08
[19]
웹사이트
Vitamins, Minerals, Supplements
https://themedicalbi[...]
2020-05-18
[20]
논문
Structure-based classification of FAD binding sites: A comparative study of structural alignment tools
2016-11-01
[21]
논문
Flavin-Dependent Enzymes
2010
[22]
논문
Electron transfer proteins of cytochrome P450 systems
https://www.science.[...]
[23]
논문
The structure of adrenodoxin reductase of mitochondrial P450 systems: electron transfer for steroid biosynthesis
1999-06
[24]
논문
Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme
[25]
논문
Mitochondrial cytochrome P-450scc. Mechanism of electron transport by adrenodoxin
http://www.jbc.org/c[...]
1980-04
[26]
논문
Genetic control of biosynthesis and transport of riboflavin and flavin nucleotides and construction of robust biotechnological producers
2011-06
[27]
논문
Prokaryotic assembly factors for the attachment of flavin to complex II
2013-05
[28]
논문
Conformational behavior of flavin adenine dinucleotide: conserved stereochemistry in bound and free states
2014-11
[29]
논문
The prokaryotic FAD synthetase family: a potential drug target
2013
[30]
논문
LOV to BLUF: flavoprotein contributions to the optogenetic toolkit
2012-05
[31]
논문
In vivo native fluorescence spectroscopy and nicotinamide adinine dinucleotide/flavin adenine dinucleotide reduction and oxidation states of oral submucous fibrosis for chemopreventive drug monitoring
2010
[32]
웹사이트
補酵素
https://www.sc.fukuo[...]
[[福岡大学]]理学部化学科
2021-11-20
[33]
논문
Unusual flavoenzyme catalysis in marine bacteria
2016-04-01
[34]
논문
Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement.
https://archive.org/[...]
2013-11-28
[35]
논문
Biochemical Establishment and Characterization of EncM's Flavin-N5-oxide Cofactor
2015-07-01
[36]
서적
B Vitamins and Folate: Chemistry, Analysis, Function and Effects
https://archive.org/[...]
The Royal Society of Chemistry
2013
[37]
저널
Isolation of the prosthetic group of the amino acid oxidase
1938
[38]
서적
Biochemistry
Harcourt, Academic Press
2003
[39]
서적
Textbook of Biochemistry: with Clinical Correlations
John Wiley & Sons
2011
[40]
저널
Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement
2013-11-28
[41]
저널
Emerging concepts in the flavinylation of succinate dehydrogenase
2013-05
[42]
저널
The FAD-dependent tricarballylate dehydrogenase (TcuA) enzyme of Salmonella enterica converts tricarballylate into cis-aconitate
https://archive.org/[...]
2006-08
[43]
저널
Biosynthesis of flavin cofactors in man: implications in health and disease
2013
[44]
서적
B Vitamins and Folate: Chemistry, Analysis, Function and Effects
https://archive.org/[...]
The Royal Society of Chemistry
2013
[45]
저널
Flavogenomics--a genomic and structural view of flavin-dependent proteins
2011-08
[46]
저널
The human flavoproteome
2013-07
[47]
저널
Quantification of riboflavin, flavin mononucleotide, and flavin adenine dinucleotide in mammalian model cells by CE with LED-induced fluorescence detection
2015-02
[48]
서적
Biochemistry
Freeman
2007
[49]
저널
The diverse roles of flavin coenzymes--nature's most versatile thespians
2007-08
[50]
웹인용
Vitamins, Minerals, Supplements
[51]
저널
Structure-based classification of FAD binding sites: A comparative study of structural alignment tools
2016-11-01
[52]
저널
Flavin-Dependent Enzymes
2010
[53]
저널
Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme
[54]
서적
Electron transfer proteins of cytochrome P450 systems
https://www.science.[...]
[55]
저널
Genetic control of biosynthesis and transport of riboflavin and flavin nucleotides and construction of robust biotechnological producers
2011-06
[56]
저널
Prokaryotic assembly factors for the attachment of flavin to complex II
2013-05
[57]
저널
Conformational behavior of flavin adenine dinucleotide: conserved stereochemistry in bound and free states
2014-11
[58]
저널
The prokaryotic FAD synthetase family: a potential drug target
2013
[59]
저널
LOV to BLUF: flavoprotein contributions to the optogenetic toolkit
2012-05
[60]
저널
In vivo native fluorescence spectroscopy and nicotinamide adinine dinucleotide/flavin adenine dinucleotide reduction and oxidation states of oral submucous fibrosis for chemopreventive drug monitoring
2010
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


