글리세르알데하이드 3-인산 탈수소효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
글리세르알데하이드 3-인산 탈수소효소는 세포질에서 주로 사량체 형태로 존재하는 효소로, 해당과정의 여섯 번째 단계를 촉매하여 글리세르알데하이드 3-인산을 1,3-비스포스포글리세르산으로 전환한다. 이 효소는 산화 스트레스, 세포 부착, 전사 조절, 아폽토시스 유도, 소포체-골지체 수송 등 다양한 생물학적 과정에 관여하며, 암, 신경변성과 같은 질병과 관련되어 있다. 글리세르알데하이드 3-인산 탈수소효소는 단백질 및 핵산과의 상호작용을 통해 다양한 기능을 수행하며, 코닝산과 같은 저해제에 의해 억제될 수 있다.
더 읽어볼만한 페이지
- EC 1.2.1 - 수소화효소
수소화효소는 활성 부위 금속 성분에 따라 니켈-철, 철-황, 철 수소화효소 등으로 나뉘며 미생물에서 발견되는 효소로, 수소 산화 환원 반응 촉매, 에너지 생성, 생물 정화 등 생물학적 기능 수행 및 재생 에너지 분야 응용 가능성으로 주목받는다. - EC 1.2.1 - 폼산 탈수소효소
폼산 탈수소효소는 폼산을 이산화탄소로 산화시키는 효소로, NAD 의존성과 사이토크롬 의존성 효소로 나뉘며 메틸영양생물과 혐기성 대사에서 중요하고 몰리브도프테린, 몰리브데넘, 셀레늄을 필요로 하며 전자 전달을 수행한다. - 해당 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 해당 - 글루코스
글루코스는 6개의 탄소 원자를 가진 단당류로, D-글루코스 이성질체는 덱스트로스라고도 불리며 생물체의 에너지원, 식물의 광합성 생산물, 그리고 다양한 탄수화물의 구성 성분으로서 중요한 역할을 한다. - 위키백과 특수 효과용 - 찰리 채플린
찰리 채플린은 런던 빈민가 출신으로 뛰어난 코미디 연기와 영화 연출로 세계적인 명성을 얻었으며, "작은 방랑자" 캐릭터, 슬랩스틱 코미디, 판토마임 연기, 사회 비판적 메시지, 매카시즘 시대의 탄압, 아카데미 명예상 수상 등으로 대표되는 파란만장한 삶을 살았던 영국의 배우이자 영화 감독이다. - 위키백과 특수 효과용 - 1996년 하계 올림픽
1996년 하계 올림픽은 미국 애틀랜타에서 개최되어 26개 종목 271개 세부 종목으로 구성, 197개국이 참가했으나, 센테니얼 올림픽 공원 폭탄 테러 사건과 재정적 성공, 도시 인프라 개선이라는 양면성을 남겼다.
2. 구조
정상적인 세포 조건에서, 세포질의 글리세르알데하이드 3-인산 탈수소효소는 주로 사량체로 존재한다. 글리세르알데하이드 3-인산 탈수소효소는 각각의 단일 촉매 싸이올기를 함유하고 있고 효소의 촉매 기능에 결정적인 4개의 동일한 37kDa 소단위체로 구성된다.[40][41] 핵의 글리세르알데하이드 3-인산 탈수소효소는 pH 8.3~8.7의 등전점(pI)를 가진다.[41] 주목할 점은, 효소 활성 부위의 시스테인 잔기 Cys152는 산화 스트레스에 의한 아폽토시스의 유도에 필요하다.[41] 특히 세포질의 글리세르알데하이드 3-인산 탈수소효소의 번역 후 변형은 해당과정 이외의 역할에 기능할 수 있도록 한다.[40]
글리세르알데하이드 3-인산 탈수소효소는 알려지지 않은 스플라이스 변이체로 단일 mRNA 전사체를 생성하는 단일 유전자에 의해 암호화되지만, 아이소 형태는 정자에서만 발현되는 별도의 유전자로서 존재한다.[41]
3. 반응
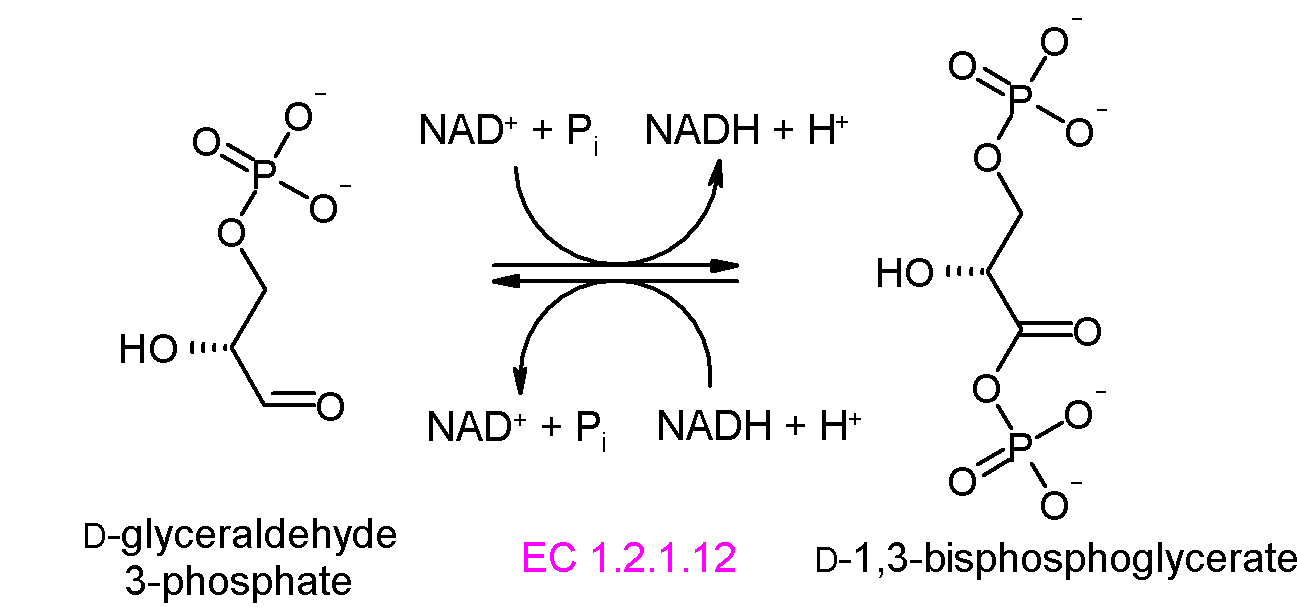
글리세르알데하이드 3-인산 탈수소효소는 글리세르알데하이드 3-인산을 1,3-비스포스포글리세르산으로 전환시키는 반응을 촉매한다. 이 반응은 해당과정의 중요한 단계 중 하나이며, 에너지 생성에 필수적이다.
이 반응은 가역적이며, NAD+와 무기 인산(Pi)을 필요로 하고, NADH와 수소 이온(H+)을 생성한다. 반응의 표준 자유 에너지 변화(ΔG'°)는 6.3 kJ/mol이다.
3. 1. 글리세르알데하이드 3-인산의 두 단계 전환
첫 번째 반응은 1번 위치에서 글리세르알데하이드 3-인산의 산화인데, 여기서 알데하이드는 카복실산으로 전환되고(ΔG°'=-50 kJ/mol (−12kcal/mol)) 동시에 NAD+는 NADH로 환원된다.
이러한 높은 에너지 방출반응의 산화 반응에 의해 방출된 에너지는 무기 인산이 글리세르알데하이드 3-인산 중간생성물로 전달되어 고에너지 인산 화합물인 1,3-비스포스포글리세르산을 형성하는 에너지 흡수반응(ΔG°'=+50 kJ/mol (+12kcal/mol))을 유발한다.
이것은 산화와 짝지어진 인산화의 예이고, 전체 반응은 다소 에너지 흡수성(ΔG°'=+6.3 kJ/mol (+1.5))이다. 여기서 에너지 짝지어짐은 글리세르알데하이드 3-인산 탈수소효소에 의해 가능해진다.
3. 2. 메커니즘
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 해당과정의 6번째 단계인 글리세르알데하이드 3-인산의 산화 및 인산화 반응에서 공유결합성 촉매 및 일반 염기 촉매를 사용하여 활성화 에너지를 낮춘다.
이 반응은 크게 두 단계로 나뉜다. 첫 번째는 글리세르알데하이드 3-인산이 산화되는 과정이고, 두 번째는 인산화 과정이다. 첫 번째 단계에서는 효소 활성 부위의 시스테인 잔기가 글리세르알데하이드 3-인산의 카보닐기를 공격하여 헤미싸이오아세탈 중간생성물을 생성하고, 히스티딘 잔기가 탈양성자화를 촉진하여 싸이오에스터 중간생성물을 형성한다. 이 과정에서 NAD+가 수소화물 이온을 받아 NADH로 환원되며, 글리세르알데하이드 3-인산은 싸이오에스터로 산화된다. 싸이오에스터는 카복실산보다 에너지가 높아 다음 단계 반응이 더 쉽게 일어날 수 있도록 돕는다.
두 번째 인산화 단계에서는 NADH가 효소를 떠난 후, 다른 NAD+ 분자가 결합하여 다음 단계의 전이상태를 안정화시킨다. 마지막으로 무기 인산이 싸이오에스터를 공격하여 1,3-비스포스포글리세르산을 생성하고, 효소의 시스테인 잔기는 싸이올기 형태로 방출된다.
3. 2. 1. 1: 산화
먼저, 글리세르알데하이드 3-인산 탈수소효소의 활성 부위에서 시스테인 잔기가 글리세르알데하이드 3-인산의 카보닐기를 공격하여 헤미싸이오아세탈 중간생성물(공유결합성 촉매)을 생성한다.
헤미싸이오아세탈은 효소의 활성 부위에 있는 히스티딘 잔기에 의해 탈양성자화(일반적 염기 촉매)된다. 탈양성자화는 다음에 생성되는 싸이오에스터 중간체에서 카보닐기의 재형성 및 수소화물 이온의 방출을 촉진한다.
다음으로 NAD+의 인접하고 밀접하게 결합된 분자는 글리세르알데하이드 3-인산으로부터 수소화물 이온을 받아들여 NADH를 형성하는 한편, 글리세르알데하이드 3-인산은 일련의 단계에서 싸이오에스터로 동시에 산화된다.
이 싸이오에스터 종은 글리세르알데하이드 3-인산 탈수소효소가 없을 때 글리세르알데하이드 3-인산이 산화되어 생성되는 카복실산 종보다 에너지가 훨씬 더 높다(덜 안정함). 이 카복실산 종은 에너지 상태가 너무 낮아 반응의 두 번째 단계(인산화)에 대한 에너지 장벽을 너무 높아지게 만들기 때문에 반응 속도가 너무 느려져 살아있는 생명체에 불리해진다.
3. 2. 2. 2: 인산화
NADH는 활성 부위를 떠나고, 다른 NAD+ 분자의 양전하가 다음 단계 및 최종 단계의 전이상태에서 음전하를 띤 카보닐 산소를 안정화시킨다. 마지막으로 무기 인산 분자가 싸이오에스터를 공격하여 사면체 중간생성물을 형성하고, 이 중간생성물은 붕괴되어 1,3-비스포스포글리세르산과 효소의 시스테인 잔기에 있는 싸이올기를 방출한다.
3. 3. 조절
글리세르알데하이드 3-인산 탈수소효소는 다른 자리 입체성 조절의 모르페인 모델을 사용할 수 있다.[42][5]
4. 기능
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 해당과정에서 글리세르알데하이드 3-인산을 1,3-비스포스포글리세르산으로 전환하는 반응을 촉매하는 효소로 잘 알려져 있다. 그러나 최근 연구에 따르면 GAPDH는 해당과정 외에도 다양한 세포 내 기능에 관여하는 것으로 밝혀졌다.
GAPDH는 미코플라스마, 연쇄상구균, 파라콕시디오이데스 브라실리엔시스, 칸디다 알비칸스와 같은 세균 및 진균에서 세포 외 기질 성분과 결합하여 부착에 기여하는 세포 부착 기능을 수행한다.[6][7][8][10] 또한, 프로바이오틱스 종의 GAPDH는 인간 결장 뮤신과 ECM에 결합하여 장내 프로바이오틱스의 정착을 돕는다.[11][12][13]
GAPDH는 ''OCA-S'' 전사 공동활성화제 복합체의 일부로서 전사를 활성화하고, 세포핵과 세포질 사이를 이동하며 대사 상태를 유전자 전사와 연결하는 역할을 한다.[43] 또한, 세포 스트레스 상황에서 ''S''-나이트로실화되어 SIAH1 단백질과 결합, 핵으로 이동하여 세포 사멸(아폽토시스)을 유도하기도 한다.[44]
산화 스트레스 조건에서 GAPDH는 해당과정에서 오탄당 인산 경로로 대사 흐름을 전환시켜 세포가 항산화 보조 인자인 NADPH를 더 많이 생성하도록 돕는 대사 스위치 역할을 한다.[46][18]
GAPDH는 소포체에서 골지체로의 소포 수송에도 관여하며, Rab2와 함께 COPI 소포 형성을 돕는다.[48]
이 외에도 GAPDH는 세포 내 철 항상성을 유지하고, 불안정한 헴에 대한 샤페론 단백질 역할을 하는 등 다양한 기능을 수행한다.[49][50]
4. 1. 물질대사
첫 번째 반응은 1번 위치에서 글리세르알데하이드 3-인산의 산화인데, 여기서 알데하이드는 카복실산(ΔG°'=-50 kJ/mol (−12kcal/mol))으로 전환되고 동시에 NAD+는 NADH로 환원된다.이러한 높은 에너지 방출성의 산화 반응에 의해 방출된 에너지는 무기 인산이 글리세르알데하이드 3-인산 중간생성물로 전달되어 고에너지 인산 화합물인 1,3-비스포스포글리세르산을 형성하는 에너지 흡수성의 두 번째 반응(ΔG°'=+50 kJ/mol (+12kcal/mol))을 유발한다.
이것은 산화와 짝지어진 인산화의 예이고, 전체 반응은 다소 에너지 흡수성(ΔG°'=+6.3 kJ/mol (+1.5))이다. 여기서 에너지 짝지어짐은 글리세르알데하이드 3-인산 탈수소효소에 의해 가능해진다.
글리세르알데하이드 3-인산 탈수소효소는 글리세르알데하이드 3-인산의 1,3-비스포스포글리세르산으로의 전환을 촉매한다. 이 반응은 진핵세포의 세포질에서 일어나는 에너지와 탄소 분자 공급의 중요한 대사 경로인 포도당의 해당과정의 6번째 단계이다. 전환은 두 단계로 구성되는데, 첫 번째 단계는 열역학적으로 유리한 단계이고, 두 번째 단계는 열역학적으로 불리한 단계이다.
4. 2. 세포 부착
글리세르알데하이드 3-인산 탈수소효소의 문라이팅 기능 중 하나는 다른 파트너와의 부착 및 결합 역할이다. 미코플라스마와 ''연쇄상구균''에서 유래된 세균성 GAPDH와 ''파라콕시디오이데스 브라실리엔시스''에서 유래된 진균성 GAPDH는 인간 세포 외 기질 성분과 결합하여 부착에 작용하는 것으로 알려져 있다.[6][7][8] GAPDH는 표면에 결합하여 부착에 기여하며 유해한 병원체의 경쟁적 배제에도 기여하는 것으로 밝혀졌다.[9] ''칸디다 알비칸스''에서 유래된 GAPDH는 세포벽에 결합되어 피브로넥틴과 라미닌에 결합하는 것으로 밝혀졌다.[10] 프로바이오틱스 종의 GAPDH는 인간 결장 뮤신과 ECM에 결합하여 인간 장내 프로바이오틱스의 식민지화를 향상시키는 것으로 알려져 있다.[11][12][13] Patel D. 등은 ''락토바실러스 아시도필루스'' GAPDH가 뮤신과 결합하여 부착에 작용한다는 것을 보여주었다.[14]4. 3. 전사 및 아폽토시스
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 자체로 전사를 활성화할 수 있다. ''OCA-S'' 전사 공동활성화제 복합체는 글리세르알데하이드 3-인산 탈수소효소 및 젖산 탈수소효소를 함유하는데, 이 두 단백질은 이전에는 대사에만 관여하는 것으로 생각되어 왔다. 글리세르알데하이드 3-인산 탈수소효소는 세포질과 세포핵 사이를 이동하여 대사 상태를 유전자 전사와 연결시킬 수 있다.[43]2005년에 하라(Hara) 외 연구진들은 글리세르알데하이드 3-인산 탈수소효소가 아폽토시스를 일으킨다는 것을 보여주었다. 이것은 제3의 기능은 아니지만, 전사 활성화에서와 같이 DNA에 글리세르알데하이드 3-인산 탈수소효소가 결합하는 것에 의해 매개되는 활성으로 볼 수 있다. 이 연구는 글리세르알데하이드 3-인산 탈수소효소가 세포 스트레스에 반응하여 일산화 탄소에 의해 ''S''-나이트로실화되어 유비퀴틴 연결효소인 SIAH1 단백질에 결합하는 것을 입증했다. 복합체는 핵으로 이동하여 SIAH1은 분해를 위해 핵 단백질을 표적으로 하여 조절된 세포 셧다운을 개시한다.[44] 후속 연구에서 연구팀은 파킨슨병을 치료하기 위해 임상적으로 사용된 데프레닐이 ''S''-나이트로실화를 방지함으로써 글리세르알데하이드 3-인산 탈수소효소의 아폽토시스 작용을 강하게 감소시켜 약물로 사용될 수 있음을 보여주었다.[45]
4. 4. 대사 스위치
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 산화 스트레스 조건에서 가역적인 대사 스위치 역할을 한다.[46][18] 세포가 산화제에 노출되면, 세포는 과도한 양의 항산화 보조 인자인 NADPH를 필요로 한다. 세포질에서 NADPH는 여러 효소에 의해 NADP+로부터 환원되는데, 그 중 세 가지 효소가 오탄당 인산 경로의 첫 번째 단계를 촉매한다. 산화제 처리로 인해 글리세르알데하이드 3-인산 탈수소효소가 비활성화된다. 이러한 비활성화는 일시적으로 대사 흐름을 해당과정에서 오탄당 인산 경로로 전환시켜 세포가 더 많은 NADPH를 생성할 수 있게 한다.[47][19] 스트레스 조건에서 NADPH는 글루타레독신과 티오레독신을 포함한 일부 항산화 시스템에 필요하며, 글루타티온의 재활용에도 필수적이다.4. 5. 소포체-골지체 수송
글리세르알데하이드 3-인산 탈수소효소는 분비된 단백질의 운반 경로의 일부인 소포체에서 골지체로의 소포 수송에도 관여하는 것으로 보인다. 글리세르알데하이드 3-인산 탈수소효소는 Rab2에 의해 소포체의 소포소관 클러스터로 모여서 COPI 소포를 형성하는 것을 돕는 것으로 밝혀졌다.[48] 글리세르알데하이드 3-인산 탈수소효소는 Src에 의한 티로신 인산화를 통해 활성화된다.[48]4. 6. 추가적인 기능
글리세르알데하이드 3-인산 탈수소효소는 다른 많은 효소들과 마찬가지로 여러 기능들을 가지고 있다. 해당과정의 6번째 단계를 촉매하는 것 외에도 최근의 연구 결과들은 글리세르알데하이드 3-인산 탈수소효소가 다른 세포 과정들에 관여하는 것으로 나타나고 있다. 글리세르알데하이드 3-인산 탈수소효소는 세포의 철 항상성,[49] 특히 세포 내 불안정한 헴에 대한 샤페론 단백질을 유지하는 맥락에서 더 높은 차수의 다기능성을 나타내는 것으로 설명되었다.[50] 이것은 연구자들에게는 놀라운 일이었지만, 새로운 단백질을 처음부터 진화시키는 대신 기존의 단백질을 재사용하고 적응시키는 것은 진화적으로 의미가 있다.5. 세포에서의 분포
글리세르알데하이드 3-인산 탈수소효소는 대부분의 조직과 세포에서 안정적이고 구성적으로 발현되기 때문에 하우스키핑 유전자로 간주된다. 이러한 이유로 글리세르알데하이드 3-인산 탈수소효소는 생물학적 연구자들에 의해 웨스턴 블롯의 부하 조절 및 qPCR의 조절 수단으로 일반적으로 사용된다. 그러나 연구자들은 특정 조건 하에서 글리세르알데하이드 3-인산 탈수소효소의 다른 조절을 보고했다.[51] 예를 들어, 전사인자 MZF1은 글리세르알데하이드 3-인산 탈수소효소 유전자를 조절하는 것으로 나타났다.[52] 저산소증은 또한 글리세르알데하이드 3-인산 탈수소효소를 강력하게 상향 조절한다.[53] 따라서 글리세르알데하이드 3-인산 탈수소효소를 부하 조절로 사용하는 것은 신중하게 고려되어야 한다.
해당과정의 모든 과정은 세포질에서 일어나며 글리세르알데하이드 3-인산 탈수소효소는 해당과정의 6번째 단계의 반응을 촉매한다. 적혈구에서 글리세르알데하이드 3-인산 탈수소효소 및 다른 해당과정의 효소들은 세포막 내부의 복합체에 모인다. 이러한 과정은 인산화 및 산소화에 의해 조절되는 것으로 보인다.[26] 해당과정의 여러 효소들이 서로 가까이 모여 있으면 포도당 분해의 전체 속도가 크게 증가할 것으로 예상된다. 최근의 연구에 의하면 글리세르알데하이드 3-인산 탈수소효소가 세포막 외부에 철 의존적 방식으로 발현되며, 세포성 철 항상성 유지에 역할을 하는 것으로 밝혀졌다.[27][28]
6. 임상적 중요성
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 여러 사람의 암에서 과발현되며, 이 효소의 발현은 종양의 진행과 양의 상관관계가 있다.[57][58][29][30] 이 효소의 해당과정 및 항아폽톱시스 기능은 종양 세포의 증식 및 보호에 기여하며 발암을 촉진한다. 특히 글리세르알데하이드 3-인산 탈수소효소는 스핑고지질인 세라마이드를 자극하는 화학요법 약물에 의해 유도된 텔로미어의 단축을 방지한다. 산화 스트레스와 같은 조건은 글리세르알데하이드 3-인산 탈수소효소의 기능을 손상시켜 세포의 노화 및 사망으로 이어지게 한다.[41][4] 글리세르알데하이드 3-인산 탈수소효소의 고갈은 종양 세포의 생물학적 노화를 유도하기 때문에 종양의 성장을 제어하기 위한 새로운 치료 전략으로 제시되었다.[59][31]
글리세르알데하이드 3-인산 탈수소효소는 몇몇 퇴행성 신경질환 및 장애와 연관되어 있다. 이러한 상호작용은 에너지 대사뿐만 아니라 글리세르알데하이드 3-인산 탈수소효소의 다른 기능에도 영향을 줄 수 있다.[40] 예를 들어, 아밀로이드 베타 전구체 단백질과 글리세르알데하이드 3-인산 탈수소효소의 상호작용은 세포골격 또는 막수송과 관련된 기능을 방해할 수 있는 반면, 헌팅틴과의 상호작용은 아폽토시스, 핵의 tRNA 수송, DNA 복제, DNA 복구와 관련된 기능을 방해할 수 있다. 또한 글리세르알데하이드 3-인산 탈수소효소의 핵 전위는 파킨슨병에서 보고되었으며, 라사길린과 같은 몇몇 항아폽토시스성 파킨슨병 약물은 글리세르알데하이드 3-인산 탈수소효소의 핵 전위를 방지하는 기능을 한다. 신경 퇴행성 질환에 글리세르알데하이드 3-인산 탈수소효소 관여의 기본 메커니즘은 명확하게 남아 있다.[60] 글리세르알데하이드 3-인산 탈수소효소 유전자의 5' UTR에서 SNP rs3741916은 후기 발병 알츠하이머병과 관련될 수 있다.[61]
6. 1. 암
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 피부 흑색종과 같은 여러 사람의 암에서 과발현되며, 이의 발현은 종양의 진행과 양의 상관관계가 있다.[57][58][29][30] 이 효소의 해당과정 및 항아폽톱시스 기능은 종양 세포의 증식 및 보호에 기여하며 발암을 촉진한다. 특히 글리세르알데하이드 3-인산 탈수소효소는 스핑고지질인 세라마이드를 자극하는 화학요법 약물에 의해 유도된 텔로미어의 단축을 방지한다. 한편, 산화 스트레스와 같은 조건은 글리세르알데하이드 3-인산 탈수소효소의 기능을 손상시켜 세포의 노화 및 사망으로 이어지게 한다.[41][4] 또한, 글리세르알데하이드 3-인산 탈수소효소의 고갈은 종양 세포의 생물학적 노화를 유도하기 때문에 종양의 성장을 제어하기 위한 새로운 치료 전략으로 제시되었다.[59][31]6. 2. 신경변성
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 주로 그 질환 또는 장애에 특이적인 다른 단백질과의 상호작용을 통해 몇몇 퇴행성 신경질환 및 장애와 연관되어 있다. 이러한 상호작용은 에너지 대사뿐만 아니라 글리세르알데하이드 3-인산 탈수소효소의 다른 기능에도 영향을 줄 수 있다.[40] 예를 들어, 아밀로이드 베타 전구체 단백질과 글리세르알데하이드 3-인산 탈수소효소의 상호작용은 세포골격 또는 막수송과 관련된 기능을 방해할 수 있는 반면, 헌팅틴과의 상호작용은 아폽토시스, 핵의 tRNA 수송, DNA 복제, DNA 복구와 관련된 기능을 방해할 수 있다. 또한 글리세르알데하이드 3-인산 탈수소효소의 핵 전위는 파킨슨병에서 보고되었으며, 라사길린과 같은 몇몇 항아폽토시스성 파킨슨병 약물은 글리세르알데하이드 3-인산 탈수소효소의 핵 전위를 방지하는 기능을 한다. 저(低)대사가 파킨슨병의 한 기여자일 수 있다고 제안되었지만, 신경 퇴행성 질환에 글리세르알데하이드 3-인산 탈수소효소 관여의 기본 메커니즘은 명확하게 남아 있다.[60] 글리세르알데하이드 3-인산 탈수소효소 유전자의 5' UTR에서 SNP rs3741916은 후기 발병 알츠하이머병과 관련될 수 있다.[61]7. 상호작용
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 단백질-단백질 상호작용을 통해 여러 가지 생물학적 기능에 참여한다.[40][3]
글리세르알데하이드 3-인산 탈수소효소는 단일 가닥 RNA[64] 및 DNA와 결합하며, 다음과 같은 핵산 결합 파트너가 확인되었다.[41]
7. 1. 단백질 결합 파트너
글리세르알데하이드 3-인산 탈수소효소(GAPDH)는 다음과 같은 물질들과 단백질-단백질 상호작용을 통해 여러 가지 생물학적 기능에 참여한다.[40][3]
7. 2. 핵산 결합 파트너
글리세르알데하이드 3-인산 탈수소효소는 단일 가닥 RNA[64] 및 DNA와 결합하며, 다수의 핵산 결합 파트너가 확인되었다.[41]8. 저해제
글리세르알데하이드 3-인산 탈수소효소(GAPDH)의 저해제는 다음과 같다.
참조
[1]
논문
GAPDH, a novel regulator of the pro-apoptotic mitochondrial membrane permeabilization
2007-04
[2]
논문
Vesicular glycolysis provides on-board energy for fast axonal transport
2013-01
[3]
논문
The diverse functions of GAPDH: views from different subcellular compartments
2011-02
[4]
논문
GAPDH: a common enzyme with uncommon functions
2012-08
[5]
논문
Dynamic dissociating homo-oligomers and the control of protein function
2012-03
[6]
논문
Role of Mycoplasma pneumoniae glyceraldehyde-3-phosphate dehydrogenase (GAPDH) in mediating interactions with the human extracellular matrix
2011-08
[7]
논문
Cloning and purification of the Streptococcus suis serotype 2 glyceraldehyde-3-phosphate dehydrogenase and its involvement as an adhesin
2004-08
[8]
논문
Glyceraldehyde-3-phosphate dehydrogenase of Paracoccidioides brasiliensis is a cell surface protein involved in fungal adhesion to extracellular matrix proteins and interaction with cells
2006-01
[9]
논문
Surface-bound proteins of Lactobacillus plantarum 423 that contribute to adhesion of Caco-2 cells and their role in competitive exclusion and displacement of Clostridium sporogenes and Enterococcus faecalis
2008-07-01
[10]
논문
The cell wall-associated glyceraldehyde-3-phosphate dehydrogenase of Candida albicans is also a fibronectin and laminin binding protein
1998-05
[11]
논문
Glyceraldehyde-3-Phosphate Dehydrogenase Increases the Adhesion of ''Lactobacillus reuteri'' to Host Mucin to Enhance Probiotic Effects
2020-12
[12]
논문
Cell surface Lactobacillus plantarum LA 318 glyceraldehyde-3-phosphate dehydrogenase (GAPDH) adheres to human colonic mucin
2008-06
[13]
논문
Cell surface glyceraldehyde-3-phosphate dehydrogenase (GAPDH) of Lactobacillus plantarum LA 318 recognizes human A and B blood group antigens
2008-11-01
[14]
논문
Cloning, expression and characterization of a mucin-binding GAPDH from Lactobacillus acidophilus
2016-10
[15]
논문
S phase activation of the histone H2B promoter by OCA-S, a coactivator complex that contains GAPDH as a key component
2003-07
[16]
논문
S-nitrosylated GAPDH initiates apoptotic cell death by nuclear translocation following Siah1 binding
2005-07
[17]
논문
Neuroprotection by pharmacologic blockade of the GAPDH death cascade
2006-03
[18]
논문
Short-term cigarette smoke exposure induces reversible changes in energy metabolism and cellular redox status independent of inflammatory responses in mouse lungs
2012-11
[19]
논문
Dynamic rerouting of the carbohydrate flux is key to counteracting oxidative stress
2007-12
[20]
논문
A GAPDH mutant defective in Src-dependent tyrosine phosphorylation impedes Rab2-mediated events
2007-06
[21]
논문
Protein moonlighting in iron metabolism: glyceraldehyde-3-phosphate dehydrogenase (GAPDH)
2014-12
[22]
논문
Glyceraldehyde-3-phosphate dehydrogenase is a chaperone that allocates labile heme in cells
2018-09
[23]
논문
GAPDH as a housekeeping gene: analysis of GAPDH mRNA expression in a panel of 72 human tissues
2005-05
[24]
논문
The glyceraldehyde 3-phosphate dehydrogenase gene (GAPDH) is regulated by myeloid zinc finger 1 (MZF-1) and is induced by calcitriol
2014-08
[25]
논문
Transcriptional profiling of lung cell populations in idiopathic pulmonary arterial hypertension
[26]
논문
Assembly and regulation of a glycolytic enzyme complex on the human erythrocyte membrane
2005-02
[27]
논문
Structural analysis of glyceraldehyde-3-phosphate dehydrogenase functional diversity
2014-12
[28]
논문
Characterization of glyceraldehyde-3-phosphate dehydrogenase as a novel transferrin receptor
2012-01
[29]
논문
Deregulation of glyceraldehyde-3-phosphate dehydrogenase expression during tumor progression of human cutaneous melanoma
2015-01
[30]
논문
The expression of glyceraldehyde-3-phosphate dehydrogenase associated cell cycle (GACC) genes correlates with cancer stage and poor survival in patients with solid tumors
2013
[31]
논문
Accelerated cellular senescence phenotype of GAPDH-depleted human lung carcinoma cells
2011-07
[32]
논문
Alteration of intracellular structure and function of glyceraldehyde-3-phosphate dehydrogenase: a common phenotype of neurodegenerative disorders?
2002-10
[33]
논문
Association and heterogeneity at the GAPDH locus in Alzheimer's disease
2012-01
[34]
논문
The macrophage cell surface glyceraldehyde-3-phosphate dehydrogenase is a novel transferrin receptor
2007-02
[35]
논문
Secreted multifunctional Glyceraldehyde-3-phosphate dehydrogenase sequesters lactoferrin and iron into cells via a non-canonical pathway
2015-12
[36]
논문
A dimer interface mutation in glyceraldehyde-3-phosphate dehydrogenase regulates its binding to AU-rich RNA
2015-01
[37]
논문
A critical review of evidence for preclinical differences between rasagiline and selegiline
2012
[38]
논문
GAPDH, a novel regulator of the pro-apoptotic mitochondrial membrane permeabilization
2007-04
[39]
논문
Vesicular glycolysis provides on-board energy for fast axonal transport
2013-01
[40]
논문
The diverse functions of GAPDH: views from different subcellular compartments
2011-02
[41]
논문
GAPDH: a common enzyme with uncommon functions
2012-08
[42]
논문
Dynamic dissociating homo-oligomers and the control of protein function
2012-03
[43]
논문
S phase activation of the histone H2B promoter by OCA-S, a coactivator complex that contains GAPDH as a key component
2003-07
[44]
논문
S-nitrosylated GAPDH initiates apoptotic cell death by nuclear translocation following Siah1 binding
2005-07
[45]
논문
Neuroprotection by pharmacologic blockade of the GAPDH death cascade
2006-03
[46]
논문
Short-term cigarette smoke exposure induces reversible changes in energy metabolism and cellular redox status independent of inflammatory responses in mouse lungs
2012-11
[47]
논문
Dynamic rerouting of the carbohydrate flux is key to counteracting oxidative stress
2007
[48]
논문
A GAPDH mutant defective in Src-dependent tyrosine phosphorylation impedes Rab2-mediated events
2007-06
[49]
논문
Protein moonlighting in iron metabolism: glyceraldehyde-3-phosphate dehydrogenase (GAPDH)
2014-12
[50]
논문
Glyceraldehyde 3-phosphate dehydrogenase is a chaperone that allocates labile heme in cells
2018-07
[51]
논문
GAPDH as a housekeeping gene: analysis of GAPDH mRNA expression in a panel of 72 human tissues
2005-05
[52]
논문
The glyceraldehyde 3-phosphate dehydrogenase gene (GAPDH) is regulated by myeloid zinc finger 1 (MZF-1) and is induced by calcitriol
2014-08
[53]
URL
https://link.springe[...]
[54]
논문
Assembly and regulation of a glycolytic enzyme complex on the human erythrocyte membrane
2005-02
[55]
논문
Structural analysis of glyceraldehyde-3-phosphate dehydrogenase functional diversity
2014-12
[56]
논문
Characterization of glyceraldehyde-3-phosphate dehydrogenase as a novel transferrin receptor
2012-01
[57]
논문
Deregulation of glyceraldehyde-3-phosphate dehydrogenase expression during tumor progression of human cutaneous melanoma
2015-01
[58]
논문
The expression of glyceraldehyde-3-phosphate dehydrogenase associated cell cycle (GACC) genes correlates with cancer stage and poor survival in patients with solid tumors
2013
[59]
논문
Accelerated cellular senescence phenotype of GAPDH-depleted human lung carcinoma cells
2011-07
[60]
논문
Alteration of intracellular structure and function of glyceraldehyde-3-phosphate dehydrogenase: a common phenotype of neurodegenerative disorders?
2002-10
[61]
논문
Association and heterogeneity at the GAPDH locus in Alzheimer's disease
2012-01
[62]
논문
The macrophage cell surface glyceraldehyde-3-phosphate dehydrogenase is a novel transferrin receptor
2007-02
[63]
논문
Secreted multifunctional Glyceraldehyde-3-phosphate dehydrogenase sequesters lactoferrin and iron into cells via a non-canonical pathway
2015
[64]
논문
A dimer interface mutation in glyceraldehyde-3-phosphate dehydrogenase regulates its binding to AU-rich RNA
2015-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com