액틴
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
액틴은 세포 내에서 다양한 기능을 수행하는 단백질로, 세포 구조 유지, 수송 네트워크, 이동, 복제 등에 관여한다. 미세섬유를 형성하여 세포골격을 구성하며, 세포 운동과 수축에도 중요한 역할을 한다. 액틴은 G-액틴과 F-액틴 형태로 존재하며, ATP와 결합하여 중합과 탈중합을 반복하며 동적인 구조를 형성한다. 액틴은 효모, 식물, 핵 등 다양한 생물학적 과정에 관여하며, 세포 내 신호 전달 경로를 통합하는 역할도 한다. 액틴 유전자에는 다양한 이소형이 존재하며, 돌연변이는 근육병증, 심장 질환 등 다양한 질병을 유발할 수 있다. 액틴은 나노기술, 분자생물학 연구, 질병 진단, 식품 기술 등 다양한 분야에서 활용된다. 액틴은 1887년 처음 관찰되었으며, 1942년 브루노 페렌츠 슈트라웁에 의해 순수한 형태로 분리되었다.
더 읽어볼만한 페이지
- 세포골격 단백질 - 미오신
미오신은 액틴 필라멘트를 따라 움직이며 힘을 생성하는 단백질 분자로, 근육 수축, 세포 운동, 소포 수송 등 다양한 생체 내 기능에 관여하며, 근육형, 비근육형, 프로세시브형, 논프로세시브형으로 분류된다. - 세포골격 단백질 - 튜불린
튜불린은 진핵생물과 원핵생물에서 발견되는 GTP 가수분해효소 단백질 패밀리이며, 진핵생물에서는 미세소관을 형성하여 세포 구조 유지, 세포 내 수송, DNA 분리에 관여하고, 원핵생물에서는 세포 분열, 플라스미드 분리, 세포 형태 변화 등에 기여하며, 다양한 약물의 표적이 되기도 한다. - 자가항원 - 니코틴성 아세틸콜린 수용체
니코틴성 아세틸콜린 수용체는 아세틸콜린에 의해 활성화되어 이온을 통과시키는 리간드 개폐 이온 채널 막단백질로, 척추동물에서 근육형과 신경형으로 나뉘어 신경 전달에 중요한 역할을 하며, 활성화는 뉴런 탈분극을 유발하고 니코틴 의존증과 같은 질병 위험과도 연관된다. - 자가항원 - 피루브산 탈수소 효소
피루브산 탈수소 효소는 티아민 피로인산을 조효소로 사용하여 피루브산을 아세틸-CoA로 전환시키는 효소 복합체로서 세포 호흡에 중요하며, 피루브산 탈수소 효소 키나아제와 피루브산 탈수소 효소 포스파타아제에 의해 활성이 조절되고 결핍 시 선천성 대사 질환을 유발할 수 있다.
2. 액틴의 기능
액틴은 세포 내에서 다양한 기능을 수행하는 미세섬유를 형성하는 단백질이다. 미세섬유는 세포 구조, 수송 네트워크, 이동 및 복제 등 다양한 기능을 수행한다.[6] 액틴 필라멘트는 가역적으로 형성되며, 극성을 띠고, 다양한 단백질과 결합하여 기능을 조절한다.
대부분의 세포에서 액틴 필라멘트는 대규모 네트워크를 형성하여 세포에 기계적 지지를 제공하고, 세포질을 통한 수송 경로를 제공하며, 신호 전달을 돕는다. 또한, 액틴 네트워크의 빠른 조립과 분해는 세포의 이동을 가능하게 한다.[6] 액틴은 세포 총 단백질량의 1~5%를 차지하며, 근육 세포에서는 10%를 차지할 정도로 풍부하다. 액틴 단백질은 세포질과 세포핵 모두에서 발견되며, 세포막 신호 전달 경로에 의해 조절된다.[7]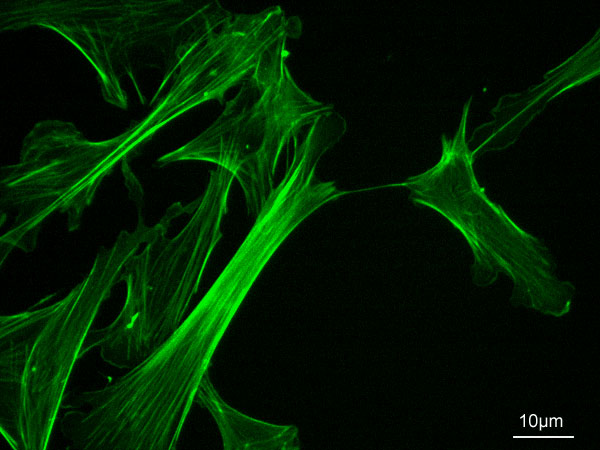
구형 액틴(G-액틴)은 중합되어 섬유상 중합체(F-액틴)인 미세섬유를 형성한다. 미세섬유는 지름이 6-7nm로 세포골격 중 가장 가늘다. F-액틴은 G-액틴이 이중나선 구조로 연결된 형태로, +극에서 성장하고 -극에서 소멸하는 방향성을 가진다. 이러한 트레드밀링 현상은 세포의 기능에 중요하다.[185]
액틴은 주로 ATP와 결합하며, ATP 결합 액틴은 ADP 결합 액틴보다 빠르게 중합하고 느리게 탈중합한다. 코필린은 ADP 결합 액틴의 탈중합을 촉진하고, 프로필린은 ADP와 ATP의 교환을 촉진하여 액틴 중합을 조절한다. Arp2/3 단백질은 핵 형성을 촉진하여 필라멘트 생성을 돕는다.
액틴 필라멘트는 섬유 다발과 네트워크의 두 가지 주요 구조 유형을 형성한다. 액틴 결합 단백질은 액틴 필라멘트와 가교 결합하여 이러한 구조 형성을 조절한다. 평행 섬유다발은 필린에 의해, 수축성 섬유다발은 액티닌에 의해 형성된다.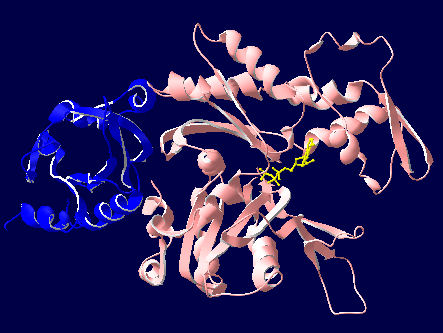
평행 섬유다발은 세포의 미세융모를 지지하며, 빌린이 장관 세포에서 발견된다. 액틴 네트워크는 세포 피질에 형성되며, 세포막 내 물질 확산 장벽 역할을 한다.
액틴은 세포자멸사, 세포 부착 및 발생, 유전자 발현 조절, 입체섬모 역동성, 키랄성 등 다양한 생물학적 과정에도 관여한다.
2. 1. 세포골격
액틴은 세포골격을 구성하는 주요 요소 중 하나로, 세포의 형태 유지 및 변화에 중요한 역할을 한다. 대부분의 세포에서 액틴 필라멘트는 대규모 네트워크를 형성하여 다음과 같은 주요 기능을 수행한다.[6]- 세포에 기계적 지지를 제공하고 세포질을 통한 수송 경로를 제공하여 신호 전달을 돕는다.
- 빠른 조립과 분해를 통해 세포의 이동을 가능하게 한다.
액틴 단백질은 세포질과 세포핵 모두에서 발견되며,[71] 그 위치는 세포가 받는 자극을 통합하는 세포막 신호 전달 경로에 의해 조절된다.[7]
약간 다른 구조와 기능을 가진 여러 종류의 액틴이 존재한다. 근육 섬유에서만 발견되는 α-액틴과 달리, β-액틴과 γ-액틴은 다른 세포에서 발견된다. 근육 세포 이외의 세포에서 발견되는 미세섬유는 다음과 같은 세 가지 형태로 존재한다.[60]
- '''미세섬유 네트워크:''' 동물 세포는 일반적으로 세포막 아래에 많은 수의 미세섬유를 포함하는 세포 피질을 가지고 있으며, 이는 세포 외부로 신호를 전달하는 많은 수용체와 연결되어 있다.
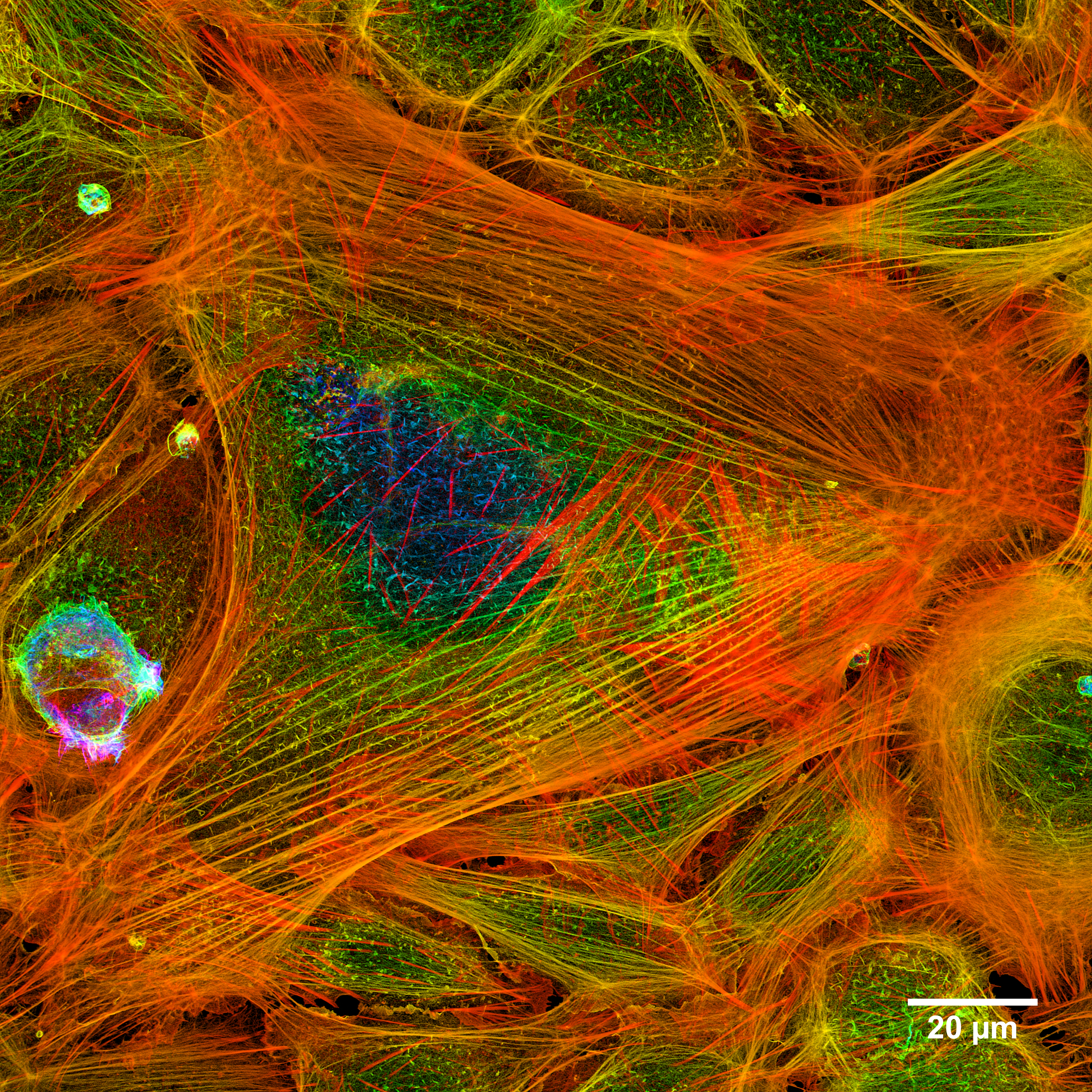
- '''주기적 액틴 고리:''' 축삭에서 발견되는 주기적인 구조로, 액틴 고리는 이웃하는 액틴 고리를 연결하는 스펙트린 사량체와 함께 축삭 막을 지지하는 응집성 세포골격을 형성한다.[8]
분자량이 약 42,000인 구형 액틴은 G-액틴이라 불리며, G-액틴이 다수 중합된 섬유상 중합체는 F-액틴이라 불리며 “미세섬유”가 된다. 미세섬유는 3종류의 세포골격 중에서 가장 가늘며, 지름이 6-7nm이다. F-액틴은 G-액틴이 오른쪽으로 감긴 이중나선 구조로 연결되어 있으며, 약 13개가 포함된 36nm 정도가 반주기가 된다. G-액틴의 중합에 의한 성장과 탈중합에 의한 소멸은 각각 특정한 한쪽 끝에서 일반적으로 일어나기 때문에, 미세소관과 마찬가지로 액틴 필라멘트에는 방향성이 있으며, 성장 쪽을 “+극”(플러스 극), 소멸 쪽을 “-극”(마이너스 극)이라 부른다. 또한, 전자 현미경 사진에서는 미오신의 결합이 화살촉처럼 보이기 때문에, 화살촉의 끝이 되는 -극을 “화살촉 끝”, “P극”, 그 반대쪽의 +극을 “반대 화살촉 끝”, “B극”이라고 부르기도 한다. G-액틴의 세포 내 농도가 중합 반응과 탈중합 반응을 속도 결정 단계로 하고 있으며, 두 반응이 같아지는 G-액틴의 농도를 임계 농도라고 부른다. 임계 농도는 +극에서는 0.1μM, -극에서는 0.6μM이며, 이 농도 사이에서는 +극이 임계 농도가 더 낮기 때문에 중합이 진행되고, -극에서는 탈중합이 진행된다. 따라서 정상 상태에서는 +극에서 신장하고 -극에서 단축하고 있다. 이것은 트레드밀링이라고 불린다.[185]
액틴은 주로 ATP와 결합하지만 ADP와도 결합할 수 있다. ATP와 액틴의 복합체는 ADP와 액틴의 복합체보다 빠르게 중합하고, 느리게 탈중합한다. 액틴의 중합인 핵 형성 과정은 3개의 G액틴 단량체가 삼량체로 합체하는 것으로 시작된다. 이때, ATP가 붙은 액틴은 +극에 결합하고, ATP는 그 후 가수분해되어, 그에 따라 이웃 유닛과의 결합 길이가 짧아져 일반적으로 섬유는 불안정해진다. ADP가 붙은 액틴은 -극에서 탈중합하고, ADP 결합 액틴의 증가가 결합한 ADP의 ATP로의 교환을 자극하여 ATP 결합 액틴을 증가시킨다. 이 빠른 대사 회전이 세포의 작용에 중요하다.
코필린은 ADP 결합 액틴 유닛에 결합하여 -극으로부터의 탈중합을 촉진하고, 재구축을 방해한다. 프로필린은 결합하는 ADP와 ATP의 교환을 자극함으로써 이 효과를 역전시킨다. 게다가, 프로필린과 결합한 ATP 결합 액틴 유닛은 코필린과 분리되어 자유롭게 중합할 수 있다. 그 외에 필라멘트 생성에 중요한 성분으로 Arp2/3 단백질이 있으며, 이것은 핵 형성의 장소로서 유용하고, G액틴 삼량체의 형성을 자극한다. 이들 3가지 단백질은 모두 세포 신호의 기전에서 조절된다.
'''섬유 다발'''과 '''네트워크'''는 액틴 필라멘트를 구성하는 두 가지 일반적인 구조 유형이다. 액틴 결합 단백질이 액틴 필라멘트와 가교 결합하여 어떤 구조를 형성할지 결정한다.
평행 섬유다발과 수축성 섬유다발의 두 종류의 액틴 다발이 있다. 평행 섬유다발에서는 섬유가 액틴 다발화 단백질인 필린으로부터 14nm 떨어져 존재한다. 평행 섬유다발은 세포의 미세융모를 지지하고 있다. 척추동물에서는 액틴 결합 단백질인 빌린이 대부분의 장관 세포에서 발견된다.
액틴은 미오신 섬유와 함께 액토미오신을 형성하여 근육 수축을 일으킨다. ATP는 가수분해를 통해 미오신 머리 부분을 뻗어 액틴 필라멘트와의 결합을 가능하게 한다. ADP를 사용한 이완 또는 수축 운동 후 액틴 필라멘트가 움직인 후 미오신 머리 부분이 분리된다.
수축성 섬유 다발에서는 액틴 섬유 다발 단백질인 액티닌이 각각 40nm 간격으로 배열되어 있다. 이러한 간격 덕분에 모터 단백질인 미오신이 필라멘트와 상호 작용할 수 있어 변형과 수축이 가능하다. 이 변형 과정에서 미오신의 한쪽 끝은 원형질막에 결합하고 반대쪽 끝은 액틴 필라멘트의 + 끝을 향해 이동한다. 이것이 세포의 피질과 다른 형태로 막을 밀어내는 것이다. 수축 시 미오신 분자는 일반적으로 두 개의 다른 필라멘트에 결합하고 양쪽 끝은 동시에 + 끝을 향해 서로의 액틴 필라멘트를 따라 미끄러진다. 이것이 액틴 섬유 다발(필라멘트가 아님)의 수축을 가져온다. 이러한 기전이 근육 수축과 세포 분열의 원인이 된다. 다수의 액틴 결합 단백질(필라민)을 포함하는 액틴 네트워크가 세포의 피질에 형성된다. 최근 연구에서는 세포막 내 물질의 확산 장벽 역할을 하는 것으로 나타났다.
2. 1. 1. 효모
효모에서 액틴 세포골격은 세포내이입, 세포질분열, 세포극성 결정 및 형태형성 과정에 중요하다. 이러한 과정은 액틴에 의존하는 것 외에도, 진화적으로 매우 보존된 20~30개의 관련 단백질과 많은 신호 전달 분자를 포함한다. 이러한 요소들은 세포가 내부 및 외부 자극에 반응하는 것을 결정하는 공간적, 시간적으로 조절된 조립을 가능하게 한다.[9]효모는 액틴과 관련된 세 가지 주요 요소, 즉 패치, 케이블 및 고리(ring)를 포함한다. 이러한 구조는 오래 지속되지 않지만, 끊임없는 중합과 탈중합으로 인해 동적인 평형 상태를 유지한다. 여기에는 여러 보조 단백질이 포함되는데, 분자량 16kDa이고 ''COF1''이라는 단일 유전자에 의해 암호화되는 ADF/코필린, 미세섬유의 분해를 촉진하는 코필린 보조인자 Aip1, 아데닐산 고리화효소 단백질과 관련된 과정 조절 인자 Srv2/CAP, 액틴 단량체와 관련된 약 14kDa의 프로필린, 그리고 패치의 조직에 관여하는 40kDa 단백질인 트윈필린이 있다.[9]
2. 1. 2. 식물
식물 세포에서 액틴은 세포벽 형성과 세포질 흐름, 세포 기관의 이동, 세포 분열, 세포 신장 및 분화 등 다양한 과정에 관여한다.[12]식물 게놈 연구는 액틴 유전자 계열 내에 단백질 이소변이체가 존재함을 밝혀냈다. 모델 생물인 ''애기장대''에는 10가지 유형의 액틴, 6가지 프로필린, 수십 가지의 미오신이 있다. 이러한 다양성은 시간적 및 공간적 발현이 약간 다른 변이체를 보유해야 하는 진화적 필요성에 의해 설명된다.[3] 이러한 단백질의 대부분은 분석된 조직에서 공동으로 발현되었다. 액틴 네트워크는 ''시험관 내''에서 배양된 세포의 세포질 전체에 분포되어 있다. 핵 주변에는 세포 피질과 스포크를 통해 연결된 네트워크가 집중되어 있으며, 이 네트워크는 중합과 탈중합이 지속적으로 일어나는 매우 역동적인 구조이다.[10]
대부분의 식물 세포는 형태를 결정하는 세포벽을 가지고 있지만, 미세섬유는 미세섬유와 미오신에 의해 생성되는 세포질 흐름과 같은 여러 세포 활동을 달성하기에 충분한 힘을 생성할 수 있다. 액틴은 또한 세포 소기관의 이동과 세포 분열뿐만 아니라 세포의 신장과 분화를 포함하는 세포 형태 형성에도 관여한다.[12]
식물에서 액틴 세포골격과 관련된 가장 주목할 만한 단백질은 다음과 같다.[12]
- 젤솔린/세베린과 같은 계열에 속하며 미세섬유를 절단하고 칼슘 양이온이 존재할 때 액틴 단량체에 결합할 수 있는 빌린
- 액틴 단량체를 인식하고 결합하며 (동물과 효모의 조절 과정과 다른) 네트워크 형성에 관여하는 핌브린[13]
- F-액틴 중합 핵 생성제 역할을 할 수 있는 포르민
- 진핵생물에 특이적인 전형적인 분자 모터이며 ''애기장대''에서는 두 개의 별개의 계열에 있는 17개의 유전자에 의해 암호화되는 미오신
- 액틴에 결합할 수 있으며 세포 내 엽록체의 공간적 분포에 관여하는 CHUP1
- 골지체의 형태와 세포벽의 자일로그루칸 구성을 결정하는 KAM1/MUR3
- 액틴 세포 구조의 출현을 촉진하는 NtWLIM1
- 막과 미세섬유 내 소기관의 결합에 관여하며 스트레스에 대한 유기체의 반응에 관여하는 역할을 하는 것으로 보이는 ERD10
2. 2. 핵 액틴
액틴은 세포핵 내에서도 발견되며, 핵 구조 유지, 전사 조절, 유전자 활성 조절, DNA 복구 등 다양한 핵 내 과정에 관여한다.[16] 1977년 클라크(Clark)와 메리암(Merriam)은 아프리카발톱개구리(''Xenopus laevis'') 난자의 핵 분획에서 골격근 액틴과 유사한 특징을 가진 단백질을 처음 발견하고 기술했다.[14] 이후 핵 내 액틴의 구조와 기능에 대한 많은 연구가 진행되었다.[15] 핵 액틴은 주로 단량체 형태로 존재하지만, 역동적인 올리고머와 짧은 폴리머를 형성하기도 한다. 핵 내 액틴의 조절된 수준, 액틴 결합 단백질(ABP)과의 상호작용, 그리고 여러 종류의 존재는 액틴이 많은 중요한 핵 과정에서 중요한 역할을 할 수 있게 한다.[16]2. 2. 1. 핵막 수송
액틴은 크기가 작아(약 43 kDa) 수동 확산을 통해 핵으로 들어갈 수 있다.[17] 핵으로의 액틴 수송은 (아마도 코필린과의 복합체로) 수입 단백질 임포틴 9에 의해 촉진된다.[18]핵 내 액틴의 낮은 수준은 중요한 것으로 보이는데, 액틴은 서열에 두 개의 핵 수출 신호(NES)를 가지고 있기 때문이다. 미세 주입된 액틴은 핵에서 세포질로 빠르게 제거된다. 액틴은 엑스포틴 1과 엑스포틴 6을 통해 적어도 두 가지 방식으로 수출된다.[19][20] SUMOylation과 같은 특정 변형은 핵 액틴 유지를 허용한다. SUMOylation을 막는 돌연변이는 핵에서 베타 액틴의 빠른 수출을 유발한다.[21]
2. 2. 2. 핵 액틴의 조직화
핵 액틴은 1977년 클라크(Clark)와 메리암(Merriam)에 의해 처음 발견되고 기술되었다.[14] 이들은 아프리카발톱개구리(''Xenopus laevis'') 난자에서 얻은 핵 분획에 존재하는 단백질을 설명했는데, 이 단백질은 골격근 액틴과 같은 특징을 보였다. 그 이후로 핵 내 액틴의 구조와 기능에 대한 많은 과학적 보고가 있었다.(Hofmann 2009.[15]) 핵 내 액틴의 조절된 수준, 액틴 결합 단백질(ABP)과의 상호작용, 그리고 여러 이소형의 존재는 액틴이 많은 중요한 핵 과정에서 중요한 역할을 할 수 있게 한다.[16]액틴 서열에는 핵 위치 신호가 포함되어 있지 않다. 액틴의 작은 크기(약 43kDa)는 수동 확산을 통해 핵으로 들어갈 수 있게 한다.[17] 핵으로의 액틴 수송(아마도 코필린과의 복합체로)은 수입 단백질 임포틴 9에 의해 촉진된다.[18]
핵 내 액틴의 낮은 수준은 중요한 것으로 보이는데, 액틴은 서열에 두 개의 핵 수출 신호(NES)를 가지고 있기 때문이다. 미세 주입된 액틴은 핵에서 세포질로 빠르게 제거된다. 액틴은 엑스포틴 1과 엑스포틴 6을 통해 적어도 두 가지 방식으로 수출된다.[19][20] SUMOylation과 같은 특정 변형은 핵 액틴 유지를 허용한다. SUMOylation을 막는 돌연변이는 핵에서 베타 액틴의 빠른 수출을 유발한다.[21]
세포핵에는 서로 다른 액틴 이성체가 존재한다. 액틴 이성체의 수준은 세포 성장 자극 또는 증식 및 전사 활동의 정지에 따라 변할 수 있다.[27] 핵 액틴에 대한 연구는 베타 이성체에 초점을 맞추고 있다.[28][29][30][31] 그러나 서로 다른 액틴 이성체를 표적으로 하는 항체를 사용하면 세포핵 내 세포질 베타뿐만 아니라 특정 세포 유형에서 알파 및 감마 액틴도 확인할 수 있다.[24][32][33] 서로 다른 액틴 이성체의 존재는 개별 이성체의 수준을 독립적으로 조절할 수 있기 때문에 핵 과정에서의 기능에 상당한 영향을 미칠 수 있다.[24]
2. 2. 3. 액틴 이소형
세포핵에는 서로 다른 액틴 이소형이 존재하며, 이들의 수준은 세포 성장 자극 또는 증식 및 전사 활동의 정지에 따라 변할 수 있다.[27] 핵 액틴 연구는 주로 베타 이소형에 초점을 맞추고 있지만,[28][29][30][31] 특정 세포 유형에서는 알파 및 감마 액틴도 세포핵 내에서 확인될 수 있다.[24][32][33] 이러한 서로 다른 액틴 이소형이 존재한다는 것은 핵 과정에서 이들의 기능에 상당한 영향을 미칠 수 있음을 의미한다. 왜냐하면 각 이소형의 수준을 독립적으로 조절할 수 있기 때문이다.[24]2. 2. 4. 핵 액틴의 기능
핵 액틴은 1977년 클라크(Clark)와 메리암(Merriam)에 의해 처음 발견되어 기술되었다.[14] 이들은 아프리카 발톱개구리(''Xenopus laevis'') 난자에서 얻은 핵 분획에서 골격근 액틴과 같은 특징을 보이는 단백질을 발견했다. 이후 핵 내 액틴의 구조와 기능에 대한 많은 연구가 진행되었다.[15] 핵 내 액틴의 조절된 수준, 액틴 결합 단백질(ABP)과의 상호작용, 그리고 여러 종류의 존재는 액틴이 많은 중요한 핵 과정에서 중요한 역할을 할 수 있게 한다.[16]액틴 서열에는 핵 위치 신호가 없지만, 액틴의 작은 크기(약 43 kDa)는 수동 확산을 통해 핵으로 들어갈 수 있게 한다.[17] 핵으로의 액틴 수송은 수입 단백질 임포틴 9에 의해 촉진되며, 이 과정은 코필린과의 복합체 형성을 통해 이루어지는 것으로 보인다.[18]
핵 내 액틴의 낮은 수준은 중요한데, 액틴은 서열에 두 개의 핵 수출 신호(NES)를 가지고 있기 때문이다. 미세 주입된 액틴은 핵에서 세포질로 빠르게 제거된다. 액틴은 엑스포틴 1과 엑스포틴 6을 통해 적어도 두 가지 방식으로 수출된다.[19][20] SUMOylation과 같은 특정 변형은 핵 액틴 유지를 가능하게 한다. SUMOylation을 막는 돌연변이는 핵에서 베타 액틴의 빠른 수출을 유발한다.[21]
핵 내 액틴의 기능은 액틴의 중합 능력과 다양한 액틴 결합 단백질(ABP) 및 핵의 구조적 요소와의 상호작용과 관련이 있다. 핵 액틴의 기능은 다음과 같다.
- 핵 구조: 액틴과 알파 II-스펙트린 및 다른 단백질의 상호작용은 핵의 적절한 모양을 유지하는 데 중요하다.[34][35]
- 전사: 액틴은 염색질 재구성,[71][28][36][37] 전사 개시 및 전사 복합체와의 상호작용에 관여한다.[38] RNA 중합효소 I,[31] II[29] 및 III[30]과 상호 작용하여 염색질 구조 조절에 참여한다.[39][40][41] Pol I 전사에서 액틴과 미오신(MYO1C, DNA에 결합)은 분자 모터 역할을 한다. Pol II 전사의 경우, 전개시 복합체 형성에 β-액틴이 필요하다. Pol III에는 β-액틴이 소단위체로 포함되어 있다. 액틴은 또한 염색질 재구성 복합체와 전구체 메신저 RNA가 단백질에 묶인 전구체 mRNP 입자의 구성 요소가 될 수 있으며, RNA와 단백질의 핵 수출에 관여한다.[42]
- 유전자 활성 조절: 액틴은 다양한 종류의 유전자의 조절 영역에 결합한다.[43][44][45][46] 액틴의 유전자 활성 조절 능력은 분화된 세포를 배아 상태로 되돌리는 분자 재프로그래밍 방법에 사용된다.[45]
- 활성화된 염색체 단편의 전좌: 막 하부 영역에서 전사가 시작되는 이염색질로 이동한다. 이러한 이동에는 액틴과 미오신의 상호작용이 필요하다.[48][49]
- 다른 세포 구획의 통합: 액틴은 세포질 및 핵 신호 전달 경로를 통합하는 분자이다.[50] 세포의 혈청 자극에 대한 반응으로 전사가 활성화되는 ''in vitro'' 연구가 그 예이다.[51][52][53]
- 면역 반응: T 세포 수용체 자극 시 핵 액틴이 중합되며, ''in vivo'' 사이토카인 발현과 항체 생성에 필요하다.[54]
- DNA 복구: 핵 액틴은 DNA 이중 가닥 절단의 복구를 매개한다.[55] 세포핵에서 액틴의 필라멘트 중합체(F-액틴)는 비상동 말단 연결 DNA 복구 경로와 상동 재조합 복구 경로 모두에서 작용한다.[15]
액틴은 많은 단백질과의 상호 작용과 구조적 변화를 일으키는 능력으로 인해 전사 복합체와 같은 단백질 복합체의 형성과 활성을 조절하는 역할을 한다.[38]
2. 3. 세포 운동
대부분의 세포에서 액틴 필라멘트는 여러 주요 기능을 수행하는 대규모 네트워크를 형성한다. 액틴 네트워크는 세포에 기계적 지지를 제공하고, 세포질을 통한 수송 경로를 제공하여 신호 전달을 돕는다. 또한, 액틴 네트워크의 빠른 조립과 분해는 세포의 이동을 가능하게 한다.[6]움직이는 세포의 앞쪽 가장자리에는 액틴 필라멘트의 망상 구조가 있다. 새로운 액틴 필라멘트가 중합하면서 돌기를 통해 세포막을 앞으로 밀어낸다.[56][57] 이 돌출부는 기질에 부착되어 부착반(focal adhesions)이라는 구조를 형성하고 액틴 네트워크에 연결된다. 부착이 이루어지면 세포체 뒤쪽이 수축하여 내용물을 부착 지점 앞으로 밀어낸다. 세포 뒤쪽으로 이동한 부착 지점은 분해되어 세포 뒤쪽이 앞으로 이동할 수 있게 된다.
세포막에서 뻗어 나온 액틴 필라멘트는 세포막을 역학적으로 밀어 세포 가장자리를 앞으로 뻗게 한다. 간기의 섬유아세포에서는 길고 가지가 없는 액틴 필라멘트가 미는 필로포디아(filopodia)와 짧고 가지가 있는 액틴 필라멘트가 미는 라멜리포디아(lamellipodia)가 관찰된다. 액틴 필라멘트가 밀고 나아간 후에는 스트레스 섬유(stress fiber)가 형성된다. 스트레스 섬유는 α-액티닌에 의해 서로 가교된 액틴 필라멘트 구조이며, 양 끝은 인테그린에 의해 세포막 부분에 연결되어 있다.
2. 3. 1. 액틴/미오신 운동
액틴 중합에 의해 생성되는 물리적 힘 외에도, 미세섬유는 운동 단백질의 일종인 미오신이 이동하는 통로 역할을 하여, 다양한 세포 내 구성 요소의 이동을 촉진한다.[6]2. 4. 기타 생물학적 과정
액틴은 세포자멸사, 세포 부착 및 발생, 유전자 발현 조절, 입체섬모 역동성, 키랄성 등 다양한 생물학적 과정에 관여한다.- '''세포자멸사''': 프로그램 세포 사멸 과정에서 특정 프로테아제 계열(ICE/ced-3)이 액틴을 분해하여 세포 생존력을 파괴한다. 이는 세포자멸사의 주요 메커니즘 중 하나이다.[61] 칼페인 프로테아제도 이 과정에 관여하며, 칼페인 억제제는 액틴과 DNA 분해를 감소시킨다.[62][63] 반대로, 스트레스로 유도된 세포자멸사는 액틴 세포골격의 재구성을 유발하여 스트레스 섬유를 생성하며, 이는 MAP 키나제 경로에 의해 활성화된다.[64]

- '''세포 부착 및 발생''': 세포 간 부착은 다세포 생물의 특징으로, 조직 특수화를 가능하게 한다. 세포 상피의 부착에는 액틴 세포골격과 카데린이 관여하며, 이 둘의 연결은 카테닌에 의해 매개된다.[65] 액틴 역동성에 대한 간섭은 유기체 발달에 영향을 미치며, 액틴의 중요성 때문에 중복되는 유전자 시스템이 존재한다.[66]
- '''유전자 발현 조절''': 액틴의 중합 상태는 유전자 발현 패턴에 영향을 미친다. 사이토칼라신 D 매개 탈중합은 슈반 세포의 수초화 관련 유전자 발현을 유발한다.[67] F-액틴은 ''칸디다 알비칸스''와 같은 곰팡이의 전사체를 변형시킨다.[68] 액틴 유사 단백질은 쥐의 정자형성 과정에서 조절 역할을 하며,[69] 효모에서는 유전자 발현 조절에 관여한다.[70] 액틴은 RNA 중합효소 등과 상호작용하여 전사 개시자 역할을 할 수 있다.[71]
- '''입체섬모 역동성''': 일부 세포는 기계감각 기능을 가진 미세한 돌기인 입체섬모를 가진다. 귀의 코르티 기관에 존재하는 이 구조는 길이를 변경할 수 있다.[72] 입체섬모는 파라결정 액틴 코어를 가지며, VI형과 VIIa형 미오신, 그리고 미오신 XVa가 관여한다.[73]
- '''고유한 키랄성''': 액토미오신 네트워크는 세포의 고유한 키랄성 생성에 관여한다.[74] 키랄 표면에서 배양된 세포는 액토미오신에 의존하는 좌/우 편향을 보일 수 있다.[75][76]
3. 액틴의 구조
액틴 단량체(G-액틴)는 깊은 틈으로 분리된 두 개의 로브(lobe)로 구성된 구형 구조를 가지며, 틈 바닥에는 ATP 및 GTP 결합 단백질에서 보존된 구조인 "ATPase 폴드"가 있어 마그네슘 이온과 ATP 분자에 결합한다.[77] 각 액틴 단량체를 안정화하기 위해서는 ATP 또는 ADP 결합이 필요하며, 결합되지 않을 경우 액틴은 빠르게 변성된다.[77]
횡문근 조직의 토끼에서 최초로 정제된 액틴의 X선 결정학 모델은 구조 연구에서 가장 일반적으로 사용된다. 카브슈(Kabsch)가 결정화한 G-액틴은 크기가 약 67 x 40 x 37 Å이며, 분자량은 41,785 Da, 추정 등전점은 4.8, pH = 7에서의 순 전하는 -7이다.[175][77] 엘징가(Elzinga)와 동료들의 연구에 따르면 G-액틴은 374개의 아미노산 잔기로 구성되며, N-말단은 산성, C-말단은 염기성이다.[77]
구형 액틴(G-액틴)은 여러 개가 중합되어 섬유상 중합체인 F-액틴, 즉 미세섬유를 형성한다. 미세섬유는 3종류의 세포골격 중 가장 가늘며(지름 6-7nm), F-액틴은 G-액틴이 오른쪽으로 감긴 이중나선 구조로 약 13개가 포함된 36nm 정도가 반주기이다.
액틴은 주로 ATP와 결합하지만 ADP와도 결합할 수 있으며, ATP 결합 액틴 복합체는 ADP 결합 액틴 복합체보다 빠르게 중합하고 느리게 탈중합한다.
코필린은 ADP 결합 액틴 유닛에 결합하여 -극으로부터의 탈중합을 촉진하고 재구축을 방해하며, 프로필린은 ADP와 ATP의 교환을 자극하여 이 효과를 역전시킨다.
3. 1. G-액틴
G-액틴은 단백질의 일종으로, 구형 단백질이다. 영어로는 Globular actin (구형 액틴)이며, G-액틴의 G는 구형을 뜻하는 Globular의 약자이다. 분자량은 약 42,000이다. G-액틴은 여러 개가 모여 중합체를 형성할 수 있는데, 이를 F-액틴이라 부른다.G-액틴 단량체는 깊은 틈으로 분리된 두 개의 로브(lobe)로 구성되어 있다.[77] 틈 바닥에는 ATP 및 GTP 결합 단백질에서 보존된 구조인 "ATPase 폴드"가 있으며, 마그네슘 이온과 ATP 분자에 결합한다.[77] 각 액틴 단량체를 안정화하기 위해서는 ATP 또는 ADP의 결합이 필수적이다. 이 분자들 중 하나가 결합되어 있지 않으면 액틴은 빠르게 변성된다.[77]
횡문근 조직의 토끼에서 생성된 액틴의 X선 결정학 모델은 최초로 정제되었기 때문에 구조 연구에서 가장 일반적으로 사용된다. G-액틴은 크기가 약 67 x 40 x 37 Å이며, 분자량은 41,785 Da이고 추정 등전점은 4.8이다. pH = 7에서의 순 전하는 -7이다.[175][77]
액틴은 ATP를 가수분해하는 효소인 ATP가수분해효소이다. G-액틴 상태에서 이 효소는 느린 반응 속도를 가지지만, 액틴이 필라멘트의 일부가 될 때 그 속도가 약 40,000배 증가한다.[80]
3. 1. 1. 1차 구조
G-액틴은 374개의 아미노산 잔기로 구성된다. N-말단은 산성이며, C-말단은 염기성이다.[77]3. 1. 2. 3차 구조
G-액틴은 크고 작은 두 개의 도메인으로 구성된 구형 구조를 가지고 있으며, 이들은 ATP-ADP+Pi 결합 위치를 중심으로 한 틈으로 분리되어 있다.[175] 틈의 바닥은 마그네슘 이온과 ATP 분자에 결합하는 "ATPase 폴드"로, ATP 및 GTP 결합 단백질에서 보존된 구조이다.[77]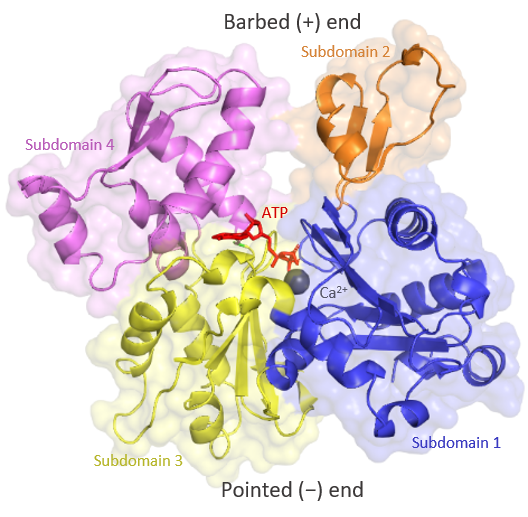
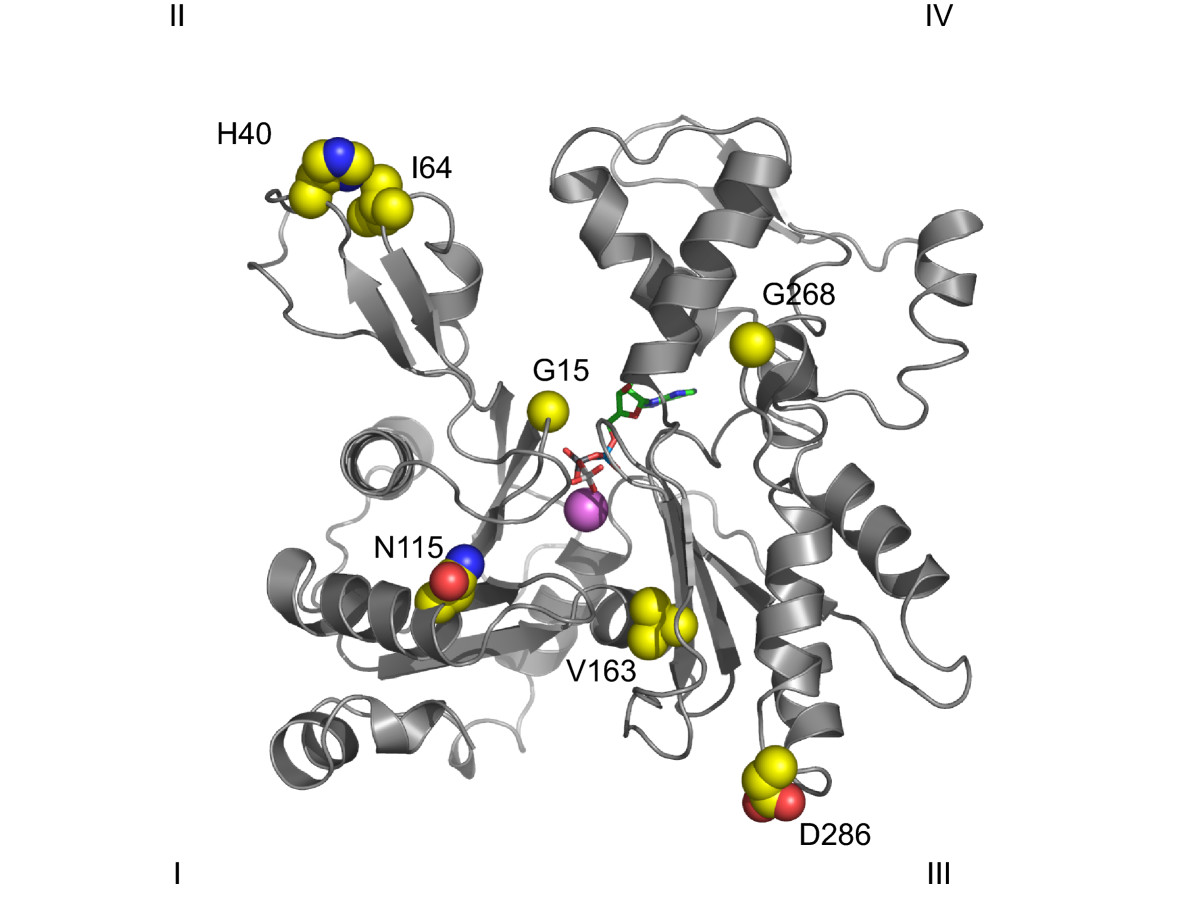
위상 연구에서 일반적으로 큰 도메인은 왼쪽에, 작은 도메인은 오른쪽에 표시한다. 작은 도메인은 서브도메인 I (아래쪽, 잔기 1–32, 70–144 및 338–374)과 서브도메인 II (위쪽, 잔기 33–69)로 나뉜다. 큰 도메인도 서브도메인 III (아래쪽, 잔기 145–180 및 270–337)과 서브도메인 IV (위쪽, 잔기 181–269)로 나뉜다.[116]
3. 1. 3. 기타 중요한 구조
G-액틴은 깊은 틈으로 분리된 두 개의 로브로 구성된 구형 구조를 가지고 있다.[77] 틈의 바닥에는 ATP 및 GTP 결합 단백질에서 보존된 구조인 "ATPase 폴드"가 있으며, 마그네슘 이온과 ATP 분자에 결합한다.[77] G-액틴의 주요 구조는 다음과 같다.- 아데노신 뉴클레오타이드 결합 부위: I 및 III 도메인에 속하는 두 개의 베타 헤어핀 모양 구조 사이에 위치한다. 관여하는 잔기는 각각 Asp11-Lys18 및 Asp154-His161이다.[176]
- 2가 양이온 결합 부위: 아데노신 뉴클레오타이드 결합 부위 바로 아래에 위치한다. ''In vivo''에서는 대부분 Mg2+ 또는 Ca2+에 의해 형성된다.[177] 이 칼슘은 Asp11, Asp154 및 Gln137에 의해 유지되는 6개의 물 분자와 배위된다. 이들은 "힌지" 영역(잔기 137과 144 사이에 위치)의 움직임을 제한하는 뉴클레오타이드와 복합체를 형성한다.[177]
- D-loop: 서브도메인 2에 위치하며, DNase I과 결합하기 때문에 "D-loop"라고 불린다. His40과 Gly48 잔기 사이에 위치한다.[177]
3. 2. F-액틴
G-액틴 분자는 다양한 조건에서 중합하여 F-액틴이라는 섬유 형태를 이룬다.[79] F-액틴 섬유는 일반적으로 서로 감겨 있는 두 가닥의 액틴으로 구성되며, 7nm~9nm 너비의 나선형 구조를 이루고 72nm(또는 14개의 G-액틴 서브유닛)마다 반복된다. F-액틴 섬유에서 G-액틴 분자는 모두 같은 방향으로 배열된다. F-액틴 섬유의 두 끝은 서로 다르다. 한쪽 끝은 (−) 끝으로 지정되며, 말단 액틴 분자의 ATP 결합 부위가 바깥쪽을 향하고 있다. 반대쪽 끝은 (+) 끝으로 지정되며, ATP 결합 부위는 필라멘트에 묻혀 있으며, 이웃하는 액틴 분자와 접촉한다. F-액틴 섬유가 성장함에 따라 새로운 분자는 기존 F-액틴 가닥의 (+) 끝에 결합하는 경향이 있다. 반대로, 섬유는 가닥의 (−) 끝에서 액틴 단량체를 떨어뜨림으로써 수축하는 경향이 있다.코필린과 같은 일부 단백질은 회전각을 증가시키는 것으로 보이지만, 이는 다시 다른 구조적 상태의 확립으로 해석될 수 있다. 이것은 중합 과정에서 중요할 수 있다.[80]
근육에서 발견되는 나선형 F-액틴 필라멘트에는 F-액틴 나선 주위에 감긴 40nm 길이의 단백질인 트로포미오신 분자도 포함되어 있다.[182] 휴지 단계 동안 트로포미오신은 액틴의 활성 부위를 덮어 액틴-미오신 상호작용이 일어나지 않고 근육 수축이 발생하지 않도록 한다. 트로포미오신 가닥에 결합된 다른 단백질 분자들이 있는데, 이들은 트로포닌 I, 트로포닌 T, 트로포닌 C 세 가지 중합체를 가진 단백질이다.[83]
4. 액틴의 접힘
액틴은 자발적으로 삼차 구조의 상당 부분을 얻을 수 있다.[85] 그러나 새로 합성된 천연 형태에서 완전히 기능적인 형태를 얻는 방식은 특별하며 단백질 화학에서 거의 유일하다. 이러한 특별한 경로는 잘못 접힌 액틴 단량체가 비효율적인 중합 종결자 역할을 하여 독성을 나타낼 수 있기 때문에, 이를 피하기 위함일 수 있다. 액틴의 올바른 접힘은 세포골격의 안정성을 확립하고 세포 주기를 조절하는 데 필수적이다.[86][87]
액틴의 올바른 접힘을 위해서는 샤페로닌 CCT와 프리폴딘의 도움이 필요하다.
4. 1. CCT
CCT는 그룹 II 샤페로닌으로, 다른 단백질의 접힘을 돕는 큰 단백질 복합체이다. CCT는 여덟 개의 서로 다른 소단위체로 이루어진 이중 고리(헤테로-팔량체)로 구성되며, 진정세균과 진핵 세포 소기관에서 발견되는 GroEL과 같은 그룹 I 샤페로닌과는 다르다. CCT는 중앙 촉매 공동을 덮는 뚜껑 역할을 하는 공샤페론을 필요로 하지 않는다.[88] 기질은 특정 도메인을 통해 CCT에 결합한다. 처음에는 액틴과 튜불린에만 결합한다고 생각되었지만, 최근 면역침강 연구에 따르면 많은 수의 폴리펩티드와 상호 작용하는 것으로 나타났는데, 이들은 아마도 기질로 기능할 것이다.[88] CCT는 ATP 의존성 구조 변화를 통해 작용하며, 반응을 완료하기 위해 여러 번의 해리와 촉매가 필요한 경우도 있다.[88]
CCT는 단순히 공동에 액틴을 둘러싸는 것이 아니라, 소단위체와의 결합을 형성함으로써 액틴의 순차적 접힘을 유도한다.[91] 이것이 CCT가 정단 β-도메인에 특정 인식 영역을 가지고 있는 이유이다. 접힘의 첫 번째 단계는 잔기 245–249의 인식으로 구성된다. 다음으로 다른 결정 인자가 접촉을 형성한다.[92] 액틴과 튜불린 모두 ATP가 없는 상태에서 열린 구조로 CCT에 결합한다. 액틴의 경우, 각 구조 변화 중 두 개의 소단위체가 결합하는 반면, 튜불린의 경우 네 개의 소단위체가 결합한다. 액틴은 δ 및 β-CCT 소단위체 또는 δ-CCT 및 ε-CCT와 상호 작용하는 특정 결합 서열을 가지고 있다. AMP-PNP가 CCT에 결합한 후, 기질은 샤페로닌의 공동 내부로 이동한다. 액틴의 경우, CAP 단백질이 액틴의 최종 접힘 상태에서 보조 인자로 필요한 것으로 보인다.[87]
이 과정이 조절되는 정확한 방식은 아직 완전히 이해되지 않았지만, 포스듀신과 유사한 단백질인 PhLP3가 삼원 복합체 형성을 통해 활성을 억제한다는 것이 알려져 있다.[88]
4. 2. 프리폴딘
프리폴딘은 6개의 서로 다른 소단위체로 구성된 헤테로 육량체 복합체로, 액틴과 튜불린의 접힘을 돕는다. 이들은 공진화했을 정도로 특이적인 상호작용을 한다.[90] 액틴은 형성되는 동안, 특히 N 말단에 있는 약 145개의 아미노산이 있을 때 프리폴딘과 복합체를 형성한다.[89]
액틴이나 튜불린에 대해 서로 다른 인식 소단위체가 사용되지만, 어느 정도 중복은 존재한다. 액틴의 경우, 프리폴딘과 결합하는 소단위체는 PFD3과 PFD4로 추정되며, 잔기 60–79 사이와 잔기 170–198 사이의 두 곳에 결합한다. 액틴은 프리폴딘의 "촉수" 안쪽 끝에서 열린 구조로 인식되고, 로딩되며, 세포질 샤페로닌(CCT)에 전달된다.[85] 액틴이 전달될 때의 접촉은 매우 짧아서 삼원 복합체가 형성되지 않고 프리폴딘이 즉시 해리된다.[90]
5. 액틴의 조립 역학
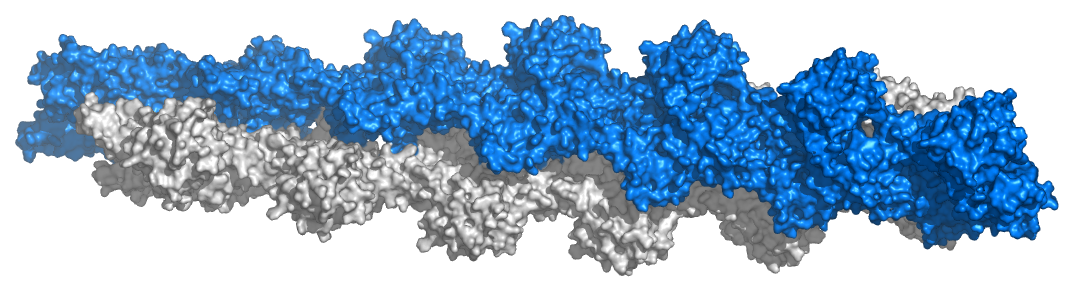
G-액틴 분자는 다양한 조건에서 "필라멘트성" 또는 "F-액틴"이라고 하는 더 긴 섬유로 중합된다. F-액틴 섬유는 일반적으로 서로 감겨 있는 두 가닥의 액틴으로 구성되며, 7~9나노미터 너비의 나선형 구조를 이루고 72나노미터(또는 14개의 G-액틴 서브유닛)마다 반복된다.[79] F-액틴 섬유에서 G-액틴 분자는 모두 같은 방향으로 배향된다. F-액틴 섬유의 두 끝은 서로 다른데, (−) 끝에서는 말단 액틴 분자의 ATP 결합 부위가 바깥쪽을 향하고, (+) 끝에서는 ATP 결합 부위가 필라멘트에 묻혀 이웃하는 액틴 분자와 접촉한다.[79] F-액틴 섬유는 (+) 끝에 새로운 분자가 결합하는 경향이 있고, (−) 끝에서 액틴 단량체를 떨어뜨림으로써 수축하는 경향이 있다.[79]
코필린과 같은 일부 단백질은 회전각을 증가시키는 것으로 보이지만, 이는 다른 구조적 상태의 확립으로 해석될 수 있다. 이것은 중합 과정에서 중요할 수 있다.[80]
회전 반지름과 필라멘트 두께 측정에 대한 합의는 적다. 최초 모델은 25Å의 길이를 할당했지만, 현재 X선 회절 데이터는 저온전자현미경에 의해 뒷받침되어 23.7Å의 길이를 제시한다. 이 연구들은 단량체 사이의 정확한 접촉점을 보여주었다. 일부는 같은 사슬의 단위로 형성되며, 한 단량체의 "가시돌기" 끝과 다음 단량체의 "뾰족한" 끝 사이에 있다. 인접 사슬의 단량체는 서브도메인 IV의 돌출부를 통해 측면 접촉을 하는데, 가장 중요한 돌출부는 C-말단과 잔기 39-42, 201-203 및 286을 포함하는 세 개의 부위로 형성된 소수성 연결이다. 이 모델은 필라멘트가 "시트" 형태의 단량체로 형성되며, 여기서 서브도메인은 스스로 회전하고, 이 형태는 박테리아 액틴 상동체 MreB에서도 발견된다는 것을 시사한다.[181]
미세섬유의 두 끝을 가리키는 "뾰족한"과 "가시돌기"라는 용어는 투과전자현미경에서 "장식"이라는 준비 기술을 사용하여 검사할 때의 모양에서 유래한다. 이 방법은 탄닌산으로 고정된 조직에 미오신 S1 단편을 추가하는 것으로 구성된다. 이 미오신은 액틴 단량체와 극성 결합을 형성하여 액틴이 샤프트이고 미오신이 깃털 장식인 화살촉 모양의 구조를 만든다. 이 논리에 따르면, 돌출된 미오신이 없는 미세섬유의 끝을 화살촉의 끝(− 끝)이라고 하고, 다른 끝을 가시돌기 끝(+ 끝)이라고 한다.[81] S1 단편은 미오신 II의 머리와 목 도메인으로 구성된다. 생리적 조건 하에서 G-액틴(단량체 형태)은 ATP에 의해 F-액틴(중합체 형태)으로 변환되며, 여기서 ATP의 역할은 필수적이다.[82]
근육에서 발견되는 나선형 F-액틴 필라멘트에는 F-액틴 나선 주위에 감긴 40나노미터 길이의 단백질인 트로포미오신 분자도 포함되어 있다.[182] 휴지 단계 동안 트로포미오신은 액틴의 활성 부위를 덮어 액틴-미오신 상호작용이 일어나지 않고 근육 수축이 발생하지 않도록 한다. 트로포미오신 가닥에는 트로포닌 I, 트로포닌 T, 트로포닌 C 세 가지 중합체를 가진 단백질 분자들이 결합되어 있다.[83]
F-액틴은 강하고 역동적이다. 구성 요소가 공유 결합으로 결합되어 있는 DNA와 같은 다른 중합체와 달리, 액틴 필라멘트의 단량체는 더 약한 결합으로 조립된다.[84] 이웃 단량체와의 측면 결합은 이러한 이상 현상을 해결하며, 이론적으로 열적 요동에 의해 파괴될 수 있으므로 구조를 약화시킬 수 있다. 또한, 약한 결합은 필라멘트 끝이 단량체를 쉽게 방출하거나 포함할 수 있다는 장점을 제공한다. 즉, 필라멘트는 빠르게 재구성될 수 있으며 환경 자극에 반응하여 세포 구조를 변경할 수 있는데, 이는 "조립 역동성"으로 알려진 생화학적 메커니즘을 통해 이루어진다.[5]
5. 1. 조립 단계
액틴 필라멘트의 조립은 고전적으로 다음 세 단계를 거친다.1. 핵 형성 단계: 2~3개의 G-액틴 분자가 서서히 결합하여 더 많은 성장을 유도하는 작은 올리고머를 형성한다.[185]
2. 신장 단계: 액틴 필라멘트가 양쪽 끝에 많은 액틴 분자가 추가됨으로써 빠르게 성장한다. 필라멘트가 성장함에 따라 액틴 분자는 (-) 끝보다 (+) 끝에 약 10배 더 빠르게 추가되므로 필라멘트는 주로 (+) 끝에서 성장하는 경향이 있다.[79]
3. 정상 상태 단계: 액틴 분자가 필라멘트에 결합하고 떨어지는 속도가 같아져 필라멘트의 길이를 유지하는 평형 상태에 도달한다. 정상 상태 단계에서 필라멘트의 길이는 일정하게 유지되지만, 새로운 분자가 (+) 끝에 계속 추가되고 (-) 끝에서 떨어져 나가는데, 이 현상은 주어진 액틴 분자가 가닥을 따라 움직이는 것처럼 보이기 때문에 "트레드밀링(treadmilling)"이라고 한다.[185]
분리된 상태에서 필라멘트가 성장할지 수축할지, 그리고 얼마나 빨리 성장할지는 필라멘트 주변의 G-액틴 농도에 따라 결정된다. 그러나 세포 내에서는 액틴 필라멘트의 역동성이 다양한 액틴 결합 단백질의 영향을 크게 받는다.

G-액틴의 세포 내 농도가 중합 반응과 탈중합 반응을 속도 결정 단계로 하고 있으며, 두 반응이 같아지는 G-액틴의 농도를 임계 농도라고 부른다. 임계 농도는 +극에서는 0.1μM, -극에서는 0.6μM이며, 이 농도 사이에서는 +극이 임계 농도가 더 낮기 때문에 중합이 진행되고, -극에서는 탈중합이 진행된다. 따라서 정상 상태에서는 +극에서 신장하고 -극에서 단축하고 있다. 이것은 트레드밀링이라고 불린다.[185]
액틴은 주로 ATP와 결합하지만 ADP와도 결합할 수 있다. ATP와 액틴의 복합체는 ADP와 액틴의 복합체보다 빠르게 중합하고, 느리게 탈중합한다.
액틴의 중합, 즉 핵 형성 과정은 3개의 G액틴 단량체가 삼량체로 합쳐지는 것으로 시작된다. 이때, ATP가 붙은 액틴은 +극에 결합하고, ATP는 그 후 가수분해되어, 이웃 유닛과의 결합 길이가 짧아져 일반적으로 섬유는 불안정해진다. ADP가 붙은 액틴은 -극에서 탈중합하고, ADP 결합 액틴의 증가가 결합한 ADP의 ATP로의 교환을 자극하여 ATP 결합 액틴을 증가시킨다. 이 빠른 대사 회전이 세포의 작용에 중요하다.
코필린이라는 단백질은 ADP 결합 액틴 유닛에 결합하여 -극으로부터의 탈중합을 촉진하고, 재구축을 방해한다. 프로필린이라는 단백질은 결합하는 ADP와 ATP의 교환을 자극함으로써 이 효과를 역전시킨다. 게다가, 프로필린과 결합한 ATP 결합 액틴 유닛은 코필린과 분리되어 자유롭게 중합할 수 있다. 그 외에 필라멘트 생성에 중요한 성분으로 Arp2/3 단백질이 있으며, 이것은 핵 형성 장소로 유용하고, G액틴 삼량체의 형성을 자극한다. 이들 3가지 단백질은 모두 세포 신호 기전에서 조절된다.
5. 2. 액틴 결합 단백질
생체 내 액틴 세포골격은 액틴 외에 다양한 액틴 결합 단백질(ABP)에 의해 조절된다.[97] 액틴 결합 단백질은 액틴의 중합, 탈중합, 안정성 및 조직화에 관여하며,[97] 이 단백질의 다양성으로 인해 액틴은 가장 많은 단백질-단백질 상호작용에 관여하는 단백질로 여겨진다.[98]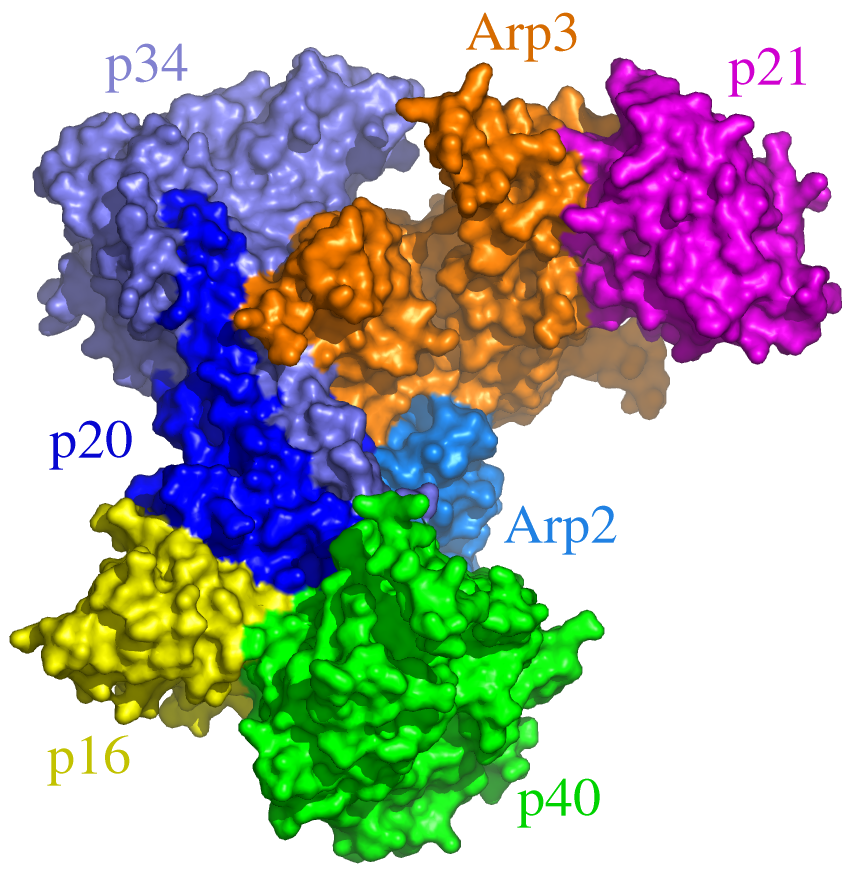
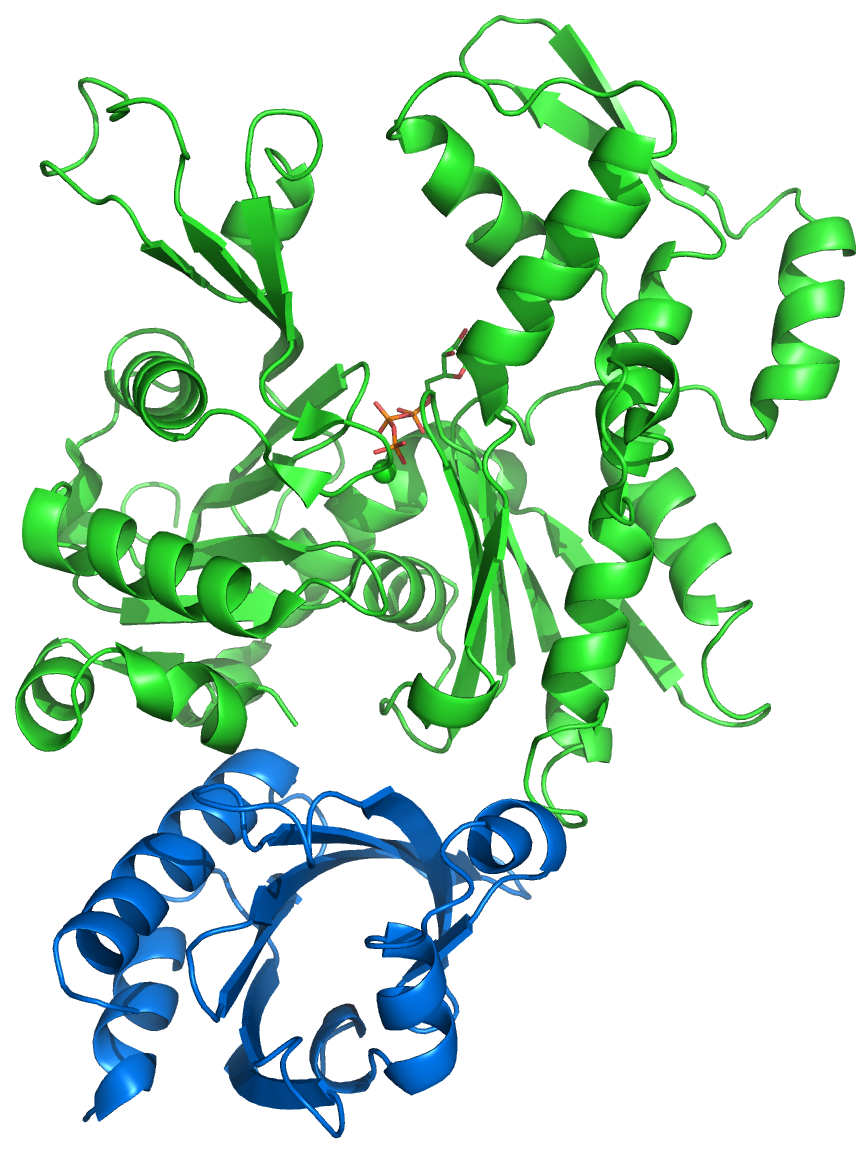
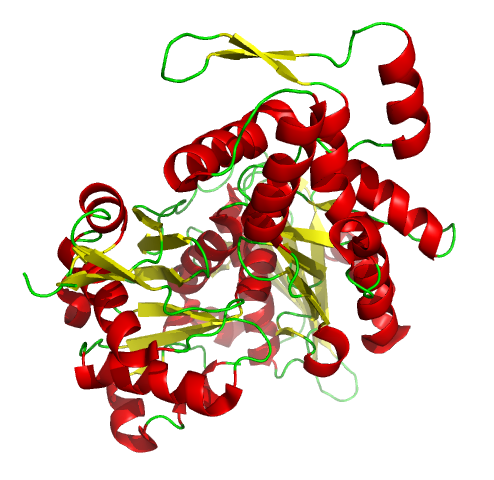
새로운 액틴 필라멘트의 핵 형성은 포르민(예: 포르민-2) 및 Arp2/3 복합체와 같은 액틴 핵 형성 단백질의 도움을 받는다.[97] 포르민은 긴 액틴 필라멘트의 핵 형성을 돕고, Arp2/3 복합체는 핵 형성 촉진 인자와 함께 작용하여 액틴 필라멘트의 가지 형성을 돕는다.
필라멘트가 성장함에 따라 사용 가능한 G-액틴 분자 풀은 프로필린 및 티모신 β-4와 같은 G-액틴 결합 단백질에 의해 관리된다. 프로필린은 ADP 결합 G-액틴에 결합하고 ADP를 ATP로 교환하는 것을 촉진하여 사용 가능한 액틴-ATP의 공급을 보장한다. 반대로 티모신 β-4는 액틴-ATP에 결합하여 격리함으로써 미세섬유에 결합하는 것을 방지한다.
액틴 섬유가 확립되면 성장 또는 붕괴 역학은 코필린, 젤솔린과 같은 필라멘트 절단 단백질과 CapZ, 트로포모듈린을 포함하는 "캡핑 단백질" 등 다양한 단백질의 영향을 받는다. 코필린은 필라멘트를 불안정하게 만들어 파괴를 유도하고, 젤솔린은 필라멘트를 파괴한 후 새로운 (+) 말단에 부착되어 성장을 방지한다. 캡핑 단백질은 필라멘트의 말단에 결합하여 안정화시킨다. CapZ는 (+) 말단에 결합하여 액틴 추가나 손실을 방지하고, 트로포모듈린은 (−) 말단에 결합하여 분자 추가나 손실을 방지한다.
코필린은 ADP 결합 액틴 유닛에 결합하여 -극으로부터의 탈중합을 촉진하고 재구축을 방해한다. 프로필린은 결합하는 ADP와 ATP의 교환을 자극함으로써 이 효과를 역전시킨다. 프로필린과 결합한 ATP 결합 액틴 유닛은 코필린과 분리되어 자유롭게 중합할 수 있다. 필라멘트 생성에 중요한 또 다른 성분으로 Arp2/3 단백질이 있으며, 이는 핵 형성 장소로 유용하고 G-액틴 삼량체 형성을 자극한다. 이들 세 가지 단백질은 모두 세포 신호 기전에서 조절된다.
6. 액틴의 유전학
대부분의 효모는 단 하나의 액틴 유전자만 가지고 있지만, 고등 진핵생물은 일반적으로 여러 액틴 아이소폼을 발현한다.
전형적인 액틴 유전자는 약 100 뉴클레오티드의 5'UTR, 1200 뉴클레오티드의 번역 영역 및 200 뉴클레오티드의 3'UTR을 가지고 있다. 대부분의 액틴 유전자는 인트론에 의해 중단되며, 잘 특징지어진 19개 위치 중 어느 곳에서든 최대 6개의 인트론이 존재한다. 이 유전자군의 높은 보존성으로 인해 액틴은 인트론 초기 모델과 인트론 후기 모델의 인트론 진화 비교 연구에 유용한 모델이 된다.
6. 1. 액틴 유전자
포유류는 최소 여섯 가지의 액틴 아이소폼을 가지며, 이들은 등전점에 따라 알파, 베타, 감마의 세 가지 종류로 나뉜다.[101] 일반적으로 알파 액틴은 근육 (α-골격근, α-대동맥 평활근, α-심장근)에서 발견되는 반면, 베타와 감마 아이소폼은 비근육 세포 (β-세포질, γ1-세포질, γ2-장 평활근)에서 두드러진다. 아미노산 서열과 ''시험관 내'' 특성이 매우 유사하지만, 이러한 아이소폼은 ''생체 내''에서 서로 완전히 대체할 수 없다.[102] 식물은 60개 이상의 액틴 유전자와 유사유전자를 포함하고 있다.7. 액틴의 진화
액틴은 진핵생물의 진화 과정에서 가장 잘 보존된 단백질 중 하나이다. 동물과 아메바의 액틴 단백질 서열은 약 10억 년의 진화적 차이에도 불구하고 80%의 동일성을 보인다.[123] 많은 단세포 진핵생물은 하나의 액틴 유전자를 가지고 있는 반면, 인간은 6개, 식물은 10개 이상의 액틴 유전자를 가지는 등 다세포 진핵생물은 종종 여러 개의 밀접하게 관련된 유전자를 가지고 있으며, 이들은 특수한 기능을 수행한다.[123]
모든 분류군의 진핵생물 세포골격은 액틴과 튜불린과 유사한 구성 요소를 가지고 있다. 예를 들어, 인간의 ''ACTG2'' 유전자에 의해 암호화되는 단백질은 쥐와 생쥐에 존재하는 상동체와 완전히 동일하지만, 뉴클레오타이드 수준에서는 유사성이 92%로 감소한다.[123]
일부 연구자들은 액틴, 튜불린, 그리고 DNA의 안정화 및 조절에 관여하는 단백질인 히스톤이 뉴클레오타이드 결합 능력과 브라운 운동을 이용하는 능력에서 유사하며, 이들이 모두 공통 조상을 가지고 있을 것이라고 제안한다.[104] 따라서 진화 과정을 통해 조상 단백질이 오늘날의 다양한 형태로 분화되었고, 그중에서도 액틴은 엔도사이토시스와 같은 필수적인 조상 생물학적 과정을 처리할 수 있는 효율적인 분자로 보존되었다.[105]
7. 1. 액틴 관련 단백질 (Arp)
진핵생물은 액틴과 공통 조상을 공유하는 많은 액틴 관련 단백질(Arp, actin-related proteins) 계열을 가지고 있으며, 이들은 Arp1~Arp11로 불린다. 이 중 Arp1이 액틴과 가장 가깝고 Arp11이 가장 멀다.[123] Arp2/3 복합체(Arp2/3 complex)는 모든 진핵생물에서 널리 발견된다.[106]7. 2. 원핵생물에서의 상동체
세균은 액틴과 유사한 단백질인 MreB, FtsA, ParM 등을 가지고 있다.[3][103][109] MreB는 세포 모양에 영향을 주고,[181][107] FtsA는 세포 분열에 관여하며, ParM은 큰 플라스미드의 분리를 담당한다.[3][109] 이 단백질들은 진핵생물 액틴과 높은 수준의 구조적 유사성을 가지고 있다.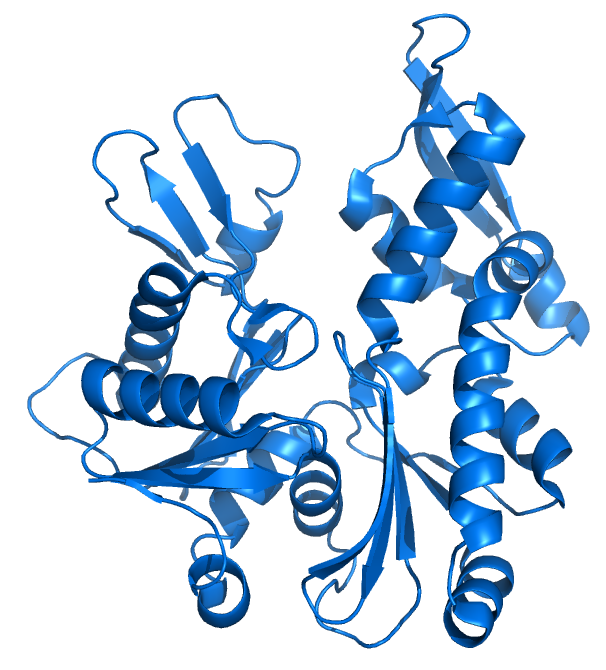
일부 고세균은 세균과 유사한 MreB 유전자를 가지고 있는 반면, 다른 고세균은 진핵생물 액틴과 더 유사한 액틴 유전자를 가지고 있다.[113]
8. 액틴의 분자 병리학
대부분의 포유류는 여섯 가지 액틴 유전자를 가지고 있다. 이 중 ''ACTB''와 ''ACTG1''는 세포골격을 구성하며, ''ACTA1'', ''ACTA2'', ''ACTG2'', ''ACTC1''는 각각 골격근, 평활근 조직, 소장 근육, 심장근에 관여한다.[116] 세포골격 액틴은 HIV 등 여러 병원체의 발병 기전에 관여하며, 대부분 점 돌연변이로 우성 효과를 나타낸다.[116]
액틴 유전자 돌연변이는 다양한 질병을 유발한다. ''ACTA1'' 돌연변이는 근병증을, ''ACTG1'' 돌연변이는 난청을 일으킬 수 있다. 일부 감염성 병원체는 세포 내 이동 및 전파에 액틴을 이용한다.
8. 1. ACTA1 관련 병리
''ACTA1'' 유전자는 사람의 골격근에서 주로 발현되는 α-액틴 이성체를 암호화하는 유전자이지만, 심장근육과 갑상선에서도 발현된다.[114] 이 유전자의 돌연변이는 골격근의 구조와 기능을 변화시켜 근병증을 유발할 수 있는데, 3형 네말린 근병증, 얇은 근절섬유 과다 선천성 근병증(CM), 섬유형태 비대칭 선천성 근병증(CMFTD)이 대표적이다. 중심핵 근병증을 유발하는 돌연변이도 발견되었다.[117]
표현형은 유사하지만, 전형적인 네말린 근병증 외에도 일부 전문가들은 액틴성 네말린 근병증이라고 불리는 또 다른 유형의 근병증을 구분한다. 액틴성 네말린 근병증에서는 전형적인 소체 대신 액틴 덩어리가 형성된다. 환자의 생검에서 이러한 여러 표현형이 나타날 수 있다.[118] 가장 흔한 증상으로는 근병증성 안면과 같은 전형적인 안면 형태, 근력 약화, 운동 발달 지연, 호흡 곤란 등이 있다. 질병의 경과, 중증도, 발병 연령은 모두 다양하며, 중복되는 형태의 근병증도 발견된다. 네말린 근병증의 한 증상은 1형 근섬유의 여러 부위에 "네말린 소체"가 나타나는 것이다. 이 소체는 사르코머에 있는 Z선과 유사한 구성을 가진 비특징적 병변 구조이다.[119]
이 근병증의 발병 기전은 매우 다양하다. 많은 돌연변이는 액틴의 뉴클레오티드 결합 부위 근처의 함몰 부위에서 발생하는 반면, 다른 돌연변이는 도메인 2 또는 관련 단백질과 상호 작용하는 부위에서 발생한다. 이는 네말린 소체, 핵내 소체, 얼룩말 소체와 같은 다양한 덩어리가 형성되는 것을 설명하는 데 도움이 된다.[116] 네말린 근병증에서는 액틴의 접힘 변화뿐만 아니라 응집 변화도 발생하며, 다른 관련 단백질의 발현에도 변화가 있다. 핵내 소체가 발견되는 일부 변이체에서는 접힘 변화가 핵의 단백질 수출 신호를 가리고, 그 결과 액틴 돌연변이 형태가 세포핵에 축적된다.[120] 반면, CFTDM을 일으키는 ''ACTA1'' 돌연변이는 구조보다는 사르코머 기능에 더 큰 영향을 미치는 것으로 보인다.[121] 최근 연구에서는 소체 수와 근력 약화 사이에 명확한 상관관계가 없는 것으로 보이는 이러한 역설을 이해하려고 노력해 왔다. 일부 돌연변이는 2형 근섬유에서 더 높은 세포자멸사율을 유도할 수 있는 것으로 보인다.[86]
8. 2. 평활근 액틴 관련 병리
'''ACTG2'''는 가장 큰 액틴 이소형을 암호화하며, 9개의 엑손을 가지고 있다. 그 중 5' 말단에 위치한 하나는 번역되지 않는다.[123] 이것은 장 평활근에서 발현되는 γ-액틴이다. 이 유전자의 돌연변이 중 시스플라틴을 이용한 항암 화학요법에 내성이 있는 경우에 이 단백질이 더 자주 발현된다는 것을 보여주는 마이크로어레이 분석 결과가 있지만, 병리와 관련된 돌연변이는 발견되지 않았다.[124]'''ACTA2'''는 평활근과 혈관 평활근에 위치한 α-액틴을 암호화한다. MYH11 돌연변이는 특히 6형의 유전성 흉부 대동맥류의 최소 14%를 유발할 수 있다고 알려져 있다. 이는 돌연변이 변이체가 잘못된 필라멘트 조립을 생성하고 혈관 평활근 수축 능력을 감소시키기 때문이다. 이러한 개인에게서는 대동맥 중막의 퇴행이 관찰되었으며, 대동맥의 혈관의 혈관의 조직 무질서 및 증식과 협착이 나타난다.[125] 이 유전자가 관련된 질병의 수는 증가하고 있다. 모야모야병과 관련이 있으며, 이형접합성의 특정 돌연변이는 흉부 대동맥류 및 허혈성 심장 질환과 같은 많은 혈관 병리에 대한 소인을 부여할 수 있을 것으로 보인다.[126] 평활근에서 발견되는 α-액틴은 또한 간 간경변의 진행 과정을 평가하는 데 유용한 지표이다.[127]
8. 3. 심장근 액틴 관련 병리
ACTC1 유전자는 심장 근육에 존재하는 α-액틴 동형체를 암호화한다. 이 유전자의 점 돌연변이와 관련된 여러 구조적 장애들이 묘사되었는데, 이는 1형 확장성 심근병증과 11형 비대성 심근병증과 같이 심장 기능 장애를 유발한다. 최근에는 심방중격의 특정 결함도 이러한 돌연변이와 관련이 있을 수 있다고 보고되었다.[131][132]확장성 심근병증의 두 가지 사례는 고도로 보존된 아미노산의 치환과 관련되어 연구되었는데, 이는 Z선과 결합하고 섞이는 단백질 도메인에 속한다. 이는 근세포에서 근수축 전달의 결함에 의해 확장이 발생한다는 이론으로 이어졌다.[133][129]
ACTC1의 돌연변이는 비대성 심근병증의 최소 5%를 차지한다.[134] 다수의 점 돌연변이도 발견되었다.[135]
- E101K 돌연변이: 순 전하의 변화와 액토마이오신 결합 부위에서 약한 정전기적 결합 형성.
- P166A: 액틴 단량체 간 상호 작용 영역.
- A333P: 액틴-마이오신 상호 작용 영역.
발병 기전은 보상 기전을 포함하는 것으로 보인다. 돌연변이 단백질은 우성 효과를 가진 독소처럼 작용하여 심장의 수축 능력을 감소시키고 비정상적인 기계적 행동을 유발한다. 일반적으로 지연되는 비대증은 심근의 스트레스에 대한 정상적인 반응의 결과이다.[136]
최근 연구에서는 영아 특발성 제한성 심근병증,[137] 좌심실 심근의 비압축[138]과 같은 다른 두 가지 병리학적 과정에 관여하는 ACTC1 돌연변이를 발견했다.
8. 4. 세포질 액틴 관련 병리
''ACTB''와 ''ACTG1'' 유전자는 세포질 액틴을 만드는 유전 정보(암호)를 담고 있으며, 이들 유전자에 돌연변이가 생기면 다음과 같은 질병을 일으킬 수 있다.[139][145]- '''이긴긴장증''': ''ACTB'' 유전자 돌연변이는 뇌의 특정 영역에 이상 단백질 덩어리(호산성 포함체)를 만들고, 신경계에 문제를 일으켜 근육 긴장 이상, 감각 난청 등을 유발할 수 있다.[143]
- '''호중구 기능 장애''': ''ACTB'' 유전자 돌연변이는 면역 세포인 호중구의 기능을 떨어뜨려 반복적인 감염을 일으킬 수 있다.[144]
- '''난청''': ''ACTG1'' 유전자 돌연변이는 귀 속 코르티 기관의 섬모 세포에 영향을 주어 소리를 잘 듣지 못하게 되는 감각 신경성 난청을 일으킬 수 있다.[116]
8. 5. 기타 병리학적 메커니즘
일부 감염성 병원체는 세포 내 이동이나 세포 간 전파에 액틴을 이용한다. 예를 들어, *리스테리아 모노사이토제네스*, 일부 *리케차* 종, *시겔라 플렉스네리* 등은 액틴 필라멘트 캡슐로 자신을 감싸 식세포 소포체에서 탈출한다. *리스테리아*와 *시겔라*는 "혜성 꼬리" 모양의 액틴 꼬리를 만들어 이동하며, 이 꼬리의 중합 메커니즘은 종마다 약간씩 다르다.[149] 이러한 세균들은 미오신 유사 단백질 모터를 사용하지 않고, 숙주 세포의 액틴 중합 압력을 이용해 움직이며, Arp2/3 복합체, Ena/VASP 단백질, 코필린 등 핵 생성 촉진제를 이용한다.[150] *마이코박테리움 마리눔*과 *버크홀데리아 슈도말레이* 같은 세균도 Arp2/3 복합체를 이용해 세포 액틴의 국소 중합을 일으켜 이동을 돕는다. 백시니아 바이러스도 전파를 위해 액틴 세포골격 요소를 사용한다.[151]HIV와 같은 일부 바이러스는 세포 내 침투 초기 단계에서 코필린 복합체를 비활성화하여 액틴 중합을 촉진한다.[153]
암세포 침입 과정에서도 액틴이 중요한 역할을 하지만, 그 자세한 메커니즘은 아직 완전히 밝혀지지 않았다.[154]
9. 액틴의 응용
액틴은 미오신과 같은 분자 모터의 이동 경로로, 그리고 세포 기능에 필요한 구성 요소로 과학 및 기술 연구실에서 사용된다. 또한 여러 변이체가 특정 병리 현상과 관련되어 있어 진단 도구로도 활용된다. 액틴은 나노기술, 분자생물학 연구, 질병 진단, 식품 기술 등 다양한 분야에 응용된다.
9. 1. 나노기술
액틴-미오신 시스템은 세포질 전체에 소포와 세포 소기관을 수송하는 분자 모터 역할을 한다. 액틴의 동적 능력은 세포 외 시스템에서 수행된 실험을 포함한 여러 실험에서 활용되어 나노기술에 적용될 가능성이 있다. 기본적인 아이디어는 미세섬유를 사용하여 주어진 짐을 수송할 수 있는 분자 모터를 안내하는 경로로 사용하는 것이다. 즉, 액틴을 사용하여 다소 제어되고 지시된 방식으로 짐을 수송할 수 있는 회로를 정의할 수 있다. 일반적인 응용 프로그램 측면에서, 특정 위치에 분자를 침착시키기 위한 지시된 수송에 사용될 수 있으며, 이는 나노 구조체의 제어된 조립을 허용한다.[158] 이러한 특성은 랩온어칩과 같은 실험실 공정, 나노 구성 요소 역학 및 기계 에너지를 전기 에너지로 변환하는 나노 변압기에 적용될 수 있다.[160]9. 2. 분자생물학 연구
액틴은 웨스턴 블롯에서 내부 대조군으로 사용된다. 이는 각 젤 레인에 동일한 양의 단백질이 로드되었는지 확인하기 위함이다. 예시로, 왼쪽 블롯 이미지에서는 각 웰에 75μg의 총 단백질이 로드되었다. 이 블롯은 항-β-액틴 항체와 반응하였다.[160]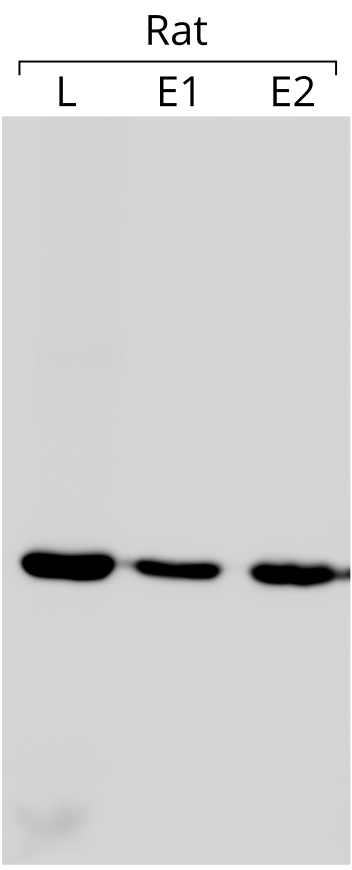
액틴을 내부 대조군으로 사용하는 것은 액틴의 발현이 실험 조건과 무관하게 일정하다는 가정에 기반한다. 관심 있는 유전자의 발현을 액틴의 발현과 비교함으로써, 액틴의 발현이 일정할 때 서로 다른 실험 간에 비교할 수 있는 상대적인 양을 얻을 수 있다.[161] 그러나 액틴이 항상 유전자 발현에서 원하는 안정성을 가지는 것은 아니다.[162]
9. 3. 질병 진단
액틴의 일부 대립유전자는 질병을 유발하기 때문에 이를 검출하기 위한 기술이 개발되었다. 또한, 액틴은 수술 병리학에서 간접적인 표지자로 사용될 수 있다. 조직에서의 분포 패턴 변화는 종양, 혈관염 및 기타 질환의 침윤 표지자로 사용될 수 있다.[163] 액틴은 근육 수축 기구와 밀접하게 관련되어 있기 때문에, 근육 조직이 위축될 때 골격근에서의 액틴 수준이 감소하므로 이 생리적 과정의 표지자로도 사용될 수 있다.[164]9. 4. 식품 기술
액틴의 양을 정량화하여 소시지와 같은 특정 가공 식품의 품질을 결정할 수 있다. 전통적으로 이러한 제품의 가수분해된 샘플에서 3-메틸히스티딘의 검출을 기반으로 하는 방법이 사용되어 왔는데, 이 화합물은 액틴과 F-미오신의 무거운 사슬(둘 다 근육의 주요 구성 요소임)에 존재하기 때문이다. 육류에서 이 화합물의 생성은 두 단백질에 존재하는 히스티딘 잔기의 메틸화에서 유래한다.[165][166]10. 액틴 연구의 역사
액틴은 1887년 W.D. 핼리버턴(W.D. Halliburton)에 의해 처음으로 실험적으로 관찰되었는데, 그는 근육에서 단백질을 추출하여 '응고'시키는 미오신 제제를 "미오신 발효체"라고 불렀다.[167] 그러나 핼리버턴은 그의 발견을 더욱 정제할 수 없었고, 액틴의 발견은 헝가리 세게드 대학교(University of Szeged) 의학화학연구소에서 알베르트 센트죄르지(Albert Szent-Györgyi)의 실험실에서 일하던 젊은 생화학자 브루노 페렌츠 슈트라웁(Brunó Ferenc Straub)에게 돌아갔다.
1941년 일로나 방가(Ilona Banga)와 센트죄르지가 응고가 일부 미오신 추출물에서만 일어나며 ATP를 첨가하면 역전된다는 것을 발견한 데 이어,[168] 슈트라웁은 응고된 미오신 제제에서 액틴을 확인하고 정제했다. 그는 방가의 원래 추출 방법을 바탕으로 근육 단백질을 추출하는 새로운 기술을 개발하여 상당량의 비교적 순수한 액틴을 분리했고, 1942년에 발표했다.[169] 슈트라웁의 방법은 오늘날 실험실에서 사용되는 방법과 본질적으로 동일하다. 슈트라웁의 단백질은 미오신의 응고를 활성화하는 데 필요했기 때문에 ''액틴''이라고 불렸다.[168][170] 방가의 응고 미오신 제제에도 액틴이 포함되어 있다는 것을 알게 된 센트죄르지는 두 단백질의 혼합물을 액토미오신(actomyosin)이라고 불렀다.[171]
제2차 세계 대전의 적대 행위로 인해 센트죄르지는 그의 실험실 연구 결과를 서구 과학 저널에 발표할 수 없었다. 따라서 액틴은 1945년 그들의 논문이 ''Acta Physiologica Scandinavica''의 보충 자료로 발표되었을 때 서구에서 알려지게 되었다.[172] 슈트라웁은 액틴 연구를 계속했고, 1950년에 액틴이 결합된 아데노신 삼인산(ATP)을 포함하고 있으며,[173] 단백질이 미세섬유로 중합되는 동안 뉴클레오티드는 가수분해되어 아데노신 이인산(ADP)과 무기 인산(미세섬유에 결합된 상태로 남아 있음)이 된다고 보고했다. 슈트라웁은 ATP 결합 액틴이 ADP 결합 액틴으로 변환되는 것이 근육 수축에 역할을 한다고 제안했다.
액틴의 아미노산 서열은 1973년 M. 엘징가(M. Elzinga)와 그의 동료들에 의해 완료되었다.[175] G-액틴의 결정 구조는 1990년 카브쉬(Kabsch)와 그의 동료들에 의해 밝혀졌다.[176]
참조
[1]
논문
Mediation, modulation, and consequences of membrane-cytoskeleton interactions
[2]
논문
Cytoskeletal tropomyosins: choreographers of actin filament functional diversity
2013-08-00
[3]
논문
The evolution of compositionally and functionally distinct actin filaments
2015-06-00
[4]
논문
In search of the primordial actin filament
2015-07-00
[5]
서적
Molecular biology of the cell
Garland Science
[6]
논문
Emergent complexity of the cytoskeleton: from single filaments to tissue
2013-01-00
[7]
서적
Eckert animal physiology: mechanisms and adaptations
https://archive.org/[...]
W.H. Freeman and CO
[8]
논문
Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons
2013-01-00
[9]
논문
The yeast actin cytoskeleton: from cellular function to biochemical mechanism
2006-09-00
[10]
논문
Isovariant dynamics expand and buffer the responses of complex systems: the diverse plant actin gene family
1999-06-00
[11]
논문
Solution structures of the C-terminal headpiece subdomains of human villin and advillin, evaluation of headpiece F-actin-binding requirements
2004-05-00
[12]
논문
Actin microfilament dynamics and actin side-binding proteins in plants
2007-12-00
[13]
논문
AtFim1 is an actin filament crosslinking protein from Arabidopsis thaliana
2000-12-00
[14]
논문
Diffusible and bound actin nuclei of Xenopus laevis oocytes
1977-12-00
[15]
서적
International Review of Cell and Molecular Biology
Academic Press
2009-01-01
[16]
논문
Emerging properties and functions of actin and actin filaments inside the nucleus
2021-02-00
[17]
논문
A selective block of nuclear actin export stabilizes the giant nuclei of Xenopus oocytes
2006-03-00
[18]
논문
Active maintenance of nuclear actin by importin 9 supports transcription
2012-02-00
[19]
논문
Nuclear export of actin: a novel mechanism regulating the subcellular localization of a major cytoskeletal protein
1998-03-00
[20]
논문
Exportin 6: a novel nuclear export receptor that is specific for profilin.actin complexes
2003-11-00
[21]
논문
SUMOylation of nuclear actin
2009-07-00
[22]
논문
Nucleoplasmic beta-actin exists in a dynamic equilibrium between low-mobility polymeric species and rapidly diffusing populations
2006-02-00
[23]
논문
Tracking down the different forms of nuclear actin
2006-08-00
[24]
논문
β- and γ-Actins in the nucleus of human melanoma A375 cells
2015-11-00
[25]
논문
Actin in the nucleus: what form and what for?
2002-12-01
[26]
논문
Cofilin, actin and their complex observed in vivo using fluorescence resonance energy transfer
2005-09-00
[27]
논문
Nuclear actin: A key player in extracellular matrix-nucleus communication
2011-09-00
[28]
논문
Rapid and phosphoinositol-dependent binding of the SWI/SNF-like BAF complex to chromatin after T lymphocyte receptor signaling
1998-11-00
[29]
논문
Actin is part of pre-initiation complexes and is necessary for transcription by RNA polymerase II
2004-11-00
[30]
논문
A role for beta-actin in RNA polymerase III transcription
2004-12-00
[31]
논문
Nuclear actin and myosin I are required for RNA polymerase I transcription
2004-12-00
[32]
논문
New roles for lamins, nuclear envelope proteins and actin in the nucleus
2004-01-01
[33]
논문
Cells lacking β-actin are genetically reprogrammed and maintain conditional migratory capacity
2012-08-00
[34]
논문
Emerin caps the pointed end of actin filaments: evidence for an actin cortical network at the nuclear inner membrane
2004-09-00
[35]
서적
Muscular Dystrophies
2011-01-01
[36]
논문
Chromatin remodelling and actin organisation
2008-06-01
[37]
논문
The growing pre-mRNA recruits actin and chromatin-modifying factors to transcriptionally active genes
2005-08-01
[38]
논문
Molecular functions of nuclear actin in transcription
2006-03-01
[39]
논문
Nuclear architecture and gene regulation
2008-11-01
[40]
논문
Actin on DNA-an ancient and dynamic relationship
2010-08-01
[41]
논문
Nuclear actin and actin-related proteins in chromatin remodeling
2002-01-01
[42]
논문
Nuclear actin and actin-binding proteins in the regulation of transcription and gene expression
2009-05-01
[43]
논문
Induction of HoxB transcription by retinoic acid requires actin polymerization
2009-08-01
[44]
논문
Nuclear translocation of beta-actin is involved in transcriptional regulation during macrophage differentiation of HL-60 cells
2010-03-01
[45]
논문
Nuclear actin polymerization is required for transcriptional reprogramming of Oct4 by oocytes
2011-05-01
[46]
논문
Coronin 2A mediates actin-dependent de-repression of inflammatory response genes
2011-02-01
[47]
논문
Nuclear actin and transcriptional activation
2011-09-01
[48]
논문
Long-range directional movement of an interphase chromosome site
2006-04-01
[49]
논문
Nuclear myosin I is necessary for the formation of the first phosphodiester bond during transcription initiation by RNA polymerase II
2006-11-01
[50]
논문
Linking actin dynamics and gene transcription to drive cellular motile functions
2010-05-01
[51]
논문
Actin dynamics control SRF activity by regulation of its coactivator MAL
2003-05-01
[52]
논문
Nuclear actin dynamics--from form to function
2008-06-01
[53]
논문
Actin-mediated gene expression in neurons: the MRTF-SRF connection
2010-06-01
[54]
논문
T cell receptor-triggered nuclear actin network formation drives CD4+ T cell effector functions
2019-01-01
[55]
서적
Nuclear Actin Dynamics in Gene Expression, DNA Repair, and Cancer
2022-01-01
[56]
논문
Actuation of single downstream nodes in growth factor network steers immune cell migration
https://doi.org/10.1[...]
2023-07-01
[57]
논문
Ras suppression potentiates rear actomyosin contractility-driven cell polarization and migration
https://www.nature.c[...]
2024-07-01
[58]
논문
Alpha-actinin localization in the cleavage furrow during cytokinesis
1978-10-01
[59]
논문
Actin dynamics in the contractile ring during cytokinesis in fission yeast
2002-09-01
[60]
서적
Citología e histología vegetal y animal
McGraw-Hill Interamericana de España, S.A.U.
[61]
논문
Actin cleavage by CPP-32/apopain during the development of apoptosis
1997-03-01
[62]
논문
Calpain and caspase: can you tell the difference?
2000-01-01
[63]
논문
Calpain inhibitors, but not caspase inhibitors, prevent actin proteolysis and DNA fragmentation during apoptosis
1998-03-01
[64]
논문
SAPK2/p38-dependent F-actin reorganization regulates early membrane blebbing during stress-induced apoptosis
1998-11-01
[65]
논문
Quantitative analysis of cadherin-catenin-actin reorganization during development of cell-cell adhesion
1996-12-01
[66]
논문
Redundancy in the microfilament system: abnormal development of Dictyostelium cells lacking two F-actin cross-linking proteins
1992-01-01
[67]
논문
Actin plays a role in both changes in cell shape and gene-expression associated with Schwann cell myelination
1997-01-01
[68]
논문
Role of actin cytoskeletal dynamics in activation of the cyclic AMP pathway and HWP1 gene expression in Candida albicans
2007-10-01
[69]
논문
Novel actin-like proteins T-ACTIN 1 and T-ACTIN 2 are differentially expressed in the cytoplasm and nucleus of mouse haploid germ cells
2003-08-01
[70]
논문
Epigenetic effects on yeast transcription caused by mutations in an actin-related protein present in the nucleus
1996-03-01
[71]
논문
Actin and myosin as transcription factors
2006-04-01
[72]
논문
Dynamic length regulation of sensory stereocilia
2008-12-01
[73]
논문
An actin molecular treadmill and myosins maintain stereocilia functional architecture and self-renewal
2004-03-01
[74]
논문
Polarity reveals intrinsic cell chirality
2007-05-01
[75]
논문
Autonomous right-screw rotation of growth cone filopodia drives neurite turning
2010-02-01
[76]
논문
Micropatterned mammalian cells exhibit phenotype-specific left-right asymmetry
2011-07-01
[77]
논문
The primary structure of actin from rabbit skeletal muscle. Completion and analysis of the amino acid sequence
1975-08-01
[78]
논문
Crystal structures of expressed non-polymerizable monomeric actin in the ADP and ATP states
2006-10-01
[79]
논문
Atomic model of the actin filament
1990-09-01
[80]
논문
Actin structure and function: what we still do not understand
2007-12-01
[81]
논문
The visualization of actin filament polarity in thin sections. Evidence for the uniform polarity of membrane-associated filaments
1978-12-01
[82]
서적
Histologi
https://books.google[...]
Munksgaard
[83]
서적
Textbook of medical physiology
https://archive.org/[...]
Elsevier Saunders
[84]
서적
Molecular Biology of the Cell
Garland Science
[85]
논문
Structure of eukaryotic prefoldin and of its complexes with unfolded actin and the cytosolic chaperonin CCT
2002-12-01
[86]
논문
alpha-Skeletal muscle actin nemaline myopathy mutants cause cell death in cultured muscle cells
https://hal.science/[...]
2009-07-01
[87]
논문
Activities of the chaperonin containing TCP-1 (CCT): implications for cell cycle progression and cytoskeletal organisation
2009-01-01
[88]
논문
PhLP3 modulates CCT-mediated actin and tubulin folding via ternary complexes with substrates
2006-03-01
[89]
논문
Prefoldin-nascent chain complexes in the folding of cytoskeletal proteins
1999-04-01
[90]
논문
Selective contribution of eukaryotic prefoldin subunits to actin and tubulin binding
2004-02-01
[91]
논문
The inter-ring arrangement of the cytosolic chaperonin CCT
2007-03-01
[92]
논문
Actin interacts with CCT via discrete binding sites: a binding transition-release model for CCT-mediated actin folding
2006-01-01
[93]
논문
Actin polymerization kinetics, cap structure, and fluctuations
2005-06-01
[94]
논문
Insights into the cooperative nature of ATP hydrolysis in actin filaments
2018-09-01
[95]
논문
Unraveling the mystery of ATP hydrolysis in actin filaments
2014-09-01
[96]
논문
Water molecules in the nucleotide binding cleft of actin: effects on subunit conformation and implications for ATP hydrolysis
2011-10-01
[97]
서적
Biología celular
https://books.google[...]
Elsevier España
[98]
논문
Actin-binding proteins--a unifying hypothesis
2004-11-01
[99]
논문
Crystal structure of Arp2/3 complex
2001-11-01
[100]
논문
The structure of crystalline profilin-beta-actin
1993-10-01
[101]
논문
At least six different actins are expressed in a higher mammal: an analysis based on the amino acid sequence of the amino-terminal tryptic peptide
1978-12-01
[102]
서적
Functional specificity of actin isoforms
[103]
논문
Evolution of the cytoskeleton
2007-07-01
[104]
논문
Are histones, tubulin, and actin derived from a common ancestral protein?
[105]
논문
Actin and endocytosis: mechanisms and phylogeny
2009-02-01
[106]
논문
Structure and function of the Arp2/3 complex
1999-04-01
[107]
논문
Filament structure, organization, and dynamics in MreB sheets
2010-05-01
[108]
논문
Prokaryotic origin of the actin cytoskeleton
2001-09-01
[109]
논문
The bacterial actin-like cytoskeleton
2006-12-01
[110]
논문
Structure and filament dynamics of the pSK41 actin-like ParM protein: implications for plasmid DNA segregation
2010-03-01
[111]
논문
Polymeric structures and dynamic properties of the bacterial actin AlfA
2010-04-01
[112]
논문
Novel actin-like filament structure from Clostridium tetani
2012-06-01
[113]
논문
An actin homolog of the archaeon Thermoplasma acidophilum that retains the ancient characteristics of eukaryotic actin
2007-03-01
[114]
논문
A gene atlas of the mouse and human protein-encoding transcriptomes
2004-04-01
[115]
웹사이트
ACTS_HUMAN
https://www.uniprot.[...]
UniProt Consortium
2013-01-21
[116]
서적
Actin-binding Proteins and Disease
https://books.google[...]
Springer
[117]
논문
Missense mutations of ACTA1 cause dominant congenital myopathy with cores
2004-11-01
[118]
논문
Muscle disease caused by mutations in the skeletal muscle alpha-actin gene (ACTA1)
2003-09-01
[119]
서적
GeneReviews [Internet]
University of Washington, Seattle
[120]
논문
Evidence for a dominant-negative effect in ACTA1 nemaline myopathy caused by abnormal folding, aggregation and altered polymerization of mutant actin isoforms
2004-08-01
[121]
논문
The pathogenesis of ACTA1-related congenital fiber type disproportion
2007-06-01
[122]
논문
Phenotypes of myopathy-related actin mutants in differentiated C2C12 myotubes
[123]
논문
Structure, chromosome location, and expression of the human smooth muscle (enteric type) gamma-actin gene: evolution of six human actin genes
1991-06-01
[124]
논문
Expression microarray analysis reveals genes associated with in vitro resistance to cisplatin in a cell line model
[125]
논문
Mutations in smooth muscle alpha-actin (ACTA2) lead to thoracic aortic aneurysms and dissections
2007-12-01
[126]
논문
Mutations in smooth muscle alpha-actin (ACTA2) cause coronary artery disease, stroke, and Moyamoya disease, along with thoracic aortic disease
2009-05-01
[127]
논문
The value of alpha-SMA in the evaluation of hepatic fibrosis severity in hepatitis B infection and cirrhosis development: a histopathological and immunohistochemical study
2005-09-01
[128]
논문
Molecular structure and evolutionary origin of human cardiac muscle actin gene
1982-10-01
[129]
논문
Actin mutations in dilated cardiomyopathy, a heritable form of heart failure
1998-05-01
[130]
논문
Pol II-expressed shRNA knocks down Sod2 gene expression and causes phenotypes of the gene knockout in mice
2006-01-01
[131]
OMIM
Actin, alpha, cardiac muscle; ACTC1
[132]
논문
Alpha-cardiac actin mutations produce atrial septal defects
2008-01-01
[133]
서적
Bioquimica
https://books.google[...]
Reverté
[134]
논문
Genetic analysis in hypertrophic cardiomyopathy
2002-11-11
[135]
논문
Inherited and de novo mutations in the cardiac actin gene cause hypertrophic cardiomyopathy
2000-09-01
[136]
논문
Cardiomiopatía Hipertrófica familiar: Genes, mutaciones y modelos animales. Revisión
http://ve.scielo.org[...]
[137]
논문
Idiopathic restrictive cardiomyopathy in children is caused by mutations in cardiac sarcomere protein genes
2008-11-01
[138]
논문
Idiopathic common peroneal nerve palsy--a review of thirteen cases
[139]
웹사이트
Gene: ACTB
https://www.ncbi.nlm[...]
U.S. National Center for Biotechnology Information (NCBI)
2013-01-21
[140]
논문
Identification of a novel actin isoform in hepatocellular carcinoma
2006-09-01
[141]
논문
Hsp27 and axonal growth in adult sensory neurons in vitro
[142]
웹사이트
Soft tissue tumors: Pericytoma with t(7;12)
http://atlasgenetics[...]
University Hospital of Poitiers
2013-01-21
[143]
논문
A mutation of beta -actin that alters depolymerization dynamics is associated with autosomal dominant developmental malformations, deafness, and dystonia
2006-06-00
[144]
논문
A heterozygous mutation of beta-actin associated with neutrophil dysfunction and recurrent infection
1999-07-00
[145]
웹사이트
Gene: ACTG1
https://www.ncbi.nlm[...]
U.S. National Center for Biotechnology Information (NCBI)
2013-01-21
[146]
논문
Nucleotide sequence of the human gamma cytoskeletal actin mRNA: anomalous evolution of vertebrate non-muscle actin genes
1986-07-00
[147]
논문
Allele-specific effects of human deafness gamma-actin mutations (DFNA20/26) on the actin/cofilin interaction
2009-07-00
[148]
논문
Cytoplasmic gamma-actin is not required for skeletal muscle development but its absence leads to a progressive myopathy
2006-09-00
[149]
논문
A comparative study of the actin-based motilities of the pathogenic bacteria Listeria monocytogenes, Shigella flexneri and Rickettsia conorii
1999-06-00
[150]
논문
Listeria comet tails: the actin-based motility machinery at work
2008-05-00
[151]
논문
Actin-based motility of intracellular pathogens
2005-02-00
[152]
논문
Neutrophil enhancement of Pseudomonas aeruginosa biofilm development: human F-actin and DNA as targets for therapy
2009-04-00
[153]
논문
HIV infection of T cells: actin-in and actin-out
https://zenodo.org/r[...]
[154]
논문
Actin-based protrusions: promoters or inhibitors of cancer invasion?
2009-07-00
[155]
논문
Malarial pigment hemozoin impairs chemotactic motility and transendothelial migration of monocytes via 4-hydroxynonenal
2014-00-00
[156]
논문
Malarial pigment hemozoin impairs chemotactic motility and transendothelial migration of monocytes via 4-hydroxynonenal
2014-00-00
[157]
논문
Oxidative stress and antioxidants in health and disease
2023-00-00
[158]
논문
Light-controlled molecular shuttles made from motor proteins carrying cargo on engineered surfaces
[159]
논문
Actin-Based Molecular Motors for Cargo Transportation in Nanotechnology—Potentials and Challenges
[160]
논문
Mapping the sites of localization of epithelial sodium channel (ENaC) and CFTR in segments of the mammalian epididymis
2019-04-00
[161]
논문
Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes
2002-06-00
[162]
논문
Beta-actin--an unsuitable internal control for RT-PCR
https://github.com/J[...]
2001-10-00
[163]
논문
Immunohistochemical localization of actin: applications in surgical pathology
1981-01-00
[164]
논문
Atrophy responses to muscle inactivity. II. Molecular markers of protein deficits
2003-08-00
[165]
논문
Current advances in proteomic analysis and its use for the resolution of poultry meat quality
[166]
서적
Handbook of food analysis
Marcel Dekker
[167]
논문
On Muscle-Plasma
1887-08-00
[168]
논문
Preparation and properties of myosin A and B.
http://actin.aok.pte[...]
1942-00-00
[169]
논문
Actin
http://actin.aok.pte[...]
1942-00-00
[170]
논문
The discovery of actin: "to see what everyone else has seen, and to think what nobody has thought"
2020-03-00
[171]
논문
Discussion
http://actin.aok.pte[...]
1942-00-00
[172]
논문
Studies on muscle
[173]
논문
Adenosinetriphosphate. The functional group of actin. 1950
[174]
논문
Exchange of the actin-bound nucleotide in intact arterial smooth muscle
2001-12-00
[175]
논문
Complete amino-acid sequence of actin of rabbit skeletal muscle
1973-09-00
[176]
논문
Atomic structure of the actin:DNase I complex
1990-09-00
[177]
논문
The crystal structure of uncomplexed actin in the ADP state
2001-07-00
[178]
논문
Crystallization of native striated-muscle actin
1977-01-00
[179]
논문
Multiple crystal structures of actin dimers and their implications for interactions in the actin filament
2008-04-00
[180]
논문
Structural basis of actin filament capping at the barbed-end: a cryo-electron microscopy study
2006-11-00
[181]
논문
The nature of the globular- to fibrous-actin transition
2009-01-00
[182]
논문
Structure of the F-actin-tropomyosin complex
2015-05-00
[183]
논문
The evolution of compositionally and functionally distinct actin filaments
[184]
논문
In search of the primordial actin filament.
[185]
서적
分子生物学イラストレイテッド
羊土社
2009-03-10
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

