류신
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
류신은 식품 첨가물로 사용되며, 분지쇄 아미노산 중 하나로 근육 단백질 합성을 유도하는 필수 아미노산이다. 사람의 경우 류신을 합성할 수 없어 외부 섭취가 필요하며, 육류, 생선, 유제품 등을 통해 섭취할 수 있다. 류신은 간 기능 개선, 혈당 조절, 근육 유지 등 다양한 건강 효과가 있는 것으로 알려져 있다. 류신은 19세 이상 성인의 경우 체중 1kg당 42mg이 필요하며, 류신 과다 섭취는 메이플 시럽 뇨증, 펠라그라, 고암모니아혈증 등의 부작용을 유발할 수 있다.
더 읽어볼만한 페이지
- 가지사슬 아미노산 - 발린
발린은 헤르만 에밀 피셔가 카세인에서 처음 분리한 필수 아미노산으로, 체내 합성이 불가능하여 음식으로 섭취해야 하며, 에너지 대사, 인슐린 저항성, 조혈줄기세포 자가 재생 등에 관여하고 대사 과정 손상 시 특정 질환을 유발할 수 있다. - 가지사슬 아미노산 - 아이소류신
아이소류신은 섭취를 통해 얻어야 하는 필수 아미노산으로, 단백질 합성의 필수 구성 요소이며 포도당 대사 조절에 관여하고, 여러 이성질체가 존재하며 1903년 펠릭스 에를리히에 의해 발견되어 식물과 미생물에서 합성된다. - 케톤체 생성성 아미노산 - 페닐알라닌
페닐알라닌은 필수 아미노산으로, L형은 단백질 구성, D형은 화학 합성으로 얻어지며, 체내에서 티로신으로 전환되어 뇌 기능에 영향을 주고, 식물에서 플라보노이드와 리그난 생합성의 출발 물질로 사용되며, 유전 질환인 페닐케톤뇨증 환자는 섭취를 제한해야 한다. - 케톤체 생성성 아미노산 - 트립토판
트립토판은 체내 합성이 불가능하여 섭취해야 하는 필수 아미노산으로, 단백질 생합성뿐만 아니라 세로토닌, 멜라토닌, 니아신 등의 전구체로 작용하며 뇌 기능 및 정신 건강에 영향을 미치지만 과다 섭취 시 부작용 위험이 있다. - 필수 아미노산 - 발린
발린은 헤르만 에밀 피셔가 카세인에서 처음 분리한 필수 아미노산으로, 체내 합성이 불가능하여 음식으로 섭취해야 하며, 에너지 대사, 인슐린 저항성, 조혈줄기세포 자가 재생 등에 관여하고 대사 과정 손상 시 특정 질환을 유발할 수 있다. - 필수 아미노산 - 히스티딘
히스티딘은 이미다졸 곁사슬을 가진 필수 아미노산으로, 효소 촉매 반응, 금속 이온과의 결합, 다른 생물학적 활성 아민으로의 전환 등 다양한 생물학적 역할을 수행하며, 성인의 경우 체중 1kg당 14mg이 권장된다.
2. 식이 류신
L-류신은 식품 첨가물로 사용될 때 E 번호 E641로 향미 증진제로 분류된다.[46][9] 류신은 발린, 이소류신과 함께 분지쇄 아미노산 중 하나로, 체내에서 근육 단백질 합성을 유도하는 역할을 한다.[35] 사람은 류신을 합성할 수 없기 때문에 필수 아미노산 중 하나이다. 유아에게는 성장, 성인에게는 질소 평형에 필수적이다. 유전자 이상이 있는 경우, 메이플 시럽 뇨증의 원인이 되는 아미노산 중 하나이며, 케토성을 가진다. 단백질의 생성·분해를 조절함으로써 근육의 유지에 관여한다. 천연형 류신은 S체인 L-류신이며, 사람은 이를 쓰게 느낀다. 반면, 천연에서는 거의 보이지 않는 R체인 D-류신은, 사람에게 달게 느껴진다. 거의 모든 단백질에 포함된 물질이지만, 특히 헤모글로빈과 카제인 등에 많이 포함되어 있다.[36] 류신은 섭취함으로써 간 기능 향상 및 간세포의 증식과 분화의 정상화, 혈당 조절, 단백질 생합성 촉진, 근육 단백질 유지, 근육 글리코겐 합성·효소 활성 촉진 등의 효과가 있다고 알려져 있다.[38]
2. 1. 요구 사항
2002년 미국 의학 연구소의 식품 영양 위원회(FNB)는 필수 아미노산에 대한 권장 식이 허용량(RDA)을 제정했다. 19세 이상의 성인은 매일 체중 1kg당 42mg의 류신이 필요하다.[47][10] 류신은 하루 필요량이 가장 많지만, 육류, 생선, 유제품에 많이 포함되어 있어 부족할 일은 거의 없다.[36][37]2. 2. 공급원
L-류신과 D-류신은 모두 뇌전증 발작으로부터 쥐를 보호한다.[51] 또한 D-류신은 적어도 다이제팜만큼 효과적으로 진정 효과없이 발작이 시작된 후에 쥐의 발작을 종결시킨다.[51] L-류신의 식이 섭취 감소는 쥐의 비만을 촉진한다.[52] 류신의 높은 혈중 수치는 사람, 쥐 및 설치류에서 인슐린 저항성과 관련이 있다.[53] 이것은 mTOR 신호전달을 자극하는 류신의 효과 때문일 수 있다.[54] 류신 및 다른 가지사슬 아미노산의 식이 제한은 에너지 소비를 증가시켜 야행성 쥐에서 식이 유발 비만을 억제시킬 수 있고 과다섭취 쥐의 지방 증가를 제한할 수 있다.[55][56]
류신은 발린, 이소류신과 함께 분지쇄 아미노산 중 하나이다.[35] 단백질을 구성하는 아미노산이지만, 사람은 류신을 합성할 수 없기 때문에 필수 아미노산 중 하나로 꼽힌다. 류신은 육류, 생선, 유제품에 많이 포함되어 있어 부족할 일은 거의 없다.[36][37]
3. 건강에 대한 효과
3. 1. 근육 건강
식이 보충제로서 류신은 늙은 쥐의 근육 단백질 합성을 증가시켜 근육 조직의 분해를 늦추는 것으로 밝혀졌다.[49] 그러나 비교 연구 결과는 상충된다. 장기간의 류신 보충은 건강한 노인 남성의 근육량이나 근력을 증가시키지 않는다.[50] 더 많은 연구가 필요하며, 바람직하게는 객관적이고 무작위적인 사회 표본을 기반으로 하는 연구가 필요하다. 류신을 단독으로 또는 다른 가지사슬 아미노산과 함께 섭취하는 경우 류신 보충의 효과를 알아내기 위해 생활 방식, 연령, 성별, 식이, 운동 등과 같은 요인들을 분석시 고려해야 한다. 그때까지는 식이 류신 보충을 전체 인구에 대한 근육 생장 또는 최적 상태의 유지를 위한 주요 이유와 관련시킬 수 없다.
류신은 발린, 이소류신과 함께 가지사슬 아미노산 중 하나로, 체내에서 근육 단백질 합성을 유도하는 역할을 한다.[35] 단백질의 생성·분해를 조절함으로써 근육의 유지에 관여한다. 사람은 류신을 섭취함으로써 간 기능 향상, 간세포 증식과 분화 정상화, 혈당 조절, 단백질 생합성 촉진, 근육 단백질 유지, 근육 글리코겐 합성·효소 활성 촉진 등의 효과가 있다고 알려져 있다.[38]
3. 2. 기타 건강 효과
식이 보충제로 류신은 늙은 쥐의 근육 단백질 합성을 증가시켜 근육 조직의 분해를 늦추는 것으로 밝혀졌다.[49] 그러나 비교 연구 결과는 상충된다. 장기간의 류신 보충은 건강한 노인 남성의 근육량이나 근력을 증가시키지 않는다.[50] 더 많은 연구가 필요하며, 바람직하게는 객관적이고 무작위적인 사회 표본을 기반으로 하는 연구가 필요하다. 류신을 단독으로 또는 다른 가지사슬 아미노산과 함께 섭취하는 경우 류신 보충의 효과를 알아내기 위해 생활 방식, 연령, 성별, 식이, 운동 등과 같은 요인들을 분석시 고려해야 한다. 그때까지는 식이 류신 보충을 전체 인구에 대한 근육 생장 또는 최적 상태의 유지를 위한 주요 이유와 관련시킬 수 없다.
L-류신과 D-류신은 모두 뇌전증 발작으로부터 쥐를 보호한다.[51] 또한 D-류신은 적어도 다이제팜만큼 효과적으로 진정 효과없이 발작이 시작된 후에 쥐의 발작을 종결시킨다.[51] L-류신의 식이 섭취 감소는 쥐의 비만을 촉진한다.[52] 류신의 높은 혈중 수치는 사람, 쥐 및 설치류에서 인슐린 저항성과 관련이 있다.[53] 이것은 mTOR 신호전달을 자극하는 류신의 효과 때문일 수 있다.[54] 류신 및 다른 가지사슬 아미노산의 식이 제한은 에너지 소비를 증가시켜 야행성 쥐에서 식이 유발 비만을 억제시킬 수 있고 과다섭취 쥐의 지방 증가를 제한할 수 있다.[55][56]
4. 안전성
류신은 과다 섭취하면 여러 부작용을 일으킬 수 있다. 류신 독성은 대상부전 단풍시럽뇨병 환자에게 섬망, 신경학적 손상 등을 유발하여 생명을 위협할 수 있다.[57] 트립토판이 니아신으로 전환되는 것을 방해하여 니아신 수치가 낮은 사람들에게 펠라그라 증상을 유발하거나 악화시킬 수 있다.[58] 체중 1kg 당 500mg/d를 초과하는 류신 섭취는 고암모니아혈증을 유발할 수 있으며,[59] 건강한 성인 남성의 경우 류신 허용 상한 섭취량은 체중 1kg 당 500mg/d 또는 35g/d이다.[59][60]
4. 1. 류신 독성
대상부전 단풍시럽뇨병에서 볼 수 있는 류신 독성은 섬망과 신경학적 손상을 유발하고 생명을 위협할 수 있다.[57][20]류신을 많이 섭취하면 L-트립토판이 니아신으로 전환되는 것을 방해하기 때문에 니아신 수치가 낮은 사람들에게 펠라그라 증상을 유발하거나 악화시킬 수 있다.[58][21]
500mg/kg/d를 초과하는 용량의 류신은 고암모니아혈증에서 관찰되었다.[59][22] 따라서 비공식적으로 건강한 성인 남성의 류신 허용 상한 섭취량(UL)은 급성 식이 조건에서 500mg/kg/d 또는 35g/d로 제안될 수 있다.[59][60][22][23]
4. 2. 펠라그라
류신을 많이 섭취하면 L-트립토판이 니아신으로 전환되는 것을 방해하기 때문에 니아신 수치가 낮은 사람들에게 펠라그라 증상을 유발하거나 악화시킬 수 있다.[58][21]4. 3. 고암모니아혈증
체중 1 kg 당 500 mg/d를 초과하는 용량의 류신은 고암모니아혈증을 유발할 수 있다고 관찰되었다.[59] 따라서 건강한 성인 남성의 류신 허용 상한 섭취량(UL)은 급성 식이 조건에서 체중 1 kg 당 500 mg/d 또는 35 g/d로 제안될 수 있다.[59][60]5. 약리학
류신은 근원섬유 근단백질 합성을 직접적으로 자극하는 식이성 아미노산이다.[61] 류신의 이러한 효과는 단백질 생합성 및 세포 생장을 조절하는 세린-트레오닌 단백질 키네이스인 mTOR의 활성인자로서의 역할에서 비롯된다.[45] 류신에 의한 mTOR 활성화는 Rag GTPase,[62][63][64] 류실-tRNA 합성효소에 대한 류신의 결합,[62][63] 세스트린 2에 대한 류신의 결합,[65][66][67] 및 다른 가능한 메커니즘을 통해 매개된다.
5. 1. 약력학
류신은 근원섬유 근단백질 합성을 직접적으로 자극하는 능력을 가진 식이성 아미노산이다.[61] 류신의 이러한 효과는 단백질 생합성 및 세포 생장을 조절하는 세린-트레오닌 단백질 키네이스인 mTOR의 활성인자로서의 역할에서 비롯된다.[45] 류신에 의한 mTOR의 활성화는 Rag GTPase,[62][63][64] 류실-tRNA 합성효소에 대한 류신의 결합,[62][63] 세스트린 2에 대한 류신의 결합,[65][66][67] 및 다른 가능한 메커니즘을 통해 매개된다.5. 2. 사람에서의 물질대사
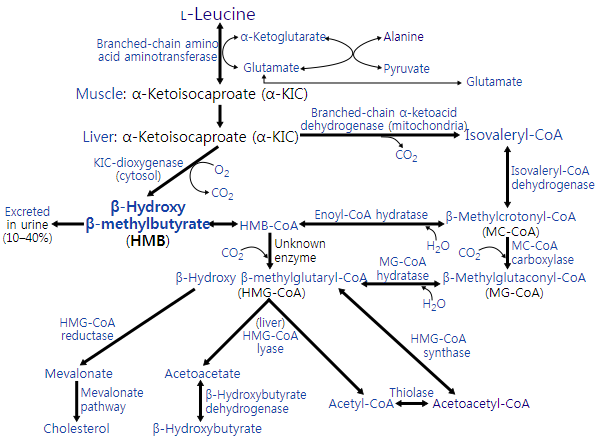
류신 대사는 인체의 많은 조직에서 일어난다. 그러나 대부분의 식이 류신은 간, 지방 조직, 근육 조직 내에서 대사된다.[71] 지방 조직 및 근육 조직은 스테롤 및 기타 화합물의 형성에 류신을 사용한다.[71] 이들 두 조직에서 결합된 류신의 사용은 간보다 7배 더 많다.[71]
건강한 사람의 경우 식이 L-류신의 약 60%가 몇 시간 후에 대사되고, 식이 L-류신의 약 5%(2~10% 범위)가 β-하이드록시 β-메틸뷰티르산(HMB)으로 전환된다.[73][72][74] 식이 L-류신의 약 40%는 아세틸-CoA로 전환되며, 이는 이후에 다른 화합물의 합성에 사용된다.[74]
대부분의 L-류신 대사는 초기에 가지사슬 아미노산 아미노기전이효소에 의해 촉매되어 α-케토아이소카프로산(α-KIC)을 생성한다.[73][74] α-케토아이소카프로산은 대부분 미토콘드리아의 효소인 가지사슬 α-케토산 탈수소효소 복합체에 의해 대사되어 아이소발레릴-CoA로 전환된다.[73][74] 아이소발레릴-CoA는 이후에 아이소발레릴-CoA 탈수소효소에 의해 대사되어 아세틸-CoA 및 기타 화합물의 합성에 사용되는 β-메틸크로토닐-CoA로 전환된다.[74] 비오틴 결핍증에서 β-하이드록시 β-메틸뷰티르산(HMB)은 엔오일-CoA 수화효소와 알려지지 않은 싸이오에스터레이스를 통해 β-메틸크로토닐-CoA로부터 합성될 수 있는데, 이 효소들은 각각 β-메틸크로토닐-CoA(MC-CoA)를 β-하이드록시 β-메틸뷰티릴-CoA(HMB-CoA)로, β-하이드록시 β-메틸뷰티릴-CoA를 β-하이드록시 β-메틸뷰티르산으로 전환시킨다.[75][76][77] 상대적으로 적은 양의 α-케토아이소카프로산은 세포질의 효소 4-하이드록시페닐피루브산 이산소화효소에 의해 간에서 β-하이드록시 β-메틸뷰티르산으로 전환된다.[73][74][78] 건강한 사람의 경우 L-류신이 α-케토아이소카프로산으로 전환된 다음 β-하이드록시 β-메틸뷰티르산으로 전환되는 이러한 경로는 β-하이드록시 β-메틸뷰티르산 합성의 주요 경로이다.[73][74]
L-류신 대사의 작은 부분(약 33%를 차지하는 고환을 제외한 모든 조직에서 5% 미만)은 초기에 류신 2,3-아미노뮤테이스에 의해 촉매되어 β-류신을 생성하고, 이는 후속적으로 일련의 특성화되지 않은 효소들에 의해 β-케토아이소카프로산, β-케토아이소카프로일-CoA, 아세틸-CoA로 대사된다.[74][79]
β-하이드록시 β-메틸뷰티르산(HMB)의 대사는 β-하이드록시 β-메틸뷰티릴-CoA(HMB-CoA)로 전환시키는 특성화되지 않은 효소에 의해 촉매된다.[76][74] β-하이드록시 β-메틸뷰티릴-CoA는 엔오일-CoA 수화효소 또는 다른 특성화되지 않은 효소에 의해 대사되어 각각 β-메틸크로토닐-CoA(MC-CoA) 또는 β-하이드록시 β-메틸글루타릴-CoA(HMG-CoA)를 생성한다.[73][74] 그런 다음 β-메틸크로토닐-CoA는 메틸크로토닐-CoA 카복실화효소에 의해 β-메틸글루타코닐-CoA(MG-CoA)로 전환되고, 이는 후속적으로 메틸글루타코닐-CoA 수화효소에 의해 β-하이드록시 β-메틸글루타릴-CoA로 전환된다.[73][74][79] 그런 다음 β-하이드록시 β-메틸글루타릴-CoA는 β-하이드록시 β-메틸글루타릴-CoA 분해효소에 의해 아세틸-CoA와 아세토아세트산으로 분해되거나 메발론산 경로를 통해 콜레스테롤의 생산에 사용된다.[73][74]
6. 사람 이외의 생물에서의 합성
사람을 제외한 동물은 류신을 스스로 합성할 수 있는 대사 경로가 없기 때문에 필수 아미노산으로 섭취해야 한다.[80] 따라서 동물은 보통 단백질 형태로 류신을 섭취한다. 반면 식물과 미생물은 피루브산으로부터 류신을 합성할 수 있는데, 이 과정에는 다음과 같은 효소들이 관여한다.[80]
- 아세토락트산 생성효소
- 아세토하이드록시산 아이소머로리덕테이스
- 다이하이드록시산 탈수효소
- α-아이소프로필말산 생성효소
- α-아이소프로필말산 이성질화효소
- 류신 아미노기전이효소
이 대사 경로의 초기 단계는 발린 합성에도 사용된다.
7. 화학
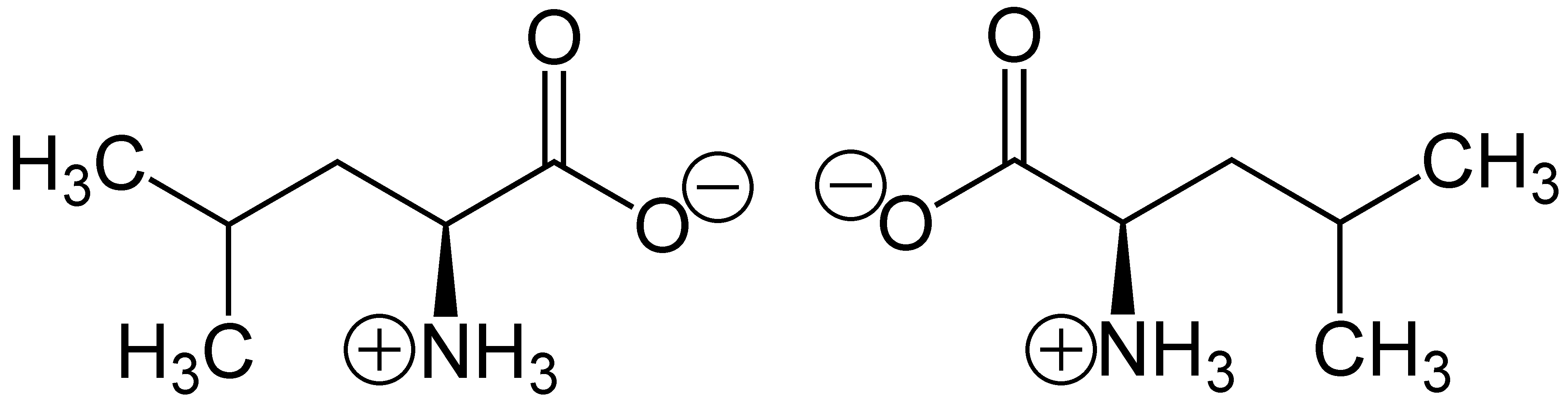
류신은 선형이 아닌 지방족 곁사슬을 가지고 있기 때문에 가지사슬 아미노산이다.
7. 1. 광학 이성질체
라세미 류신은 생체분자의 비대칭성 기원을 더 잘 이해하기 위해 원형 편광 싱크로트론 방사에 노출되었다. 이 실험에서 2.6%의 거울상 이성질체 증가가 유도되었으며, 이는 생체분자의 호모카이랄성에 대한 가능한 광화학적 기원을 제시한다.[81]
7. 2. 호모키랄성
라세미 류신은 생체분자의 비대칭 기원을 더 잘 이해하기 위해 원형 편광 싱크로트론 방사에 노출되었다. 2.6%의 거울상 이성질체 증가가 유도되었으며, 이는 생체분자의 호모키랄성의 가능한 광화학적 기원을 나타낸다.[81]
참조
[1]
논문
Accurate hydrogen parameters for the amino acid L-leucine
https://www.pure.ed.[...]
2016-12
[2]
서적
Data for Biochemical Research
Oxford, Clarendon Press
1959
[3]
웹사이트
Nomenclature and Symbolism for Amino Acids and Peptides
http://www.chem.qmul[...]
IUPAC-IUB Joint Commission on Biochemical Nomenclature
2018-03-05
[4]
서적
Salts of Amino Acids: Crystallization, Structure and Properties
https://link.springe[...]
Springer International Publishing
2014
[5]
서적
Biochemistry
https://books.google[...]
Lippincott Williams & Wilkins
2013
[6]
서적
Metabolic & Therapeutic Aspects of Amino Acids in Clinical Nutrition
https://books.google[...]
CRC Press
2003
[7]
논문
β-hydroxy-β-methylbutyrate free acid supplementation may improve recovery and muscle adaptations after resistance training: a systematic review
2017-09
[8]
논문
Effects of leucine and its metabolite β-hydroxy-β-methylbutyrate on human skeletal muscle protein metabolism
2013-06
[9]
서적
A consumer's dictionary of food additives
https://archive.org/[...]
Three Rivers Press
2009
[10]
서적
Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids
The National Academies Press
[11]
웹사이트
National Nutrient Database for Standard Reference
http://www.nal.usda.[...]
U.S. Department of Agriculture
2009-09-16
[12]
논문
A leucine-supplemented diet restores the defective postprandial inhibition of proteasome-dependent proteolysis in aged rat skeletal muscle
2005-12
[13]
논문
Long-term leucine supplementation does not increase muscle mass or strength in healthy elderly men
2009-05
[14]
논문
Potent anti-seizure effects of D-leucine
2015-10
[15]
논문
Decreased Consumption of Branched-Chain Amino Acids Improves Metabolic Health
2016-07
[16]
논문
Branched-chain amino acids in metabolic signalling and insulin resistance
2014-12
[17]
논문
The Roles of mTOR Complexes in Lipid Metabolism
[18]
논문
Restoration of metabolic health by decreased consumption of branched-chain amino acids
2018-02
[19]
논문
Branched-chain amino acid restriction in Zucker-fatty rats improves muscle insulin sensitivity by enhancing efficiency of fatty acid oxidation and acyl-glycine export
2016-07
[20]
논문
Brain Amino Acid Requirements and Toxicity: The Example of Leucine
https://academic.oup[...]
2005-06-01
[21]
논문
Mechanisms of the pellagragenic effect of leucine: stimulation of hepatic tryptophan oxidation by administration of branched-chain amino acids to healthy human volunteers and the role of plasma free tryptophan and total kynurenines
[22]
논문
Determination of the tolerable upper intake level of leucine in acute dietary studies in young men
2012-10
[23]
논문
Determination of the safety of leucine supplementation in healthy elderly men
2016-07
[24]
논문
Manufacture and use of dairy protein fractions
2004-04
[25]
논문
Control of leucine-dependent mTORC1 pathway through chemical intervention of leucyl-tRNA synthetase and RagD interaction
2017-09
[26]
논문
Amino acid signalling upstream of mTOR
2013-03
[27]
논문
The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1
2008-06
[28]
논문
Sestrin2 is a leucine sensor for the mTORC1 pathway
2016-01
[29]
논문
Structural basis for leucine sensing by the Sestrin2-mTORC1 pathway
2016-01
[30]
논문
The Sestrins interact with GATOR2 to negatively regulate the amino-acid-sensing pathway upstream of mTORC1
2014-10
[31]
논문
Metabolic fate of leucine: a significant sterol precursor in adipose tissue and muscle
1974-02
[32]
서적
Lehninger principles of biochemistry.
Worth Publishers
2000
[33]
서적
Amino acids and the asymmetry of life
Springer-Verlag
2008
[34]
서적
Data for Biochemical Research
Oxford, Clarendon Press
1959
[35]
웹사이트
ロイシンとは何ですか。
https://direct.ajino[...]
味の素株式会社
2021-11-14
[36]
웹사이트
対象外物質評価書 ロイシン
https://www.fsc.go.j[...]
食品安全委員会肥料・飼料等専門調査会
2021-11-14
[37]
웹사이트
Vol.19 ロイシン
https://www.ekenkosh[...]
e健康ショップ
2021-11-14
[38]
웹사이트
必須アミノ酸と非必須アミノ酸
https://www.orthomol[...]
一般社団法人オーソモレキュラー栄養医学研究所
2021-11-14
[39]
저널
Accurate hydrogen parameters for the amino acid L-leucine
https://www.pure.ed.[...]
2016-12
[40]
서적
Data for Biochemical Research
Oxford, Clarendon Press
1959
[41]
웹인용
Nomenclature and Symbolism for Amino Acids and Peptides
http://www.chem.qmul[...]
IUPAC-IUB Joint Commission on Biochemical Nomenclature
2018-03-05
[42]
서적
Biochemistry
https://books.google[...]
Lippincott Williams & Wilkins
2013-05-24
[43]
서적
Metabolic & Therapeutic Aspects of Amino Acids in Clinical Nutrition
https://books.google[...]
CRC Press
2003-11-13
[44]
저널
β-hydroxy-β-methylbutyrate free acid supplementation may improve recovery and muscle adaptations after resistance training: a systematic review
2017-09
[45]
저널
Effects of leucine and its metabolite β-hydroxy-β-methylbutyrate on human skeletal muscle protein metabolism
2013-06
[46]
서적
A consumer's dictionary of food additives
https://archive.org/[...]
Three Rivers Press
2009
[47]
서적
Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids
The National Academies Press
[48]
서적
National Nutrient Database for Standard Reference
http://www.nal.usda.[...]
U.S. Department of Agriculture
2009-09-16
[49]
저널
A leucine-supplemented diet restores the defective postprandial inhibition of proteasome-dependent proteolysis in aged rat skeletal muscle
2005-12
[50]
저널
Long-term leucine supplementation does not increase muscle mass or strength in healthy elderly men
2009-05
[51]
저널
Potent anti-seizure effects of D-leucine
2015-10
[52]
저널
Decreased Consumption of Branched-Chain Amino Acids Improves Metabolic Health
2016-07
[53]
저널
Branched-chain amino acids in metabolic signalling and insulin resistance
2014-12
[54]
저널
The Roles of mTOR Complexes in Lipid Metabolism
[55]
저널
Restoration of metabolic health by decreased consumption of branched-chain amino acids
2018-02
[56]
저널
Branched-chain amino acid restriction in Zucker-fatty rats improves muscle insulin sensitivity by enhancing efficiency of fatty acid oxidation and acyl-glycine export
2016-07
[57]
저널
Brain Amino Acid Requirements and Toxicity: The Example of Leucine
https://academic.oup[...]
2005-06-01
[58]
저널
Mechanisms of the pellagragenic effect of leucine: stimulation of hepatic tryptophan oxidation by administration of branched-chain amino acids to healthy human volunteers and the role of plasma free tryptophan and total kynurenines
[59]
저널
Determination of the tolerable upper intake level of leucine in acute dietary studies in young men
2012-10
[60]
저널
Determination of the safety of leucine supplementation in healthy elderly men
2016-07
[61]
저널
Manufacture and use of dairy protein fractions
2004-04
[62]
저널
Control of leucine-dependent mTORC1 pathway through chemical intervention of leucyl-tRNA synthetase and RagD interaction
2017-09
[63]
저널
Amino acid signalling upstream of mTOR
2013-03
[64]
저널
The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1
2008-06
[65]
저널
Sestrin2 is a leucine sensor for the mTORC1 pathway
2016-01
[66]
저널
Structural basis for leucine sensing by the Sestrin2-mTORC1 pathway
2016-01
[67]
저널
The Sestrins interact with GATOR2 to negatively regulate the amino-acid-sensing pathway upstream of mTORC1
2014-10
[68]
저널
International Society of Sports Nutrition Position Stand: beta-hydroxy-beta-methylbutyrate (HMB)
2013-02
[69]
저널
HMB supplementation: clinical and athletic performance-related effects and mechanisms of action
2011-04
[70]
서적
Nutrient Metabolism: Structures, Functions, and Genes
https://books.google[...]
Academic Press
2015-05
[71]
저널
Metabolic fate of leucine: a significant sterol precursor in adipose tissue and muscle
1974-02
[72]
저널
Muscle wasting and aging: Experimental models, fatty infiltrations, and prevention
https://hal.archives[...]
2016-08
[73]
저널
HMB supplementation: clinical and athletic performance-related effects and mechanisms of action
https://repositorio.[...]
2011-04
[74]
서적
Nutrient Metabolism: Structures, Functions, and Genes
https://books.google[...]
Academic Press
2016-06-06
[75]
저널
Urinary excretion of 3-hydroxyisovaleric acid and 3-hydroxyisovaleryl carnitine increases in response to a leucine challenge in marginally biotin-deficient humans
2011-11
[76]
웹인용
KEGG Reaction: R10759
http://www.genome.jp[...]
Kanehisa Laboratories
2016-06-24
[77]
웹인용
KEGG Reaction: R04137
http://www.genome.jp[...]
Kanehisa Laboratories
2016-06-24
[78]
웹인용
Homo sapiens: 4-hydroxyphenylpyruvate dioxygenase reaction
http://www.biocyc.or[...]
SRI International
2016-06-06
[79]
웹인용
Leucine metabolism
http://www.brenda-en[...]
Technische Universität Braunschweig
2016-08-12
[80]
서적
Lehninger principles of biochemistry.
https://archive.org/[...]
Worth Publishers
2000
[81]
서적
Amino acids and the asymmetry of life
Springer-Verlag
2008
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
