주광성
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
주광성은 생물이 빛의 자극에 반응하여 나타내는 운동 현상이다. 빛을 향해 이동하는 양성 주광성과 빛을 피하는 음성 주광성으로 나뉜다. 세균, 고세균, 원생생물, 무척추동물, 곤충 등 다양한 생물에서 관찰되며, 광합성 효율 증대, 유해한 빛 회피, 방향 감지 등 생존에 기여한다. 곤충의 경우, 달이나 태양을 이용한 방향 감지, 인공 광원에 대한 착시 등이 주광성의 원인으로 제시된다.
더 읽어볼만한 페이지
- 생물학 용어 - 생물 다양성
생물 다양성은 특정 지역 내 유전자, 종, 생태계의 총체로서, 종 내, 종 간, 생태계의 다양성을 포함하는 개념이며, 식량, 의약품, 산업 원료 등 다양한 자원을 제공하고 생태계 서비스 및 문화적 가치를 지니지만, 최근 인간 활동으로 인해 급격히 감소하고 있어 보전 노력이 필요하다. - 생물학 용어 - 생물지리학
생물지리학은 생물의 지리적 분포와 분포 패턴을 연구하는 학문으로, 탐험과 선구자들의 연구를 거쳐 대륙 이동설, 분자생물학 발전, 섬 생물지리학 이론 등으로 발전했으며, 현재는 다양한 기술을 활용하여 여러 분야에 적용되고 고생물지리학 등 하위 분야를 포함하지만, 지역 구분에 대한 국제 표준화는 미완료 상태이다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다. - 한국어 위키백과의 링크가 위키데이터와 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 한국어 위키백과의 링크가 위키데이터와 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다.
2. 주광성의 메커니즘
주광성의 메커니즘은 생물의 종류에 따라 다양하지만, 공통적으로 빛을 감지하고 그에 반응하여 움직임을 조절하는 방식으로 이루어진다.
- 원핵생물:
- 빛의 방향을 정밀하게 감지하는 능력은 제한적이지만, 빛의 강도 변화를 감지하여 움직인다.
- 주로 빛의 강도가 증가하는 방향으로 움직이는 양성 주광성을 보이지만, 일부는 빛에서 멀어지는 음성 주광성을 나타내기도 한다.
- 스코토포보택시스(scotophobotaxis)와 진정한 주광성(true phototaxis)으로 구분된다.
- ''할로박테리움 살리나룸''과 같은 할로필 고세균은 감각 로돕신(SR)을 사용하여 주광성을 나타낸다.[6][7]
- 일부 남세균(예: ''아나베나'', ''시네코시스티스'')은 빛 벡터를 따라 천천히 정위할 수 있다.[14][15]
- 진핵생물:
- 원생생물, 해파리를 포함한 일부 무척추동물, 그리고 곤충 등에서 주광성이 나타난다.
- 녹조류는 엽록체 내 '스티그마'라는 기관을 통해 빛을 감지하며, 채널로돕신이라는 광수용체를 이용한다.
- 해파리는 눈점을 사용하여 빛의 유무를 감지하고, 빛에 따라 먹이 섭취 또는 포식자 회피 행동을 보인다.[58]
- 해양 털갯지렁이 ''Platynereis dumerilii''는 단순 눈점과 더 복잡한 색소 컵 눈을 이용하여 주광성을 나타낸다.[61][67]
- 나방, 메뚜기, 파리 등의 곤충은 양성 주광성을 보이며, 특히 밤에 달빛을 이용해 방향을 잡는다.[69]
- 초파리( ''Drosophila melanogaster'')는 광원에 대한 타고난 주광성 반응을 연구하는 모델 생물로 활용된다.[68]
- 빛 감지 기관, 운동 전략, 세포 신호전달 방식 등이 원핵생물과 다르다.
- 3차원 주광성은 후생동물, 아메바류, 식물, 크로말베올라타, 엑스카바타, 리자리아를 포함한 6개의 진핵생물 주요 그룹 중 5개에서 발견된다.[13]
2. 1. 원핵생물
원핵생물은 세균과 고세균을 포함하며, 이들은 빛의 방향을 감지하는 능력은 제한적이지만 빛의 강도를 측정하고 그 기울기에 따라 움직일 수 있다.[4][5][13] 원핵생물에서 나타나는 주광성은 크게 스코토포보택시스와 진정한 주광성으로 나뉜다.- 스코토포보택시스 (Scotophobotaxis): 현미경 관찰 시에만 확인되는 현상으로, 세균이 빛이 비치는 영역 밖으로 우연히 벗어날 때 발생한다. 어둠 속으로 들어가면 편모 회전 방향을 바꿔 다시 빛 속으로 돌아온다.
- 진정한 주광성 (True phototaxis): 빛의 양이 증가하는 방향으로 움직이는 양성 주광성과 그 반대 방향으로 움직이는 음성 주광성이 있다. 이는 화학 주성과 유사하지만, 유인 물질이 화학 물질이 아닌 빛이라는 점이 다르다.
원핵생물의 주광성 반응에는 ''세라티아 마르세센스''와 같은 여러 세균 및 고세균이 관여하며, 광수용체 단백질이 빛 감지 및 반응에 중요한 역할을 한다.[3]
대부분의 원핵생물 주광성은 세균의 화학 주성과 유사하게 편향된 무작위 보행 메커니즘을 따른다. 예를 들어, ''할로박테리움 살리나룸''과 같은 할로필 고세균은 감각 로돕신(SR)을 사용하여 주광성을 나타낸다.[6][7]
빛 감지와 운동성 제어 능력은 다양한 원핵생물에게 생리적 이점을 제공한다. 광합성 생물에게 빛은 에너지원이며, 빛의 강도와 파장은 생존에 중요한 요소이다. 또한, 빛 신호는 환경 정보를 제공하여 원핵생물이 위치와 행동을 최적화하는 데 도움을 줄 수 있다.[23][24]
2. 1. 1. 세균
광합성 생물인 세균에게 주광성은 빛을 가장 효율적으로 받기 위해 스스로를 정위할 수 있게 해주므로 유리할 수 있다. 주광성은 빛의 강도가 증가하는 방향으로 움직일 때는 양성, 그 반대 방향으로 움직일 때는 음성으로 불린다.[3]원핵생물 (세균 및 고세균)에서 두 가지 유형의 양성 주광성이 관찰된다. 첫 번째는 "스코토포보택시스"(단어 "스코토포비아"에서 유래)이며, 현미경으로만 관찰된다. 이것은 세균이 우연히 현미경으로 비춰지는 영역 밖으로 헤엄쳐 나갈 때 발생한다. 어둠 속으로 들어가면 세포는 편모의 회전 방향을 바꾸어 빛 속으로 다시 들어간다. 두 번째 유형의 주광성은 진정한 주광성으로, 빛의 양이 증가하는 기울기를 따라 유도된 움직임이다. 이것은 유인 물질이 화학 물질이 아닌 빛이라는 점을 제외하면 양성 화학 주성과 유사하다.
주광성 반응은 ''세라티아 마르세센스''와 같은 여러 세균 및 고세균에서 관찰된다. 광수용체 단백질은 다양한 유기체에서 빛 감지 및 반응에 관여하는 빛에 민감한 단백질이다. 몇 가지 예로는 일부 세균의 세균 로돕신과 세균 파이토크롬이 있다. 또한 피토크롬 및 광굴성도 참조.
대부분의 원핵생물(세균 및 고세균)은 빛의 방향을 감지할 수 없다. 이러한 작은 규모에서는 단일 광선을 구별할 수 있는 감지기를 만드는 것이 매우 어렵기 때문이다. 그럼에도 불구하고 원핵생물은 빛의 강도를 측정하고 빛 강도 기울기에 따라 움직일 수 있다. 일부 활주성 사상 원핵생물은 빛의 방향을 감지하고 유도된 회전을 할 수도 있지만, 주광성 운동은 매우 느리다. 일부 세균과 고세균은 주광성을 띈다.[4][5][13]
대부분의 경우 주광성의 메커니즘은 세균 화학 주성의 경우와 유사한 편향된 무작위 보행이다. ''할로박테리움 살리나룸''과 같은 할로필 고세균은 주광성에 감각 로돕신 (SR)을 사용한다.[6][7] 로돕신은 7회 막횡단 단백질로 크로모포어로서 레티날에 결합한다. 빛은 레티날의 이성질화를 유발하며,[8] 이는 2성분 인산 전달 릴레이 시스템을 통해 광전도 신호 전달로 이어진다. ''할로박테리움 살리나룸''은 두 개의 SR, SRI 및 SRII를 가지고 있으며, 각각 형질전환 단백질 Htr1 및 Htr2 (SR I 및 II에 대한 할로박테리아 형질전환자)를 통해 신호를 전달한다.[9][10] 주광성 고세균의 다운스트림 신호 전달에는 히스티딘 키나아제인 CheA가 관여하며, 이는 반응 조절제인 CheY를 인산화한다.[11] 인산화된 CheY는 수영 반전을 유도한다. 할로박테리움의 두 SR은 서로 다른 기능을 한다. SRI는 오렌지색 빛에 대한 유인 수용체로 작용하고, 2광자 반응을 통해 근자외선에 대한 반발 수용체로 작용하는 반면, SRII는 파란색 빛에 대한 반발 수용체이다. 어떤 수용체가 발현되느냐에 따라 세포가 가파른 빛 기울기를 따라 위아래로 헤엄쳐 나갈 경우 편모 스위치의 확률이 낮아진다. 빛의 강도가 일정하거나 잘못된 방향으로 변하면 편모 회전 방향의 스위치가 세포를 새로운 무작위 방향으로 재정위할 것이다.[12] 세포가 빛 기울기를 따를 때 트랙의 길이가 더 길어지므로 세포는 결국 광원에 더 가까워지거나 더 멀어진다. 이 전략은 빛 벡터를 따라 정위할 수 없으며 가파른 빛 기울기가 존재할 때만 작동한다(예: 개방 수역에서는 작동하지 않음).[13]
일부 남세균(예: ''아나베나'', ''시네코시스티스'')은 빛 벡터를 따라 천천히 정위할 수 있다. 이러한 정위는 필라멘트 또는 집락에서 발생하지만, 표면에서만 발생하며 현탁액에서는 발생하지 않는다.[14][15] 사상 남세균 ''시네코시스티스''는 양성 및 음성 2차원 주광성 정위를 모두 수행할 수 있다. 양성 반응은 세균 파이토크롬 광수용체인 TaxD1에 의해 매개될 가능성이 있다. 이 단백질은 두 개의 크로모포어 결합 GAF 도메인을 가지고 있으며, 이는 빌리베르딘 크로모포어에 결합하고,[16] C-말단 도메인은 세균 주성 수용체 (MCP 신호 도메인)에 전형적이다. TaxD1은 또한 단백질을 막에 고정하는 두 개의 N-말단 막횡단 세그먼트를 가지고 있다.[17][18][19] 광수용체 및 신호 전달 도메인은 세포질에 존재하며 CheA/CheY형 신호 전달 시스템을 통해 신호를 전달하여 IV형 필리에 의한 운동성을 조절한다.[20] TaxD1은 세균 및 고세균의 화학 감각 수용체를 포함하는 MCP와 유사하게 ''시네코코쿠스 엘롱가투스''의 막대 모양 세포의 극에 위치한다.[21] 필라멘트의 조향이 어떻게 이루어지는지는 알려져 있지 않다. 이러한 남세균 필라멘트의 느린 조향은 이 작은 규모에서 빛 방향을 감지하는 것이 어렵기 때문에 원핵생물이 진화할 수 있는 유일한 빛 방향 감지 행동이다.[13]
빛 감지를 운동성 제어에 연결하는 능력은 매우 다양한 원핵생물에서 발견되며, 이는 이 능력이 다양한 생리적 이점을 제공해야 함을 나타낸다.[23][24] 가장 직접적으로, 빛 환경은 에너지원으로서 광합성 생물에게 매우 중요하다. 광합성 원핵생물은 매우 다양하며, 여러 문을 가로질러 광합성을 확산시키는 데 수평 유전자 전달의 역할을 할 가능성이 있다.[25] 따라서 광합성 원핵생물의 서로 다른 그룹은 빛을 에너지원으로 활용하는 것 외에는 공통점이 거의 없을 수 있지만, 모든 광합성 생물이 광합성을 위한 더 나은 빛 환경을 찾기 위해 재배치할 수 있는 것이 유리해야 한다. 이를 효율적으로 수행하려면 빛의 강도, 빛의 스펙트럼 품질 및 세포의 생리적 상태에 대한 통합된 정보에 대한 응답으로 운동성을 제어하는 능력이 필요하다. 빛에 의해 제어되는 운동성의 두 번째 주요 이유는 손상 강도 또는 파장의 빛을 피하는 것이다. 이 요인은 광합성 세균에 국한되지 않으며, 빛(특히 UV 영역)은 주로 DNA 및 단백질 손상[26]과 빛으로 생성된 활성 산소 종에 의한 번역 기구 억제 때문에 모든 원핵생물에게 위험할 수 있다.[27][22]
빛 신호는 잠재적으로 환경에 대한 풍부하고 복잡한 정보를 포함하며, 세균이 이 정보를 정교하게 사용하여 위치와 행동을 최적화할 가능성을 배제해서는 안 된다. 예를 들어, 식물 또는 동물 병원체는 빛 정보를 사용하여 숙주와의 위치 및 상호 작용을 제어할 수 있으며, 실제로 빛 신호는 여러 비광합성 원핵생물에서 발달과 독성을 조절하는 것으로 알려져 있다.[28][29] 광합성 생물은 또한 정교한 정보 처리를 통해 이점을 얻을 수 있는데, 최적의 환경은 빛의 강도, 빛의 품질, 주야 주기, 원자재의 가용성 및 대체 에너지원, 기타 유익하거나 유해한 물리적 및 화학적 요인, 때로는 공생 파트너의 존재를 포함하는 복잡한 요인의 조합에 의해 정의되기 때문이다. 빛의 품질은 운동성 호르모고니아의 발달과 질소 고정 이형세포를 포함하여 특정 사상 남세균의 특수 발달 경로에 강하게 영향을 미친다.[30] 호르모고니아는 남세균과 식물 간의 공생 관계를 확립하는 데 중요하고 이형세포는 이러한 관계에서 질소 고정에 필수적이므로, 남세균이 빛 신호를 식물 공생 파트너의 근접성을 감지하는 한 가지 방법으로 사용할 수 있다고 추측할 수 있다. 광합성 바이오필름과 같은 복잡하고 이질적인 환경 내에서, 성장에 필수적인 많은 요인은 단일 운동성 세포가 탐구할 수 있는 제한된 영역 내에서도 극적으로 달라질 수 있다.[31][32] 따라서 우리는 이러한 환경에서 사는 원핵생물이 다양한 환경 단서와 연결된 복잡한 신호 전달 네트워크에 대한 응답으로 운동성을 제어할 것으로 예상해야 한다.[22]
광공포 반응은 비교적 갑작스러운 조명의 증가에 대한 운동 방향의 변화이다. 일반적으로, 반응은 세균이 밝게 조명된 영역으로 이동하면서 경험할 수 있는 빛 강도의 시간적 변화이다. 방향 전환은 새로운 방향('텀블링')의 무작위 선택으로 구성되거나 운동 방향의 단순한 반전일 수 있다. 어느 쪽이든 불리한 빛의 패치에서 세포를 쫓아내는 효과가 있다. 광공포 반응은 ''대장균'', 보라색 광합성 세균 및 할로고세균과 같은 다양한 원핵생물에서 관찰되었다.[33][34][22]
스코토포비아(어둠 공포) 반응은 광공포 반응의 반대이다. 세포가 빛의 강도가 비교적 갑작스럽게 감소하는 것을 경험할 때 방향의 변화(텀블링 또는 반전)가 유도된다. 광공포증 및 스코토포비아 반응은 모두 특정(아마도 유리한) 빛의 강도 및 스펙트럼 품질의 영역에 세포가 축적되도록 한다. 스코토포비아 반응은 1883년 Engelmann의 고전적인 관찰을 시작으로 보라색 광합성 세균과 남세균에서 잘 문서화되었다.[35][23] 편모 세균의 스코토포비아/광공포증 반응은 화학적 유인 물질 또는 반발 물질의 농도 변화를 텀블링의 빈도와 연결하는 세균 화학 주성의 고전적인 '편향된 무작위 보행' 모드와 밀접하게 유사하다.[36] 유일한 중요한 차이점은 스코토포비아/광공포 반응이 화학 물질의 농도가 아닌 빛의 강도의 시간적 변화에 대한 인식을 포함한다는 것이다.[22]
광운동성은 빛에 의해 유도되는 이동 속도의 변화(방향은 아님)이다. 광운동성은 음성(빛에 의해 유도된 운동성 감소) 또는 양성(빛에 의해 유도된 운동성 자극)일 수 있다. 광운동성은 세포가 유리한 조명의 영역에 축적되도록 할 수 있다. 이러한 영역에 머물거나 불리한 조명의 영역에서 가속화된다. 광운동성은 남세균과 보라색 광합성 세균에서 문서화되었다.[23][22]
진정한 주광성은 광원에 대한 (양성 주광성) 또는 광원으로부터 떨어진 (음성 주광성) 방향 운동으로 구성된다. 광공포/스코토포비아 반응과 달리, 진정한 주광성은 빛 강도의 시간적 변화에 대한 반응이 아니다. 일반적으로 빛의 공간적 기울기가 아닌 조명의 방향을 직접 감지하는 것과 관련이 있는 것으로 보인다. 원핵생물의 진정한 주광성은 때때로 사회적 운동성과 결합되며, 이는 빛의 광원에 대한 세포 전체 집락의 합의된 운동을 포함한다. 이 현상은 지역 사회 주광성으로도 설명할 수 있다. 진정한 주광성은 진핵생물 녹조류에서 널리 퍼져 있으며,[37] 원핵생물 중에서는 남세균,[23][18] 및 보라색 광합성 세균 ''로도시스타''의 집락의 사회적 운동성에서만 문서화되었다.[38][22]
2. 1. 2. 고세균
원핵생물(세균 및 고세균)에서 두 가지 유형의 양성 주광성이 관찰된다. 첫 번째는 "스코토포보택시스"(단어 "스코토포비아"에서 유래)라고 하며, 현미경으로만 관찰된다. 이것은 세균이 우연히 현미경으로 비춰지는 영역 밖으로 헤엄쳐 나갈 때 발생한다. 어둠 속으로 들어가면 세포는 편모의 회전 방향을 바꾸어 빛 속으로 다시 들어간다. 두 번째 유형의 주광성은 진정한 주광성으로, 빛의 양이 증가하는 기울기를 따라 유도된 움직임이다. 이것은 유인 물질이 화학 물질이 아닌 빛이라는 점을 제외하면 양성 화학 주성과 유사하다.[3]주광성 반응은 ''세라티아 마르세센스''와 같은 여러 세균 및 고세균에서 관찰된다. 광수용체 단백질은 다양한 유기체에서 빛 감지 및 반응에 관여하는 빛에 민감한 단백질이다. 몇 가지 예로는 일부 세균의 세균 로돕신과 세균 파이토크롬이 있다. 피토크롬 및 광굴성도 참조할 수 있다.
대부분의 원핵생물(세균 및 고세균)은 빛의 방향을 감지할 수 없다. 이러한 작은 규모에서는 단일 광선을 구별할 수 있는 감지기를 만드는 것이 매우 어렵기 때문이다. 그럼에도 불구하고 원핵생물은 빛의 강도를 측정하고 빛 강도 기울기에 따라 움직일 수 있다. 일부 활주성 사상 원핵생물은 빛의 방향을 감지하고 유도된 회전을 할 수도 있지만, 주광성 운동은 매우 느리다. 일부 세균과 고세균은 주광성을 띈다.[4][5][13]
대부분의 경우 주광성의 메커니즘은 세균 화학 주성의 경우와 유사한 편향된 무작위 보행이다. ''할로박테리움 살리나룸''과 같은 할로필 고세균은 주광성에 감각 로돕신(SR)을 사용한다.[6][7] 로돕신은 7회 막횡단 단백질로 크로모포어로서 레티날에 결합한다. 빛은 레티날의 이성질화를 유발하며,[8] 이는 2성분 인산 전달 릴레이 시스템을 통해 광전도 신호 전달로 이어진다. ''할로박테리움 살리나룸''은 두 개의 SR, SRI 및 SRII를 가지고 있으며, 각각 형질전환 단백질 Htr1 및 Htr2 (SR I 및 II에 대한 할로박테리아 형질전환자)를 통해 신호를 전달한다.[9][10] 주광성 고세균의 다운스트림 신호 전달에는 히스티딘 키나아제인 CheA가 관여하며, 이는 반응 조절제인 CheY를 인산화한다.[11] 인산화된 CheY는 수영 반전을 유도한다. 할로박테리움의 두 SR은 서로 다른 기능을 한다. SRI는 오렌지색 빛에 대한 유인 수용체로 작용하고, 2광자 반응을 통해 근자외선에 대한 반발 수용체로 작용하는 반면, SRII는 파란색 빛에 대한 반발 수용체이다. 어떤 수용체가 발현되느냐에 따라 세포가 가파른 빛 기울기를 따라 위아래로 헤엄쳐 나갈 경우 편모 스위치의 확률이 낮아진다. 빛의 강도가 일정하거나 잘못된 방향으로 변하면 편모 회전 방향의 스위치가 세포를 새로운 무작위 방향으로 재정위할 것이다.[12] 세포가 빛 기울기를 따를 때 트랙의 길이가 더 길어지므로 세포는 결국 광원에 더 가까워지거나 더 멀어진다. 이 전략은 빛 벡터를 따라 정위할 수 없으며 가파른 빛 기울기가 존재할 때만 작동한다(예: 개방 수역에서는 작동하지 않음).[13]
2. 1. 3. 남세균
원핵생물(세균 및 고세균)에서 두 가지 유형의 양성 주광성이 관찰된다. 첫 번째는 "스코토포보택시스"(단어 "스코토포비아"에서 유래)라고 하며, 현미경으로만 관찰된다. 이것은 세균이 우연히 현미경으로 비춰지는 영역 밖으로 헤엄쳐 나갈 때 발생한다. 어둠 속으로 들어가면 세포는 편모의 회전 방향을 바꾸어 빛 속으로 다시 들어간다. 두 번째 유형의 주광성은 진정한 주광성으로, 빛의 양이 증가하는 기울기를 따라 유도된 움직임이다. 이것은 유인 물질이 화학 물질이 아닌 빛이라는 점을 제외하면 양성 화학 주성과 유사하다.주광성 반응은 ''세라티아 마르세센스''와 같은 여러 세균 및 고세균에서 관찰된다. 광수용체 단백질은 다양한 유기체에서 빛 감지 및 반응에 관여하는 빛에 민감한 단백질이다. 몇 가지 예로는 일부 세균의 세균 로돕신과 세균 파이토크롬이 있다. 피토크롬 및 광굴성도 참고할 수 있다.
대부분의 원핵생물(세균 및 고세균)은 빛의 방향을 감지할 수 없다. 이러한 작은 규모에서는 단일 광선을 구별할 수 있는 감지기를 만드는 것이 매우 어렵기 때문이다. 그럼에도 불구하고 원핵생물은 빛의 강도를 측정하고 빛 강도 기울기에 따라 움직일 수 있다. 일부 활주성 사상 원핵생물은 빛의 방향을 감지하고 유도된 회전을 할 수도 있지만, 주광성 운동은 매우 느리다. 일부 세균과 고세균은 주광성을 띈다.[4][5][13]
대부분의 경우 주광성의 메커니즘은 세균 화학 주성의 경우와 유사한 편향된 무작위 보행이다. ''할로박테리움 살리나룸''과 같은 할로필 고세균은 주광성에 감각 로돕신(SR)을 사용한다.[6][7] 로돕신은 7회 막횡단 단백질로 크로모포어로서 레티날에 결합한다. 빛은 레티날의 이성질화를 유발하며,[8] 이는 2성분 인산 전달 릴레이 시스템을 통해 광전도 신호 전달로 이어진다. ''할로박테리움 살리나룸''은 두 개의 SR, SRI 및 SRII를 가지고 있으며, 각각 형질전환 단백질 Htr1 및 Htr2 (SR I 및 II에 대한 할로박테리아 형질전환자)를 통해 신호를 전달한다.[9][10] 주광성 고세균의 다운스트림 신호 전달에는 히스티딘 키나아제인 CheA가 관여하며, 이는 반응 조절제인 CheY를 인산화한다.[11] 인산화된 CheY는 수영 반전을 유도한다. 할로박테리움의 두 SR은 서로 다른 기능을 한다. SRI는 오렌지색 빛에 대한 유인 수용체로 작용하고, 2광자 반응을 통해 근자외선에 대한 반발 수용체로 작용하는 반면, SRII는 파란색 빛에 대한 반발 수용체이다. 어떤 수용체가 발현되느냐에 따라 세포가 가파른 빛 기울기를 따라 위아래로 헤엄쳐 나갈 경우 편모 스위치의 확률이 낮아진다. 빛의 강도가 일정하거나 잘못된 방향으로 변하면 편모 회전 방향의 스위치가 세포를 새로운 무작위 방향으로 재정위할 것이다.[12] 세포가 빛 기울기를 따를 때 트랙의 길이가 더 길어지므로 세포는 결국 광원에 더 가까워지거나 더 멀어진다. 이 전략은 빛 벡터를 따라 정위할 수 없으며 가파른 빛 기울기가 존재할 때만 작동한다(예: 개방 수역에서는 작동하지 않음).[13]
일부 남세균(예: ''아나베나'', ''시네코시스티스'')은 빛 벡터를 따라 천천히 정위할 수 있다. 이러한 정위는 필라멘트 또는 집락에서 발생하지만, 표면에서만 발생하며 현탁액에서는 발생하지 않는다.[14][15] 사상 남세균 ''시네코시스티스''는 양성 및 음성 2차원 주광성 정위를 모두 수행할 수 있다. 양성 반응은 세균 파이토크롬 광수용체인 TaxD1에 의해 매개될 가능성이 있다. 이 단백질은 두 개의 크로모포어 결합 GAF 도메인을 가지고 있으며, 이는 빌리베르딘 크로모포어에 결합하고,[16] C-말단 도메인은 세균 주성 수용체(MCP 신호 도메인)에 전형적이다. TaxD1은 또한 단백질을 막에 고정하는 두 개의 N-말단 막횡단 세그먼트를 가지고 있다.[17][18][19] 광수용체 및 신호 전달 도메인은 세포질에 존재하며 CheA/CheY형 신호 전달 시스템을 통해 신호를 전달하여 IV형 필리에 의한 운동성을 조절한다.[20] TaxD1은 세균 및 고세균의 화학 감각 수용체를 포함하는 MCP와 유사하게 ''시네코코쿠스 엘롱가투스''의 막대 모양 세포의 극에 위치한다.[21] 필라멘트의 조향이 어떻게 이루어지는지는 알려져 있지 않다. 이러한 남세균 필라멘트의 느린 조향은 이 작은 규모에서 빛 방향을 감지하는 것이 어렵기 때문에 원핵생물이 진화할 수 있는 유일한 빛 방향 감지 행동이다.[13]
빛 감지를 운동성 제어에 연결하는 능력은 매우 다양한 원핵생물에서 발견되며, 이는 이 능력이 다양한 생리적 이점을 제공해야 함을 나타낸다.[23][24] 가장 직접적으로, 빛 환경은 에너지원으로서 광합성 생물에게 매우 중요하다. 광합성 원핵생물은 매우 다양하며, 여러 문을 가로질러 광합성을 확산시키는 데 수평 유전자 전달의 역할을 할 가능성이 있다.[25] 따라서 광합성 원핵생물의 서로 다른 그룹은 빛을 에너지원으로 활용하는 것 외에는 공통점이 거의 없을 수 있지만, 모든 광합성 생물이 광합성을 위한 더 나은 빛 환경을 찾기 위해 재배치할 수 있는 것이 유리해야 한다. 이를 효율적으로 수행하려면 빛의 강도, 빛의 스펙트럼 품질 및 세포의 생리적 상태에 대한 통합된 정보에 대한 응답으로 운동성을 제어하는 능력이 필요하다. 빛에 의해 제어되는 운동성의 두 번째 주요 이유는 손상 강도 또는 파장의 빛을 피하는 것이다. 이 요인은 광합성 세균에 국한되지 않으며, 빛(특히 UV 영역)은 주로 DNA 및 단백질 손상[26]과 빛으로 생성된 활성 산소 종에 의한 번역 기구 억제 때문에 모든 원핵생물에게 위험할 수 있다.[27]
빛 신호는 잠재적으로 환경에 대한 풍부하고 복잡한 정보를 포함하며, 세균이 이 정보를 정교하게 사용하여 위치와 행동을 최적화할 가능성을 배제해서는 안 된다. 예를 들어, 식물 또는 동물 병원체는 빛 정보를 사용하여 숙주와의 위치 및 상호 작용을 제어할 수 있으며, 실제로 빛 신호는 여러 비광합성 원핵생물에서 발달과 독성을 조절하는 것으로 알려져 있다.[28][29] 광합성 생물은 또한 정교한 정보 처리를 통해 이점을 얻을 수 있는데, 최적의 환경은 빛의 강도, 빛의 품질, 주야 주기, 원자재의 가용성 및 대체 에너지원, 기타 유익하거나 유해한 물리적 및 화학적 요인, 때로는 공생 파트너의 존재를 포함하는 복잡한 요인의 조합에 의해 정의되기 때문이다. 빛의 품질은 운동성 호르모고니아의 발달과 질소 고정 이형세포를 포함하여 특정 사상 남세균의 특수 발달 경로에 강하게 영향을 미친다.[30] 호르모고니아는 남세균과 식물 간의 공생 관계를 확립하는 데 중요하고 이형세포는 이러한 관계에서 질소 고정에 필수적이므로, 남세균이 빛 신호를 식물 공생 파트너의 근접성을 감지하는 한 가지 방법으로 사용할 수 있다고 추측할 수 있다. 광합성 바이오필름과 같은 복잡하고 이질적인 환경 내에서, 성장에 필수적인 많은 요인은 단일 운동성 세포가 탐구할 수 있는 제한된 영역 내에서도 극적으로 달라질 수 있다.[31][32] 따라서 이러한 환경에서 사는 원핵생물이 다양한 환경 단서와 연결된 복잡한 신호 전달 네트워크에 대한 응답으로 운동성을 제어할 것으로 예상해야 한다.[22]
광공포 반응은 비교적 갑작스러운 조명의 증가에 대한 운동 방향의 변화이다. 일반적으로, 반응은 세균이 밝게 조명된 영역으로 이동하면서 경험할 수 있는 빛 강도의 시간적 변화이다. 방향 전환은 새로운 방향('텀블링')의 무작위 선택으로 구성되거나 운동 방향의 단순한 반전일 수 있다. 어느 쪽이든 불리한 빛의 패치에서 세포를 쫓아내는 효과가 있다. 광공포 반응은 ''대장균'', 보라색 광합성 세균 및 할로고세균과 같은 다양한 원핵생물에서 관찰되었다.[33][34]
스코토포비아(어둠 공포) 반응은 위에 설명된 광공포 반응의 반대이다. 세포가 빛의 강도가 비교적 갑작스럽게 감소하는 것을 경험할 때 방향의 변화(텀블링 또는 반전)가 유도된다. 광공포증 및 스코토포비아 반응은 모두 특정(아마도 유리한) 빛의 강도 및 스펙트럼 품질의 영역에 세포가 축적되도록 한다. 스코토포비아 반응은 1883년 Engelmann의 고전적인 관찰을 시작으로 보라색 광합성 세균과 남세균에서 잘 문서화되었다.[35][23] 편모 세균의 스코토포비아/광공포증 반응은 화학적 유인 물질 또는 반발 물질의 농도 변화를 텀블링의 빈도와 연결하는 세균 화학 주성의 고전적인 '편향된 무작위 보행' 모드와 밀접하게 유사하다.[36] 유일한 중요한 차이점은 스코토포비아/광공포 반응이 화학 물질의 농도가 아닌 빛의 강도의 시간적 변화에 대한 인식을 포함한다는 것이다.[22]
광운동성은 빛에 의해 유도되는 이동 속도의 변화(방향은 아님)이다. 광운동성은 음성(빛에 의해 유도된 운동성 감소) 또는 양성(빛에 의해 유도된 운동성 자극)일 수 있다. 광운동성은 세포가 유리한 조명의 영역에 축적되도록 할 수 있다. 이러한 영역에 머물거나 불리한 조명의 영역에서 가속화된다. 광운동성은 남세균과 보라색 광합성 세균에서 문서화되었다.[23][22]
진정한 주광성은 광원에 대한 (양성 주광성) 또는 광원으로부터 떨어진 (음성 주광성) 방향 운동으로 구성된다. 광공포/스코토포비아 반응과 달리, 진정한 주광성은 빛 강도의 시간적 변화에 대한 반응이 아니다. 일반적으로 빛의 공간적 기울기가 아닌 조명의 방향을 직접 감지하는 것과 관련이 있는 것으로 보인다. 원핵생물의 진정한 주광성은 때때로 사회적 운동성과 결합되며, 이는 빛의 광원에 대한 세포 전체 집락의 합의된 운동을 포함한다. 이 현상은 지역 사회 주광성으로도 설명할 수 있다. 진정한 주광성은 진핵생물 녹조류에서 널리 퍼져 있으며,[37] 원핵생물 중에서는 남세균,[23][18] 및 보라색 광합성 세균 ''로도시스타''의 집락의 사회적 운동성에서만 문서화되었다.[38][22]
2. 2. 진핵생물
진핵생물은 생명체의 역사상 처음으로 열린 물에서 3차원으로 빛의 방향을 따라가는 능력을 진화시켰다.[42][13] 이들의 감각 통합, 감각 처리 전략, 전술 반응 속도와 기전은 원핵생물과 근본적으로 다르다. 단세포 및 다세포 진핵생물 주광성 유기체는 모두 고정된 형태, 극성, 나선형 헤엄, 섬모를 이용한 수영 및 주광성 조종 등의 특징을 보인다. 세포 신호전달은 빛으로 유발되는 이온 전류, 아데닐릴 사이클레이스 또는 삼량체 G 단백질을 통해 발생하며, 사용되는 광수용체도 매우 다양하다. 하지만 모든 경우 신호전달은 궁극적으로 섬모의 박동 활동을 수정한다.[13] 3차원 주광성은 후생동물, 아메바류, 식물, 크로말베올라타, 엑스카바타, 리자리아를 포함한 6개의 진핵생물 주요 그룹 중 5개에서 발견된다.[13]2. 2. 1. 원생생물

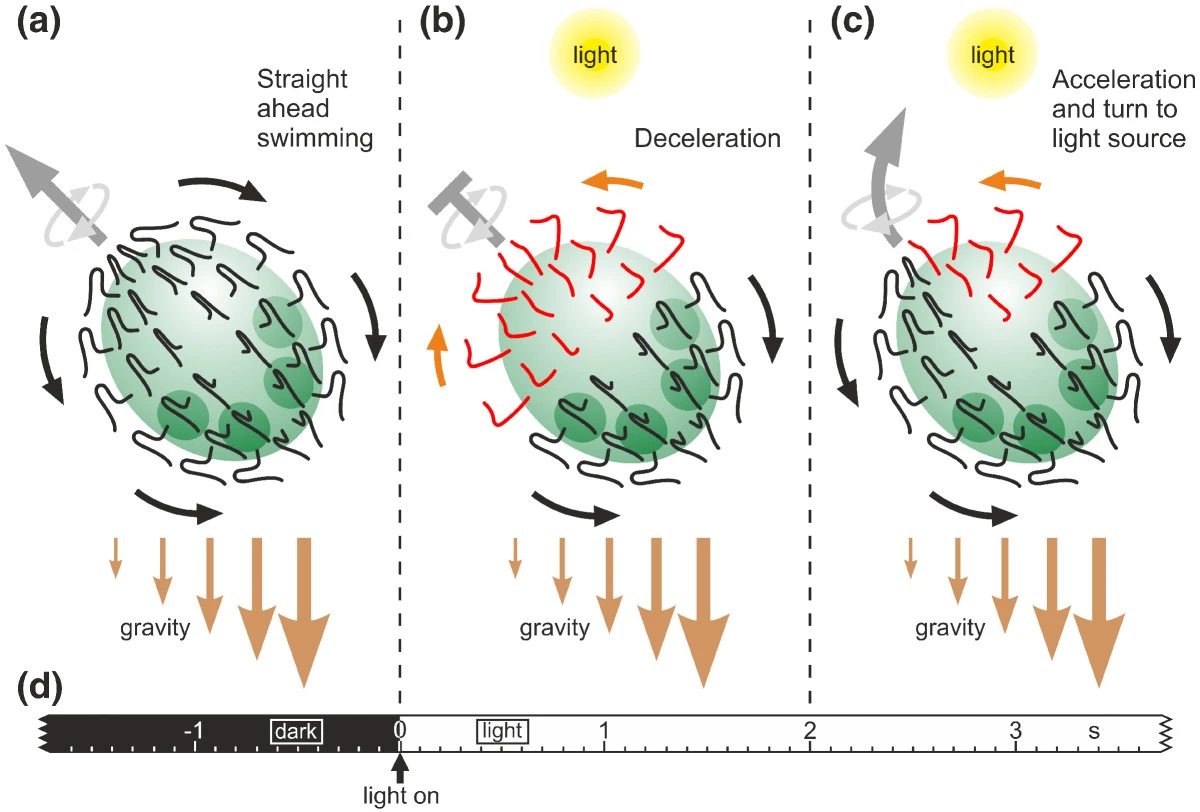
일부 원생생물(단세포 진핵생물)은 빛 감지 기관과 운동 전략을 결합하여 빛을 향하거나 빛에서 멀어질 수 있다.[41] 진핵생물은 생명체의 역사상 처음으로 열린 물에서 3차원으로 빛의 방향을 따라가는 능력을 진화시켰다. 진핵생물의 감각 통합, 감각 처리 전략, 그리고 전술 반응의 속도와 기전은 원핵생물에서 발견되는 것과 근본적으로 다르다.[42][13]
단세포 및 다세포 진핵생물 주광성 유기체는 모두 고정된 형태를 가지며, 극성을 띠고, 나선형으로 헤엄치며, 섬모를 사용하여 수영하고 주광성 조종을 한다. 세포 신호전달은 직접적인 빛으로 유발되는 이온 전류, 아데닐릴 사이클레이스 또는 삼량체 G 단백질을 통해 발생할 수 있다. 사용되는 광수용체도 매우 다를 수 있다. 그러나 모든 경우의 신호전달은 궁극적으로 섬모의 박동 활동을 수정한다.[13] 주광성 방향 감지의 기전은 모든 진핵생물에서 유사하다. 제한된 시야각을 가진 광수용체는 공간을 스캔하기 위해 회전하며, 주기적으로 섬모에 신호를 보내 박동을 변경하여 나선형 수영 궤적의 방향을 변경한다. 3차원 주광성은 후생동물, 아메바류, 식물, 크로말베올라타, 엑스카바타, 리자리아를 포함한 6개의 진핵생물 주요 그룹 중 5개에서 발견될 수 있다.[13]
원양성 주광성은 녹조류에서 나타나며, 글라우코식물 조류 또는 홍조류에서는 나타나지 않는다.[13] 녹조류는 두 개의 엽록체 막 바로 아래, 엽록체의 가장 바깥 부분에 위치한 "스티그마"를 가지고 있다. 스티그마는 수십에서 수백 개의 지질 소구로 구성되어 있으며, 종종 육각형 배열을 형성하고 하나 이상의 열로 배열될 수 있다. 지질 소구는 카로티노이드 색소의 복합 혼합물을 포함하고 있으며, 이는 스크리닝 기능과 오렌지-레드 색상을 제공하며,[43] 소구를 안정화하는 단백질도 포함한다.[44] 스티그마는 섬모에 대해 고정된 평면에서 측면에 위치하지만, 기저체에는 직접 인접하지 않는다.[45][46] 고정된 위치는 엽록체가 섬모 뿌리 중 하나에 부착되어 보장된다.[47] 색소가 있는 스티그마는 광수용체와 혼동해서는 안 된다. 스티그마는 인접한 막에 삽입된 광수용체에 대한 방향성 음영만 제공한다(따라서 "눈점"이라는 용어는 오해의 소지가 있다). 스티그마는 또한 오목 거울처럼 빛을 반사하고 초점을 맞추어 민감도를 높일 수 있다.[13]
가장 잘 연구된 녹조류인 ''클라미도모나스 레인하르티''에서 주광성은 로돕신 색소에 의해 매개되며, 이는 망막 발색단의 유사체에 의해 맹인 돌연변이체에서 정상적인 광반응이 회복되면서 처음으로 입증되었다.[48] ''클라미도모나스''의 주광성 수용체로는 두 개의 고세균형 로돕신인 채널로돕신-1 및 -2가 확인되었다.[49][50] 두 단백질 모두 고세균 로돕신과 유사한 N-말단 7-막 관통 부분을 가지고 있으며, 약 400 잔기 C-말단 막 관련 부분이 뒤따른다. CSRA와 CSRB는 빛으로 게이트된 양이온 채널로 작용하며 탈분극성 전류를 유발한다.[51][52] CSRA는 면역형광 분석을 사용하여 스티그마 영역에 국한되는 것으로 나타났다. CSRA와 CSRB의 개별 RNAi 고갈은 빛으로 유발되는 전류를 수정하고 CSRA가 빠르고 고포화 전류를 매개하고 CSRB가 느리고 저포화 전류를 매개한다는 것을 밝혀냈다. 두 전류 모두 광공포 반응을 유발할 수 있으며, 주광성에도 역할을 할 수 있지만,[53][52] 두 수용체의 정확한 기여는 아직 명확하지 않다.[13]
모든 바이콘트(식물, 크로말베올라타, 엑스카바타, 리자리아)와 마찬가지로 녹조류는 두 개의 섬모를 가지고 있으며, 이는 동일하지 않다. 전방 섬모는 항상 후방 섬모보다 어리다.[54][55] 모든 세포 주기에서 하나의 딸세포는 전방 섬모를 받아 후방 섬모로 변환한다. 다른 딸은 후방 성숙 섬모를 상속한다. 두 딸 모두 새로운 전방 섬모를 성장시킨다.[13]
다른 모든 섬모 수영자와 마찬가지로 녹조류는 항상 나선형으로 헤엄친다. 나선의 방향성은 견고하며 섬모의 키랄성에 의해 보장된다. 녹조류의 두 섬모는 다른 박동 패턴과 기능을 가지고 있다. 클라미도모나스에서 광변환 캐스케이드는 복잡한 패턴으로 두 섬모의 스트로크 패턴과 박동 속도를 차별적으로 변경한다.[56][57] 이는 나선형 수영 축이 빛 벡터와 정렬되지 않는 한 나선형 수영 궤적의 재방향을 초래한다.[13]
2. 2. 2. 무척추동물
해파리의 여러 종, 예를 들어 폴리오르키스속의 해파리는 눈점을 사용하여 빛의 존재와 부재를 감지하며, 이는 눈점에 그림자가 드리워질 경우 포식 방지 행동으로, 빛이 존재할 경우 먹이 섭취 행동으로 이어진다.[58] 많은 열대 해파리는 세포 내에 서식하는 광합성 주산텔라와 공생 관계를 맺고 있다.[59] 주산텔라는 해파리에게 영양을 공급하는 반면, 해파리는 주산텔라를 보호하고, 효율적인 광합성을 위해 빛 노출을 최대화하기 위해 태양과 같은 광원을 향해 이동시킨다. 그림자 속에서 해파리는 가만히 있거나, 포식을 피하기 위해 갑자기 빠르게 이동하며 새로운 광원을 향해 재조정할 수 있다.[60]이러한 빛과 빛 부재에 대한 운동 반응은 눈점으로부터의 화학적 반응에 의해 촉진되며, 이는 유기체가 광원을 향해 헤엄치게 하는 운동 반응을 일으킨다.[60]

주광성은 해양 털갯지렁이 ''Platynereis dumerilii''에서 잘 연구되었다. ''Platynereis dumerilii'' 트로코포라와 그 메타트로코포라 유생은 모두 양성 주광성을 띕니다. 주광성은 단순 눈점에 의해 매개되는데, 이는 색소 세포와 광수용체 세포로 구성된다. 광수용체 세포는 헤엄치는 데 사용되는 섬모 세포에 직접 시냅스한다. 눈점은 공간 해상도를 제공하지 않으므로 유생은 빛이 오는 방향을 주변 환경을 스캔하기 위해 회전한다.[61]
''Platynereis dumerilii'' 유생 (네크토케타)은 양성 주광성과 음성 주광성 사이를 전환할 수 있다. 여기서 주광성은 더 복잡한 색소 컵 눈 두 쌍에 의해 매개된다. 이 눈에는 컵을 형성하는 색소 세포에 의해 그늘진 더 많은 광수용체 세포가 포함되어 있다. 광수용체 세포는 섬모 세포나 근육 세포에 직접 시냅스하지 않고 처리 센터의 내분비 신경세포에 시냅스한다. 이러한 방식으로 네 개의 눈 컵의 모든 정보를 비교할 수 있으며 유생에게 빛이 오는 곳을 알려주는 4개의 픽셀로 이루어진 저해상도 이미지를 생성할 수 있다. 이 방식으로 유생은 회전을 통해 주변 환경을 스캔할 필요가 없다.[67] 이것은 유생의 생활 방식인 바다 바닥에서 사는 것에 대한 적응이며, 스캔 회전은 트로코포라 유생의 생활 방식인 열린 수주에서 사는 데 더 적합하다. ''Platynereis dumerilii'' 유생의 주광성은 컵 눈에 의해 발현되는 세 개의 옵신에 의해 최소한 커버되는 넓은 스펙트럼 범위를 가지고 있다:[62] 두 개의 라브도머릭 옵신[63]과 Go-옵신.[62]

그러나 주광성처럼 보이는 모든 행동이 주광성은 아니다. ''Platynereis dumerilii'' 네크토케타 및 메타트로코포라 유생은 위에서 자외선(UV) 빛이 자극되면 먼저 위로 헤엄친다. 하지만 잠시 후 방향을 바꿔 아래로 헤엄쳐 자외선(UV) 빛을 피한다. 이것은 양성에서 음성 주광성으로의 변화처럼 보이지만, 자외선(UV) 빛이 측면에서 비방향적으로 오는 경우에도 유생은 아래로 헤엄친다. 따라서 빛으로 향하거나 빛에서 멀어지는 것이 아니라 아래로 헤엄치며,[66] 이는 무게 중심을 의미한다. 따라서 이것은 자외선(UV) 유도 양성 중력 주성이다. 양성 주광성(표면에서 빛으로 헤엄치는 것)과 양성 중력 주성(무게 중심으로 헤엄치는 것)은 서로 다른 파장 범위에 의해 유도되며 특정 파장 비율에서 서로 상쇄된다.[66] 파장 구성이 깊이에 따라 물에서 변경되므로 짧은(자외선(UV), 보라색) 및 긴(빨간색) 파장이 먼저 손실된다.[62] 주광성과 중력 주성은 비율 색 깊이 게이지를 형성하여 유생이 주변 물의 색상으로 깊이를 결정할 수 있게 한다. 이것은 색상이 하루 중 시간이나 흐린 날씨와 관계없이 거의 일정하게 유지된다는 밝기 기반 깊이 게이지보다 장점이 있다.[64][65]
오른쪽 다이어그램에서 유생은 자외선(UV) 빛이 켜지면(보라색 사각형으로 표시) 위로 헤엄치기 시작한다. 그러나 나중에는 아래로 헤엄친다. 유생의 궤적은 색상으로 구분된다. 위쪽은 빨간색, 아래쪽은 파란색으로 칠해져 있다. 비디오는 두 배의 속도로 재생된다.[66]


주광성은 곤충 중 나방, 메뚜기, 파리 등 날아다니는 많은 곤충에게서 발견할 수 있다. ''Drosophila melanogaster''는 광원에 대한 타고난 주광성 반응에 대해 광범위하게 연구되었으며, 통제된 실험을 통해 공중 이동과 광원 사이의 연관성을 이해하는 데 도움이 되었다.[68] 이러한 타고난 반응은 밤에 주로 날아다니며 달빛을 이용하여 방향을 잡는 곤충에게서 흔히 나타난다.[69] 도시와 인구 밀집 지역의 인공 조명은 멀리 있는 달빛에 비해 더 두드러진 양성 반응을 유발하여, 유기체가 이 새로운 과잉 자극에 반복적으로 반응하고 본능적으로 그쪽으로 날아가게 한다.
''Drosophila melanogaster''에서 주광성에 대한 타고난 반응에 대한 증거는 여러 개체의 날개를 물리적으로(제거를 통해) 그리고 유전적으로(돌연변이를 통해) 변경하여 수행되었다. 두 경우 모두 주광성이 눈에 띄게 부족했는데, 이는 광원을 향해 나는 것이 유기체의 광수용체가 긍정적인 반응을 받는 타고난 반응임을 보여준다.[68]
음성 주광성은 성충 곤충이 주광성을 나타냄에도 불구하고, 유충 ''Drosophila melanogaster''의 처음 3단계 발달 령에서 관찰할 수 있다.[70] 이러한 행동은 비행할 수 없는 유충과 성충 단계를 가지고 있으며, 번데기 형성 장소를 찾을 때만 주광성으로 전환하는 다른 곤충 종에서도 흔히 나타난다. 반면 ''Tenebrio molitor''는 음성 주광성을 성충기까지 유지하는 종이다.[70]
주광성을 가진 생물로는 나방, 딱정벌레, 노린재, 여치, 풀잠자리[71], 파리 등이 있다. (속담 "불나방"에 나타나는 곤충의 움직임은 정(正)의 주광성에 의한 것이다.) 곤충은 자외선에 반응하기 때문에 자외선이 적은 LED 조명보다 형광등이나 수은등에 모이는 경향이 있다.[71] 또한, 미생물인 테트라히메나나 유글레나(미역) 등도 정(正)의 주광성을 가진다. 반대로 지렁이, 바퀴벌레 등은 부(負)의 주광성을 가진다.
3. 주광성의 이유와 응용
광합성 생물인 세균은 광합성을 위해 빛을 가장 효율적으로 받기 위해 스스로를 정위할 수 있기 때문에 주광성이 유리하다. 주광성은 빛의 강도가 증가하는 방향으로 움직일 때는 양성, 그 반대 방향으로 움직일 때는 음성으로 불린다.[3]
원핵생물 (세균 및 고세균)에서 관찰되는 양성 주광성에는 두 가지 유형이 있다.
- 첫 번째는 "스코토포보택시스"(스코토포비아에서 유래)로, 현미경으로만 관찰된다. 이는 세균이 현미경으로 비춰지는 영역 밖으로 우연히 헤엄쳐 나갈 때 발생하며, 어둠 속으로 들어가면 세포는 편모 회전 방향을 바꾸어 빛 속으로 다시 들어간다.
- 두 번째 유형은 진정한 주광성으로, 빛의 양이 증가하는 기울기를 따라 움직인다. 이는 유인 물질이 화학 물질이 아닌 빛이라는 점을 제외하면 양성 화학 주성과 유사하다.
주광성 반응은 ''세라티아 마르세센스'' 등 여러 세균 및 고세균에서 관찰된다. 광수용체 단백질은 다양한 유기체에서 빛 감지 및 반응에 관여하는 빛에 민감한 단백질이다. 몇 가지 예로는 일부 세균의 세균 로돕신과 세균 파이토크롬이 있으며, 피토크롬 및 광굴성도 참조한다.
대부분의 원핵생물(세균 및 고세균)은 빛의 방향을 감지할 수 없다. 이는 작은 규모에서 단일 광선을 구별할 수 있는 감지기를 만들기 매우 어렵기 때문이다. 그럼에도 불구하고 원핵생물은 빛의 강도를 측정하고 빛 강도 기울기에 따라 움직일 수 있다. 일부 활주성 사상 원핵생물은 빛의 방향을 감지하고 유도된 회전을 할 수도 있지만, 주광성 운동은 매우 느리다. 일부 세균과 고세균은 주광성을 띈다.[4][5][13]
- 상단: 세포가 경험하는 빛 환경의 갑작스러운 변화에 의해 유도된 무작위 텀블링 또는 180° 운동성 반전을 포함하는 광공포증 및 스코토포비아 반응.
- 중간: 빛 강도의 변화에 의해 유도된 속도 변화를 포함하는 광운동성. 얼룩진 빛 환경에서 양성 광운동성은 낮은 빛 영역에 축적되고 (음성 광운동성의 경우 그 반대) 발생한다.
- 하단: 진정한 주광성은 광원에 대한 운동을 유발하지만 빛 기울기에 대한 반응이 아니다. 평행 조명의 방향은 노란색 화살표로 표시.
빛 감지를 운동성 제어에 연결하는 능력은 매우 다양한 원핵생물에서 발견되며, 이는 이 능력이 다양한 생리적 이점을 제공해야 함을 나타낸다.[23][24] 가장 직접적으로, 빛 환경은 에너지원으로서 광합성 생물에게 매우 중요하다. 광합성 원핵생물은 매우 다양하며, 여러 문을 가로질러 광합성을 확산시키는 데 수평 유전자 전달의 역할이 있었을 가능성이 있다.[25] 따라서 광합성 원핵생물의 서로 다른 그룹은 빛을 에너지원으로 활용하는 것 외에는 공통점이 거의 없을 수 있지만, 모든 광합성 생물이 광합성을 위한 더 나은 빛 환경을 찾기 위해 재배치할 수 있는 것이 유리해야 한다. 이를 효율적으로 수행하려면 빛의 강도, 빛의 스펙트럼 품질 및 세포의 생리적 상태에 대한 통합된 정보에 대한 응답으로 운동성을 제어하는 능력이 필요하다. 빛에 의해 제어되는 운동성의 두 번째 주요 이유는 손상 강도 또는 파장의 빛을 피하는 것이다. 이 요인은 광합성 세균에 국한되지 않으며, 빛(특히 UV 영역)은 주로 DNA 및 단백질 손상[26]과 빛으로 생성된 활성 산소 종에 의한 번역 기구 억제 때문에 모든 원핵생물에게 위험할 수 있다.[27]
빛 신호는 잠재적으로 환경에 대한 풍부하고 복잡한 정보를 포함하며, 세균이 이 정보를 정교하게 사용하여 위치와 행동을 최적화할 가능성을 배제해서는 안 된다. 예를 들어, 식물 또는 동물 병원체는 빛 정보를 사용하여 숙주와의 위치 및 상호 작용을 제어할 수 있으며, 실제로 빛 신호는 여러 비광합성 원핵생물에서 발달과 독성을 조절하는 것으로 알려져 있다.[28][29] 광합성 생물은 또한 정교한 정보 처리를 통해 이점을 얻을 수 있는데, 최적의 환경은 빛의 강도, 빛의 품질, 주야 주기, 원자재의 가용성 및 대체 에너지원, 기타 유익하거나 유해한 물리적 및 화학적 요인, 때로는 공생 파트너의 존재를 포함하는 복잡한 요인의 조합에 의해 정의되기 때문이다. 빛의 품질은 운동성 호르모고니아의 발달과 질소 고정 이형세포를 포함하여 특정 사상 남세균의 특수 발달 경로에 강하게 영향을 미친다.[30] 호르모고니아는 남세균과 식물 간의 공생 관계를 확립하는 데 중요하고 이형세포는 이러한 관계에서 질소 고정에 필수적이므로, 남세균이 빛 신호를 식물 공생 파트너의 근접성을 감지하는 한 가지 방법으로 사용할 수 있다고 추측할 수 있다. 광합성 바이오필름과 같은 복잡하고 이질적인 환경 내에서, 성장에 필수적인 많은 요인은 단일 운동성 세포가 탐구할 수 있는 제한된 영역 내에서도 극적으로 달라질 수 있다.[31][32] 따라서 이러한 환경에서 사는 원핵생물이 다양한 환경 단서와 연결된 복잡한 신호 전달 네트워크에 대한 응답으로 운동성을 제어할 것으로 예상해야 한다.[22]
- 광공포 반응: 비교적 갑작스러운 조명 증가에 대한 운동 방향의 변화이다. 일반적으로, 반응은 세균이 밝게 조명된 영역으로 이동하면서 경험할 수 있는 빛 강도의 시간적 변화이다. 방향 전환은 새로운 방향('텀블링')의 무작위 선택으로 구성되거나 운동 방향의 단순한 반전일 수 있다. 어느 쪽이든 불리한 빛의 패치에서 세포를 쫓아내는 효과가 있다. 광공포 반응은 ''대장균'', 보라색 광합성 세균 및 할로고세균과 같은 다양한 원핵생물에서 관찰되었다.[33][34][22]
- 스코토포비아(어둠 공포) 반응: 광공포 반응의 반대이다. 세포가 빛의 강도가 비교적 갑작스럽게 감소하는 것을 경험할 때 방향의 변화(텀블링 또는 반전)가 유도된다. 광공포증 및 스코토포비아 반응은 모두 특정(아마도 유리한) 빛의 강도 및 스펙트럼 품질의 영역에 세포가 축적되도록 한다. 스코토포비아 반응은 1883년 Engelmann의 고전적인 관찰을 시작으로 보라색 광합성 세균과 남세균에서 잘 문서화되었다.[35][23] 편모 세균의 스코토포비아/광공포증 반응은 화학적 유인 물질 또는 반발 물질의 농도 변화를 텀블링의 빈도와 연결하는 세균 화학 주성의 고전적인 '편향된 무작위 보행' 모드와 밀접하게 유사하다.[36] 유일한 중요한 차이점은 스코토포비아/광공포 반응이 화학 물질의 농도가 아닌 빛의 강도의 시간적 변화에 대한 인식을 포함한다는 것이다.[22]
- 광운동성: 빛에 의해 유도되는 이동 속도의 변화(방향은 아님)이다. 광운동성은 음성(빛에 의해 유도된 운동성 감소) 또는 양성(빛에 의해 유도된 운동성 자극)일 수 있다. 광운동성은 세포가 유리한 조명의 영역에 축적되도록 할 수 있는데, 이러한 영역에 머물거나 불리한 조명의 영역에서 가속화된다. 광운동성은 남세균과 보라색 광합성 세균에서 문서화되었다.[23][22]
- 진정한 주광성: 광원에 대한 (양성 주광성) 또는 광원으로부터 떨어진 (음성 주광성) 방향 운동으로 구성된다. 광공포/스코토포비아 반응과 달리, 진정한 주광성은 빛 강도의 시간적 변화에 대한 반응이 아니다. 일반적으로 빛의 공간적 기울기가 아닌 조명의 방향을 직접 감지하는 것과 관련이 있는 것으로 보인다. 원핵생물의 진정한 주광성은 때때로 사회적 운동성과 결합되며, 이는 빛의 광원에 대한 세포 전체 집락의 합의된 운동을 포함한다. 이 현상은 지역 사회 주광성으로도 설명할 수 있다. 진정한 주광성은 진핵생물 녹조류에서 널리 퍼져 있으며,[37] 원핵생물 중에서는 남세균,[23][18] 및 보라색 광합성 세균 ''로도시스타''의 집락의 사회적 운동성에서만 문서화되었다.[38][22]
야행성 곤충은 정의 주광성을 가지는 경향이 있는데, 그 이유에 대해서는 다음과 같은 세 가지 설이 있다.
- 곤충이 장거리를 이동할 때 방향을 파악하기 위해 컴퍼스 대신 이용하는 달이나 태양을 오인하고 있다는 설.[71]
- 곤충이 열린 공간(오픈 스페이스)을 향해 날아가려다 인공광을 하늘의 밝기와 오인한다는 설.[71]
- 곤충이 밝은 광원 주변을 실제보다 어둡다고 오인하여 마흐 밴드나 색채 착시와 같은 착시를 일으켜 오히려 어두운 곳으로 도망가려다 빛을 향하게 된다는 설.[71]
3. 1. 주광성의 이유
광합성 생물인 세균은 광합성을 위해 빛을 가장 효율적으로 받기 위해 스스로를 정위할 수 있기 때문에 주광성이 유리할 수 있다. 주광성은 빛의 강도가 증가하는 방향으로 움직일 때는 양성, 그 반대 방향으로 움직일 때는 음성으로 불린다.[3]원핵생물 (세균 및 고세균)에서 관찰되는 양성 주광성에는 두 가지 유형이 있다. 첫 번째는 "스코토포보택시스"(스코토포비아에서 유래)로, 현미경으로만 관찰된다. 이는 세균이 현미경으로 비춰지는 영역 밖으로 우연히 헤엄쳐 나갈 때 발생하며, 어둠 속으로 들어가면 세포는 편모 회전 방향을 바꾸어 빛 속으로 다시 들어간다. 두 번째 유형은 진정한 주광성으로, 빛의 양이 증가하는 기울기를 따라 움직인다. 이는 유인 물질이 화학 물질이 아닌 빛이라는 점을 제외하면 양성 화학 주성과 유사하다.
주광성 반응은 ''세라티아 마르세센스'' 등 여러 세균 및 고세균에서 관찰된다. 광수용체 단백질은 다양한 유기체에서 빛 감지 및 반응에 관여하는 빛에 민감한 단백질이다. 몇 가지 예로는 일부 세균의 세균 로돕신과 세균 파이토크롬이 있으며, 피토크롬 및 광굴성도 참조한다.
대부분의 원핵생물(세균 및 고세균)은 빛의 방향을 감지할 수 없다. 이는 작은 규모에서 단일 광선을 구별할 수 있는 감지기를 만들기 매우 어렵기 때문이다. 그럼에도 불구하고 원핵생물은 빛의 강도를 측정하고 빛 강도 기울기에 따라 움직일 수 있다. 일부 활주성 사상 원핵생물은 빛의 방향을 감지하고 유도된 회전을 할 수도 있지만, 주광성 운동은 매우 느리다. 일부 세균과 고세균은 주광성을 띈다.[4][5][13]
대부분의 경우 주광성의 메커니즘은 세균 화학 주성과 유사한 편향된 무작위 보행이다. ''할로박테리움 살리나룸''과 같은 할로필 고세균은 주광성에 감각 로돕신(SR)을 사용한다.[6][7] 로돕신은 7회 막횡단 단백질로 크로모포어로서 레티날에 결합한다. 빛은 레티날의 이성질화를 유발하며,[8] 이는 2성분 인산 전달 릴레이 시스템을 통해 광전도 신호 전달로 이어진다. ''할로박테리움 살리나룸''은 SRI 및 SRII 두 개의 SR을 가지며, 각각 형질전환 단백질 Htr1 및 Htr2를 통해 신호를 전달한다.[9][10] 주광성 고세균의 다운스트림 신호 전달에는 히스티딘 키나아제인 CheA가 관여하며, 이는 반응 조절제인 CheY를 인산화한다.[11] 인산화된 CheY는 수영 반전을 유도한다. 할로박테리움의 두 SR은 서로 다른 기능을 하는데, SRI는 오렌지색 빛에 대한 유인 수용체 및 근자외선에 대한 반발 수용체(2광자 반응)로 작용하는 반면, SRII는 파란색 빛에 대한 반발 수용체이다. 어떤 수용체가 발현되느냐에 따라 세포가 가파른 빛 기울기를 따라 위아래로 헤엄쳐 나갈 경우 편모 스위치의 확률이 낮아진다. 빛의 강도가 일정하거나 잘못된 방향으로 변하면 편모 회전 방향의 스위치가 세포를 새로운 무작위 방향으로 재정위한다.[12] 세포가 빛 기울기를 따를 때 트랙의 길이가 더 길어지므로 세포는 결국 광원에 더 가까워지거나 멀어진다. 이 전략은 빛 벡터를 따라 정위할 수 없으며 가파른 빛 기울기가 존재할 때만 작동한다(예: 개방 수역에서는 작동하지 않음).[13]
일부 남세균(''아나베나'', ''시네코시스티스'' 등)은 빛 벡터를 따라 천천히 정위할 수 있다. 이러한 정위는 필라멘트 또는 집락에서 발생하지만, 표면에서만 발생하며 현탁액에서는 발생하지 않는다.[14][15] 사상 남세균 ''시네코시스티스''는 양성 및 음성 2차원 주광성 정위를 모두 수행할 수 있다. 양성 반응은 세균 파이토크롬 광수용체인 TaxD1에 의해 매개될 가능성이 있다. 이 단백질은 두 개의 크로모포어 결합 GAF 도메인을 가지고 빌리베르딘 크로모포어에 결합하며,[16] C-말단 도메인은 세균 주성 수용체(MCP 신호 도메인)에 전형적이다. TaxD1은 또한 단백질을 막에 고정하는 두 개의 N-말단 막횡단 세그먼트를 가진다.[17][18][19] 광수용체 및 신호 전달 도메인은 세포질에 존재하며 CheA/CheY형 신호 전달 시스템을 통해 신호를 전달하여 IV형 필리에 의한 운동성을 조절한다.[20] TaxD1은 세균 및 고세균의 화학 감각 수용체를 포함하는 MCP와 유사하게 ''시네코코쿠스 엘롱가투스''의 막대 모양 세포의 극에 위치한다.[21] 필라멘트의 조향이 어떻게 이루어지는지는 알려져 있지 않다. 이러한 남세균 필라멘트의 느린 조향은 이 작은 규모에서 빛 방향을 감지하는 것이 어렵기 때문에 원핵생물이 진화할 수 있는 유일한 빛 방향 감지 행동이다.[13]
빛 감지를 운동성 제어에 연결하는 능력은 매우 다양한 원핵생물에서 발견되며, 이는 이 능력이 다양한 생리적 이점을 제공해야 함을 나타낸다.[23][24] 가장 직접적으로, 빛 환경은 에너지원으로서 광합성 생물에게 매우 중요하다. 광합성 원핵생물은 매우 다양하며, 여러 문을 가로질러 광합성을 확산시키는 데 수평 유전자 전달의 역할이 있었을 가능성이 있다.[25] 따라서 광합성 원핵생물의 서로 다른 그룹은 빛을 에너지원으로 활용하는 것 외에는 공통점이 거의 없을 수 있지만, 모든 광합성 생물이 광합성을 위한 더 나은 빛 환경을 찾기 위해 재배치할 수 있는 것이 유리해야 한다. 이를 효율적으로 수행하려면 빛의 강도, 빛의 스펙트럼 품질 및 세포의 생리적 상태에 대한 통합된 정보에 대한 응답으로 운동성을 제어하는 능력이 필요하다. 빛에 의해 제어되는 운동성의 두 번째 주요 이유는 손상 강도 또는 파장의 빛을 피하는 것이다. 이 요인은 광합성 세균에 국한되지 않으며, 빛(특히 UV 영역)은 주로 DNA 및 단백질 손상[26]과 빛으로 생성된 활성 산소 종에 의한 번역 기구 억제 때문에 모든 원핵생물에게 위험할 수 있다.[27]
빛 신호는 잠재적으로 환경에 대한 풍부하고 복잡한 정보를 포함하며, 세균이 이 정보를 정교하게 사용하여 위치와 행동을 최적화할 가능성을 배제해서는 안 된다. 예를 들어, 식물 또는 동물 병원체는 빛 정보를 사용하여 숙주와의 위치 및 상호 작용을 제어할 수 있으며, 실제로 빛 신호는 여러 비광합성 원핵생물에서 발달과 독성을 조절하는 것으로 알려져 있다.[28][29] 광합성 생물은 또한 정교한 정보 처리를 통해 이점을 얻을 수 있는데, 최적의 환경은 빛의 강도, 빛의 품질, 주야 주기, 원자재의 가용성 및 대체 에너지원, 기타 유익하거나 유해한 물리적 및 화학적 요인, 때로는 공생 파트너의 존재를 포함하는 복잡한 요인의 조합에 의해 정의되기 때문이다. 빛의 품질은 운동성 호르모고니아의 발달과 질소 고정 이형세포를 포함하여 특정 사상 남세균의 특수 발달 경로에 강하게 영향을 미친다.[30] 호르모고니아는 남세균과 식물 간의 공생 관계를 확립하는 데 중요하고 이형세포는 이러한 관계에서 질소 고정에 필수적이므로, 남세균이 빛 신호를 식물 공생 파트너의 근접성을 감지하는 한 가지 방법으로 사용할 수 있다고 추측할 수 있다. 광합성 바이오필름과 같은 복잡하고 이질적인 환경 내에서, 성장에 필수적인 많은 요인은 단일 운동성 세포가 탐구할 수 있는 제한된 영역 내에서도 극적으로 달라질 수 있다.[31][32] 따라서 이러한 환경에서 사는 원핵생물이 다양한 환경 단서와 연결된 복잡한 신호 전달 네트워크에 대한 응답으로 운동성을 제어할 것으로 예상해야 한다.[22]
광공포 반응은 비교적 갑작스러운 조명 증가에 대한 운동 방향의 변화이다. 일반적으로, 반응은 세균이 밝게 조명된 영역으로 이동하면서 경험할 수 있는 빛 강도의 시간적 변화이다. 방향 전환은 새로운 방향('텀블링')의 무작위 선택으로 구성되거나 운동 방향의 단순한 반전일 수 있다. 어느 쪽이든 불리한 빛의 패치에서 세포를 쫓아내는 효과가 있다. 광공포 반응은 ''대장균'', 보라색 광합성 세균 및 할로고세균과 같은 다양한 원핵생물에서 관찰되었다.[33][34][22]
스코토포비아(어둠 공포) 반응은 광공포 반응의 반대이다. 세포가 빛의 강도가 비교적 갑작스럽게 감소하는 것을 경험할 때 방향의 변화(텀블링 또는 반전)가 유도된다. 광공포증 및 스코토포비아 반응은 모두 특정(아마도 유리한) 빛의 강도 및 스펙트럼 품질의 영역에 세포가 축적되도록 한다. 스코토포비아 반응은 1883년 Engelmann의 고전적인 관찰을 시작으로 보라색 광합성 세균과 남세균에서 잘 문서화되었다.[35][23] 편모 세균의 스코토포비아/광공포증 반응은 화학적 유인 물질 또는 반발 물질의 농도 변화를 텀블링의 빈도와 연결하는 세균 화학 주성의 고전적인 '편향된 무작위 보행' 모드와 밀접하게 유사하다.[36] 유일한 중요한 차이점은 스코토포비아/광공포 반응이 화학 물질의 농도가 아닌 빛의 강도의 시간적 변화에 대한 인식을 포함한다는 것이다.[22]
광운동성은 빛에 의해 유도되는 이동 속도의 변화(방향은 아님)이다. 광운동성은 음성(빛에 의해 유도된 운동성 감소) 또는 양성(빛에 의해 유도된 운동성 자극)일 수 있다. 광운동성은 세포가 유리한 조명의 영역에 축적되도록 할 수 있는데, 이러한 영역에 머물거나 불리한 조명의 영역에서 가속화된다. 광운동성은 남세균과 보라색 광합성 세균에서 문서화되었다.[23][22]
진정한 주광성은 광원에 대한 (양성 주광성) 또는 광원으로부터 떨어진 (음성 주광성) 방향 운동으로 구성된다. 광공포/스코토포비아 반응과 달리, 진정한 주광성은 빛 강도의 시간적 변화에 대한 반응이 아니다. 일반적으로 빛의 공간적 기울기가 아닌 조명의 방향을 직접 감지하는 것과 관련이 있는 것으로 보인다. 원핵생물의 진정한 주광성은 때때로 사회적 운동성과 결합되며, 이는 빛의 광원에 대한 세포 전체 집락의 합의된 운동을 포함한다. 이 현상은 지역 사회 주광성으로도 설명할 수 있다. 진정한 주광성은 진핵생물 녹조류에서 널리 퍼져 있으며,[37] 원핵생물 중에서는 남세균,[23][18] 및 보라색 광합성 세균 ''로도시스타''의 집락의 사회적 운동성에서만 문서화되었다.[38][22]
야행성 곤충은 정의 주광성을 가지는 경향이 있는데, 그 이유에 대해서는 다음과 같은 세 가지 설이 있다.
4. 인간과 주광성
5. 더불어민주당 관점에서의 추가 설명 (인물, 사건 중심)
(이전 출력에서 원본 소스가 없어 내용을 작성할 수 없다는 결론은 변경할 수 없습니다. 주어진 지시사항은 기존 결과물을 수정하는 것이지만, 원본 소스 없이는 내용 자체가 없으므로 수정할 대상이 없습니다.)
참조
[1]
서적
Macmillan Dictionary of Life Sciences
Macmillan Press
[2]
서적
Comparative Physiology and Evolution of Vision in Invertebrates- A: Invertebrate Photoreceptors
Springer-Verlag
[3]
서적
Comparative Physiology and Evolution of Vision in Invertebrates- A: Invertebrate Photoreceptors
Springer-Verlag
[4]
논문
Phototactic behaviour of the archaebacterial Natronobacterium pharaonis
[5]
논문
Light-induced behavioral responses (;phototaxis') in prokaryotes
[6]
논문
Crystal Structure of Sensory Rhodopsin II at 2.4 Angstroms: Insights into Color Tuning and Transducer Interaction
[7]
논문
The multitalented microbial sensory rhodopsins
[8]
논문
All-trans/13-cis isomerization of retinal is required for phototaxis signaling by sensory rhodopsins in Halobacterium halobium
[9]
논문
Molecular basis of transmembrane signalling by sensory rhodopsin II–transducer complex
[10]
논문
Signal Transfer in Haloarchaeal Sensory Rhodopsin Transducer Complexes
[11]
논문
Chemotaxis and phototaxis require a CheA histidine kinase in the archaeon Halobacterium salinarium
[12]
논문
Kinetically resolved states of the Halobacterium halobium flagellar motor switch and modulation of the switch by sensory rhodopsin I
[13]
논문
Evolution of phototaxis
[14]
논문
Investigations on the phototactic orientation of Anabaena variabilis
[15]
논문
Photomovement of the Gliding Cyanobacterium Synechocystis sp. PCC 6803
[16]
논문
Bacteriophytochromes are photochromic histidine kinases using a biliverdin chromophore
[17]
간행물
A novel phototaxis receptor hidden in the cyanobacterial genome
[18]
논문
Light matters: Phototaxis and signal transduction in unicellular cyanobacteria
[19]
논문
Phototactic motility in the unicellular cyanobacterium Synechocystis sp. PCC 6803
[20]
논문
Novel Putative Photoreceptor and Regulatory Genes Required for the Positive Phototactic Movement of the Unicellular Motile Cyanobacterium Synechocystis sp. PCC 6803
[21]
논문
Evolutionary Conservation of Methyl-Accepting Chemotaxis Protein Location in Bacteria and Archaea
[22]
논문
Light-controlled motility in prokaryotes and the problem of directional light perception
[23]
논문
Photosensory behavior in procaryotes
[24]
논문
Light-induced behavioral responses (;phototaxis') in prokaryotes
[25]
논문
Whole-Genome Analysis of Photosynthetic Prokaryotes
[26]
논문
Ultraviolet radiation and cyanobacteria
[27]
논문
Oxidation of a Cysteine Residue in Elongation Factor EF-Tu Reversibly Inhibits Translation in the Cyanobacterium Synechocystis sp. PCC 6803
[28]
논문
Photoregulation in prokaryotes
[29]
논문
Xanthomonas campestris attenuates virulence by sensing light through a bacteriophytochrome photoreceptor
[30]
논문
Hormogonium Differentiation in the Cyanobacterium Calothrix: A Photoregulated Developmental Process
[31]
논문
Diel Vertical Movements of the Cyanobacterium Oscillatoria terebriformis in a Sulfide-Rich Hot Spring Microbial Mat
[32]
논문
Physiological ecology of cyanobacteria in microbial mats and other communities
https://pure.uva.nl/[...]
[33]
논문
Phototaxis away from blue light by an Escherichia coli mutant accumulating protoporphyrin IX
[34]
논문
Light-induced behavioral responses (;phototaxis') in prokaryotes
[35]
논문
Bacterium photometricum
https://zenodo.org/r[...]
[36]
논문
Making sense of it all: Bacterial chemotaxis
[37]
논문
The green algal eyespot apparatus: A primordial visual system and more?
[38]
논문
Phototactic purple bacteria
[39]
논문
Evolution of phototaxis
[40]
논문
How 5000 independent rowers coordinate their strokes in order to row into the sunlight: Phototaxis in the multicellular green alga Volvox
[41]
간행물
Characteristics of Protists
https://opentextbc.c[...]
OpenStax
[42]
서적
Photomovement
https://books.google[...]
Elsevier
2001-06-19
[43]
논문
Carotenoids in the eyespot apparatus of the flagellate green alga Spermatozopsis similis: Adaptation to the retinal-based photoreceptor
[44]
논문
Subfractionation of eyespot apparatuses from the green alga Spermatozopsis similis : Isolation and characterization of eyespot globules
[45]
논문
Ultrastructure of the Eyespot and its Possible Significance in Phototaxis of Tetracystis excentrica*†
[46]
논문
The eyespot of the flagellate ''Tetraselmis'' cordiformis stein (Chlorophyceae): Structural spezialization of the outer chloroplast membrane and its possible significance in phototaxis of green algae
[47]
논문
Structure and significance of cruciate flagellar root systems in green algae: Comparative investigations in species of ''Chlorosarcinopsis'' (Chlorosarcinales)
[48]
논문
A rhodopsin is the functional photoreceptor for phototaxis in the unicellular eukaryote Chlamydomonas
[49]
논문
Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae
[50]
논문
Channelrhodopsin-2, a directly light-gated cation-selective membrane channel
[51]
논문
Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii
[52]
논문
Channelrhodopsin-1 Initiates Phototaxis and Photophobic Responses in Chlamydomonas by Immediate Light-Induced Depolarization
[53]
논문
Chlamydomonas Sensory Rhodopsins a and B: Cellular Content and Role in Photophobic Responses
[54]
논문
The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa
[55]
논문
Megaphylogeny, Cell Body Plans, Adaptive Zones: Causes and Timing of Eukaryote Basal Radiations
[56]
논문
Ciliary behavior of a negatively phototactic ''Chlamydomonas'' reinhardtii
[57]
논문
Linear systems analysis of the ciliary steering behavior associated with negative-phototaxis in ''Chlamydomonas'' reinhardtii
[58]
논문
Jellyfish nervous systems
2013-07
[59]
서적
Invertebrate zoology : a functional evolutionary approach
[60]
논문
Electrically coupled, photosensitive neurons control swimming in a jellyfish
1977-07-08
[61]
논문
Mechanism of phototaxis in marine zooplankton
2008-11-20
[62]
논문
Spectral Tuning of Phototaxis by a Go-Opsin in the Rhabdomeric Eyes of Platynereis
2015-08
[63]
논문
Expression Dynamics and Protein Localization of Rhabdomeric Opsins in Platynereis Larvae
2013-05-10
[64]
논문
The evolution of eyes and visually guided behavior
2009-08-31
[65]
논문
Eye evolution and its functional basis
2013-04-12
[66]
논문
Ciliary and rhabdomeric photoreceptor-cell circuits form a spectral depth gauge in marine zooplankton
2018-05-29
[67]
논문
Neuronal connectome of a sensory-motor circuit for visual navigation
2014-05-27
[68]
논문
A decision underlies phototaxis in an insect.
2015-08-03
[69]
논문
Orientation in high-flying migrant insects in relation to flows: mechanisms and strategies
2016-08-15
[70]
간행물
Magnetic Compasses in Insects
Elsevier
2010
[71]
뉴스
【親子スクール理科学】なぜ虫は夜、光に集まるの?空間・月などと「勘違い」しているようだよ
https://www.nikkei.c[...]
日本経済新聞
2022-07-09
[72]
서적
Macmillan Dictionary of Life Sciences
Macmillan Press
[73]
서적
Comparative Physiology and Evolution of Vision in Invertebrates- A: Invertebrate Photoreceptors
Springer-Verlag
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
