해당과정
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
해당과정은 포도당이 세포질에서 피루브산으로 분해되는 대사 경로로, 생명체의 에너지 생산에 필수적이다. 19세기 와인 발효 연구에서 시작되어, 루이 파스퇴르, 에두아르트 부흐너 등의 과학자들을 거쳐 20세기 초 오토 마이어호프, 구스타프 엠덴 등에 의해 전체 과정이 밝혀졌다. 해당 과정은 10단계의 효소 반응으로 진행되며, 에너지 투자기(준비기)와 에너지 회수기(보상기)를 거쳐 포도당 1분자당 2분자의 ATP와 2분자의 NADH를 생성한다. 생성된 피루브산은 산소 유무에 따라 젖산 발효, 에탄올 발효 또는 시트르산 회로로 사용된다. 해당과정은 헥소키네이스, PFK-1, 피루브산 키네이스 등 여러 효소에 의해 조절되며, 당뇨병, 유전 질환, 암 등 다양한 질병과 관련된다. 해당 과정에는 엠덴-마이어호프 경로(EM 경로), 엔트너-두도로프 경로(ED 경로) 등 여러 종류가 있다.
더 읽어볼만한 페이지
- 생물학적 과정 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다. - 생물학적 과정 - 혈관신생
혈관신생은 기존 혈관에서 새로운 혈관이 생성되는 생리적 과정으로, 상처 치유, 종양 성장 등 다양한 생리적 현상과 질병에 관여하며, 의학적으로는 혈관 형성 촉진 또는 억제를 위한 치료 표적으로 활용된다. - 대사경로 - 스테로이드
스테로이드는 4개의 융합된 고리 구조를 가지는 유기 화합물로, 콜레스테롤, 스테로이드 호르몬, 담즙산 등 생물학적 활성 분자를 포함하며, 메발론산 경로를 통해 생합성되어 다양한 생리적 기능을 수행하고 의학적으로 사용되지만 오남용 시 부작용을 초래할 수 있다. - 대사경로 - 시트르산 회로
시트르산 회로는 아세틸-CoA를 이산화탄소로 산화시켜 NADH와 FADH₂를 생성, ATP 생산 및 생합성에 기여하며, 탄수화물, 지방, 단백질 대사를 연결하는 중심적인 대사 경로이다. - 세포 호흡 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 세포 호흡 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다.
2. 역사
해당과정 경로는 19세기에 프랑스 와인 산업의 문제 해결을 위한 루이 파스퇴르의 연구에서 시작되었다.[79] 파스퇴르는 발효가 살아있는 미생물에 의해 일어나며, 혐기성 조건보다 호기성 조건에서 효모의 포도당 소비가 감소한다는 사실을 발견했다(파스퇴르 효과).[80]

1890년대 에두아르트 부흐너는 세포가 없는 효모 추출액을 이용해서 포도당을 에탄올로 전환시키는 것이 가능하다는 것을 실험으로 증명했다.[81][82]
1905년~1911년에 아서 하든과 윌리엄 영은 알코올 발효에서 포도당 소비에 대한 ATP의 조절 효과와 해당과정의 중간생성물인 과당 1,6-이중인산의 역할을 밝혀냈다.[84] 이들은 효모 추출액에 포도당을 섞어 배양했을 때 이산화탄소(CO2) 생성량이 증가하다가 감소하는데, 무기인산을 첨가하면 다시 증가하는 것을 보고 과당 1,6-이중인산을 추출했다.
아서 하든과 윌리엄 영은 닉 셰퍼드와 함께 발효를 진행시키기 위해서 열에 민감한 고분자량의 부분(효소)과 열에 민감하지 않은 저분자량의 부분(ADP, ATP, NAD+ 및 다른 보조 인자들)이 함께 필요하다는 것을 밝혀냈다.
1920년대에 오토 마이어호프는 근육 조직에서 해당과정 효소들을 추출하여 글리코젠에서 젖산까지 생성하는 경로를 만들었다.[86][87] 마이어호프와 그의 연구팀은 과당 1,6-이중인산이 2개의 삼탄당 인산으로 분해되는 반응을 연구하여, 해당과정의 가능한 중간생성물에서 1,3-다이포스포글리세르알데하이드를 제외했다.[87]
1930년대에 구스타프 엠덴은 해당과정의 상세한 단계별 개요를 제안했다.[88] 1940년대에 이르러 마이어호프, 엠덴 및 다른 많은 생화학자들이 해당과정의 경로를 완성했다.[87]
3. 반응 순서
해당 과정의 전체 반응식은 다음과 같다.
위 반응식에서 사용된 기호들은 산소 원자, 수소 원자, 전하의 균형이 맞지 않는 것처럼 보이지만, 실제로는 다음과 같이 균형을 이룬다.[6]
해당 과정은 세포 내에서 산소가 충분한 조건(호기성 조건)에서는 시트르산 회로와 전자 전달계를 통해 더 많은 ATP를 생성하는 데 사용된다.
산소가 부족한 조건(혐기성 조건)에서는 해당 과정이 진핵 세포에서 ATP를 생성하는 유일한 경로이며, 많은 혐기성 미생물에게는 가장 중요한 ATP 생산 경로이다.[7] 이러한 혐기성 조건에서 생존을 위해 해당 과정을 계속 진행하려면 NAD+를 재활용해야 하며, 이를 위해 발효 경로가 진화되었다. 발효 경로는 에탄올 발효와 젖산 발효 등이 있다.
해당 과정은 크게 에너지 투자기(준비기)와 에너지 회수기(보상기)의 두 단계로 나눌 수 있다.
3. 1. 에너지 투자기 (준비기)
해당과정의 처음 다섯 단계는 1분자의 포도당을 2분자의 글리세르알데하이드 3-인산(G3P)으로 전환시키는데 에너지를 소비하기 때문에 에너지 투자기(또는 준비기)로 간주된다.[77]
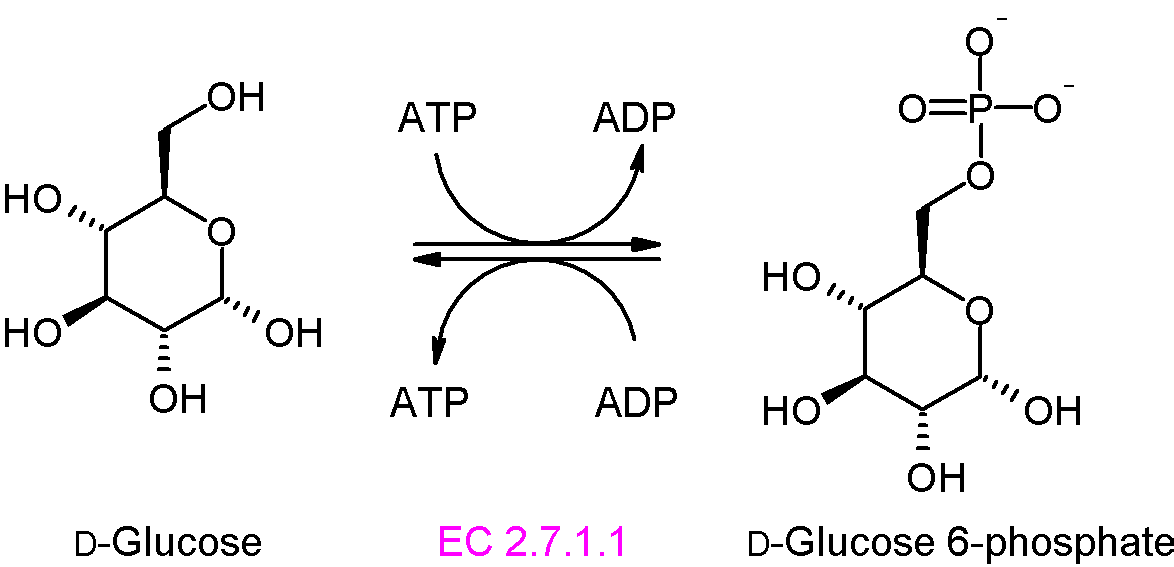
단계 1: 헥소키네이스(글루코키네이스)는 포도당을 인산화하여 포도당 6-인산(G6P)을 생성한다. 이 반응은 ATP를 소모하지만, 포도당의 농도를 낮게 유지하여 세포막 운반체를 통해 세포 내로 포도당이 계속해서 유입될 수 있도록 한다. 또한 포도당이 세포 밖으로 새어나가는 것을 막는다.[77]
동물에서 글루코키네이스라고 불리는 헥소키네이스의 동질효소(isozyme)는 간에서 사용되며, 포도당에 대한 친화도가 훨씬 낮으며 조절 메커니즘도 전혀 다르다.[77]
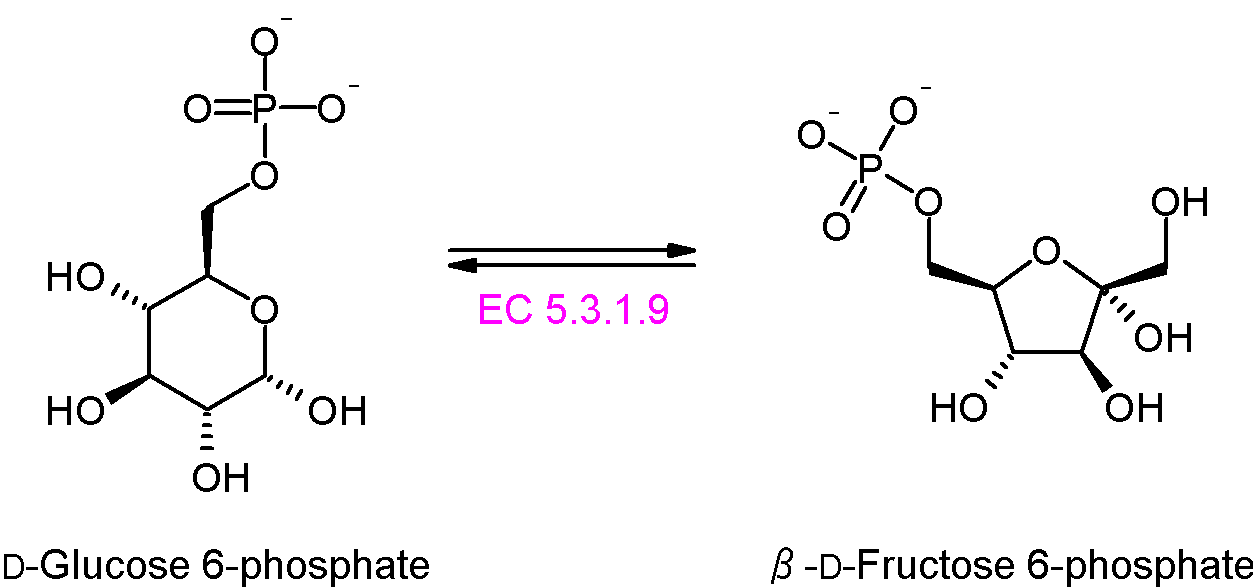
단계 2: 포스포헥소스 이성질화효소는 포도당 6-인산(G6P)을 과당 6-인산(F6P)으로 재배열(이성질화)한다. 이 반응은 정상적인 세포 조건하에서 가역적이다. 그러나 과당 6-인산의 농도가 낮기 때문에 과당 6-인산을 생성하는 쪽으로 반응이 진행된다.[77]
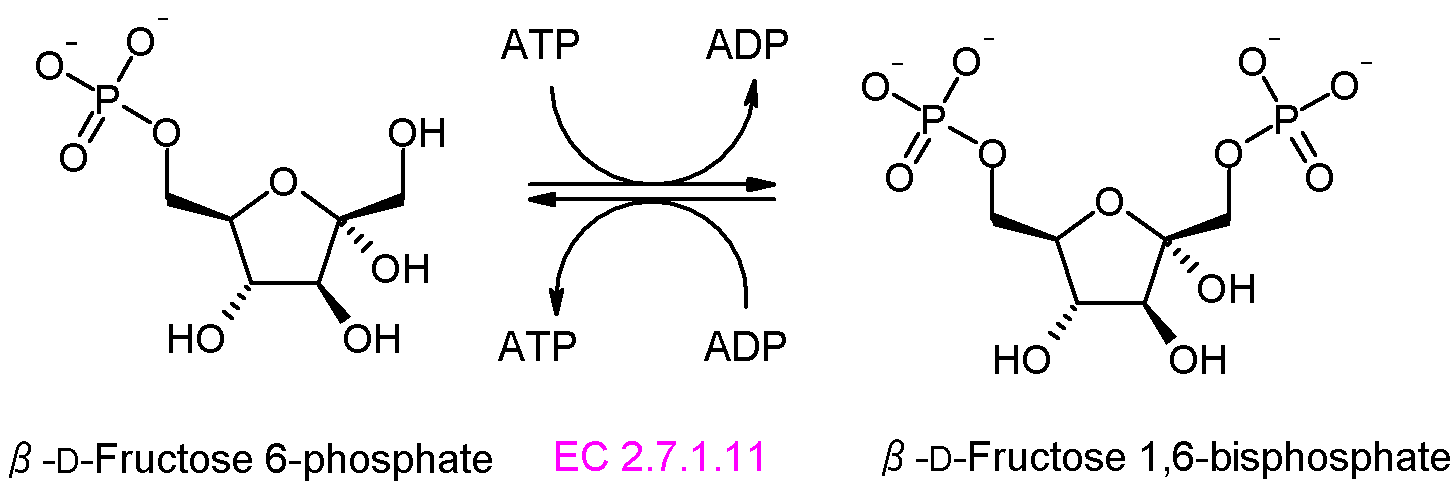
단계 3: 포스포프럭토키네이스-1(PFK-1)은 ATP의 에너지를 소비하여 과당 6-인산을 인산화하여 과당 1,6-이중인산(F1,6BP)을 생성한다. 이 반응은 비가역적이며, 해당 과정의 핵심 조절 지점이자 속도 제한 단계이다.[77]
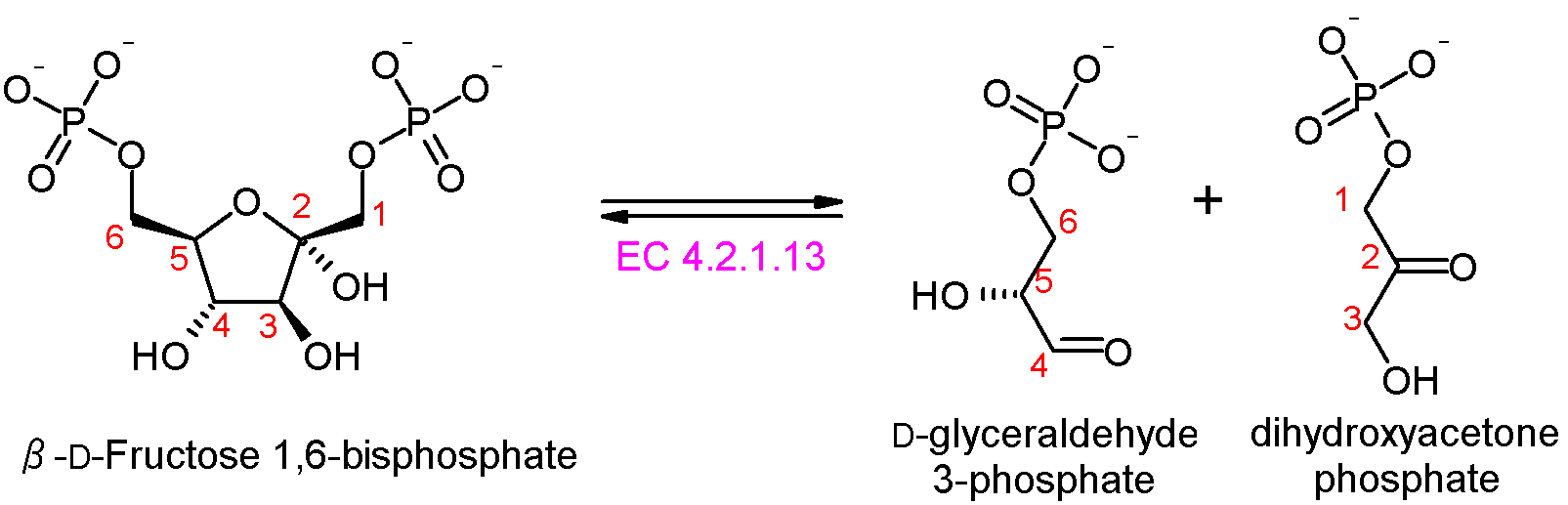
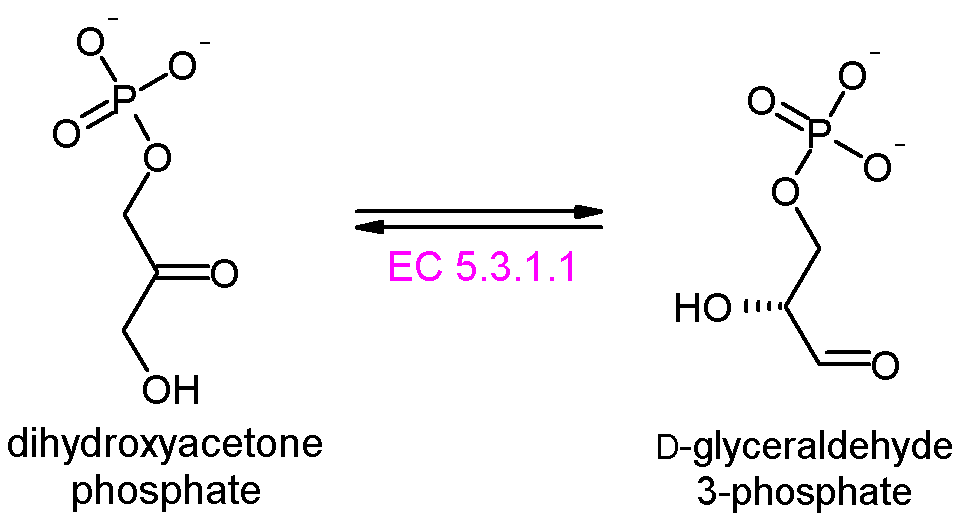
단계 4: 알돌레이스는 과당 1,6-이중인산을 글리세르알데하이드 3-인산(G3P)과 다이하이드록시아세톤 인산(DHAP)으로 분해한다. 알돌레이스에는 두 가지 종류가 있는데, 동물과 식물에 존재하는 I 형 알돌레이스와 균류와 세균에 존재하는 II 형 알돌레이스는 서로 다른 메커니즘을 사용한다.[77]
단계 5: 삼탄당 인산 이성질화효소는 다이하이드록시아세톤 인산을 글리세르알데하이드 3-인산(G3P)으로 빠르게 상호변환시킨다. G3P 만이 해당과정에서 직접적으로 계속 분해될 수 있기 때문에 이 과정은 해당 과정을 단순화 하는데 이점이 있다.
3. 2. 에너지 회수기 (보상기)
해당과정의 후반부 5단계는 에너지 회수기(보상기)로 불리며, 2분자의 글리세르알데하이드 3-인산(G3P)이 2분자의 피루브산으로 전환되는 과정이다. 이 과정에서 포도당 1분자당 4분자의 ATP와 2분자의 NADH가 생성된다.[77]
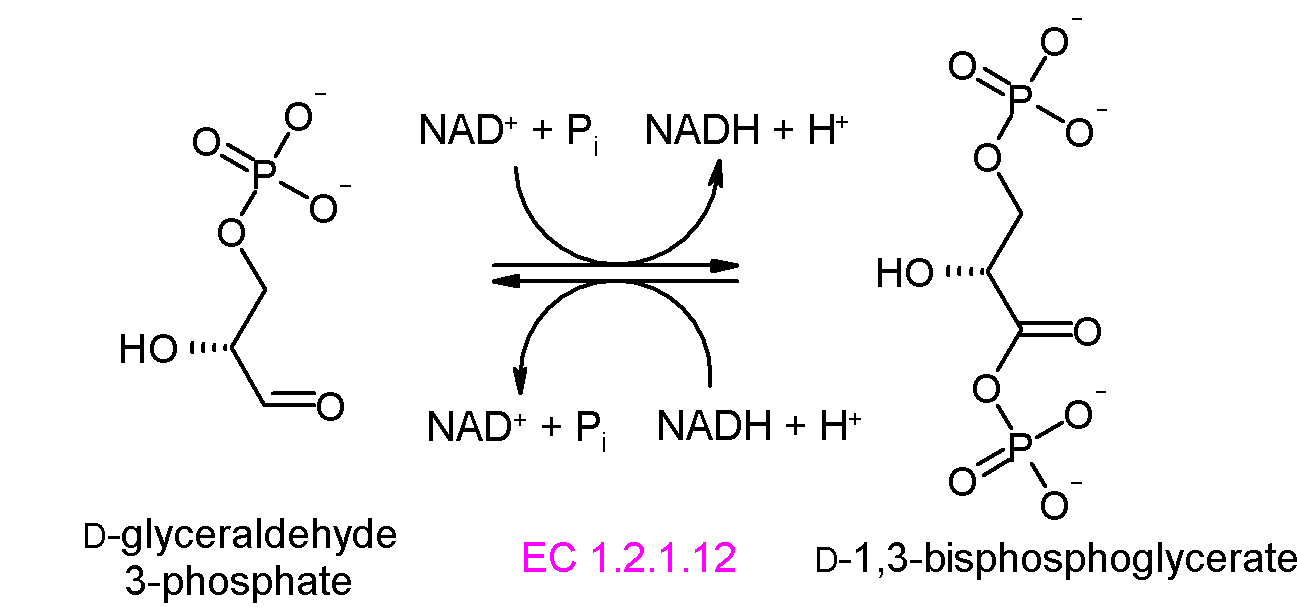
단계 6: 글리세르알데하이드 3-인산 탈수소효소는 글리세르알데하이드 3-인산을 산화시키고 무기인산을 첨가하여 1,3-비스포스포글리세르산(1,3BPG)을 생성한다. 이 과정에서 2분자의 NAD+가 환원되어 2분자의 NADH + H+를 생성한다.[64]
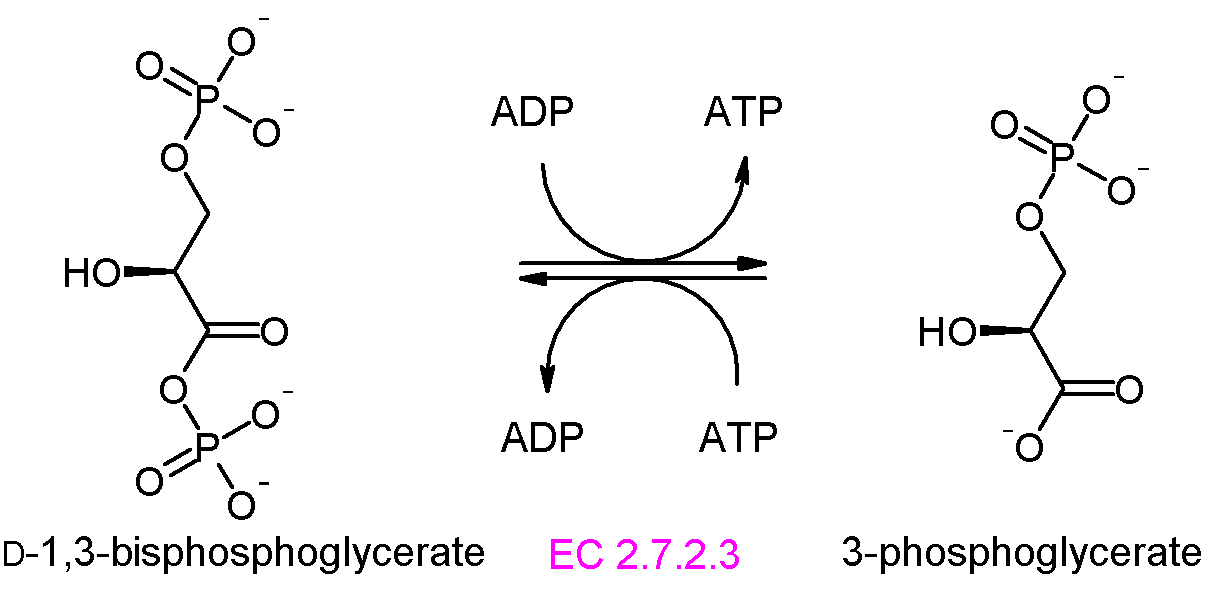
단계 7: 포스포글리세르산 키네이스는 1,3-비스포스포글리세르산에서 ADP로 인산기를 전달하여 ATP와 3-포스포글리세르산(3PG)을 생성한다. 이 단계는 기질수준 인산화의 예시이다.[67]
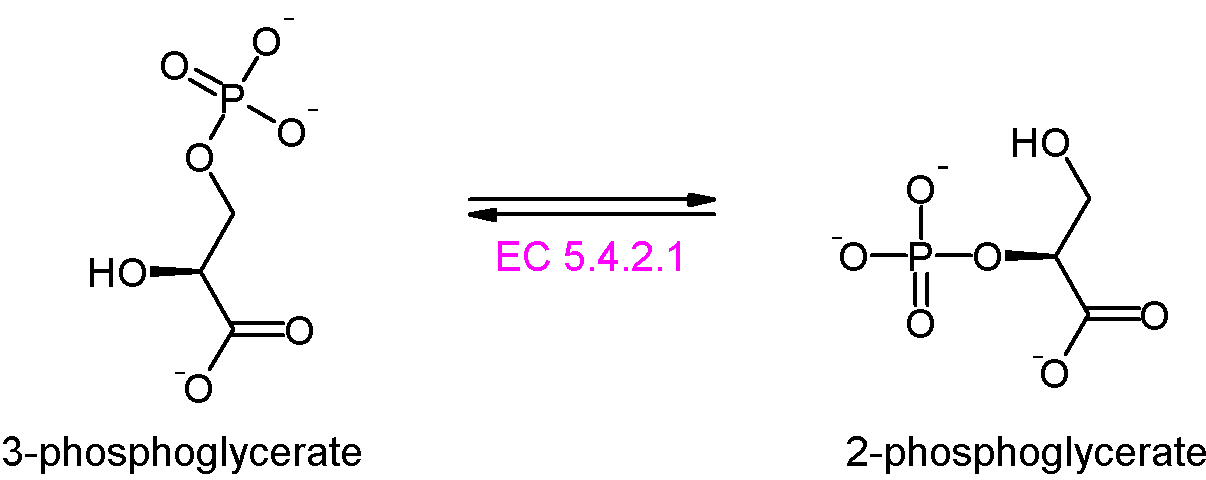
단계 8: 포스포글리세르산 뮤테이스는 3-포스포글리세르산을 2-포스포글리세르산(2PG)으로 이성질화한다.
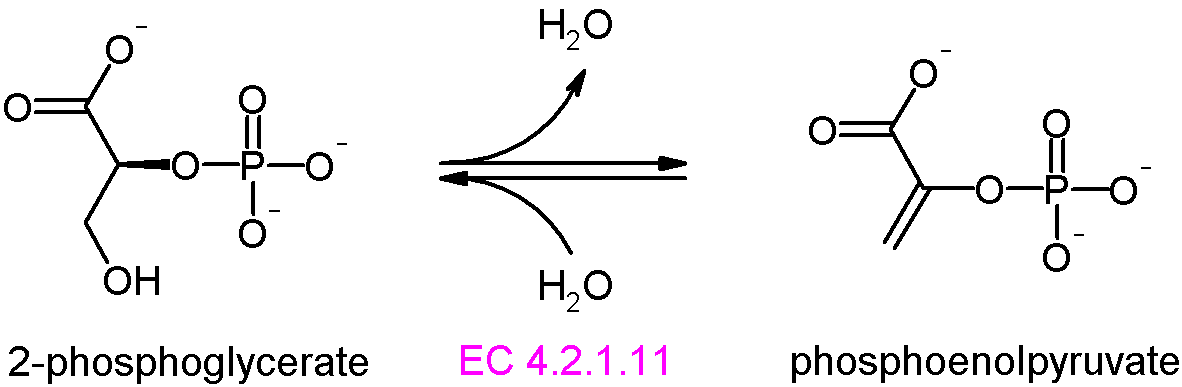
단계 9: 엔올레이스는 2-포스포글리세르산에서 물 분자를 제거하여 포스포엔올피루브산(PEP)을 생성한다.
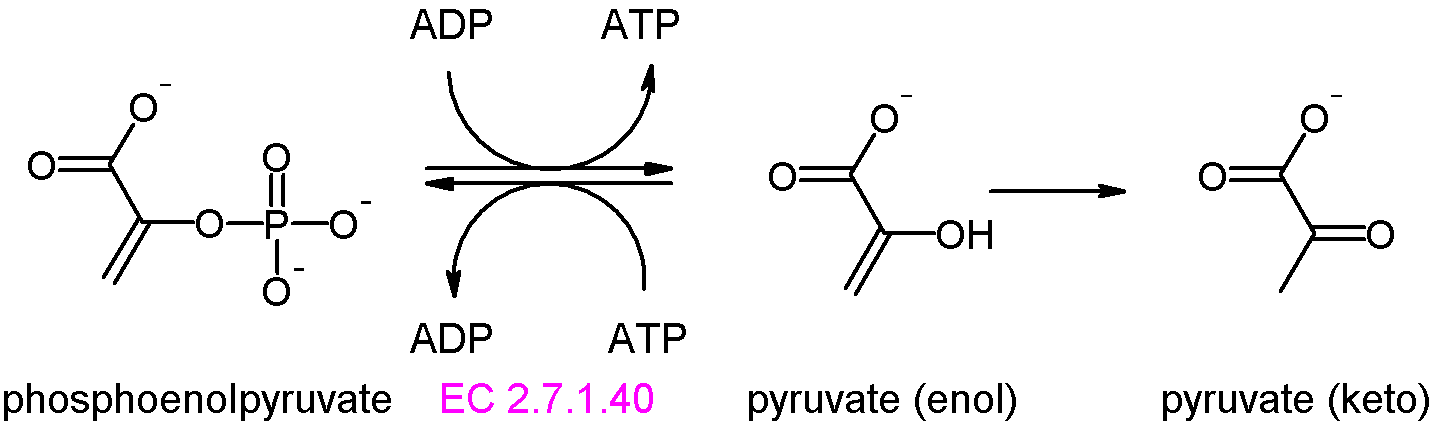
단계 10: 피루브산 키네이스는 포스포엔올피루브산에서 ADP로 인산기를 전달하여 피루브산과 ATP를 생성한다. 이 단계 역시 기질수준 인산화이며, 해당과정의 주요 조절 단계 중 하나이다.[67]
해당과정의 준비기에서 2분자의 ATP가 소비되지만, 에너지 회수기에서 4분자의 ATP가 생성되므로, 해당과정 전체를 통해 포도당 1분자당 2분자의 ATP가 순생산된다.
4. 해당과정의 조절
해당과정의 흐름은 세포 내부 및 외부 조건에 따라 조절된다. 해당과정을 조절하는 내부 요인은 주로 세포의 필요에 따라 적절한 양의 ATP을 공급하는 것이다. 외부 요인은 주로 식사 후에 혈액에서 많은 양의 포도당을 이동시킬 수 있는 간, 지방 조직, 근육에 작용한다(조직 유형에 따라 과량의 포도당을 지방 또는 글리코젠으로 저장하여 고혈당을 방지한다). 간은 또한 식사 사이, 단식 중이나 운동 중에 글리코젠 분해 및 포도당신생합성을 통해 혈액으로 포도당을 방출하여 저혈당을 방지할 수 있다.[97]
4가지 조절 효소는 헥소키네이스, 글루코키네이스, 포스포프럭토키네이스-1, 피루브산 키네이스이다.
동물에서는 간과 이자에서 혈당량을 조절하는 것이 항상성 유지의 중요한 부분이다. 이자의 β 세포는 혈당 농도에 민감하다.[96] 혈당 농도가 상승하면 인슐린이 혈액으로 방출되어 특히 간에 영향을 미치고, 지방세포와 근육세포는 혈액으로부터 포도당을 흡수한다. 혈당량이 떨어지면 이자의 β 세포가 인슐린 생성을 멈추고, 인접한 이자의 α 세포에서 혈액으로 글루카곤을 방출하도록 자극한다.[96] 이것은 저장되어 있는 글리코젠 분해와 포도당신생합성을 통해 간에서 혈액으로 포도당을 방출하게 한다. 혈당량의 저하가 급격하거나 심하면 다른 포도당 센서로 인해 부신 속질에서 혈액으로 에피네프린이 방출된다. 에피네프린은 포도당 대사에서 글루카곤과 동일한 작용을 하지만 그 효과는 더욱 두드러진다.[96] 글루카곤과 에피네프린은 간에서 해당과정, 지방산 합성, 콜레스테롤 합성, 포도당신생합성, 글리코젠 분해 대사 경로에서 핵심적인 속도 제한 효소들의 인산화를 일으킨다. 인슐린은 이러한 효소들에 대해 반대되는 효과를 나타낸다.[97] 이러한 효소들의 인산화와 탈인산화(궁극적으로 혈당량에 반응함)는 간, 지방세포 및 근육세포에서 이들 대사 경로들이 조절되는 지배적인 방식이다. 따라서 포스포프럭토키네이스-2(PFK-2)의 인산화는 해당과정을 억제하고, 인슐린의 작용을 통한 포스포프럭토키네이스-2의 탈인산화는 해당과정을 촉진한다.[97]
또한 헥소키네이스와 글루코키네이스는 다른 조직세포로 포도당의 흡수 조절에 호르몬 작용과는 별개로 작동한다. 헥소키네이스는 세포의 포도당 6-인산의 양에, 글루코키네이스는 혈당량에 반응하여 다른 조직에서 해당 과정의 세포 내 조절을 수행한다.[97]
모든 세포에는 헥소키네이스가 존재하는데, 이는 세포로 들어온 포도당을 포도당 6-인산으로 전환되는 것을 촉매한다. 세포막은 포도당 6-인산을 통과시키지 않기 때문에, 헥소키네이스는 본질적으로 포도당을 인산화시켜서 세포 안으로 들어온 포도당을 세포 밖으로 빠져나가지 않도록 붙잡아둔다. 헥소키네이스는 세포 내에서 높은 농도의 포도당 6-인산에 의해 저해된다. 따라서 세포 내로 포도당이 유입되는 속도는 부분적으로 포도당 6-인산이 해당과정과 글리코젠 합성(간과 근육 같은 글리코젠을 저장하는 세포에서)에 의해 처리되는 속도에 달려있다.[97][99]
헥소키네이스와는 달리 글루코키네이스는 포도당 6-인산에 의해 저해되지 않는다. 글루코키네이스는 간에 존재하며 혈액 중에 포도당이 풍부할 때 간세포로 들어오는 포도당을 인산화시켜 포도당 6-인산을 형성한다. 이것은 간에서 일어나는 해당과정에 대해 추가적인 조절 단계로 작용한다.[97]
포스포프럭토키네이스-1(PFK-1)는 비가역적인 반응을 촉매하며, 핵심적인 다른자리입체성 조절자인 AMP와 과당 2,6-이중인산(F2,6,BP)를 가지기 때문에 포스포프럭토키네이스는 해당과정에서 주요 조절 지점이다.
과당 6-인산(F6P)이 포스포프럭토키네이스-2(PFK-2)에 의해 인산화될 때 합성되는 과당 2,6-이중인산(F2,6BP)은 포스포프럭토키네이스-1(PFK-1)의 매우 강력한 활성인자이다. 간에서 혈당이 낮고, 글루카곤이 cAMP를 증가시키면, 포스포프럭토키네이스-2(PFK-2)는 단백질 키네이스 A에 의해 인산화된다. 포스포프럭토키네이스-2(PFK-2)와 과당 2,6-이중인산가수분해효소(FBPase-2)는 2가지 기능을 가진 단일 단백질이며, 이 단백질에 존재하는 2가지 다른 효소의 활성부위가 각각의 기능을 수행한다. 글루카곤과 에피네프린은 둘 다 간에서 cAMP의 농도를 증가시킨다. 간에서 과당 2,6-이중인산(F2,6BP)의 농도가 낮으면 포스포프럭토키네이스-1(PFK-1)의 활성이 감소하고, 과당 1,6-이중인산가수분해효소(FBPase-1)의 활성은 증가하므로 포도당신생합성(본질적으로 "해당과정의 역반응")이 촉진된다. 따라서 간은 글루카곤과 에피네프린에 반응하여 포도당을 혈액으로 방출시켜 혈당량을 증가시킨다.
ATP는 포스포프럭토키네이스-1(PFK-1)의 알로스테릭 조절 자리를 두고 AMP와 경쟁한다. 세포의 ATP 농도는 AMP의 농도보다 훨씬 더 높으며, 일반적으로 100배 더 높지만,[100] 정상적인 생리 조건하에서 ATP의 농도는 10% 이상 변하지 않는 반면에 ATP가 10% 감소하면 AMP는 6배 증가한다.[101] 따라서 ATP가 알로스테릭 조절인자라는 것은 상당히 의심스럽다. AMP의 증가는 세포의 에너지 생산이 감소한 결과다.
시험관 내의 실험에서 시트르산은 ATP의 억제효과를 강화하여 포스포프럭토키네이스-1(PFK-1)을 억제한다. 그러나 세포질에서 시트르산은 주로 지방산 합성 및 콜레스테롤 합성을 위한 아세틸-CoA로의 전환에 이용되기 때문에 시험관 내에서의 실험이 생체 내에서 의미있는 효과를 가질지는 의심스럽다.
피루브산 키네이스는 피루브산과 ATP를 생성하는 해당과정의 마지막 단계를 촉매한다. 피루브산 키네이스는 포스포엔올피루브산(PEP)에서 ADP로 인산기를 전이시키는 반응을 촉매하여 1분자의 피루브산과 1분자의 ATP를 생성시킨다.
에피네프린과 글루카곤은 단백질 키네이스 A를 통해 간에 있는 피루브산 키네이스를 간접적으로 조절한다. 단백질 키네이스 A는 간의 피루브산 키네이스를 인산화시켜 비활성 상태로 만든다. 근육의 피루브산 키네이스는 에피네프린으로 인한 단백질 키네이스 A의 활성화에 의해 저해되지 않는다. 단식 중일 때와 같이 포도당을 이용할 수 없는 상황에서는 글루카곤이 분비된다. 따라서 단식 중일 때 해당과정은 간에서 억제되지만, 근육에서는 영향을 받지 않는다. 혈당량이 증가하면 인슐린이 분비되고, 인단백질 인산가수분해효소 I (phosphoprotein phosphatase I)이 활성화되고 피루브산 키네이스가 탈인산화되어 활성화된다. 이러한 조절은 피루브산 키네이스가 촉매하는 반응과 이에 대한 역반응(피루브산 카복실화효소와 포스포엔올피루브산 카복시키네이스)이 동시에 활성화되어 낭비 회로가 되는 것을 방지한다.
5. 해당과정 이후의 대사 과정
해당과정에서 생성된 피루브산은 세포의 종류와 산소 유무에 따라 다른 대사 경로로 이어진다.
발효를 하는 대부분의 세포는 NAD+를 재생하기 위해 추가 반응을 수행하여 에탄올이나 젖산을 만든다. 많은 세균들은 NAD+ 재생을 위해 무기화합물을 전자수용체로 사용한다.[7]
산소 호흡을 하는 세포는 해당과정보다 훨씬 많은 ATP를 합성한다. 산소 호흡의 추가 반응들은 해당과정에서 생성된 피루브산과 NADH + H+를 사용한다. 진핵생물에서 산소 호흡은 포도당 1분자당 대략 32분자의 ATP를 생성하지만, 이 ATP의 대부분은 산화적 인산화로 만들어진다.[7]
산소가 부족하면 무산소 호흡으로 대사 흐름이 바뀌는데, 이때 포도당 1분자당 ATP 생산량은 산소 호흡보다 적다.
5. 1. 무산소 조건
해당과정은 계속해서 일어나려면 NAD+가 필요하지만, 해당과정 결과 NAD+는 고갈되고 NADH가 생성된다. 따라서 해당과정을 계속 진행시키기 위해 생물은 NADH를 다시 NAD+로 산화시켜야 한다. 이는 외부 전자수용체의 이용 가능 여부에 따라 달라진다.[7]젖산 발효에서는 피루브산이 젖산으로 환원되며, 이 과정에서 NADH가 NAD+로 산화된다.[70]
:피루브산 + NADH + H+ → 젖산 + NAD+
젖산 발효는 요구르트를 만드는 데 이용되는 세균에서 일어나며, 산소가 부족한 근육과 같은 저산소 상태의 동물에서도 일어난다. 젖산 발효는 많은 조직에서 에너지 생성을 위한 최후의 수단이다. 젖산 발효에서 포도당 1분자당 2분자의 ATP가 생성되며, 이는 산화적 인산화를 통해 ATP를 생성하는 속도의 약 100배이다. 그러나 H+가 근육에 축적되면 세포질의 pH가 낮아져 해당과정에 관여하는 효소를 억제하게 된다.[70]
효모와 같은 일부 생물은 에탄올 발효라는 과정에서 NADH를 NAD+로 전환시킨다. 에탄올 발효에서는 피루브산이 먼저 아세트알데하이드와 이산화 탄소로 변환된 다음 에탄올로 전환된다. 젖산 발효와 에탄올 발효는 산소가 없을 때 일어날 수 있으며, 이러한 혐기성 발효는 많은 단세포 생물이 해당과정을 유일한 에너지 공급원으로 사용할 수 있게 한다.[7]
혐기성 세균은 세포 호흡에서 최종 전자수용체로 다양한 화합물을 사용한다. 이러한 화합물에는 질산, 아질산 같은 질소화합물, 황산, 아황산, 이산화황, 황 같은 황화합물, 이산화 탄소, 철화합물, 망간화합물, 코발트화합물, 우라늄화합물 등이 있다.[70]
5. 2. 산소 조건
호기성 생물에서 산소가 충분한 조건에서는 해당과정의 최종 산물인 피루브산이 미토콘드리아 기질로 이동하여 피루브산의 산화 과정을 거쳐 아세틸-CoA로 전환된다. 이 과정에서 이산화탄소(CO2)가 방출되고, NAD+는 NADH + H+로 환원된다.[104]아세틸-CoA는 시트르산 회로(또는 크렙스 회로)로 들어가 산화되어 CO2, NADH + H+, FADH2, 그리고 GTP(또는 ATP)를 생성한다.[104]
미토콘드리아 내막에 있는 전자전달계를 통해 NADH + H+와 FADH2에서 방출된 전자는 최종 전자수용체인 산소(O2)에 전달되어 물(H2O)을 형성한다. 이 과정에서 방출되는 에너지는 미토콘드리아 내막을 경계로 수소 이온(H+)의 농도 기울기를 형성하는 데 사용된다.[104]
H+의 농도 기울기는 산화적 인산화 과정에서 사용된다. NADH + H+ 1분자가 산화될 때 약 2.5분자의 ATP가, FADH2 1분자가 산화될 때 약 1.5분자의 ATP가 생성된다.[104]
6. 다른 대사 경로와의 연관성
해당과정은 탄수화물을 지방산과 콜레스테롤로 전환하는 데 중요한 역할을 한다.[105] 해당과정의 중간생성물들은 오탄당 인산 경로, 글리코젠 합성, 지방산 합성, 콜레스테롤 합성, 아미노산 합성, 뉴클레오타이드 합성 등 다양한 대사 경로에 사용된다. 해당과정과 포도당신생합성은 많은 중간생성물들을 공유하지만, 동시에 활성화될 수 없다.[108]
7. 질병과의 연관성
해당과정은 여러 질병과 관련이 있다.
해당 과정 효소의 돌연변이는 드물지만, 일부 유전 질환은 만성 용혈성 빈혈을 유발할 수 있다. 대표적인 예로 피루브산 키나아제 결핍증이 있다.[20] ACSF3 결핍으로 인한 복합 말론산 및 메틸말론산뇨증(CMAMMA)에서는 해당 작용이 50% 감소하는데, 이는 피루브산 탈수소 효소 복합체 및 α-케토글루타르산 탈수소 효소 복합체와 같은 미토콘드리아 효소의 리포일화 감소 때문에 발생한다.
7. 1. 당뇨병
Diabetes mellitus영어 (당뇨병) 환자는 인슐린 저항성 또는 인슐린 부족으로 인해 세포가 포도당을 제대로 흡수하지 못하여 고혈당증이 발생한다. 간세포는 포도당신생합성을 통해 이러한 고혈당증에 더욱 기여하게 된다. 간세포 내에서의 해당과정은 간에서 포도당 생산 조절에 관여하며, 포도당이 간에서 과잉생산될 경우 고혈당증이 발생한다.[109]7. 2. 유전 질환
해당과정 효소의 돌연변이는 드물지만, 피루브산 키나아제 결핍증과 같은 일부 유전 질환은 만성 용혈성 빈혈을 유발할 수 있다.[20]7. 3. 암
암세포는 정상 세포보다 해당과정 속도가 10배 빠르다. 이를 바르부르크 효과라고 부른다.[110][111] 대부분의 암세포는 성장 초기에 충분한 산소를 공급받지 못하는 환경에서 자라기 때문에, ATP를 만들기 위해 해당과정과 같은 혐기성 대사 과정에 의존한다.[110]일부 암세포는 해당과정의 특정 효소들을 많이 만들어 해당과정 속도를 높인다. 이 효소들은 해당과정 효소의 동질효소로, 피드백 억제에 대한 민감성이 다양하다. 해당과정 활성이 증가하면 혐기성 대사 경로에서 충분한 ATP를 생성하여 저산소증의 영향을 상쇄한다.[110]
암세포에서 해당과정이 빠른 것은 의학적으로 매우 유용하다. 양전자 방출 단층촬영(PET)을 이용해 방사성 동위원소로 변형된 헥소키네이스 기질인 2-18F-2-디옥시글루코스(FDG)를 흡수시켜 암세포 위치를 정확하게 진단할 수 있다.[112][113]
해당과정을 억제하여 암을 치료하는 연구도 진행 중이다. 케톤생성 식이요법을 포함한 다양한 방법으로 암세포를 굶겨 죽일 수 있다.[114]
8. 해당 과정의 종류
해당 과정은 크게 엠덴-마이어호프 경로(EM 경로)와 변형 EM 경로로 나눌 수 있다.
; 엠덴-마이어호프 경로 (EM 경로)
엠덴-마이어호프 경로(EM 경로)는 진핵생물과 혐기성 진정세균에서 주로 사용하는 당 대사계이다. 10여 종의 효소가 관여하며, 무산소 상태에서도 에너지원인 ATP를 생산할 수 있다.
호기성 생물에서는 호기성 호흡의 첫 단계로 사용되며, 피루브산을 거쳐 시트르산 회로로 이어진다. 무산소 상태에서는 피루브산이 젖산이나 에탄올 등의 유기산으로 변환된다. 이는 피루브산을 젖산으로 환원시켜 EM 경로를 계속 진행하는 데 필요한 NAD+를 보충하기 위해서다. 발효 과정(젖산 발효, 에탄올 발효 등)은 해당 과정에서 일어난다.
호기성 생물이라도 과도한 운동 등으로 시트르산 회로의 처리 능력을 넘어서는 ATP가 필요할 때는 해당 과정을 통한 ATP 합성이 활발해진다. 이때 시트르산 회로에서 미처 처리하지 못한 피루브산이 젖산으로 전환되어 혈중 젖산 농도가 높아진다. 과거에는 근섬유에 쌓인 젖산이 운동 후 근육통의 원인으로 여겨졌으나, 최근에는 근섬유의 미세 손상이 근육통의 주원인이라는 견해가 지배적이다.
EM 경로에서는 4분자의 ATP가 생성되지만, 포도당과 과당 6-인산의 인산화에 2분자의 ATP가 소모되므로, 포도당 1분자당 2분자의 ATP가 순생산된다. 또한 전자 전달계에서 사용되는 NADH 2분자도 생성된다.
; 변형 EM 경로
일부 고세균(혐기성 유리아키오타에 속하는 테르모코쿠스강과 메타노코쿠스강)은 EM 경로와 유사하지만 다른 대사 경로를 사용한다. 글리세르알데히드 3-인산에서 포스포글리세르산으로 가는 경로가 우회되는 점이 가장 큰 차이점이다. 이 때문에 변형 EM 경로에서는 원래 생성되어야 할 ATP가 생성되지 않는다.
하지만 포스포에놀피루브산의 탈인산화 과정에서 ADP 대신 AMP가 소모되고 ATP가 생성되므로, 전체적인 ATP 수지는 일반 EM 경로와 같다. 포스포에놀피루브산 탈인산화에 사용되는 AMP는 포도당과 과당 6-인산의 인산화 과정에서 ATP 대신 ADP가 소모되면서 공급된다는 점도 EM 경로와 다르다.
참조
[1]
논문
Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question
2014-12-18
[2]
논문
Evolution of carbohydrate metabolic pathways
[3]
논문
Non-enzymatic glycolysis and pentose phosphate pathway-like reactions in a plausible Archean ocean
2014-04
[4]
서적
Bacterial Physiology and Metabolism
[5]
웹사이트
Glycolysis – Animation and Notes
http://pharmaxchange[...]
2011-09-20
[6]
논문
Metabolic acidosis and the importance of balanced equations
[7]
서적
Molecular Biology of the Cell
Garland Science
2014-11-18
[8]
논문
A history of research on yeasts 5: the fermentation pathway
2003-04
[9]
웹사이트
Louis Pasteur and Alcoholic Fermentation
http://www.pasteurbr[...]
2016-02-23
[10]
논문
Yeast fermentation and the making of beer and wine.
http://www.nature.co[...]
2010-01
[11]
논문
The background to Eduard Buchner's discovery of cell-free fermentation
1971-03-01
[12]
웹사이트
Eduard Buchner - Biographical
https://www.nobelpri[...]
2016-02-23
[13]
서적
New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge
Publicacions de la Universitat de València
[14]
서적
Bios 302
http://www.bioc.rice[...]
[15]
웹사이트
Otto Meyerhof - Biographical
https://www.nobelpri[...]
2016-02-23
[16]
논문
Otto Fritz Meyerhof and the elucidation of the glycolytic pathway
2005-01
[17]
웹사이트
Embden, Gustav – Dictionary definition of Embden, Gustav {{!}} Encyclopedia.com: FREE online dictionary
http://www.encyclope[...]
2016-02-23
[18]
논문
Pyrophosphate:D-fructose 6-phosphate 1-phosphotransferase. A new enzyme with the glycolytic function of 6-phosphofructokinase
1974-12
[19]
논문
Comparative analysis of Embden-Meyerhof and Entner-Doudoroff glycolytic pathways in hyperthermophilic archaea and the bacterium Thermotoga
1997-04
[20]
서적
Biochemistry
Cengage Learning
[21]
서적
Biochemistry
Freeman
[22]
서적
Biochemistry
Thomson Brooks/Cole
[23]
논문
Regulation of glycolytic flux and overflow metabolism depending on the source of energy generation for energy demand
2019-03
[24]
논문
Coordination of microbial metabolism
2014-05
[25]
서적
Hypoxia
Springer US
1999
[26]
논문
Transcriptional control of genes that regulate glycolysis and gluconeogenesis in adult liver
1994-10
[27]
논문
Regulation of gene expression by glycolytic and gluconeogenic enzymes
2022-03
[28]
논문
Regulation and control of metabolic fluxes in microbes
2011-08
[29]
논문
The Protein Interactome of Glycolysis in ''Escherichia coli''
2021-04
[30]
논문
The phosphocarrier protein HPr of the bacterial phosphotransferase system globally regulates energy metabolism by directly interacting with multiple enzymes in ''Escherichia coli''
2017-08
[31]
논문
Post-translational modifications as key regulators of bacterial metabolic fluxes
2015-04
[32]
논문
A reappraisal of the blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus-syndrome X complex
2003-06
[33]
서적
Biochemistry.
W.H. Freeman and Company
1995
[34]
서적
Biochemistry.
W.H. Freeman and Company
1995
[35]
서적
Fundamentals of Biochemistry
https://archive.org/[...]
John Wiley and Sons, Inc.
[36]
논문
The contents of adenine nucleotides, phosphagens and some glycolytic intermediates in resting muscles from vertebrates and invertebrates
1975-10
[37]
서적
Biochemistry
John Wiley & Sons, Inc.
2004
[38]
서적
TIGAR
Oxford University Press
[39]
논문
TIGAR, a p53-inducible regulator of glycolysis and apoptosis
2006-07
[40]
웹사이트
TIGAR TP53 induced glycolysis regulatory phosphatase [Homo sapiens (human)] - Gene - NCBI
https://www.ncbi.nlm[...]
2018-05-17
[41]
논문
Pyruvate kinase. Classes of regulatory isoenzymes in mammalian tissues
1973-08
[42]
논문
The allosteric regulation of pyruvate kinase
2000-06
[43]
논문
Pyruvate kinase: Function, regulation and role in cancer
2015-07
[44]
논문
The regulation of liver pyruvate kinase by phosphorylation--dephosphorylation
Elsevier
1978
[45]
서적
Biochemistry
W.H. Freeman and Company
1995
[46]
서적
Biochemistry
W.H. Freeman and Company
1995
[47]
서적
Biochemistry
W.H. Freeman and Company
1995
[48]
서적
Biochemistry
W.H. Freeman and Company
1995
[49]
논문
Metabolism
https://portlandpres[...]
2020-10-08
[50]
서적
Biochemistry.
W.H. Freeman and Company
1995
[51]
논문
Glycolysis in the control of blood glucose homeostasis
2012-08-01
[52]
논문
The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism
https://www.scienced[...]
2019-11-01
[53]
논문
Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question
2014
[54]
논문
Evolution of Tumor Metabolism might Reflect Carcinogenesis as a Reverse Evolution process (Dismantling of Multicellularity)
2011-07
[55]
서적
Lehninger principles of biochemistry
https://archive.org/[...]
W.H. Freeman
2005
[56]
웹사이트
What is Cancer?
http://thepathogenes[...]
2011-10
[57]
논문
Positron-emission tomography with [18F]fluorodeoxyglucose. Part I. Biochemical uptake mechanism and its implication for clinical studies
2000-10
[58]
웹사이트
PET Scan: PET Scan Info Reveals ...
http://www.petscanin[...]
2005-12-05
[59]
논문
Out of Warburg effect: An effective cancer treatment targeting the tumor specific metabolism and dysregulated pH
2017-04
[60]
논문
The Warburg Effect and the Hallmarks of Cancer
2017
[61]
논문
Restricted calorie ketogenic diet for the treatment of glioblastoma multiforme
2013-08
[62]
논문
The polygonal model: A simple representation of biomolecules as a tool for teaching metabolism
2018-01
[63]
논문
微生物の糖代謝経路に見られる新規な進化学的関係
[64]
서적
ホートン生化学(第3版)
東京化学同人
2003-09
[65]
서적
レーニンジャーの新生化学[上]‐第4版‐
廣川書店
2006-10
[66]
서적
マクマリー 生化学反応機構 ‐ケミカルバイオロジー理解のために‐
東京化学同人
2007-09
[67]
문서
피ルビン산 키나제의 작용에 의해 우선 에ノール 형 피ルビン산이 생성되지만 세포 내에서는 빠르게 케토 형으로 이성화된다.
[68]
웹사이트
クエン酸回路(TCA回路)
http://www.sc.fukuok[...]
[69]
논문
新たな乳酸の見方
2006
[70]
서적
閉塞性動脈硬化症(PAD)診療の実践
http://www.nankodo.c[...]
南江堂
2009
[71]
논문
The rhythm of yeast
http://onlinelibrary[...]
2003-10
[72]
웹인용
10 Steps of Glycolysis
http://biology.about[...]
2018-05-14
[73]
서적
Webster's New International Dictionary of the English Language
Merriam Company
[74]
저널
Evolution of carbohydrate metabolic pathways
[75]
저널
Non-enzymatic glycolysis and pentose phosphate pathway-like reactions in a plausible Archean ocean
2014-04
[76]
서적
Bacterial Physiology and Metabolism
[77]
웹인용
Glycolysis – Animation and Notes
http://pharmaxchange[...]
2018-05-14
[78]
저널
A history of research on yeasts 5: the fermentation pathway
2003-04
[79]
웹인용
Louis Pasteur and Alcoholic Fermentation
http://www.pasteurbr[...]
2016-02-23
[80]
웹인용
Yeast, Fermentation, Beer, Wine
http://www.nature.co[...]
2016-02-23
[81]
저널
The background to Eduard Buchner's discovery of cell-free fermentation
https://link.springe[...]
1971-03-01
[82]
웹인용
Eduard Buchner - Biographical
https://www.nobelpri[...]
2016-02-23
[83]
서적
New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge
[84]
서적
Bios 302
[85]
서적
New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge
[86]
웹인용
Otto Meyerhof - Biographical
https://www.nobelpri[...]
2016-02-23
[87]
저널
Otto Fritz Meyerhof and the Elucidation of the Glycolytic Pathway
http://www.jbc.org/c[...]
2005-01-28
[88]
웹인용
Embden, Gustav – Dictionary definition of Embden, Gustav {{!}} Encyclopedia.com: FREE online dictionary
http://www.encyclope[...]
2016-02-23
[89]
저널
Pyrophosphate: D-fructose 6-phosphate 1-phosphotransferase. A new enzyme with the glycolytic function 6-phosphate 1-phosphotransferase
[90]
저널
Comparative analysis of Embden-Meyerhof and Entner-Doudoroff glycolytic pathways in hyperthermophilic archaea and the bacterium ''Thermotoga''
[91]
저널
Metabolic acidosis and the importance of balanced equations
[92]
서적
Biochemistry
Cengage Learning; 5 edition
[93]
서적
Biochemistry
Freeman
[94]
서적
Biochemistry
https://archive.org/[...]
Thomson Brooks/Cole
[95]
서적
Biochemistry
https://archive.org/[...]
Thomson Brooks/Cole
[96]
저널
Topical Review: A reappraisal of the blood glucose homeostat which comprehensively explains the type 2 diabetes-syndrome X complex
2003
[97]
서적
In: Biochemistry.
W.H. Freeman and Company
1995
[98]
서적
Biochemistry.
https://archive.org/[...]
W.H. Freeman and Company
1995
[99]
서적
Fundamentals of Biochemistry, 2nd Edition
John Wiley and Sons, Inc.
[100]
저널
The contents of adenine nucleotides, phosphagens and some glycolytic intermediates in resting muscles from vertebrates and invertebrates
[101]
서적
Biochemistry 3rd Edition
John Wiley & Sons, Inc.
[102]
서적
TIGAR
https://archive.org/[...]
Oxford University Press
[103]
저널
TIGAR, a p53-Inducible Regulator of Glycolysis and Apoptosis
http://www.cell.com/[...]
2006-07-16
[104]
서적
In: Biochemistry.
W.H. Freeman and Company
1995
[105]
서적
In: Biochemistry.
W.H. Freeman and Company
1995
[106]
서적
In: Biochemistry.
W.H. Freeman and Company
1995
[107]
서적
In: Biochemistry.
W.H. Freeman and Company
1995
[108]
서적
Biochemistry.
https://archive.org/[...]
W.H. Freeman and Company
1995
[109]
저널
Glycolysis in the control of blood glucose homeostasis
https://www.scienced[...]
2012-08-01
[110]
서적
Lehninger principles of biochemistry
W.H. Freeman
2005
[111]
웹인용
What is Cancer?
http://thepathogenes[...]
2012-09-08
[112]
웹인용
PET Scan: PET Scan Info Reveals ...
http://www.petscanin[...]
2005-12-05
[113]
웹인용
4320139 549..559
http://biogenomica.c[...]
2005-12-05
[114]
저널
Restricted Calorie Ketogenic Diet for the Treatment of Glioblastoma Multiforme
http://intl-jcn.sage[...]
2013-05
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com