피루브산 키네이스
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
피루브산 키네이스는 해당과정의 마지막 단계에서 포스포엔올피루브산으로부터 피루브산을 생성하고, 아데노신 이인산을 아데노신 삼인산으로 인산화하는 효소이다. 척추동물에는 L, R, M1, M2의 4가지 동질효소가 존재하며, L형과 R형은 PKLR 유전자, M1형과 M2형은 PKM2 유전자로부터 발현된다. 피루브산 키네이스는 다른 자리 입체성 조절, 공유결합성 변형, 호르몬 및 유전자 발현 조절을 받으며, 과당 1,6-이중인산, ATP, 알라닌 등의 물질에 의해 활성 또는 억제된다. 피루브산 키네이스 결핍증, 암, 당뇨병 등 다양한 질병과 관련되어 연구되며, 2형 당뇨병 치료제인 메트포르민은 피루브산 키네이스에 간접적인 영향을 미친다.
더 읽어볼만한 페이지
- EC 2.7.1 - 키네이스
키네이스는 ATP의 인산기를 기질에 전달하는 효소로, 세포 신호 전달과 질병에 관여하며 키나아제 억제제 연구의 대상이다. - EC 2.7.1 - 글루코키네이스
글루코키네이스는 헥소키나아제 IV 또는 D라고도 불리는 효소로, 특정 포유류 조직에서 포도당 인산화에 관여하여 혈당을 조절하며, 특히 간에서 글리코겐 합성 및 해당 과정을, 췌장에서는 인슐린과 글루카곤 분비를 조절하고, 유전자 돌연변이는 당뇨병과 관련되어 제약 회사에서 당뇨병 치료를 위한 활성화 분자 연구를 진행 중이다. - 해당 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 해당 - 글루코스
글루코스는 6개의 탄소 원자를 가진 단당류로, D-글루코스 이성질체는 덱스트로스라고도 불리며 생물체의 에너지원, 식물의 광합성 생산물, 그리고 다양한 탄수화물의 구성 성분으로서 중요한 역할을 한다.
2. 척추동물의 동질효소
척추동물에서는 피루브산 키네이스의 네 가지 주요 동질효소가 발현된다. 이들은 각각 L형(간), R형(적혈구), M1형(근육 및 뇌), 그리고 M2형(초기 태아 조직 및 대부분의 성인 조직)으로 구분된다.[43] L형과 R형 동질효소는 ''PKLR'' 유전자에서 발현되며 다른 자리 입체성 조절을 받는 특징이 있다.[43][80][3] 반면, M1형과 M2형 동질효소는 ''PKM2'' 유전자에서 선택적 스플라이싱을 통해 생성된다.[43][82][83][5][6][45][46]
2. 1. L형 및 R형 동질효소
척추동물의 피루브산 키네이스에는 L형(간), R형(적혈구), M1형(근육, 뇌), M2형(초기 태아 조직, 대부분 성인 조직)의 네 가지 동질효소가 존재한다. 이 중 L형과 R형 동질효소는 ''PKLR'' 유전자로부터 발현되며[43], M1형 및 M2형 동질효소와는 달리 다른 자리 입체성 조절을 받는다는 점에서 구별된다.[43]효소 반응속도론적으로 L형과 R형 동질효소는 두 가지 뚜렷한 입체구조 상태를 가진다. 하나는 기질 친화성이 높은 상태이고, 다른 하나는 기질 친화성이 낮은 상태이다.
- R-상태: 높은 기질 친화성을 특징으로 하는 활성화된 형태이다. 포스포엔올피루브산(PEP)과 과당 1,6-이중인산(FBP)에 의해 안정화되어 해당과정 경로를 촉진한다.[43]
- T-상태: 낮은 기질 친화성을 특징으로 하는 비활성화된 형태이다. 아데노신 삼인산(ATP)과 알라닌에 의해 결합되고 안정화되며, 이는 피루브산 키네이스의 인산화를 유발하여 해당과정을 억제하는 결과를 낳는다.[43]
2. 2. M1형 및 M2형 동질효소
M1형과 M2형 동질효소는 PKM2 유전자로부터 발현된다. 이 두 동질효소는 PKM2 유전자의 선택적 스플라이싱 과정을 통해 만들어지는데, PKM1은 엑손 9번을 포함하고 PKM2는 엑손 10번을 포함한다.[82][83][5][6][45][46] 이 스플라이싱 차이로 인해 두 동질효소는 카복시 말단의 56개 아미노산 서열(아미노산 378번부터 434번까지) 중 23개의 아미노산만 다르다.[82][83][5][6][45][46] PKM2 유전자의 발현은 이종 리보뉴클레오타이드 단백질(hnRNP)인 hnRNPA1과 hnRNPA2 등에 의해 조절된다.[84][7][47]구조적으로 M2형 동질효소는 사량체 또는 이량체 형태로 존재할 수 있다. 사량체는 기질인 포스포엔올피루브산(PEP)에 대한 친화력이 높은 활성 형태이고, 이량체는 친화력이 낮은 비활성 형태에 가깝다. M2형의 활성은 인산화를 통해 조절될 수 있는데, 활성이 높은 사량체가 인산화되면 활성이 낮은 이량체로 전환될 수 있다.[81][4][44] 또한 M2형은 과당 1,6-이중인산(FBP)에 의해 다른 자리 입체성 조절을 받는다.[85][8][48]
반면, M1형 동질효소는 주로 사량체 형태로만 존재하며 FBP에 의한 다른 자리 입체성 조절을 받지 않는다는 점에서 M2형과 차이가 있다.[85][8][48] 이러한 구조 및 조절 방식의 차이는 M1형과 M2형 사이의 아미노산 서열 차이에서 비롯된다.[85][8][48] 참고로, 간(L형)과 적혈구(R형)에서 발현되는 피루브산 키네이스 동질효소(PKLR 유전자 산물)는 M1/M2형과 달리 다른 자리 입체성 조절을 받는다는 특징이 있다.[80][3][43]
3. 세균의 동질효소
대장균을 포함한 많은 장내세균과 세균들은 피루브산 키네이스의 두 가지 동질효소인 PykA와 PykF를 가진다. 대장균의 경우, 이 두 효소의 아미노산 서열 동일성은 37%이다 (PykA, PykF).
이 효소들은 진핵생물에서와 마찬가지로, 해당과정의 마지막 단계에서 ADP와 포스포엔올피루브산(PEP)을 이용하여 ATP를 생성하는 반응을 촉매한다. 이 반응은 생리적 조건 하에서는 비가역적으로 일어난다.
PykF는 과당 1,6-이중인산(FBP)에 의해 다른 자리 입체성 조절을 받는데, 이는 세포 대사에서 PykF가 중심적인 역할을 수행함을 보여준다.[86] 또한 대장균에서 PykF의 전사는 전사 조절 인자인 Cra (FruR)에 의해 조절된다.[87][88][89]
4. 반응
피루브산 키네이스는 주로 해당과정의 마지막 단계를 촉매하는 효소로 작용한다. 이 반응에서는 포스포엔올피루브산(PEP)과 아데노신 이인산(ADP)을 기질로 사용하여 피루브산과 아데노신 삼인산(ATP)를 생성한다.[91][14] 이 반응은 에너지 생성 과정에서 중요한 단계이며, 세포 내에서 비가역적으로 진행되어 해당과정의 전체 속도를 조절하는 주요 지점 중 하나이다.[93][17]
또한, 피루브산 키네이스는 간에서 포도당을 합성하는 대사 경로인 포도당신생합성을 조절하는 데에도 관여한다. 특정 생리적 조건, 예를 들어 단식 상태에서는 피루브산 키네이스의 활성이 억제된다. 이는 포스포엔올피루브산이 피루브산으로 전환되는 것을 막아 포도당신생합성 경로로 유도함으로써, 혈당 유지에 기여한다. 이처럼 피루브산 키네이스는 세포의 에너지 상태와 대사 요구에 따라 그 활성이 조절되는 중요한 효소이다.
4. 1. 해당과정
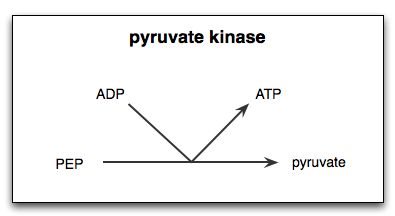
피루브산 키네이스가 촉매하는 반응은 해당과정의 마지막 단계이다. 이 반응은 두 단계로 진행된다. 첫째, 포스포엔올피루브산(PEP)은 인산기를 ADP로 전달하여 ATP와 피루브산의 엔올 형태(또는 에놀레이트)를 생성한다. 둘째, 세포가 필요로 하는 기능적 형태의 피루브산을 만들기 위해 피루브산의 엔올 형태(또는 에놀레이트)에 양성자가 첨가되어야 한다.[91][14]
피루브산 키네이스의 기질은 단순한 당인산이고 생성물은 ATP이기 때문에, 이 효소는 해당과정의 진화를 가능하게 한 기초 효소 중 하나이며 지구상 모든 생명체에서 가장 오래된 효소 중 하나일 수 있다. 원시 바다에서는 포스포엔올피루브산이 비생물학적으로 존재했을 가능성이 있으며, 원시적인 삼탄당 해당과정 경로에서 높은 수율로 생성되는 것으로 나타났다.[15]
효모 세포에서 효모 피루브산 키네이스(YPK)와 포스포엔올피루브산 및 다른 자리 입체성 조절 인자인 과당 1,6-이중인산(FBP)의 상호작용은 Mg2+의 존재 하에 향상된다. 따라서 Mg2+는 피루브산 키네이스에 의한 포스포엔올피루브산의 피루브산으로의 전환 반응에서 중요한 보조 인자로 작용한다. 또한, 금속 이온인 Mn2+는 Mg2+와 유사하지만 효모 피루브산 키네이스에 더 강한 영향을 미치는 것으로 나타났다. 피루브산 키네이스의 금속 결합 부위에 이러한 금속 이온이 결합하면 반응 속도가 증가한다.[92][16]
이 반응은 해당과정의 3가지 속도 제한 단계 중 하나이다. 속도 제한 단계는 대사 경로의 전체 속도를 결정하는 느리고 조절되는 단계이다. 해당과정에서 속도 제한 단계는 ATP의 가수분해 또는 ADP의 인산화와 짝지어져 경로가 에너지적으로 유리하고 세포 내에서 본질적으로 비가역적이 되도록 한다. 이 마지막 단계는 피루브산이 추가적인 대사 경로를 위한 중요한 중간생성물이기 때문에 고도로 조절되며 의도적으로 비가역적이다.[93][17] 생성된 피루브산은 호기성 조건에서는 추가적인 ATP 생성을 위해 시트르산 회로(TCA 회로)로 들어가거나, 혐기성 조건에서는 젖산 또는 에탄올로 전환된다.[93][17]
4. 2. 포도당신생합성
피루브산 키네이스는 간에서 피루브산 및 다른 기질들로부터 포도당을 생성하는 대사 경로인 포도당신생합성을 조절하는 효소로도 작용한다. 포도당신생합성은 직접적인 포도당 비축분이 소진되는 단식이나 기아 상태에서 뇌와 적혈구에 포도당을 공급하기 위해 비탄수화물 공급원을 이용하는 중요한 과정이다.[78] 단식 중에는 피루브산 키네이스의 활성이 억제된다. 이는 포스포엔올피루브산(PEP)이 피루브산으로 전환되는 것을 막아, PEP가 포도당신생합성에 사용되도록 유도하는 역할을 한다. 대신, PEP는 일련의 포도당신생합성 반응들을 통해 포도당으로 전환된다. 포도당신생합성은 해당과정과 일부 동일한 효소를 사용하지만, 단순히 해당과정의 역반응은 아니다. 오히려 해당과정의 비가역적인 단계를 우회하는 별도의 경로이다. 또한, 포도당신생합성과 해당과정은 세포 신호전달을 통해 상호적으로 조절되기 때문에, 세포 내에서 동시에 활발하게 일어나지 않는다. 포도당신생합성 경로를 통해 최종적으로 생성된 포도당은 간에서 혈액으로 방출되어, 단식 상태일 때 중요한 조직에 에너지를 공급한다.5. 조절
해당과정은 세 가지 주요 효소 반응 단계에서 엄격하게 조절된다. 첫 번째는 헥소키네이스에 의한 포도당의 인산화, 두 번째는 포스포프럭토키네이스에 의한 과당 6-인산의 인산화, 그리고 세 번째는 피루브산 키네이스에 의한 포스포엔올피루브산(PEP)에서 ADP로의 인산기 전이 반응이다.[56] 이 세 반응은 일반적인 세포 조건 하에서 비가역적 반응이며, 자유 에너지 변화가 커서 해당과정 전체의 속도를 조절하는 핵심 지점 역할을 한다.[56]
피루브산 키네이스의 활성은 여러 메커니즘을 통해 정교하게 조절된다. 주요 조절 방식으로는 다른 자리 입체성 조절, 공유결합성 변형, 그리고 호르몬에 의한 조절이 있다.[56] 이 중에서도 과당 1,6-이중인산(FBP)은 피루브산 키네이스의 가장 중요한 다른 자리 입체성 효과인자로 작용하여 효소 활성을 조절한다.[56]
5. 1. 다른 자리 입체성 조절
다른 자리 입체성 조절은 효소의 활성 부위가 아닌 다른 부위에 효과인자 분자가 결합하여 효소의 입체구조 및 활성을 변화시키는 조절 방식이다. 피루브산 키네이스의 활성은 이러한 다른 자리 입체성 조절을 통해 광범위하게 조절된다.피루브산 키네이스는 과당 1,6-이중인산(FBP)에 의해 다른 자리 입체적으로 활성화되고, ATP와 알라닌에 의해 다른 자리 입체적으로 불활성화된다.[94][18][57] 또한, 피루브산 키네이스의 사량체(네 개의 소단위체로 구성된 형태) 형성은 FBP와 세린에 의해 촉진되는 반면, 사량체의 해리는 L-시스테인에 의해 촉진된다.[95][96][97][19][20][21][58][59][60]
이 중 과당 1,6-이중인산(FBP)은 피루브산 키네이스의 가장 중요한 다른 자리 입체성 조절 인자이다. FBP는 해당과정에서 과당 6-인산이 인산화되어 생성되는 중간생성물이다. FBP는 피루브산 키네이스의 특정 부위(도메인 C)에 있는 다른 자리 입체성 결합 부위에 결합한다. 이 결합은 효소의 입체구조를 변화시켜 피루브산 키네이스의 활성을 크게 증가시킨다.[98][22][61]
FBP는 해당과정 경로의 앞 단계에서 생성되어 뒷 단계 효소인 피루브산 키네이스를 활성화시키므로, 이는 피드포워드 자극의 예시에 해당한다. 즉, 해당과정의 흐름이 원활하여 FBP의 농도가 높아지면, 피루브산 키네이스의 활성이 더욱 증가하여 해당과정 전체 속도를 높이는 역할을 한다. 피루브산 키네이스는 FBP의 효과에 매우 민감하며, ATP나 알라닌 등에 의한 다른 조절 메커니즘은 FBP 조절 효과에 더해 부가적인 미세 조정을 하는 것으로 여겨진다.[86][99][9][23][49][62]
5. 2. 공유결합성 변형
공유결합성 변형은 효소의 인산화, 탈인산화, 아세틸화, 석시닐화, 산화 등을 통해 효소 활성을 간접적으로 조절하는 방식이다.[100][24][63]특히 간에서는 호르몬에 의한 조절이 두드러진다. 혈당량이 낮을 때 분비되는 글루카곤과 스트레스 상황에서 분비되는 에피네프린(아드레날린)은 단백질 키네이스 A(PKA)를 활성화시킨다.[101][25][64] 활성화된 PKA는 피루브산 키네이스를 인산화하여 효소 활성을 억제(불활성화)한다.[101][25][64]
반대로, 식사 후 혈당량이 높아지면 췌장에서 인슐린이 분비된다. 인슐린은 단백질 포스파타아제 1(PP1, 인단백질 인산가수분해효소 I)을 활성화시킨다.[101][25][64] 활성화된 PP1은 인산화된 피루브산 키네이스에서 인산기를 제거하는 탈인산화 과정을 촉진하여 효소 활성을 높이고(활성화), 결과적으로 해당과정을 촉진한다.[101][25][64]
이러한 공유결합성 변형을 통한 조절 메커니즘은 포도당신생합성 경로의 효소들에게는 반대 효과를 나타낸다. 즉, 해당과정이 활발할 때는 포도당신생합성이 억제되고, 반대의 경우에는 포도당신생합성이 활발해진다. 이를 통해 피루브산 키네이스와 포도당신생합성 관련 효소들이 동시에 활성화되어 불필요하게 에너지를 소모하는 헛수고 회로(futile cycle)가 발생하는 것을 방지한다.[101][25][64]
5. 3. 호르몬 조절
피루브산 키네이스의 활성은 호르몬에 의해서도 조절된다. 특히 간에서는 호르몬 조절이 중요한 역할을 한다.[101]글루카곤과 에피네프린(아드레날린)은 혈당 수치가 낮을 때 분비되어 단백질 키네이스 A를 활성화시키며, 이는 피루브산 키네이스를 인산화하여 효소 활성을 억제한다.[101] cAMP 역시 글루카곤과 에피네프린 신호 전달 경로의 일부로 작용하여 피루브산 키네이스를 저해한다.[103] 이러한 호르몬들의 작용은 해당과정을 억제하고, 반대로 포도당신생합성을 촉진하는 효과를 낸다.[101][103]
반대로, 혈당 수치가 높을 때 분비되는 인슐린은 인단백질 인산가수분해효소 1 Protein phosphatase 1영어을 활성화시킨다. 이 효소는 인산화된 피루브산 키네이스를 탈인산화시켜 효소를 다시 활성화한다.[101] 따라서 인슐린은 해당과정을 촉진하고 포도당신생합성을 억제하는 역할을 한다.[101][103]
이처럼 호르몬에 의한 피루브산 키네이스 조절은 해당과정과 포도당신생합성이 동시에 일어나 에너지를 소모하는 낭비 회로(헛된 회로)가 발생하는 것을 막는 중요한 기작이다.[101][103] 호르몬 간의 상호작용은 세포 내 에너지 대사 경로의 균형을 유지하는 데 필수적이다.[103]
5. 4. 유전자 발현 조절
탄수화물 반응요소 결합단백질(ChREBP)은 피루브산 키네이스 L 동질효소의 유전자 전사를 조절하는 중요한 전사 인자이다.[30][102] ChREBP는 세포 내 포도당 농도와 cAMP 농도에 따라 활성이 조절된다. 포도당 농도가 높으면 ChREBP가 활성화되어 핵 안으로 이동하고, 피루브산 키네이스 L 동질효소 유전자의 전사를 촉진한다.[31][102] 반대로 cAMP 농도가 높으면 ChREBP가 억제되어 전사가 감소한다.[102] 이 조절 과정에는 ChREBP 단백질의 특정 부위(Ser196, Thr666)에 대한 인산화 및 탈인산화가 관여한다.[102] 높은 포도당은 탈인산화를 유도하여 ChREBP를 활성화시키고, 높은 cAMP는 인산화를 유도하여 ChREBP를 비활성화시킨다.[102][31] 포도당 6-인산 또한 ChREBP 활성화에 기여할 수 있다.[30][32]이질 리보핵단백질 입자(hnRNP)는 PKM 유전자의 선택적 스플라이싱 과정에 영향을 주어 M1과 M2 동질효소의 발현을 조절한다.[84][105][28] M1과 M2 동질효소는 PKM 유전자로부터 만들어지지만, 스플라이싱 과정에서 서로 다른 엑손(M1은 엑손 9, M2는 엑손 10)이 포함되어 만들어지는 변이체이다.[82][83] hnRNPA1, hnRNPA2와 같은 특정 hnRNP 단백질들은 저산소증과 같은 특정 조건에서 핵 안으로 이동하여 M2 동질효소의 발현을 증가시키는 방향으로 스플라이싱을 조절한다.[84][105][28]
또한, 호르몬도 PKM2 동질효소의 발현에 영향을 미친다. 인슐린은 PKM2의 발현을 증가시키는 반면, 트리요오드티로닌(T3)이나 글루카곤과 같은 호르몬은 PKM2의 발현을 감소시킨다.[106][29]
6. 임상적 활용
피루브산 키네이스는 세포 대사 과정에서 중요한 역할을 담당하는 효소로, 이 효소의 기능 이상은 여러 질병과 관련되어 임상적으로 주목받고 있다.
유전적으로 피루브산 키네이스에 결함이 생기면 피루브산 키네이스 결핍증이 발생할 수 있다. 이 질환은 특히 적혈구와 같이 미토콘드리아가 없는 세포에서 에너지(ATP) 생산을 저해하여 용혈성 빈혈을 유발하는 주요 원인이 된다.[107][70][108][71]
또한, 피루브산 키네이스의 활성은 다양한 요인에 의해 조절되거나 저해될 수 있으며, 이는 특정 질병의 발생 기전과 연관되기도 한다. 예를 들어, 활성산소는 피루브산 키네이스 M2 동질효소(PKM2)를 산화시켜 비활성화시키는데, 이는 암 발생과 관련될 수 있다.[109][110][72][73] 페닐알라닌에 의한 효소 활성 저해는 유전 질환인 페닐케톤뇨증(PKU) 환자에게서 나타나는 뇌 손상 기전의 일부로 여겨진다.[111][112] 제2형 당뇨병 치료에 사용되는 메트포르민과 같은 약물도 직접적이지는 않지만 세포 내 에너지 상태 변화를 통해 간접적으로 피루브산 키네이스 활성에 영향을 미칠 수 있다.[104][27][66]
특히 암 연구 분야에서 피루브산 키네이스는 중요한 대상으로 다뤄진다. 많은 암세포에서 특정 동질효소인 PKM2의 발현이 증가하며, 이는 암세포의 빠른 성장과 증식에 필요한 물질대사 변화에 기여하는 것으로 알려져 있다. PKM2는 암세포의 해당과정 조절뿐만 아니라, 핵 내에서 유전자 발현 조절에도 관여하며, 혈청 내 PKM2 수치는 잠재적인 종양표지자로서 연구되고 있다.[85][8][113][39][76][48]
6. 1. 피루브산 키네이스 결핍증
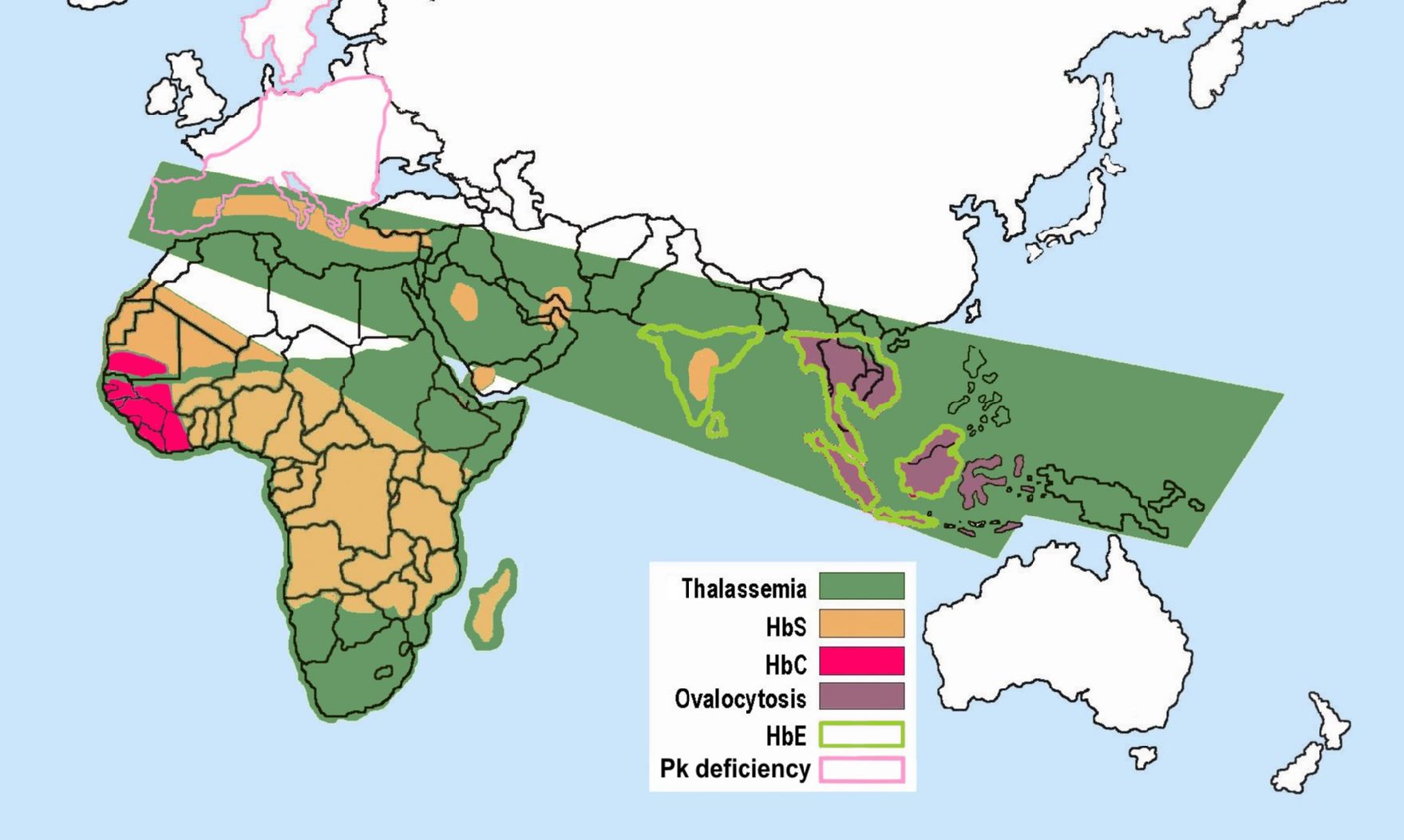
피루브산 키네이스의 유전적 결함은 피루브산 키네이스 결핍증이라는 질병을 유발한다. 이 질환에서는 피루브산 키네이스가 부족하여 해당과정의 속도가 느려진다. 이러한 영향은 미토콘드리아가 없는 세포, 예를 들어 적혈구에서 특히 치명적이다. 미토콘드리아가 없는 세포는 시트르산 회로(TCA 회로)를 이용할 수 없어 혐기성 해당과정을 유일한 에너지(ATP) 공급원으로 사용해야 하기 때문이다. 피루브산 키네이스가 결핍된 적혈구는 ATP가 부족해져 쉽게 파괴되는 용혈을 겪을 수 있다. 따라서 피루브산 키네이스 결핍은 만성 비구형적혈구 용혈성 빈혈(chronic nonspherocytic hemolytic anemia, CNSHA)을 유발할 수 있다.[107][70]
피루브산 키네이스 결핍증은 상염색체 열성 방식으로 유전된다. 포유류는 PK-LR과 PK-M이라는 두 가지 피루브산 키네이스 유전자를 가지고 있다. 이 중 PK-LR 유전자는 간과 적혈구에서 발현되는 피루브산 키네이스 동질효소 L형과 R형을 암호화하고, PK-M 유전자는 근육 등 다른 조직에서 발현되는 M1형 동질효소를 암호화한다. 피루브산 키네이스 결핍증은 적혈구에 영향을 미치므로, PK-LR 유전자의 돌연변이와 관련이 있다. 현재까지 250가지 이상의 PK-LR 유전자 돌연변이가 발견되었으며, 이들이 피루브산 키네이스 결핍증의 원인이 되는 것으로 확인되었다. DNA 검사를 통해 1번 염색체에 위치한 PK-LR 유전자를 확인할 수 있으며, 직접적인 DNA 염기서열 분석을 통해 피루브산 키네이스 결핍증을 분자 수준에서 진단할 수 있다.[108][71]
6. 2. 피루브산 키네이스 저해
활성산소(ROS)는 화학적으로 반응성이 높은 산소 형태로, 사람의 폐 세포에서 피루브산 키네이스 M2 동질효소(PKM2)를 억제하는 것으로 밝혀졌다. 활성산소는 PKM2의 Cys358 잔기를 산화시켜 효소를 비활성화시킨다. PKM2가 비활성화되면, 포도당 대사 흐름은 피루브산으로 전환되는 대신 오탄당 인산 경로로 우회하게 된다. 이 경로는 활성산소를 감소시키고 해독하는 데 필요한 물질을 생성한다. 그러나 이러한 과정은 결과적으로 폐 세포 내 산화 스트레스를 증가시켜 잠재적으로 종양 형성을 촉진할 수 있다. 이는 PKM2의 조절 메커니즘이 암세포가 산화 스트레스에 저항하고 종양 성장을 강화하는 데 관여할 수 있음을 시사한다.[109][110][72][73]페닐알라닌은 뇌에서 피루브산 키네이스의 경쟁적 저해제로 작용한다. 페닐알라닌에 의한 저해 정도는 태아 세포와 성인 세포에서 유사하게 나타나지만, 태아의 뇌 세포에 있는 효소가 성인의 효소보다 저해에 훨씬 더 민감하다. 유전 질환인 페닐케톤뇨증(PKU)을 앓는 아기의 경우, 혈중 페닐알라닌 수치가 비정상적으로 높으며 PKM2의 활성이 감소하는 것으로 관찰되었다. 이러한 페닐알라닌에 의한 피루브산 키네이스 저해는 페닐케톤뇨증 환자에게서 나타나는 뇌 손상 메커니즘의 일부일 수 있다.[111][112]
메트포르민은 제2형 당뇨병 치료에 주로 사용되는 약물이다. 메트포르민은 피루브산 키네이스 활성에 직접적인 영향을 주지는 않지만, 포도당신생합성을 억제함으로써 간접적으로 영향을 미친다. 메트포르민은 세포 내 ATP 농도를 감소시킨다. ATP는 피루브산 키네이스의 다른자리 입체성 저해제(allosteric inhibitor)로 작용하기 때문에, ATP 농도가 감소하면 피루브산 키네이스에 대한 저해 효과가 약해져 결과적으로 효소 활성이 증가하게 된다. 이렇게 증가된 피루브산 키네이스 활성은 포도당 대사 흐름을 포도당신생합성보다는 해당과정 쪽으로 유도하는 효과를 나타낸다.[104][27][66]
6. 3. 암에서의 역할
암세포는 특징적으로 대사 기구를 가속화시키며, 피루브산 키네이스는 암에서 중요한 역할을 하는 것으로 여겨진다. 건강한 세포와 비교했을 때, 암세포는 피루브산 키네이스 M2 동질효소(PKM2), 특히 낮은 활성을 보이는 이량체 형태의 수준이 높게 나타난다.[85][8] 이 때문에 혈청 내 PKM2 수치는 암 진단을 위한 종양표지자로 사용되기도 한다.[8] 낮은 활성의 PKM2 이량체는 기질인 포스포엔올피루브산(PEP)의 축적을 유발하고, 이는 해당과정의 중간 산물 농도를 높여 암세포가 성장과 증식에 필요한 생체분자 합성에 사용하도록 한다.[85][8]또한, MAPK1(ERK2)와 같은 단백질 키네이스에 의해 PKM2가 인산화되면 구조적 변화가 일어나 핵 안으로 이동할 수 있게 된다. 핵으로 이동한 PKM2는 종양 형성에 필요한 해당과정 관련 유전자들의 유전자 발현을 조절하는 역할을 한다.[113][39][76]
일부 연구에서는 암 발생 과정에서 PKM1 동질효소 대신 PKM2 동질효소의 발현이 우세해지는 전환 현상이 나타난다고 보고한다.[85][8][76] 종양 미세환경의 특징 중 하나인 저산소증 상태는 저산소 유도 인자(HIF)와 같은 전사인자를 활성화시킨다. 활성화된 전사인자는 PKM2의 전사를 촉진하며, 이는 다시 자신의 전사를 더욱 증가시키는 양성 피드백 고리를 형성하여 암세포의 생존과 성장에 기여한다.[85][8][48]
7. 대체 효소
피루브산 키네이스와 유사한 기능을 가진 가역적인 효소로 피루브산 인산 다이키네이스(PPDK)가 있다. 이 효소는 일부 세균에서 발견되며, 여러 혐기성 진핵생물 그룹(예: ''스트레블로마스틱스'', ''지아르디아'', ''엔트아메바'', ''트리코모나스'')에서도 확인된다. 진핵생물에서 PPDK가 발견되는 것은 수평적 유전자 전이를 통해 전달된 결과로 보이며, 이러한 전이는 두 번 이상 일어난 것으로 추정된다. 어떤 경우에는 하나의 생물체 안에 피루브산 키네이스와 피루브산 인산 다이키네이스가 함께 존재하기도 한다.[114][40][77]
참조
[1]
논문
Human pyruvate kinase M2: a multifunctional protein
2010-11
[2]
서적
Basic Medical Endocrinology
https://archive.org/[...]
Elsevier
[3]
논문
Isoenzymes of pyruvate kinase
1990-04
[4]
논문
Double role for pyruvate kinase type M2 in the expansion of phosphometabolite pools found in tumor cells
1992-01-01
[5]
논문
The M1- and M2-type isozymes of rat pyruvate kinase are produced from the same gene by alternative RNA splicing
1986-10
[6]
논문
Structural basis for tumor pyruvate kinase M2 allosteric regulation and catalysis
2005-07
[7]
논문
Turning on a fuel switch of cancer: hnRNP proteins regulate alternative splicing of pyruvate kinase mRNA
2010-11
[8]
논문
Posttranslational Modifications of Pyruvate Kinase M2: Tweaks that Benefit Cancer
2018
[9]
논문
The allosteric regulation of pyruvate kinase
2000-06
[10]
논문
In vitro binding of the pleiotropic transcriptional regulatory protein, FruR, to the fru, pps, ace, pts and icd operons of Escherichia coli and Salmonella typhimurium
1993-11
[11]
논문
The global regulatory protein FruR modulates the direction of carbon flow in Escherichia coli
1995-06
[12]
논문
The catabolite repressor/activator (Cra) protein of enteric bacteria
1996-06
[13]
논문
Pleiotropic regulation of central carbohydrate metabolism in Escherichia coli via the gene csrA
1995-12
[14]
논문
Phosphoenolpyruvate and Mg2+ binding to pyruvate kinase monitored by infrared spectroscopy
2010-05
[15]
논문
Prebiotic synthesis of phosphoenol pyruvate by α-phosphorylation-controlled triose glycolysis
https://discovery.uc[...]
2017-04
[16]
논문
Kinetic linked-function analysis of the multiligand interactions on Mg(2+)-activated yeast pyruvate kinase
2001-10
[17]
서적
Biochemistry
https://archive.org/[...]
W.H. Freeman
2002
[18]
논문
Pyruvate kinase. Classes of regulatory isoenzymes in mammalian tissues
1973-08
[19]
논문
Synergistic Allosteric Mechanism of Fructose-1,6-bisphosphate and Serine for Pyruvate Kinase M2 via Dynamics Fluctuation Network Analysis
2016-06
[20]
논문
Serine is a natural ligand and allosteric activator of pyruvate kinase M2
2012-11
[21]
논문
L-cysteine reversibly inhibits glucose-induced biphasic insulin secretion and ATP production by inactivating PKM2
2015-03
[22]
논문
Distinguishing the interactions in the fructose 1,6-bisphosphate binding site of human liver pyruvate kinase that contribute to allostery.
2015-02-24
[23]
논문
The allosteric regulation of pyruvate kinase by fructose-1,6-bisphosphate
1998-02
[24]
논문
PKM2, a potential target for regulating cancer
2018-08
[25]
논문
Activation of protein kinase and glycogen phosphorylase in isolated rat liver cells by glucagon and catecholamines
1977-01
[26]
논문
Hormonal control of pyruvate kinase activity and of gluconeogenesis in isolated hepatocytes
[27]
논문
Metformin decreases gluconeogenesis by enhancing the pyruvate kinase flux in isolated rat hepatocytes
[28]
논문
The alternative splicing repressors hnRNP A1/A2 and PTB influence pyruvate kinase isoform expression and cell metabolism
2010-02
[29]
논문
Insulin enhances metabolic capacities of cancer cells by dual regulation of glycolytic enzyme pyruvate kinase M2
2013-07
[30]
논문
Glucose and cAMP regulate the L-type pyruvate kinase gene by phosphorylation/dephosphorylation of the carbohydrate response element binding protein
2001-11
[31]
논문
Carbohydrate Sensing Through the Transcription Factor ChREBP
2019
[32]
논문
MondoA/ChREBP: The usual suspects of transcriptional glucose sensing; Implication in pathophysiology
https://pubmed.ncbi.[...]
2017
[33]
논문
Erythrocyte pyruvate kinase deficiency: 2015 status report
2015-09
[34]
논문
Red cell glycolytic enzyme disorders caused by mutations: an update
2009-06
[35]
논문
Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses
2011-12
[36]
논문
The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth
2008-03
[37]
논문
Phenylketonuria: phenylalanine inhibits brain pyruvate kinase in vivo
1973-03
[38]
논문
Inhibition of human brain pyruvate kinase and hexokinase by phenylalanine and phenylpyruvate: possible relevance to phenylketonuric brain damage
1969-08
[39]
논문
ERK1/2-dependent phosphorylation and nuclear translocation of PKM2 promotes the Warburg effect
2012-12
[40]
논문
Reconstructing the mosaic glycolytic pathway of the anaerobic eukaryote Monocercomonoides
2006-12
[41]
논문
Human pyruvate kinase M2: a multifunctional protein
2010-11
[42]
서적
Basic Medical Endocrinology
https://archive.org/[...]
Elsevier
[43]
논문
Isoenzymes of pyruvate kinase
https://semanticscho[...]
1990-04
[44]
논문
Double role for pyruvate kinase type M2 in the expansion of phosphometabolite pools found in tumor cells
1992-01-01
[45]
논문
The M1- and M2-type isozymes of rat pyruvate kinase are produced from the same gene by alternative RNA splicing
1986-10
[46]
논문
Structural basis for tumor pyruvate kinase M2 allosteric regulation and catalysis
2005-07
[47]
논문
Turning on a fuel switch of cancer: hnRNP proteins regulate alternative splicing of pyruvate kinase mRNA
2010-11
[48]
논문
Posttranslational Modifications of Pyruvate Kinase M2: Tweaks that Benefit Cancer
2018
[49]
논문
The allosteric regulation of pyruvate kinase
2000-06
[50]
논문
In vitro binding of the pleiotropic transcriptional regulatory protein, FruR, to the fru, pps, ace, pts and icd operons of Escherichia coli and Salmonella typhimurium
1993-11
[51]
논문
The global regulatory protein FruR modulates the direction of carbon flow in Escherichia coli
1995-06
[52]
논문
The catabolite repressor/activator (Cra) protein of enteric bacteria
1996-06
[53]
논문
Phosphoenolpyruvate and Mg2+ binding to pyruvate kinase monitored by infrared spectroscopy
2010-05
[54]
논문
Prebiotic synthesis of phosphoenol pyruvate by α-phosphorylation-controlled triose glycolysis
https://discovery.uc[...]
2017-04
[55]
논문
Kinetic linked-function analysis of the multiligand interactions on Mg(2+)-activated yeast pyruvate kinase
2001-10
[56]
서적
Biochemistry
https://archive.org/[...]
W.H. Freeman
2002
[57]
논문
Pyruvate kinase. Classes of regulatory isoenzymes in mammalian tissues
1973-08
[58]
논문
Synergistic Allosteric Mechanism of Fructose-1,6-bisphosphate and Serine for Pyruvate Kinase M2 via Dynamics Fluctuation Network Analysis
2016-06
[59]
논문
Serine is a natural ligand and allosteric activator of pyruvate kinase M2
2012-11
[60]
논문
L-cysteine reversibly inhibits glucose-induced biphasic insulin secretion and ATP production by inactivating PKM2
2015-03
[61]
논문
Distinguishing the interactions in the fructose 1,6-bisphosphate binding site of human liver pyruvate kinase that contribute to allostery.
2015-02-24
[62]
논문
The allosteric regulation of pyruvate kinase by fructose-1,6-bisphosphate
1998-02
[63]
논문
PKM2, a potential target for regulating cancer
2018-08
[64]
논문
Activation of protein kinase and glycogen phosphorylase in isolated rat liver cells by glucagon and catecholamines
1977-01
[65]
논문
Hormonal control of pyruvate kinase activity and of gluconeogenesis in isolated hepatocytes
[66]
논문
Metformin decreases gluconeogenesis by enhancing the pyruvate kinase flux in isolated rat hepatocytes
[67]
논문
Glucose and cAMP regulate the L-type pyruvate kinase gene by phosphorylation/dephosphorylation of the carbohydrate response element binding protein
2001-11
[68]
논문
The alternative splicing repressors hnRNP A1/A2 and PTB influence pyruvate kinase isoform expression and cell metabolism
2010-02
[69]
논문
Insulin enhances metabolic capacities of cancer cells by dual regulation of glycolytic enzyme pyruvate kinase M2
2013-07
[70]
논문
Erythrocyte pyruvate kinase deficiency: 2015 status report
2015-09
[71]
논문
Red cell glycolytic enzyme disorders caused by mutations: an update
2009-06
[72]
논문
Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses
2011-12
[73]
논문
The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth
2008-03
[74]
논문
Phenylketonuria: phenylalanine inhibits brain pyruvate kinase in vivo
1973-03
[75]
논문
Inhibition of human brain pyruvate kinase and hexokinase by phenylalanine and phenylpyruvate: possible relevance to phenylketonuric brain damage
1969-08
[76]
논문
ERK1/2-dependent phosphorylation and nuclear translocation of PKM2 promotes the Warburg effect
2012-12
[77]
논문
Reconstructing the mosaic glycolytic pathway of the anaerobic eukaryote Monocercomonoides
2006-12
[78]
논문
Human pyruvate kinase M2: a multifunctional protein
2010-11
[79]
서적
Basic Medical Endocrinology
https://archive.org/[...]
Elsevier
[80]
논문
Isoenzymes of pyruvate kinase
https://semanticscho[...]
1990-04
[81]
논문
Double role for pyruvate kinase type M2 in the expansion of phosphometabolite pools found in tumor cells
1992-01-01
[82]
논문
The M1- and M2-type isozymes of rat pyruvate kinase are produced from the same gene by alternative RNA splicing
1986-10-15
[83]
논문
Structural Basis for Tumor Pyruvate Kinase M2 Allosteric Regulation and Catalysis
2005-07-01
[84]
논문
Turning on a Fuel Switch of Cancer: hnRNP Proteins Regulate Alternative Splicing of Pyruvate Kinase mRNA
http://cancerres.aac[...]
2010-11-15
[85]
논문
Posttranslational Modifications of Pyruvate Kinase M2: Tweaks that Benefit Cancer
2018
[86]
논문
The allosteric regulation of pyruvate kinase
2000-06
[87]
논문
In vitro binding of the pleiotropic transcriptional regulatory protein, FruR, to the fru, pps, ace, pts and icd operons of Escherichia coli and Salmonella typhimurium
1993-11
[88]
논문
The global regulatory protein FruR modulates the direction of carbon flow in Escherichia coli
1995-06
[89]
논문
The catabolite repressor/activator (Cra) protein of enteric bacteria
1996-06
[90]
논문
Pleiotropic regulation of central carbohydrate metabolism in Escherichia coli via the gene csrA
1995-12
[91]
논문
Phosphoenolpyruvate and Mg2+ binding to pyruvate kinase monitored by infrared spectroscopy
https://archive.org/[...]
2010-05
[92]
논문
Kinetic linked-function analysis of the multiligand interactions on Mg(2+)-activated yeast pyruvate kinase
2001-10
[93]
서적
Biochemistry
https://archive.org/[...]
W.H. Freeman
2002
[94]
논문
Pyruvate kinase. Classes of regulatory isoenzymes in mammalian tissues
1973-08
[95]
논문
Synergistic Allosteric Mechanism of Fructose-1,6-bisphosphate and Serine for Pyruvate Kinase M2 via Dynamics Fluctuation Network Analysis
2016-06-27
[96]
논문
Serine is a natural ligand and allosteric activator of pyruvate kinase M2
2012-11
[97]
논문
l-cysteine reversibly inhibits glucose-induced biphasic insulin secretion and ATP production by inactivating PKM2
2015-03-10
[98]
논문
Distinguishing the interactions in the fructose 1,6-bisphosphate binding site of human liver pyruvate kinase that contribute to allostery.
2015-02-24
[99]
논문
The allosteric regulation of pyruvate kinase by fructose-1,6-bisphosphate
1998-02
[100]
논문
PKM2, a potential target for regulating cancer
2018-08-20
[101]
논문
Activation of protein kinase and glycogen phosphorylase in isolated rat liver cells by glucagon and catecholamines
1977-01-25
[102]
논문
Glucose and cAMP regulate the L-type pyruvate kinase gene by phosphorylation/dephosphorylation of the carbohydrate response element binding protein
2001-11
[103]
논문
Hormonal control of pyruvate kinase activity and of gluconeogenesis in isolated hepatocytes
[104]
논문
Metformin decreases gluconeogenesis by enhancing the pyruvate kinase flux in isolated rat hepatocytes
[105]
논문
The alternative splicing repressors hnRNP A1/A2 and PTB influence pyruvate kinase isoform expression and cell metabolism
2010-02-02
[106]
논문
Insulin enhances metabolic capacities of cancer cells by dual regulation of glycolytic enzyme pyruvate kinase M2
2013-07-09
[107]
논문
Erythrocyte pyruvate kinase deficiency: 2015 status report
2015-09
[108]
논문
Red cell glycolytic enzyme disorders caused by mutations: an update
2009-06
[109]
논문
Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses
2011-12
[110]
논문
The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth
2008-03
[111]
논문
Phenylketonuria: phenylalanine inhibits brain pyruvate kinase in vivo
1973-03
[112]
논문
Inhibition of human brain pyruvate kinase and hexokinase by phenylalanine and phenylpyruvate: possible relevance to phenylketonuric brain damage
1969-08
[113]
논문
ERK1/2-dependent phosphorylation and nuclear translocation of PKM2 promotes the Warburg effect
2012-12
[114]
논문
Reconstructing the mosaic glycolytic pathway of the anaerobic eukaryote Monocercomonoides
2006-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
