끓는점
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
끓는점은 액체가 기체로 변하는 온도이며, 액체의 증기압이 외부 압력과 같아질 때 발생한다. 끓는점은 분자 간 인력, 외부 압력, 불순물 등에 따라 달라지며, 압력이 낮아지면 끓는점도 낮아진다. 끓는점은 클라우지우스-클라페이론 방정식을 통해 계산할 수 있으며, 물의 경우 표준 끓는점은 1기압에서 약 100°C, IUPAC 표준 압력(100 kPa)에서는 99.61°C이다. 끓는점은 물질의 종류에 따라 다르며, 분자량, 분자 구조, 불순물의 종류와 농도에 영향을 받는다. 끓는점 오름 현상을 이용하여 열에너지를 저장하거나, 압력솥과 같은 도구, 증류와 같은 기술에 활용된다.
끓는점은 액체의 증기압이 외부 압력과 같아져 액체 내부에서 기화가 일어나는 온도이다. 끓는점은 분자 간 인력이 강할수록 높아진다.
기화는 액체가 기체로 변하는 현상이다. 기화에는 증발과 끓음(비등) 두 가지 유형이 있다. 증발은 액체 표면에서 일어나는 기화이며, 끓는점보다 낮은 온도에서도 일어난다. 반면 끓음은 액체 표면뿐만 아니라 내부에서도 기화가 일어나 기포가 발생하는 현상이다.[18] 끓는점은 액체의 증기압이 주변 압력과 같아지는 온도로, 압력에 따라 달라진다. 끓음은 끓는점에서만 일어나지만, 증발은 끓는점보다 낮은 온도에서도 가능하다. 예를 들어 젖은 식기나 옷이 100℃보다 낮은 온도에서 마르는 것은 물이 증발하기 때문이다. 따라서 끓는점은 "액체가 끓어서 기체로 변할 때의 온도"로 정의하는 것이 정확하다.
2. 끓는점의 정의 및 원리
압력이 낮아지면 끓는점이 낮아진다. 예를 들어, 에베레스트 산과 같이 높은 산에서는 대기압이 낮아 끓는점이 낮아진다. 반대로 압력이 높아지면 끓는점이 높아진다. 압력솥은 압력을 높여 끓는점을 높이는 대표적인 예이다. 한국의 전통적인 조리 도구인 가마솥은 뚜껑의 무게로 내부 압력을 높여 끓는점을 높이는 효과를 낸다.[24]
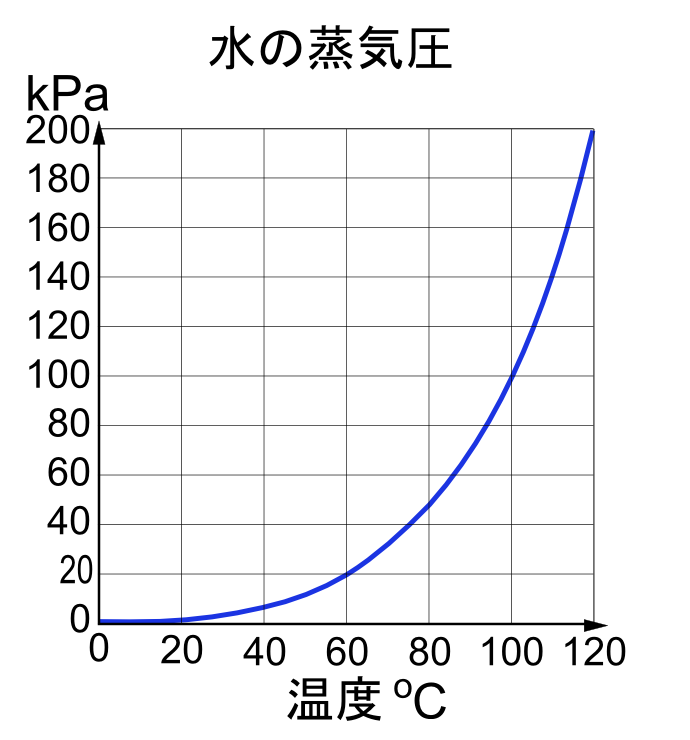
IUPAC에서 권장하는 물의 표준 끓는점(100kPa)은 99.61°C이다.[7][6][8] 참고로, 에베레스트 산 정상(8848m)에서는 압력이 약 34kPa[9]이고 물의 끓는점은 71°C이다.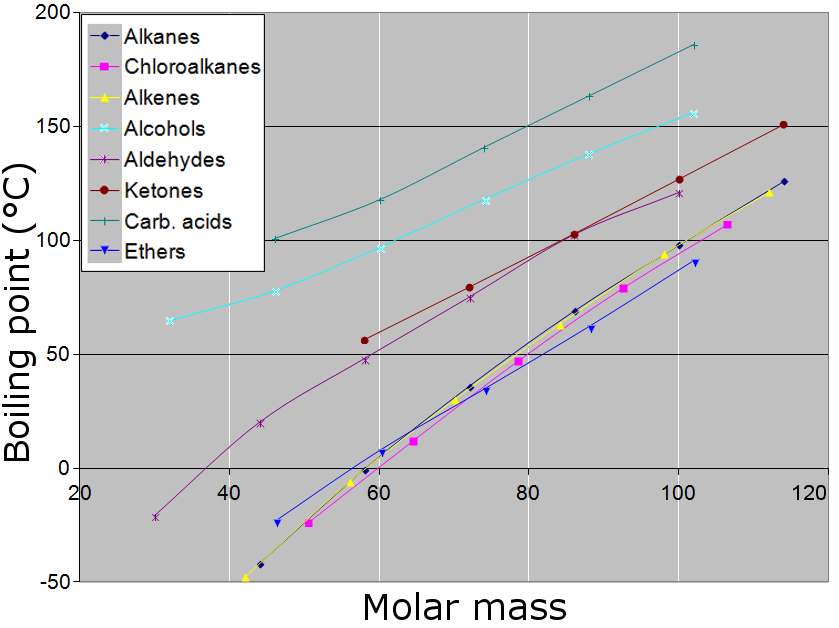
일반적으로 이온 결합 화합물은 높은 정상 끓는점을 갖는다. 많은 금속들이 높은 끓는점을 가지지만, 모든 금속이 그런 것은 아니다. 공유 결합 분자를 가진 화합물에서 분자 크기(분자량)가 증가함에 따라 정상 끓는점이 증가한다. 분자 크기가 고분자와 같이 매우 커지면, 화합물은 종종 끓는점에 도달하기 전에 고온에서 분해된다. 분자의 극성이 증가할수록, 수소 결합을 형성할 능력이 클수록 정상 끓는점이 증가한다. 간단한 카복실산은 분자 사이에 수소 결합을 형성하여 이량체화한다. 분자의 모양을 더 작게 만들면 표면적이 더 큰 동등한 분자에 비해 정상 끓는점이 약간 낮아지는 경향이 있다.
2. 1. 불순물과 끓는점
녹아 있는 용액의 포화 증기압은 일반적으로 원래 순수한 액체의 포화 증기압보다 낮아지는데, 이러한 현상을 증기압 내림이라고 한다. 압력을 세로축으로 했을 때 용액의 증기압 곡선은 원래의 증기압 곡선보다 아래쪽으로 치우치게 된다. 따라서 외압이 같다면, 이 용액의 끓는점은 일반적으로 원래 순수한 액체의 끓는점보다 높아진다. 이러한 현상을 끓는점 오름이라고 한다. 예를 들어 소금물이나 수크로스 수용액의 끓는점은, 염화나트륨과 수크로스가 비휘발성이므로 순수한 물의 끓는점보다 높아진다.[25] 이는 비휘발성 용질이 물 분자의 증기압력을 낮추기 때문이다.[25] 나트륨 성분인 소금이나 설탕을 용해시킨 물은 순수한 물보다 끓는점이 높아진다.[25]
반대로, 액체에 휘발성 물질[26]이나 기체가 녹아 있을 때 용액의 끓는점은 원래 액체의 끓는점보다 낮아지기도 하고 높아지기도 한다. 예를 들어, 물에 암모니아를 녹인 암모니아수의 끓는점은 물보다 낮고, 물에 염화수소를 녹인 묽은 염산의 끓는점은 물보다 높다.[26]
일정한 외압 하에서 끓고 있는 용액의 온도는 용액의 끓는점과 거의 같다. 그러나 순물질과는 달리, 대부분의 경우 끓는 동안 용액의 온도가 조금씩 상승한다.[27] 이것은 끓는 과정에서 액체의 조성이 변화하기 때문이다. 용매와 용질이 같더라도 농도가 다르면 용액의 끓는점이 달라지므로, 끓는 과정에 의해 용액의 농도가 변하면 끓는점도 변하고, 그 결과 용액의 온도도 변한다. 예를 들어, NaCl의 질량 백분율 농도가 14 wt%인 NaCl 수용액을 1 기압의 외압 하에서 가열하면, 103 ℃에서 끓기 시작한다. 이 온도가 14 wt% 소금물의 1 기압에서의 끓는점이다.[28] 끓는 과정에 의해 용액에서 물이 수증기로 날아가는 반면, 염화나트륨은 비휘발성이므로 용액 중에 남는다. 따라서 물의 양이 기화하여 줄어들면 염분 농도가 높아진다. 끓는점은 진한 소금물일수록 높아지므로, 끓는 현상이 계속되면 소금물의 온도는 103 ℃에서 조금씩 상승한다. 소금물의 양이 처음 양의 절반 정도가 되면 포화 소금물이 되고, 물에 더 이상 녹지 못한 염화나트륨이 고체로 석출된다. 이때의 온도는 109 ℃이며, 이것이 포화 소금물의 1 기압에서의 끓는점이다. 고체가 석출되기 시작한 후에는, 기화하는 물의 양과 같은 비율로 염화나트륨이 용액에서 석출된다. 따라서 염분 농도는 더 이상 변하지 않고, 끓는점도 변하지 않으므로, 끓는 용액의 온도는 일정하게 유지된다.
용액의 농도가 변했을 때 용액의 끓는점이 어떻게 변하는지를 나타낸 그림을 '''끓는점 그림'''이라고 한다.[29] 끓는점 그림은 상태도의 일종이며, 일반적으로 끓는점을 나타내는 곡선[30]과 함께 '''이슬점'''(혼합 기체가 응축하기 시작하는 온도)을 나타내는 곡선[31]이 그려져 있다. 예로서, 물과 암모니아 혼합물의 끓는점 그림을 보여준다. 이 그림에서 가로축은 암모니아의 질량 백분율 농도이며, 그래프의 왼쪽 끝(0 wt%)은 순수한 물, 오른쪽 끝(100 wt%)은 순수한 암모니아이다. 빨간 실선은 끓는점을 나타내고, 검은 점선은 이슬점을 나타낸다. 또는 빨간 실선이 끓기 시작하는 온도를 나타내고, 검은 점선이 끓는 과정이 끝나는 온도를 나타낸다고 생각해도 좋다. 이 그래프에서, 예를 들어 25 wt% 암모니아수의 1 기압에서의 끓는점이 37 ℃이며, 암모니아 가스와 수증기의 질량비가 25:75인 혼합 기체의 이슬점이 91 ℃임을 알 수 있다. 소금물의 경우와는 달리, 암모니아수는 끓기 시작할 때부터 끝날 때까지 액체 온도가 일정하게 유지되지 않고 항상 상승한다. 25 wt% 암모니아수를 1 기압의 외압 하에서 가열하면 37 ℃에서 끓기 시작하고, 액체가 줄어들면서 액체 온도가 상승하고, 마지막 한 방울이 기화하기 직전의 액체 온도는 이론적으로는 91 ℃가 된다. 또한, 끓는점이 91 ℃가 되는 농도를 끓는점 그림에서 읽으면 2~3 wt%이며, 이 마지막 한 방울의 질량 백분율 농도가 2~3 wt%임을 알 수 있다.
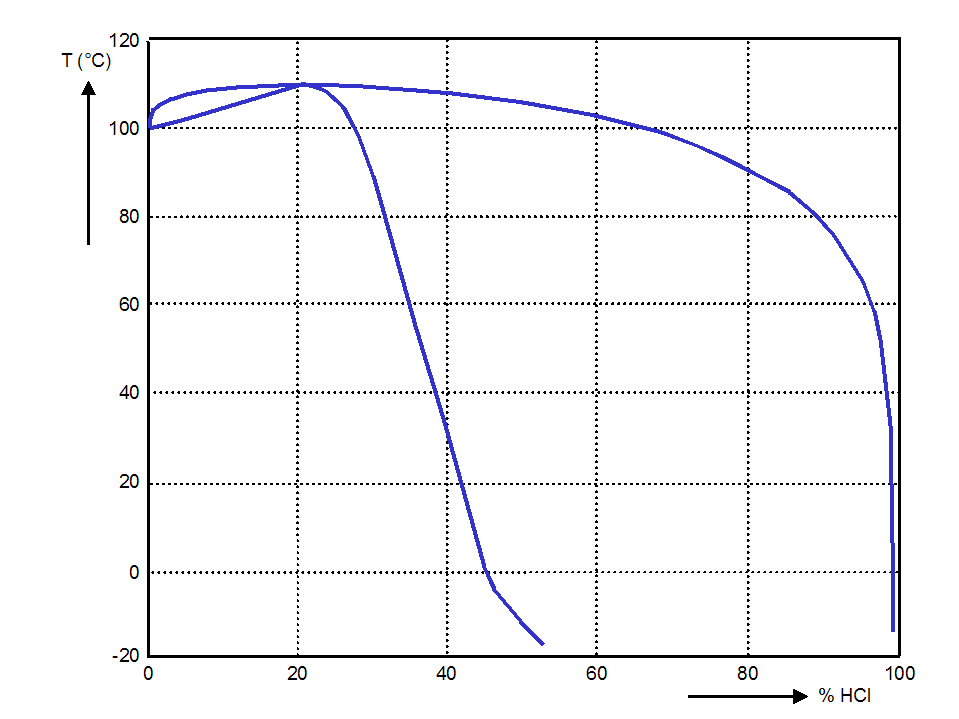
염산의 끓는점 그림은 암모니아수의 끓는점 그림과 비교하면 약간 복잡하다. 끓는점을 나타내는 곡선이 저농도 쪽에서 크게 올라가고, 20 wt%에서 이슬점을 나타내는 곡선에 접하고 있다. 또한, 이슬점을 나타내는 곡선도 약간 올라가 있고, 끓는점과 이슬점이 일치하는 농도에서 끓는점과 이슬점 모두 극대값을 나타낸다. 용액의 끓는점과 이슬점이 일치한다는 것은 끓기 시작할 때부터 끝날 때까지 용액의 조성과 온도가 모두 일정하게 유지된다는 것을 의미한다. 일반적으로, 끓을 때 혼합물의 조성이 액체상과 기체상에서 같은 현상을 '''공비'''라고 한다. 공비하는 용액을 공비 혼합물이라고 한다. 물과 염화수소의 혼합물인 염산에서는, 1 기압 하에서 염화수소의 농도가 20.22 wt%일 때 공비 혼합물이 되어 108.6 ℃에서 끓는다.[32] 이 온도는 1 기압의 물-염화수소계의 끓는점의 극대값이며, 순수한 물의 끓는점보다 높다. 다른 공비 화합물의 예로는 물과 에탄올의 혼합물이 잘 알려져 있다. 1 기압의 물-에탄올계에서는 에탄올의 질량 백분율 농도가 96.0 wt%일 때 끓는점이 극소가 되어 공비한다. 이때의 끓는점은 순수 에탄올의 끓는점보다 약간 낮으며, 78.15 ℃이다.
3. 끓는점과 증발
3. 1. 과열
'''과열'''(superheating)은 일정한 외부 압력에서 액체를 가열할 때, 끓는점을 넘어도 끓지 않고 액체 상태를 유지하며 온도가 계속 상승하는 현상이다.[20] 과열된 액체는 과열 액체라고 하며, 끓는점 이하의 일반적인 액체와 겉모습에 차이가 없어 구별하기 어렵다. 하지만 과열 액체를 계속 가열하면 액체가 갑자기 끓어오르는 '''돌비현상'''(bumping)이 발생한다. 돌비 현상 후에는 액체의 온도가 끓는점까지 내려간다.
과열 액체의 돌비 현상은 가열을 멈춘 후에도 발생할 수 있다. 예를 들어 과열 액체에 진동을 주거나, 온도계를 삽입하거나, 끓임쪽이나 기타 이물질을 넣으면 돌비 현상이 일어나기 쉽다. 이 경우에도 돌비 현상 직후 액체 온도는 끓는점까지 내려가며, 이는 기화열 때문이다.
과열은 액체의 표면장력 때문에 발생한다. 일반적인 액체 속 기포 내부 압력은 기포를 둘러싼 액체의 표면장력 때문에 외부 압력보다 높다.[21] 끓는점에서는 다음과 같은 관계가 성립한다.
:(포화 증기압) = (외부 압력) < (기포 내부의 압력)
따라서 기포 내부에 수증기만 있다면 수증기 압력만으로는 기포를 지탱할 수 없어 작은 기포는 깨진다. 액체에서 수증기 기포가 발생하려면 기포 내부에 수증기 외 다른 기체가 어느 정도 포함되거나, 주변 액체가 어느 정도 과열되어야 한다.
과열을 방지하고 끓는점에서 액체를 끓게 하려면 미리 액체에 끓임쪽을 넣고 가열하거나, 교반자를 사용하여 액체를 저으면서 가열하면 된다. 끓임쪽이나 교반자는 기포의 핵을 만드는 역할을 한다. 기포 핵이 생성되면 기포 내 수증기의 분압이 포화 증기압이 될 때까지 액체가 기포 내부로 기화하여 기포가 눈에 보이는 크기로 성장한다. 액체가 외부에서 얻은 열이 모두 기포 성장에 필요한 기화열로 사용된다면 액체 온도는 오르거나 내려가지 않는다. 즉, 액체에서 기포가 끊임없이 발생하는 동안 액체 온도는 끓는점과 거의 같다.
4. 끓는점과 분자 구조
형태
(°C)