마그네슘
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
마그네슘은 엡솜의 우물에서 발견된 황산 마그네슘에서 처음 확인된 금속 원소이다. 성질은 인간을 포함한 동물과 식물의 생명 활동에 필수적인 미네랄이며, 엽록소의 구성 성분으로 광합성에 중요한 역할을 한다. 마그네슘은 산소와 결합하기 쉽고, 강한 환원성을 가지며, 공기 중에서 가열하면 불꽃을 내며 연소한다. 주로 해수에서 염화 마그네슘을 분리하여 생산하며, 가볍고 강도가 높아 알루미늄과 합금하여 항공기, 자동차 부품 등에 사용된다. 또한, 의약품, 비료, 내화 물질 등 다양한 분야에서 활용된다. 인체 내에서 뼈의 대사에 중요한 역할을 하며, 결핍 시 골다공증, 당뇨병 등의 원인이 될 수 있다. 마그네슘 화합물은 대체로 무해하지만, 순수한 마그네슘과 그 합금은 가연성이 높고 폭발 위험이 있어 주의해야 한다.
더 읽어볼만한 페이지
- 마그네슘 - 고마그네슘혈증
고마그네슘혈증은 신장 기능 저하, 과도한 마그네슘 섭취, 호르몬 이상 등으로 혈중 마그네슘 농도가 정상 범위를 초과하여 근무력증, 혼돈, 부정맥, 심정지 등 신경근육 및 심혈관계 증상을 유발하는 상태로, 혈액 검사로 진단하고 원인 교정, 마그네슘 배설 촉진, 인공 투석 등으로 치료한다. - 마그네슘 - 마그네슘 동위 원소
마그네슘 동위 원소는 마그네슘 원자의 핵 내 중성자 수에 따라 구분되며, 세 가지 안정 동위 원소와 불안정 동위 원소를 포함하고, 불안정 동위 원소는 방사성 붕괴를 통해 다른 원소로 변환된다. - 알칼리 토금속 - 칼슘
칼슘은 석회에서 유래된 은백색 금속 원소로, 다양한 화합물을 형성하며 산업 및 생체 내에서 중요한 역할을 하고, 섭취량에 따라 건강에 영향을 미친다. - 알칼리 토금속 - 스트론튬
스트론튬은 은백색의 무른 알칼리 토금속으로 칼슘과 바륨의 중간 성질을 가지며 물과 격렬하게 반응하고 공기 중에서 산화되는 특징이 있으며, 광물 형태로 존재하며 불꽃놀이 발색제나 과거 컬러 브라운관 유리 제조 등에 사용되지만, 방사성 동위원소는 건강에 위험을 초래하고 안정 동위원소는 고고학 및 법의학 연구에 활용된다. - 장소 이름이 포함된 화학 원소 - 루테튬
루테튬은 원소 기호 Lu, 원자 번호 71을 갖는 희토류 원소로, 란타넘족 중 밀도, 녹는점, 경도가 가장 높고, 주로 +3의 산화 상태를 가지며, 안정 동위원소와 방사성 동위원소 형태로 존재하고, 제한적인 상업적 용도에도 불구하고 촉매, LED, PET, 연대 측정, 암 치료 등에 사용된다. - 장소 이름이 포함된 화학 원소 - 레늄
레늄은 텅스텐과 탄소 다음으로 녹는점이 높고 끓는점이 가장 높은 은백색 금속 원소이며, 몰리브데넘 광석에서 주로 추출되어 제트 엔진, 촉매, 고옥탄가 휘발유 생산 등에 사용된다.
2. 역사
1618년 영국 서리주 엡솜의 한 우물에서 나오는 쓴맛의 물에서 황산 마그네슘이 발견되면서 마그네슘의 존재가 처음 알려졌다.[48][49] 1755년 스코틀랜드의 조지프 블랙은 탄산 마그네슘을 열분해하여 산화 마그네슘을 분리하면서 마그네슘 원소를 확인하였다. 1808년 영국의 험프리 데이비는 산화 마그네슘과 산화 수은 혼합물을 전기분해하여 아말감에서 수은을 증발시켜 최초로 마그네슘 금속을 분리하였다.[173][180] 데이비가 처음 제안한 명칭은 '''마그늄'''(magnium영어)이었으나,[180][50] 현재는 '''마그네슘'''이라는 이름이 쓰인다.[51] 마그네슘이라는 이름은 그리스 테살리아 지방의 마그네시아에서 나는 마그네시아석의 이름에서 유래하였다. 1828년 프랑스의 앙투안 뷔시는 염화 마그네슘(MgCl2)을 칼륨으로 환원시켜 마그네슘을 분리하였다.[172] 1833년 영국의 마이클 패러데이가 용융된 무수 염화 마그네슘을 전기분해하여 액체 마그네슘을 생산하는 방법을 개발하였다. 1852년 독일의 로베르트 분젠이 이를 발전시켰고, 이를 바탕으로 1886년 독일에서 최초로 상업적인 생산이 가능해졌다.[181] 제1차 세계 대전과 제2차 세계 대전 때는 군용기와 소이탄 등에 마그네슘 합금이 사용되었다. 일본에서는 제2차 세계 대전 이전부터 1994년까지 우베흥산에 의해 마그네슘이 생산되었다. 마그네사이트 등의 광석 자원은 중국, 북한, 러시아 3개국이 6할 이상을 차지하고 있다.[145]
인간을 포함한 동물과 식물의 생명 활동을 유지하는 미네랄(필수원소) 중 하나이며, 특히 식물의 광합성에 필요한 클로로필에서 배위결합의 중심으로 필수적이다. 또한, 유기화학에서는 그리냐르 시약의 구성 원소로 중요하다.
3. 성질

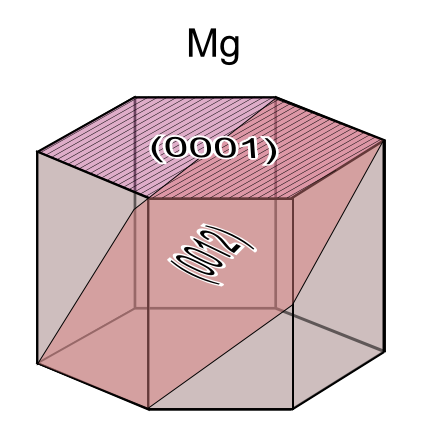
산화수는 거의 항상 2가이다. 비중 1.74의 무른 금속으로, 녹는점은 650℃, 끓는점은 1090-1110℃(실험값에 따라 다름)이다. 마그네슘에는 두 가지 동소체가 있으며, 상온, 상압에서 안정적인 결정 구조는 육방최밀충진구조(HCP)이지만, 온도를 높이면 체심입방격자가 안정된다.
산소와 결합하기 쉽고, 강한 환원 작용을 가진다. 공기 중에 장시간 방치하면 표면이 서서히 산화되어 회색을 띤다. 또한, 이산화탄소, 물, 아황산과도 반응하지만, 모두 부동태 피막이 되므로 알칼리 금속이나 칼슘과 달리 부식은 진행되지 않아 광유 속에 보관할 필요는 없다.
공기 중에서 가열하면 불꽃과 강한 빛을 내며 연소한다(연소열은 601.7 kJ/mol). 더욱이 질소나 이산화탄소 중에서도 연소하여 각각 질화마그네슘(N}}, 생성열은 461.08[137] kJ/mol), 산화마그네슘(MgO, 생성열은 601.60 [138] kJ/mol)이 된다.
:
온수나 염수, 묽은 산에는 쉽게 용해되어 수소를 발생시킨다. 따라서 마그네슘 화재의 소화에는 물을 사용할 수 없으며[139][140], 다라이가루 등을 사용한다[141].
:
3. 1. 물리적 성질
마그네슘은 은백색의 가벼운 금속이며 밀도는 1.738 g/cm³이다.[173] 녹는점은 650°C, 끓는점은 1090°C로, 알칼리 토금속 중 가장 낮다.[9] 결정 구조는 육방 밀집 구조를 가지며,[173] 연성과 전성이 있어 얇은 박이나 철사 형태로 가공할 수 있다.[173] 낮은 밀도에 비해 단단하여 구조재로 사용되며, 특히 알루미늄, 아연, 망가니즈 등과의 합금은 경량성과 내식성이 우수하여 항공기, 자동차 부품 등에 사용된다.[173]
순수한 다결정 마그네슘은 부서지기 쉽고 전단대를 따라 쉽게 파괴되지만, 알루미늄 1%와 같이 소량의 다른 금속과 합금하면 훨씬 더 가단성이 좋아진다.[10] 다결정 마그네슘의 가단성은 결정 크기를 약 1 μm 이하로 줄임으로써도 크게 향상될 수 있다.[11]
0001:전위면 0012:쌍정면
마그네슘의 결정 구조는 상온에서 두 개의 면에서만 전위가 발생하기 때문에, 순수 마그네슘이나 합금을 가열하지 않고 압연과 같은 가공을 하면 균열이 발생하기 쉽다. 따라서 가공에는 가열이 필수적이지만, 연소되지 않도록 주의해야 한다.
3. 2. 화학적 성질
마그네슘은 1s22s22p63s2의 전자배치를 가지며, 3s 오비탈의 전자 2개를 잃고 양이온이 되려는 성질로 인해 주된 산화수는 +2이다.[173] 공기 중에 노출되면 산소와 반응하여 투과성이 작고 제거하기 어려운 산화 피막을 형성하여 더 이상의 산화를 막는다.[13] 마그네슘은 분말이나 얇은 선으로 만들면 빠르게 연소하여 강한 백색광을 내며 산화 마그네슘(MgO)과 질화 마그네슘을 형성한다.[173]
마그네슘은 반응성이 낮은 질소와 반응하여 질화 마그네슘(Mg3N2)을 형성할 수 있으며,[15] 이산화 탄소와도 반응하여 산화 마그네슘과 탄소를 형성한다.[173]
:2 Mg + CO2 → 2 MgO + C
할로젠 원소들과도 반응하여 이온 결합 물질을 생성하며, 고온, 고압에서는 수소와도 반응하여 MgH2을 형성하기도 한다. 산소족 원소들과도 1:1 비율로 결합하여 화합물을 만들 수 있으며, 특히 산소와는 과산화물(MgO2)도 형성할 수 있다.[175]
마그네슘은 상온에서 물과 반응하며 칼슘에 비해서는 훨씬 더 천천히 반응한다.[13] 마그네슘이 물과 반응하면 수소 기체와 산화 마그네슘을 형성하며, 과량의 수증기에서는 불용성의 수산화 마그네슘과 수소 기체를 형성한다. 가루 형태로는 더 격렬하게 반응하고 온도가 높을수록 반응이 빨리 진행된다. 반응식은 아래와 같다.
:Mg + 2H2O → Mg(OH)2 + H2
또한, 마그네슘은 묽은 황산이나 염산과 같은 대부분의 산과 발열 반응을 하면서 수소 기체를 발생시키지만 불산과는 반응이 잘 일어나지 않는다.[176] 염기와도 대부분 반응하지 않는데,[173][177] 이는 마그네슘의 표면에 불용성의 수산화 마그네슘이 형성되기 때문이다. 염산과 마그네슘의 반응을 예로 들면 반응이 진행되었을 때 염화 마그네슘과 수소 기체를 발생시키게 된다.
:2HCl + Mg → MgCl2 + H2
마그네슘 이온(Mg2+)의 화합물 중 질산 마그네슘(Mg(NO3)2), 염화 마그네슘(MgCl2), 황화 마그네슘(MgS), 황산 마그네슘(MgSO4) 등은 물에 잘 용해되고, 탄산 마그네슘(MgCO3), 수산화 마그네슘(Mg(OH)2) 등은 물에 잘 용해되지 않는다.[178]
4. 존재
마그네슘은 지구의 지각에서 8번째로 풍부한 원소로 지각 질량의 약 2.3%를 차지한다.[182][183] 산화 마그네슘은 지각에서 두 번째로 많은 화합물이다.[184] 주로 마그네사이트, 사문암, 백운암, 활석 등의 형태로 존재하며, 이 밖에도 약 60가지 이상의 광물에서 발견된다. 이러한 광물은 중국, 북조선, 러시아에서 주로 채굴된다.[185] 마그네슘은 60개 이상의 광물에서 발견되지만, 상업적으로 중요한 것은 돌로마이트, 마그네사이트, 브루사이트, 카날라이트, 활석, 그리고 감람석 뿐이다.[29]
해수에서는 마그네슘 이온이 약 1.29 g/L 포함되어 있어[186] 이온 수로는 염화 이온(Cl-)과 나트륨 이온(Na+)에 이어 세 번째로 많고 양이온 중에서는 두 번째로 많다. 해수 속 염류 중에서는 염화 마그네슘(MgCl2)이 약 10.9%, 황산 마그네슘이 약 4.7% 포함되어 있어 각각 두 번째, 세 번째로 많은 성분이다.[187] 양이온은 해수에서 두 번째로 풍부한 양이온이다. 이 때문에 해수와 해염은 마그네슘의 매력적인 상업적 공급원이 된다.
사람의 몸에서는 11번째로 풍부한 원소로, 약 270 ppm(질량 기준)이 포함되어 있다. 콩, 옥수수, 현미, 정어리 등에 다량 포함되어 있다. 정제·가공하지 않은 식품에 널리 포함되어 있으며, 참깨와 아몬드 등의 종실류, 톳 등의 해조류에 많고, 가공식품에는 적다.
4. 1. 동위 원소
마그네슘은 세 종류의 안정 동위 원소인 24Mg, 25Mg, 26Mg를 갖는다.[188] 이들 중 존재 비율이 가장 큰 것은 24Mg로, 전체의 약 79%를 차지한다.26Mg은 26Al이 약 72만 년의 반감기를 거치며 붕괴하여 생성된 핵종이다. 26Al과 26Mg의 비율은 방사능 연대 측정에 이용되며, 주로 태양계의 역사를 연구하는 데 쓰인다. 일부 탄소질 콘드라이트 운석의 Ca-Al 풍부한 봉입물에서 안정한 26Mg의 과다한 양이 관찰되었는데, 이는 봉입물 내 모원소 26Al의 붕괴로 인한 것이다. 연구자들은 이러한 운석이 26Al이 붕괴되기 전에 태양 성운에서 형성되었다고 결론짓는다. 이들은 태양계에서 가장 오래된 천체 중 하나이며 초기 역사에 대한 정보를 보존하고 있다.25Mg는 전체 마그네슘의 약 10%를 차지하는 동위 원소이다.[188] 26Mg과 함께 인체 내에서 일어나는 마그네슘 대사 과정을 연구할 때 사용되며, 심장 질환의 연구에도 쓰인다.[188] 양전자 방출 단층촬영에 사용되는 22Na의 생산에도 사용된다.28Mg은 1950년대에서 1970년대 사이에 실험용 원자로에서 흔히 생성되었던 방사성 동위 원소이며, 반감기는 21시간이다.5. 생산
마그네슘은 주로 해수에 포함된 염화 마그네슘을 분리하여 용융시킨 후 전기분해하여 얻는다. 해수에 수산화 칼슘(소석회)를 넣어 염화 마그네슘과 반응시키면 수산화 마그네슘이 앙금 형태로 침전된다. 이를 염산과 반응시켜 염화 마그네슘을 얻고, 물을 증발시킨 후 남은 염화 마그네슘을 용융, 전기분해하면 음극에서 순수한 마그네슘을 얻을 수 있다.[173]
:Ca(OH)2 + MgCl2 → Mg(OH)2 + CaCl2
:Mg(OH)2 + 2 HCl → MgCl2 + 2H2O
광물에서 추출하는 경우, 백운석(MgCa(CO₃)₂)을 하소하여 고온에서 규소-철 합금과 반응시킨다. 이때 철은 촉매로 작용한다.[173]
:2MgO + 2 CaO + Si → 2 Mg + Ca2SiO4
피전 공정과 볼자노 공정은 산화 마그네슘을 마그네슘 금속의 전구체로 사용한다는 점에서 유사하다. 산화 마그네슘은 탄산칼슘과 탄산마그네슘의 고용액인 돌로마이트를 소성하여 산화칼슘과의 고용액으로 생성된다.
:
고온에서 페로실리콘 합금을 사용해 환원 반응이 일어난다.
:
산화칼슘은 실리콘과 결합하여 규산칼슘을 생성한다.[36]
피전 공정은 기술적으로 덜 복잡하고, 고순도 제품을 쉽게 얻을 수 있어 세계 생산량의 대부분을 차지한다.[38][37] 중국은 실리코열 피전 공정에 거의 전적으로 의존하고 있다.
피전 공정 다음으로 많이 사용되는 방법은 전기분해이다. 염화마그네슘을 전해조에서 마그네슘 금속과 염소 가스로 분리한다.[37]
:
이 반응은 680~750 °C에서 작동한다.[37] 염화마그네슘은 다우 공정을 사용하여 얻거나 염화마그네슘 브라인을 탈수하여 얻는다. 그러나 이 공정은 유해한 염소 가스를 생성하고 에너지 소비가 커 환경 위험을 초래한다.[39]
미국에서는 한때 다우 공정을 사용하여 마그네슘을 주로 얻었다. 이온을 포함하는 염수 용액을 석회로 처리하고 침전된 수산화마그네슘을 수집한다.
:(aq) + (s) + (l) → (aq) + (s)
수산화물은 염산으로 처리하고 생성물을 가열하여 염화마그네슘으로 전환된다.
:
염을 용융 상태에서 전기 분해하면, 음극에서 이온이 마그네슘 금속으로 환원되고, 양극에서 이온 쌍이 염소 가스로 산화된다.
: + 2 → Mg
:2 → (g) + 2
산화 마그네슘과 같은 마그네슘 화합물을 탄소와 같은 환원제와 반응시켜 마그네슘을 얻는 방법도 있다.[173] 탄소열 환원법은 에너지 소비는 적으면서 생산성이 높다.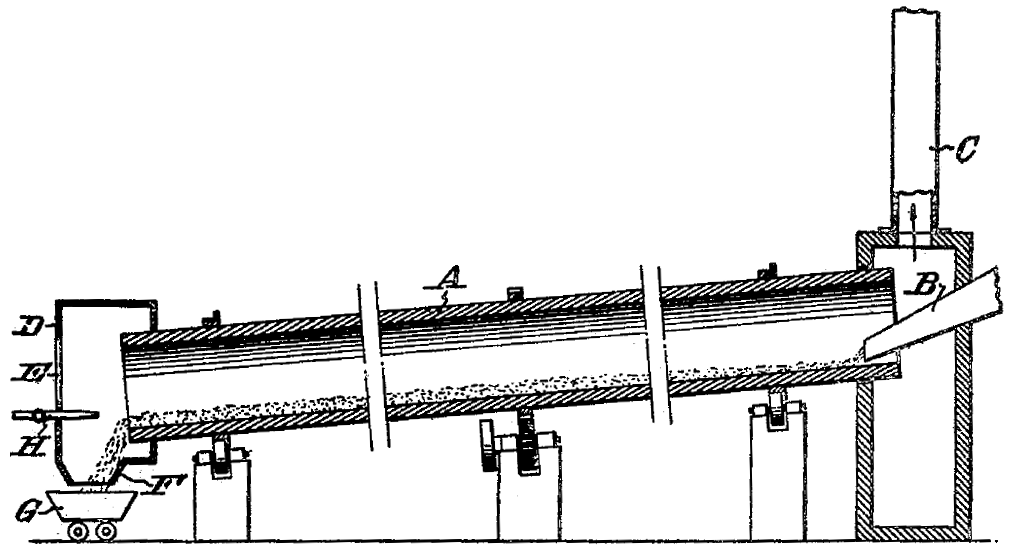
하지만 증기의 느린 냉각은 반응의 역전을 일으킬 수 있어, 빠른 냉각(quenching)이 필요하다.[40]
최근에는 고체 산화물 분리막 기술을 이용한 MgO 전해 환원 방법도 연구되고 있다. 이 방법은 이트리아 안정화 지르코니아(YSZ) 전해질을 사용하며, 액체 금속 양극에서 산소 기체가 발생한다.[41]
2017년 세계 마그네슘 생산량은 약 110만 톤이었으며, 대부분 중국(930만 톤)과 러시아(60만 톤)에서 생산되었다.[33] 미국은 20세기 주요 생산국이었으나, 중국이 피전 공정을 장악하면서 시장 점유율이 감소했다.[34] 2021년 중국 정부의 마그네슘 생산량 감축 조치로 가격이 크게 상승하기도 했다.[35] 주요 생산국은 중국, 미국, 러시아, 이스라엘, 카자흐스탄, 터키 등이다.[185][189]
6. 이용
마그네슘은 매우 가벼운 경합금 재료로 중요하며, 금속 마그네슘으로 다양한 합금의 주된 금속(합금의 기본이 되는 금속)이나 첨가제로 이용된다. 또한, 반응성이 높아서 탈산제나 탈황제, 그리고 유기 합성용 시약으로 없어서는 안 된다. 필수 원소이며, 식품과 의약품 외에도 사료, 비료로 널리 사용된다.
==== 합금 ====
마그네슘은 철과 알루미늄에 이어 세 번째로 많이 사용되는 구조용 금속이자 가장 가벼운 구조용 금속이다.[172][190][52] 순수한 마그네슘은 무르기 때문에 주로 합금 형태로 사용되며, 특히 알루미늄과의 합금을 만드는 데 많이 사용된다.[191] 마그네슘 합금은 가벼운 성질로 인해 자동차나 항공기의 엔진이나 동체 등 여러 부품에 사용되었고, 중량을 줄여 연료 소모를 최소화해야 하는 항공우주 분야에서 사용된다.[173][195]
알루미늄과의 합금은 가공하기 쉽고 가볍기 때문에 항공기, 미사일, 로켓에 사용되며,[196] 같은 이유로 야구에서 포수들이 쓰는 보호 장비와 편자, 골프채, 각종 스포츠 용품, 음료수 캔에도 사용된다. 방열성과 전자파를 차단하는 성질이 있어 휴대 전화, 노트북 컴퓨터, 카메라 등에도 사용된다.[69] 마그네슘 합금은 기계 가공 시간을 단축하고 동력을 절약하며, 마그네슘 합금으로 만든 공구의 수명도 연장시킨다.
2013년 기준 마그네슘 합금 소비량은 연간 100만 톤 미만이었던 반면, 알루미늄 합금은 5000만 톤이었다. 마그네슘 합금의 사용은 역사적으로 부식 경향,[18] 고온에서의 크리프 및 연소[19] 때문에 제한되어 왔다. 마그네슘 합금에서 철, 니켈, 구리, 코발트의 존재는 부식을 크게 촉진한다. 이러한 금속의 양을 제어하면 부식 저항성이 향상되지만, 정밀한 조성 제어가 필요하여 비용이 증가한다.[19] 음극 독극물을 첨가하면 금속 구조 내에 수소 원자를 포획하여 부식을 억제할 수 있다. 300분의 1 정도의 비소를 첨가하면 염 용액에서 마그네슘의 부식 속도가 거의 10배 감소한다.[19][20]
마그네슘은 고온에서 크리프(점진적인 변형)되는 경향이 있는데, 아연과 희토류 원소를 합금하면 이러한 경향이 감소한다.[21] 합금에 소량의 칼슘을 첨가하면 가연성이 감소한다.[19] 희토류 원소를 사용하면 마그네슘의 액상선 온도보다 높은 온도에서도 발화되지 않는 마그네슘 합금을 제조할 수 있다.[22]
역사적으로 마그네슘은 주요 항공우주 구조용 금속 중 하나였으며, 제1차 세계 대전부터 독일 군용기, 그리고 제2차 세계 대전에서 독일 항공기에 광범위하게 사용되었다. 독일은 마그네슘 합금에 "Elektron"이라는 이름을 지었는데, 이 용어는 오늘날에도 여전히 사용되고 있다. 상업용 항공우주 산업에서는 화재 및 부식 위험으로 인해 마그네슘은 일반적으로 엔진 관련 부품으로 제한되었다. 연료 효율의 중요성으로 인해 21세기에 항공우주 분야에서 마그네슘 합금의 사용이 증가하고 있다.[56]
메르세데스-벤츠는 초기 모델 메르세데스-벤츠 300 SLR의 차체에 엘렉트론 합금을 사용했다.[62] 포르쉐는 1971년 르망에서 우승한 917/053에 마그네슘 합금 프레임을 사용했으며, 무게 이점 때문에 엔진 블록에 마그네슘 합금을 계속 사용하고 있다.[63] 폭스바겐 그룹은 수년 동안 엔진 부품에 마그네슘을 사용해 왔으며,[64] 미쓰비시 자동차는 패들 시프터에 마그네슘을 사용한다.[65] BMW는 N52 엔진에 마그네슘 합금 블록을 사용했다.[66] 쉐보레는 2006년 코르벳 Z06에 마그네슘 합금 AE44를 사용했다.[67]
낮은 밀도와 우수한 기계적 및 전기적 특성으로 인해 마그네슘은 휴대전화, 노트북 및 태블릿 컴퓨터, 카메라 및 기타 전자 부품 제조에 사용된다.[69] 2020년대 일부 노트북에서는 가벼운 무게 때문에 고급 기능으로 사용되었다.[70]
아연과의 합금은 정밀 주조에 사용된다.[194]
==== 화합물 ====
마그네슘 화합물은 제산제, 완하제 등 의약품으로 널리 사용되며, 시멘트, 비료, 절연체 등의 생산에도 사용된다.[196][197] 산화 마그네슘(MgO)은 제철 및 비철 금속 제련, 유리와 시멘트 제조 시 용광로의 내화 물질로 사용된다.[91] 또한 엽록소 구성 성분인 마그네슘을 공급하기 위해 비료로 사용되기도 한다.[94][95]
수산화 마그네슘(Mg(OH)₂)은 제산제와 완하제로 사용된다.[23][24] 아황산 마그네슘(MgSO₃)은 종이 제조 공정 중 아황산법에 사용되며,[97] 황산 마그네슘 7수화물(MgSO₄·7H₂O)은 시멘트와 비료 생산, 염색, 피부 찰과상 치료제 등에 사용된다.[196][197]
탄산 마그네슘(MgCO₃)은 페인트나 잉크 제조에 이용되며, 관석의 성분이 될 수 있다. 식염에 첨가하여 수분 흡수를 줄이거나, 역도 선수나 등반가들이 습기 제거를 위해 사용하기도 한다.[196] 인산 마그네슘(Mg₃(PO₄)₂)은 건축용 불연성 목재에 사용되고,[98] 플루오린화 마그네슘(MgF₂)은 광학 렌즈의 반사 방지막으로 사용된다.
브로민화 마그네슘은 진정제로, 붕산 마그네슘, 황산 마그네슘, 살리실산 마그네슘은 소독제로 사용된다. 염화 마그네슘(MgCl₂)과 구연산 마그네슘은 마그네슘 보충제 등 의약품으로 사용된다.[198] 두부 제조에 사용되는 간수는 황산 마그네슘, 염화 마그네슘 등 여러 마그네슘 화합물을 포함하여 응고 작용을 한다.[147]
할로알케인과 반응시켜 알코올 등 유기 물질 합성에 사용되는 그리냐르 시약(RMgX)을 얻을 수 있다.[81][92] 마그네슘 화합물은 고무와 플라스틱 제조에도 이용된다.[197]
==== 불꽃놀이 및 조명 ====
마그네슘은 산소와 빠르게 반응하여 밝은 흰색 불꽃을 내며, 그 온도는 약 3100 °C까지 올라갈 수 있다.[79] 이러한 이유로 조난 시 구조 신호를 보낼 때 불을 피우는 부싯돌 역할을 할 수 있으며, 불꽃놀이의 불꽃을 낼 때도 마그네슘 분말이 사용된다. 카메라 플래시를 킬 때도 마그네슘 분말이 사용된다.
공기 중에서 마그네슘이 연소하면 강한 자외선 파장을 포함한 눈부신 흰색 빛을 생성한다. 초기 사진술에서는 피사체 조명으로 마그네슘 분말(섬광 분말)을 사용했다.[71][72] 나중에는 전기 점화식 일회용 사진 플래시 전구에 마그네슘 필라멘트가 사용되었다. 마그네슘 분말은 눈부신 흰색 빛이 필요한 폭죽과 해상 조명탄에 사용된다. 또한 번개,[74] 권총 발사 장면,[75] 초자연적인 등장[76]과 같은 다양한 연극 효과[73]에도 사용되었다.
마그네슘은 인화성이 높으며, 마그네슘 리본의 자연 발화 온도는 약 473 °C이다.[77] 마그네슘의 높은 연소 온도는 응급 화재를 시작하는 데 유용한 도구로 만든다. 마그네슘은 전쟁에서 소이탄 요소로 계속 사용되고 있다.[78]
==== 기타 활용 ====
마그네슘은 철보다 반응성이 커 지하에 매설된 철제 구조물의 희생 금속으로 사용된다. 우라늄이나 다른 금속의 염에서 금속을 얻을 때 환원제로 사용된다.[198] 선박, 지하 탱크, 파이프라인, 매설 구조물 및 온수기 등을 보호하기 위한 희생(갈바닉) 양극으로도 활용된다.[84]
강철에서 불순물로 포함된 황 성분을 제거하거나[192] 타이타늄을 생산하기 위한 크롤 법(Kroll process)에서 환원제로 사용되며,[193] 알루미늄과 합금하여 주로 음료 캔[85], 골프채[86], 낚시릴[87], 양궁 활 및 화살[88]과 같은 스포츠 용품에 사용되는 알루미늄-마그네슘 합금을 만든다.
많은 자동차 및 항공기 제조업체에서 마그네슘으로 엔진 및 차체 부품을 제작했다.[89] 마그네슘 전지는 일차 전지로 상용화되었으며, 충전식 전지에 대한 연구도 활발하게 진행되고 있다.[90]
6. 1. 합금
마그네슘은 철과 알루미늄에 이어 세 번째로 많이 사용되는 구조용 금속이자 가장 가벼운 구조용 금속이다.[172][190][52] 순수한 마그네슘은 무르기 때문에 주로 합금 형태로 사용되며, 특히 알루미늄과의 합금을 만드는 데 많이 사용된다.[191] 마그네슘 합금은 가벼운 성질로 인해 자동차나 항공기의 엔진이나 동체 등 여러 부품에 사용되었고, 중량을 줄여 연료 소모를 최소화해야 하는 항공우주 분야에서 사용된다.[173][195]알루미늄과의 합금은 가공하기 쉽고 가볍기 때문에 항공기, 미사일, 로켓에 사용되며,[196] 같은 이유로 야구에서 포수들이 쓰는 보호 장비와 편자, 골프채, 각종 스포츠 용품, 음료수 캔에도 사용된다. 방열성과 전자파를 차단하는 성질이 있어 휴대 전화, 노트북 컴퓨터, 카메라 등에도 사용된다.[69] 마그네슘 합금은 기계 가공 시간을 단축하고 동력을 절약하며, 마그네슘 합금으로 만든 공구의 수명도 연장시킨다.
2013년 기준 마그네슘 합금 소비량은 연간 100만 톤 미만이었던 반면, 알루미늄 합금은 5000만 톤이었다. 마그네슘 합금의 사용은 역사적으로 부식 경향,[18] 고온에서의 크리프 및 연소[19] 때문에 제한되어 왔다. 마그네슘 합금에서 철, 니켈, 구리, 코발트의 존재는 부식을 크게 촉진한다. 이러한 금속의 양을 제어하면 부식 저항성이 향상되지만, 정밀한 조성 제어가 필요하여 비용이 증가한다.[19] 음극 독극물을 첨가하면 금속 구조 내에 수소 원자를 포획하여 부식을 억제할 수 있다. 300분의 1 정도의 비소를 첨가하면 염 용액에서 마그네슘의 부식 속도가 거의 10배 감소한다.[19][20]
마그네슘은 고온에서 크리프(점진적인 변형)되는 경향이 있는데, 아연과 희토류 원소를 합금하면 이러한 경향이 감소한다.[21] 합금에 소량의 칼슘을 첨가하면 가연성이 감소한다.[19] 희토류 원소를 사용하면 마그네슘의 액상선 온도보다 높은 온도에서도 발화되지 않는 마그네슘 합금을 제조할 수 있다.[22]
역사적으로 마그네슘은 주요 항공우주 구조용 금속 중 하나였으며, 제1차 세계 대전부터 독일 군용기, 그리고 제2차 세계 대전에서 독일 항공기에 광범위하게 사용되었다. 독일은 마그네슘 합금에 "Elektron"이라는 이름을 지었는데, 이 용어는 오늘날에도 여전히 사용되고 있다. 상업용 항공우주 산업에서는 화재 및 부식 위험으로 인해 마그네슘은 일반적으로 엔진 관련 부품으로 제한되었다. 연료 효율의 중요성으로 인해 21세기에 항공우주 분야에서 마그네슘 합금의 사용이 증가하고 있다.[56]
메르세데스-벤츠는 초기 모델 메르세데스-벤츠 300 SLR의 차체에 엘렉트론 합금을 사용했다.[62] 포르쉐는 1971년 르망에서 우승한 917/053에 마그네슘 합금 프레임을 사용했으며, 무게 이점 때문에 엔진 블록에 마그네슘 합금을 계속 사용하고 있다.[63] 폭스바겐 그룹은 수년 동안 엔진 부품에 마그네슘을 사용해 왔으며,[64] 미쓰비시 자동차는 패들 시프터에 마그네슘을 사용한다.[65] BMW는 N52 엔진에 마그네슘 합금 블록을 사용했다.[66] 쉐보레는 2006년 코르벳 Z06에 마그네슘 합금 AE44를 사용했다.[67]
낮은 밀도와 우수한 기계적 및 전기적 특성으로 인해 마그네슘은 휴대전화, 노트북 및 태블릿 컴퓨터, 카메라 및 기타 전자 부품 제조에 사용된다.[69] 2020년대 일부 노트북에서는 가벼운 무게 때문에 고급 기능으로 사용되었다.[70]
이밖에도 강철에서 불순물로 포함된 황 성분을 제거하거나[192] 타이타늄을 생산하기 위한 크롤 법(Kroll process)에서 환원제로 사용되며,[193] 아연과의 합금은 정밀 주조에 사용된다.[194]
6. 2. 화합물
마그네슘 화합물은 제산제, 완하제 등 의약품으로 널리 사용되며, 시멘트, 비료, 절연체 등의 생산에도 사용된다.[196][197] 산화 마그네슘(MgO)은 제철 및 비철 금속 제련, 유리와 시멘트 제조 시 용광로의 내화 물질로 사용된다.[91] 또한 엽록소 구성 성분인 마그네슘을 공급하기 위해 비료로 사용되기도 한다.[94][95]수산화 마그네슘(Mg(OH)₂)은 제산제와 완하제로 사용된다.[23][24] 아황산 마그네슘(MgSO₃)은 종이 제조 공정 중 아황산법에 사용되며,[97] 황산 마그네슘 7수화물(MgSO₄·7H₂O)은 시멘트와 비료 생산, 염색, 피부 찰과상 치료제 등에 사용된다.[196][197]
탄산 마그네슘(MgCO₃)은 페인트나 잉크 제조에 이용되며, 관석의 성분이 될 수 있다. 식염에 첨가하여 수분 흡수를 줄이거나, 역도 선수나 등반가들이 습기 제거를 위해 사용하기도 한다.[196] 인산 마그네슘(Mg₃(PO₄)₂)은 건축용 불연성 목재에 사용되고,[98] 플루오린화 마그네슘(MgF₂)은 광학 렌즈의 반사 방지막으로 사용된다.
브로민화 마그네슘은 진정제로, 붕산 마그네슘, 황산 마그네슘, 살리실산 마그네슘은 소독제로 사용된다. 염화 마그네슘(MgCl₂)과 구연산 마그네슘은 마그네슘 보충제 등 의약품으로 사용된다.[198] 두부 제조에 사용되는 간수는 황산 마그네슘, 염화 마그네슘 등 여러 마그네슘 화합물을 포함하여 응고 작용을 한다.[147]
할로알케인과 반응시켜 알코올 등 유기 물질 합성에 사용되는 그리냐르 시약(RMgX)을 얻을 수 있다.[81][92] 마그네슘 화합물은 고무와 플라스틱 제조에도 이용된다.[197]
6. 3. 불꽃놀이 및 조명
마그네슘은 산소와 빠르게 반응하여 밝은 흰색 불꽃을 내며, 그 온도는 약 3100 °C까지 올라갈 수 있다. 이러한 이유로 조난 시 구조 신호를 보낼 때 불을 피우는 부싯돌 역할을 할 수 있으며, 불꽃놀이의 불꽃을 낼 때도 마그네슘 분말이 사용된다. 카메라 플래시를 킬 때도 마그네슘 분말이 사용된다.공기 중에서 마그네슘이 연소하면 강한 자외선 파장을 포함한 눈부신 흰색 빛을 생성한다. 초기 사진술에서는 피사체 조명으로 마그네슘 분말(섬광 분말)을 사용했다.[71][72] 나중에는 전기 점화식 일회용 사진 플래시 전구에 마그네슘 필라멘트가 사용되었다. 마그네슘 분말은 눈부신 흰색 빛이 필요한 폭죽과 해상 조명탄에 사용된다. 또한 번개,[74] 권총 발사 장면,[75] 초자연적인 등장[76]과 같은 다양한 연극 효과[73]에도 사용되었다.
마그네슘은 인화성이 높으며, 마그네슘 리본의 자연 발화 온도는 약 473 °C이다.[77] 마그네슘의 높은 연소 온도는 응급 화재를 시작하는 데 유용한 도구로 만든다. 마그네슘은 전쟁에서 소이탄 요소로 계속 사용되고 있다.[78]
6. 4. 기타 활용
마그네슘은 철보다 반응성이 커 지하에 매설된 철제 구조물의 희생 금속으로 사용된다. 우라늄이나 다른 금속의 염에서 금속을 얻을 때 환원제로 사용된다.[198] 선박, 지하 탱크, 파이프라인, 매설 구조물 및 온수기 등을 보호하기 위한 희생(갈바닉) 양극으로도 활용된다.[84]아연과 합금하여 인쇄 산업의 사진조각판, 건전지 벽 및 옥상 방수에 사용되는 아연판을 생산하며,[53] 알루미늄과 합금하여 주로 음료 캔[85], 골프채[86], 낚시릴[87], 양궁 활 및 화살[88]과 같은 스포츠 용품에 사용되는 알루미늄-마그네슘 합금을 만든다.
많은 자동차 및 항공기 제조업체에서 마그네슘으로 엔진 및 차체 부품을 제작했다.[89] 마그네슘 전지는 일차 전지로 상용화되었으며, 충전식 전지에 대한 연구도 활발하게 진행되고 있다.[90]
7. 생물에서의 역할
사람의 몸에서는 칼슘, 인과 함께 뼈의 대사에 중요한 역할을 한다.[126] 또한 마그네슘은 리보솜의 구조 유지 및 단백질 합성, 그 외 에너지 대사 관련 생체 기능에 필수적인 원소이기 때문에, 마그네슘 결핍은 골다공증, 허혈성 심장 질환, 당뇨병 등의 원인 중 하나로 생각되고 있다.[154]
인체에는 약 25g의 마그네슘이 존재하며,[154] 그 50~60%가 인산염으로 뼈 조직에[154], 나머지는 혈장, 적혈구, 근육 등 각 조직에 존재한다. 혈청 중의 마그네슘은 약 75~85%가 이온이나 염류 형태의 투석형이며, 나머지 15~25%는 알부민 등과 결합한 단백결합형(비투석형)으로 존재하며, 그 농도는 대략 1.8~2.3 정도로 유지된다.[154]
생체 내에서 마그네슘은 주로 뼈의 표면 근처에 마그네슘 이온으로 저장되고, 대사가 부족한 경우 칼슘 이온과 교체되어 마그네슘이 체내에 보충된다. 마그네슘의 생체 내 영양소 및 약리적인 작용에 대해서는 광범위하게 연구되고 있지만, 아직 중요한 면에 대해서는 불명확한 점이 많다.
최근에는 미네랄 성분의 하나로 영양 보충제나 청량 음료 등에 첨가되는 경우가 많아지고 있다.
동물이 직접 음식물에서 섭취하는 경우에는 다른 무기물(인이나 칼슘)과의 균형을 적절히 하지 않으면 요로 결석 등의 원인이 될 수 있다는 것이 알려져 있다. 이를 받아들여 고양이용 사료는 조성 중의 마그네슘을 줄이도록 개량되었다.
식물은 엽록소를 합성하는 데 마그네슘이 필요하며, 엽록소는 광합성에 필수적이다.[126] 엽록소의 포르피린 고리 중앙에 있는 마그네슘은 헤모글로빈의 포르피린 고리 중앙에 있는 철과 유사한 기능을 한다. 식물의 마그네슘 결핍은 특히 오래된 잎에서 늦여름 잎맥 사이의 황변을 유발하며,[127] 에프섬염(빠르게 용탈됨) 또는 분쇄된 돌로마이트 석회암을 토양에 사용하여 교정할 수 있다.
정제·가공하지 않은 식품에 널리 포함되어 있으며, 참깨와 아몬드 등의 종실류, 톳 등의 해조류에 많고, 가공식품에는 적다.
마그네슘은 식물의 광합성 색소인 클로로필에 포함되어 빛을 받아들이는 역할을 한다. 따라서 마그네슘이 결핍되면 식물의 생육이 감소하고 수확량 감소로 이어진다. 이는 사질토에서 자라는 식물에 특히 나타난다. 칼륨이 풍부하게 포함된 토양에서도 식물에 대한 마그네슘의 공급이 어려워지는 것으로 알려져 있다. 따라서 비료로 마그네슘 화합물을 포함한 것이 사용되는 경우가 있다.
식물은 마그네슘이 부족해지면 작은 잎의 엽맥 사이가 황변하는 증상이 나타난다.[153]
마그네슘 과다에 의한 식물에 대한 영향은 불명확하다.[153]
7. 1. 인체에서의 역할
마그네슘은 인체에서 다양한 역할을 수행하는 필수 미네랄이다. 칼슘이 근수축에 필요한 반면, 마그네슘은 근육 이완에 필수적이다.[179] 세포 내외의 칼슘과 마그네슘 이동은 정상적인 근육 수축 및 이완, 심장 박동을 가능하게 한다.[179]마그네슘은 신경계 흥분을 진정시키는 "항스트레스 미네랄"로 불리며,[179] 에너지 생성, 영양 대사, 신경 전도, 뼈와 치아 형성 유지에 필수적이다.[179] 또한, 모든 생명체 세포의 핵산 화학에 필수적인데, 300개가 넘는 효소가 마그네슘 이온을 필요로 하며, 여기에는 아데노신 삼인산(ATP)을 사용하거나 합성하는 효소, DNA와 RNA 합성에 관여하는 효소가 포함된다.[100] ATP 분자는 일반적으로 마그네슘 이온과 킬레이트를 형성한다.[100]

향신료, 견과류, 시리얼, 코코아, 채소, 시금치와 같은 녹색 잎채소는 마그네슘의 좋은 공급원이다.[101][102]
성인의 몸에는 22~26g의 마그네슘이 함유되어 있으며,[101][107] 60%는 뼈에, 39%는 세포 내(그중 20%는 골격근), 1%는 세포 외에 존재한다.[101] 혈청 마그네슘 수치는 0.7~1.0 mmol/L이며, 세포 내 마그네슘이 부족해도 정상 수치를 유지할 수 있다.[101] 세포 내 마그네슘은 칼륨과 상관관계가 있으며, 마그네슘 증가는 칼슘 수치에 영향을 줄 수 있다.[108]
마그네슘은 변비 치료나 위산 과다에 제산제로도 사용되는 의약품 성분이다.[179] 황산마그네슘은 목욕제나 설사약으로, 수산화마그네슘은 제산제와 설사약으로 사용된다. 염화마그네슘, 산화물, 구연산염 등은 경구 마그네슘 보충제로 사용된다.
제제와 영양 보충제가 다양하게 시판되고 있으며, 산화마그네슘은 다른 구연산마그네슘, 염화마그네슘, 젖산마그네슘, 아스파르트산마그네슘보다 생체 이용률이 낮았다.[105][106]
torsades de pointes와 관련된 심실 부정맥 환자나 긴 QT 증후군 환자에게 정맥 마그네슘 투여가 권장되며, 디곡신 유발 부정맥 치료에도 사용된다.[117] 황산마그네슘 정맥 주사는 전자간증과 자간증 치료에 사용된다.[118][119] 저마그네슘혈증은 경구 또는 비경구 마그네슘 투여로 회복 가능하다.[120] 마그네슘 보충제는 편두통 예방 및 치료에 역할을 할 수 있다는 제한적인 증거가 있다.[121]
식품 섭취만으로는 마그네슘 과다 복용이 일어나기 어렵지만, 신장 기능이 저하된 경우 과다 복용 가능성이 높아진다. 보충제 과다 섭취 시 메스꺼움, 구토, 설사, 저혈압, 혼란, 심박수 및 호흡 감소, 혼수, 심장 부정맥, 심장 정지 등이 나타날 수 있다.[108]
7. 2. 마그네슘 결핍
마그네슘은 대부분 뼈를 포함한 조직에 있고, 혈액에는 1% 미만 정도만 존재한다. 따라서 혈액 검사만으로는 체내 마그네슘 충분 여부를 정확히 판단하기 어렵다.[179] 마그네슘 상태는 혈청 및 적혈구 마그네슘 농도와 함께 요 및 변 마그네슘 함량을 측정하여 평가할 수 있지만, 정맥 내 마그네슘 부하 검사가 더 정확하고 실용적이다.[110] 주입량의 20% 이상이 체내에 남아 있으면 결핍을 나타낸다.[111]탄산음료, 정제당류, 카페인, 술 등의 섭취는 콩팥을 통해 마그네슘 배출을 촉진한다.[179] 또한 칼슘 보충제나 심장약, 혈압약으로 쓰이는 이뇨제는 마그네슘 흡수를 감소시킬 수 있다.[179]
마그네슘이 결핍되면 불안, 과민 반응, 불면증이 나타날 수 있다.[179] 또한, 깊은 잠을 자기 어려워지고 근경련, 근육 마비나 저림, 눈 밑 떨림, 얼굴 경련 등이 나타날 수 있다.[179] 만성적인 마그네슘 섭취 부족은 지방세포에서 분비되는 아디포넥틴의 감소를 초래하여, 2형 당뇨병 발병 위험을 증가시킨다.[160] 우울증과도 관련이 있는데, 마그네슘 결핍 상태에서는 흥분성 글루탐산 신경의 NMDA 수용체 억제가 제대로 이루어지지 않아[161] 신경 독성에 의해 우울증이 발생할 수 있다는 가설이 있다. NMR 측정 결과, 항우울제는 뇌 내 마그네슘 양을 증가시키는 작용이 있으며, 마그네슘 투여가 우울증 치료에 효과가 있다는 보고도 있다.[163]
알코올 중독은 종종 마그네슘 결핍과 관련이 있다.[116] 만성적으로 낮은 혈청 마그네슘 수치는 대사 증후군, 2형 당뇨병, 근섬유속수축, 고혈압과 관련이 있다.[116] 2022년 1월, 미국 식품의약국(FDA)은 마그네슘 섭취가 고혈압 위험을 감소시킬 가능성이 있음을 보여주는 건강 강조 표시를 기업이 사용하는 것에 반대하지 않겠다고 발표했다.[166]
8. 위험성
마그네슘 화합물은 대체로 무해하지만, 순수한 마그네슘과 그 합금은 용융된 상태이거나 분말, 얇은 박 형태일 때 가연성이 높고 폭발의 위험이 있다.[199] 마그네슘을 연소시키는 실험을 할 때는 항상 보안경을 착용해야 하는데, 이는 연소 시 발생하는 밝은 불꽃에는 자외선 영역의 빛도 포함되어 있어 망막을 손상시킬 위험이 있기 때문이다.[199][130]
마그네슘은 물과 반응하여 가연성이 큰 수소 기체(H2)를 발생시키고,[200][131] 이산화 탄소(CO2)와도 반응하여 산화마그네슘과 탄소를 생성할수 있다.[200][132] 따라서 물이나 이산화 탄소를 이용한 소화기로는 마그네슘에 의한 화재를 진화할 수 없다.[200] 마그네슘의 연소로 인한 화재는 마른 모래로 덮거나 D종 건조 화학 분말 소화기를 사용하여 공기 접촉을 차단 해야한다.[133]
미세한 마그네슘 분말은 가연성이 매우 크고 공기 중에서 폭발의 위험이 있으며, 노출될 경우 눈이나 호흡기에 자극을 줄 수 있다.[201]
실제로 마그네슘 폭발 및 화재로 인해 인명피해가 발생한 사례는 다음과 같다.
- 1957년 12월 26일, 아이치현 나고야시 나카구 신에이초의 사진 장비점에서 마그네슘이 폭발하여 10명이 사망하고 27명이 중경상을 입었다.[168]
- 2014년 5월 13일, 도쿄도 마치다시의 금속 가공 회사에서 마그네슘이 발화하여 1명이 사망하고 7명이 중경상을 입었다. 공장 측이 마그네슘 취급을 신고하지 않아 소방대가 계속 물을 뿌려 피해가 확대되었다.[169]
- 2018년 9월, 효고현 고베시 히가시나다구 로코아이랜드에서 보관 중이던 컨테이너에서 화재가 발생했다. 마그네슘을 보관하던 컨테이너가 제21호 태풍의 영향으로 침수된 것이 원인이었으며, 1개월 이상 불이 계속되었다.[170]
참조
[1]
서적
Rumble
[2]
서적
Selected Values of the Crystallographic Properties of Elements
ASM International
2018-01-01
[3]
서적
Rumble
[4]
서적
Rumble
[5]
서적
Rumble
[6]
서적
Physical Properties and Interrelationships of Metallic and Semimetallic Elements
1964-01-01
[7]
서적
Rumble
[8]
웹사이트
The chemical composition of seawater
http://www.seafriend[...]
2006-01-01
[9]
웹사이트
alkaline-earth metal – Physical and chemical behaviour
https://www.britanni[...]
2022-03-27
[10]
논문
A rare-earth free magnesium alloy with improved intrinsic ductility
2017-01-01
[11]
논문
Super-formable pure magnesium at room temperature
2017-01-01
[12]
웹사이트
Reactions of Group 2 Elements with Water
https://chem.librete[...]
2022-03-27
[13]
웹사이트
Magnesium
https://mmta.co.uk/m[...]
2023-11-08
[14]
논문
The formation of magnesium perperoxide Mg(O2)2 in the reaction of magnesium peroxide with ozone
1970-03-01
[15]
논문
Synthesis and characterization of magnesium nitride powder formed by Mg direct reaction with N2
2010-01-01
[16]
웹사이트
The rate of reaction of magnesium with hydrochloric acid
https://edu.rsc.org/[...]
2023-11-08
[17]
논문
Strongly reducing magnesium(0) complexes
2021-04-29
[18]
논문
Corrosion of magnesium
1993-01-01
[19]
웹사이트
Stainless magnesium breakthrough bodes well for manufacturing industries
http://www.gizmag.co[...]
Gizmag.com
2013-08-29
[20]
논문
Poisoning the corrosion of magnesium
2013-01-01
[21]
논문
Exceptional increase in the creep life of magnesium rare-earth alloys due to localized bond stiffening
2017-12-08
[22]
논문
Controlling the ignition and flammability of magnesium for aerospace applications
2014-09-01
[23]
웹사이트
8 Types of magnesium and their benefits
https://www.medicaln[...]
2024-05-04
[24]
웹사이트
Chemistry of Magnesium (Z=12)
https://chem.librete[...]
2024-05-04
[25]
논문
Hydrogen Storage Properties of Magnesium Hydride with V-Based Additives
2014-09-25
[26]
논문
Magnesium-Based Materials for Hydrogen Storage—A Scope Review
2020-09-09
[27]
웹사이트
Abundance and form of the most abundant elements in Earth's continental crust
https://web.archive.[...]
2008-02-15
[28]
웹사이트
Magnesium EA65RS-T4 Alloy
https://www.azom.com[...]
2024-05-04
[29]
웹사이트
Magnesium Statistics and Information
https://www.usgs.gov[...]
2024-05-04
[30]
논문
Evaluation of the Purity of Magnesium Hydroxide Recovered from Saltwork Bitterns
2022-12-21
[31]
웹사이트
Magnesium processing
https://www.britanni[...]
2024-05-04
[32]
웹사이트
Magnesium metal is produced by the electrolysis of molten magnesi...
https://www.pearson.[...]
2024-05-04
[33]
간행물
Magnesium Metal
https://minerals.usg[...]
U.S. Geological Survey
2019-02-01
[34]
웹사이트
Man With Many Enemies
https://www.forbes.c[...]
2013-06-06
[35]
잡지
What to do about the magnesium shortage
https://www.cips.org[...]
2022-02-17
[36]
논문
Ullmann's Encyclopedia of Industrial Chemistry
Wiley
2003
[37]
웹사이트
Magnesium Processing Techniques & Methods Britannica
https://www.britanni[...]
2023-04-16
[38]
서적
Magnesium and its alloys : technology and applications
https://www.worldcat[...]
CRC Press, Inc.
2020
[39]
논문
Development of a novel electrolytic process for producing high-purity magnesium metal from magnesium oxide using a liquid tin cathode
2021-09
[40]
논문
The carbothermic route to magnesium
http://dx.doi.org/10[...]
2006-05
[41]
논문
The Use of Solid-Oxide-Membrane Technology for Electrometallurgy
2007
[42]
웹사이트
Solid Oxide Membrane (SOM) Electrolysis of Magnesium: Scale-Up Research and Engineering for Light-Weight Vehicles
https://web.archive.[...]
MOxST
2011-05-12
[43]
논문
Chemical Synthesis Using Highly Reactive Metals
2017
[44]
논문
Active Metals
1995
[45]
논문
ChemInform Abstract: ACTIVATED METALS PART 4, PREPARATION AND REACTIONS OF HIGHLY REACTIVE MAGNESIUM METAL
1974
[46]
웹사이트
Magnesium: historical information
http://www.webelemen[...]
webelements.com
2014-10-09
[47]
웹사이트
Magnet
http://languagehat.c[...]
2005-05-28
[48]
논문
Epsom's deep bath
2013-06-01
[49]
웹사이트
Magnesium Sulfate Heptahydrate
https://pubchem.ncbi[...]
PubChem
2024-04-28
[50]
논문
Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia
1808
[51]
웹사이트
Magnesium (Mg) - Periodic Table
https://www.periodic[...]
2024-05-04
[52]
서적
Materials for the 21st Century
https://books.google[...]
Oxford University Press
2017
[53]
서적
Magnesium and magnesium alloys
Materials Information Society
1999
[54]
백과사전
Ullmann's Encyclopedia of Industrial Chemistry
Wiley-VCH
2002
[55]
웹사이트
UCLA researchers create super-strong magnesium metal
http://newsroom.ucla[...]
ucla.edu
2015-12-23
[56]
논문
Magnesium Alloys Development towards the 21st Century
2000
[57]
논문
Magnesium Alloys: An Alternative for Aluminium in Structural Applications
2010-12
[58]
웹사이트
Magnesium alloy as a lighter alternative to aluminum alloy
https://phys.org/new[...]
2017-11-29
[59]
논문
Condensed-phase modifications in magnesium particle combustion in air
[60]
서적
Mission to Tokyo: The American Airmen Who Took the War to the Heart of Japan
https://books.google[...]
Zenith Press
2012
[61]
서적
AAHS Journal
https://books.google[...]
American Aviation Historical Society
1999
[62]
뉴스
On Auto Racing's Deadliest Day
https://www.nytimes.[...]
2015-06-11
[63]
웹사이트
The 1971 Porsche 917 KH Had a Chassis Made of Ultra-Flammable Magnesium
https://www.roadandt[...]
2021-07-01
[64]
웹사이트
1950: The metal is magnesium, the car is the Beetle
https://www.hydro.co[...]
2020-08-18
[65]
웹사이트
2007 Mitsubishi Outlander brings sport sedan dynamics to compact sport-utility vehicle segment; performance credentials include 220 Hp V-6, 6-speed Sportronic(R) transmission and aluminum roof
http://media.mitsubi[...]
2006-04-12
[66]
논문
Review:Mg and Its Alloy——Scope, Future Perspectives and Recent Advancements in Welding and Processing
2017
[67]
논문
SAE Technical Paper Series
2005-04-11
[68]
보고서
Tensile and Compressive Creep of Magnesium-Aluminum-Calcium Based Alloys
https://web.archive.[...]
Materials & Processes Laboratory, General Motors Research & Development Center
2001
[69]
논문
Evaluation of Mechanical Properties of Magnesium [AZ91] Reinforced With Carbon Nanotubes And Sic/Al2O3
https://web.archive.[...]
2020
[70]
뉴스
Blue magnesium alloy laptops: Premium price, plastic feel, but lightweight
https://www.zdnet.co[...]
ZDNet
2020-01-02
[71]
서적
Encyclopedia of Nineteenth-Century Photography
Routledge
2013
[72]
서적
Scientific American: Supplement
https://books.google[...]
Munn and Company
[73]
서적
Billboard
https://archive.org/[...]
Nielsen Business Media, Inc.
[74]
서적
Silent Film Sound
Columbia University Press
2004
[75]
서적
Madness in the Making: The Triumphant Rise and Untimely Fall of America's Show Inventors
iUniverse
2005
[76]
서적
Popular Puppet Theatre in Europe, 1800-1914
Cambridge University Press
2005
[77]
웹사이트
Magnesium (Powder)
http://www.inchem.or[...]
IPCS INCHEM
2011-12-21
[78]
웹사이트
9N510 (ML-5) Submunition
https://cat-uxo.com/[...]
Collective Awareness to UXO
2022-11-22
[79]
학술지
Condensed-phase modifications in magnesium particle combustion in air
2000
[80]
서적
DOE Handbook – Primer on Spontaneous Heating and Pyrophoricity
http://www.hss.doe.g[...]
United States Department of Energy
2011-12-21
[81]
웹사이트
Grignard Reagents For Addition To Aldehydes and Ketones
https://www.masteror[...]
2024-05-04
[82]
웹사이트
Periodic Table of Elements: Los Alamos National Laboratory
https://periodic.lan[...]
2024-05-04
[83]
학술지
Magnesium reduction of uranium oxide
1974-07-00
[84]
웹사이트
Sacrificial Anode
https://chem.librete[...]
2024-05-04
[85]
웹사이트
Strong and Ductile: Magnesium Adds Benefits to Aluminum Alloys
https://www.belmontm[...]
2024-05-04
[86]
웹사이트
Golf Clubheads: Material Differences
https://www.hirekogo[...]
[87]
웹사이트
How Aluminum Changed Fly Fishing Forever
https://www.flyfishe[...]
2024-05-04
[88]
웹사이트
Compound Bow – Facts and History of Modern Bows
http://www.historyof[...]
2024-05-04
[89]
웹사이트
Automotive Applications - International Magnesium Association
https://www.intlmag.[...]
2024-05-04
[90]
학술지
Reversibility of a High-Voltage, Cl – Regulated, Aqueous Mg Metal Battery Enabled by a Water-in-Salt Electrolyte
https://pubs.acs.org[...]
2023-06-25
[91]
서적
Basic Electrical Installation Work
Taylor & Francis
2011
[92]
서적
Organic Chemistry
Pearson
[93]
웹사이트
Magnesium-Rich Food Information
https://my.cleveland[...]
2024-05-04
[94]
웹사이트
Magnesium for crop production
https://extension.um[...]
2024-05-04
[95]
학술지
Physiological Essence of Magnesium in Plants and Its Widespread Deficiency in the Farming System of China
2022-04-25
[96]
학술지
Increasing Growth Yield and Decreasing Acetylation in Escherichia coli by Optimizing the Carbon-to-Magnesium Ratio in Peptide-Based Media
2017-03-15
[97]
웹사이트
Magnesium sulfite - Hazardous Agents {{!}} Haz-Map
https://haz-map.com/[...]
2024-05-04
[98]
학술지
Synthesis and application of novel magnesium phosphate ester flame retardants for transparent intumescent fire-retardant coatings applied on wood substrates
2019-04-00
[99]
웹사이트
NCATS Inxight Drugs — MAGNESIUM HEXAFLUOROSILICATE
https://drugs.ncats.[...]
2024-05-04
[100]
서적
Interrelations between Essential Metal Ions and Human Diseases
Springer
2013
[101]
웹사이트
Dietary Supplement Fact Sheet: Magnesium
http://ods.od.nih.go[...]
Office of Dietary Supplements, US National Institutes of Health
2016-10-13
[102]
웹사이트
Magnesium in diet
https://medlineplus.[...]
MedlinePlus, U.S. National Library of Medicine, National Institutes of Health
2016-10-13
[103]
웹사이트
Vitamins and minerals – Others – NHS Choices
http://www.nhs.uk/Co[...]
Nhs.uk
2013-09-19
[104]
서적
Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride
National Academy Press
[105]
학술지
Bioavailability of US commercial magnesium preparations
2001
[106]
논문
Magnesium bioavailability from magnesium citrate and magnesium oxide
1990-01-01
[107]
논문
Magnesium. An update on physiological, clinical and analytical aspects
2000-04-01
[108]
웹사이트
Magnesium
http://umm.edu/healt[...]
University of Maryland Medical Center
2013-05-07
[109]
논문
Magnesium
1987-01-01
[110]
논문
Update on the assessment of magnesium status
2008-01-01
[111]
논문
Can one really measure magnesium deficiency using the short-term magnesium loading test?
1999-01-01
[112]
논문
A functional biological marker is needed for diagnosing magnesium deficiency
2004-01-01
[113]
서적
Disposition of Toxic Drugs and Chemicals in Man
Biomedical Publications
[114]
논문
Contemporary view of the clinical relevance of magnesium homeostasis
2014-03-01
[115]
논문
Suboptimal magnesium status in the United States: are the health consequences underestimated?
http://www.nutrition[...]
2012-03-01
[116]
논문
Magnesium in disease
2012-01-01
[117]
논문
ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society
2012-01-01
[118]
논문
Magnesium in obstetrics
2010-01-01
[119]
논문
Magnesium Sulfate for the Treatment of Eclampsia: A Brief Review
[120]
서적
Drugs of Abuse
Physicians Management Information Co.
1997-01-01
[121]
Review
An evidence-based review of oral magnesium supplementation in the preventive treatment of migraine
[122]
서적
The Fertilizer Encyclopedia
https://books.google[...]
John Wiley & Sons
2009-04-08
[123]
논문
Fatal Hypermagnesemia in a Child Treated with Megavitamin/Megamineral Therapy
2000-02-01
[124]
논문
Hypermagnesemia induced by massive cathartic ingestion in an elderly woman without pre-existing renal dysfunction
2005-01-01
[125]
논문
Severe Hypermagnesemia as a Result of Excessive Cathartic Ingestion in a Child Without Renal Failure
2000-02-01
[126]
웹사이트
Magnesium
https://www.tfi.org/[...]
The Fertilizer Institute
[127]
웹사이트
What Is the Connection between Chlorophyll and Magnesium?
http://www.allthings[...]
2023-06-12
[128]
웹사이트
Magnesium rod, diam. 6mm, 99.9+ trace metals 7439-95-4
https://www.sigmaald[...]
[129]
웹사이트
MAGNESIUM
https://cameochemica[...]
National Oceanic and Atmospheric Administration
[130]
웹사이트
Science Safety: Chapter 8
http://www.edu.gov.m[...]
Government of Manitoba
[131]
웹사이트
Chemistry : Periodic Table : magnesium : chemical reaction data
http://www.webelemen[...]
webelements.com
[132]
웹사이트
The Reaction Between Magnesium and CO2
http://chemed.chem.p[...]
Purdue University
[133]
서적
Operation of Fire Protection Systems
Jones & Bartlett Learning
2003-01-01
[134]
논문
The spectrum of magnesium hydride
http://bernath.uwate[...]
[135]
웹사이트
WEBSTER'S DICTIONARY, 1913
http://www.encyclo.c[...]
[136]
웹사이트
芝哲夫「認定化学遺産 第001号 杏雨書屋蔵 宇田川榕菴 化学関係資料」
https://www.chemistr[...]
公益社団法人日本化学会
[137]
웹사이트
magnesium nitride
https://webbook.nist[...]
[138]
웹사이트
magnesium oxide
https://webbook.nist[...]
[139]
뉴스
東京・町田「マグネシウム火災」工場 無許可操業で過去にも同様の火災!市は放置
https://www.j-cast.c[...]
J-CASTニュース
2015-11-06
[140]
뉴스
金属工場火災、鎮火のめど立たず 1人重体、7人重軽傷
https://www.sankei.c[...]
産経ニュース
2015-11-06
[141]
웹사이트
マグネシウムの基礎知識:安全な取扱い
http://magnesium.or.[...]
2015-10-06
[142]
웹사이트
安全データシート-国産化学-硫酸リチウム
http://www.kokusan-c[...]
2020-06-12
[143]
웹사이트
安全データシート-国産化学-硫酸マグネシウム
http://www.kokusan-c[...]
2020-06-12
[144]
서적
レイナーキャナム無機化学(原著第4版)
東京化学同人
2016-10-20
[145]
웹사이트
2.7 マグネシウム(Mg)
https://web.archive.[...]
2013-01-21
[146]
웹사이트
日本マグネシウム協会
http://www.magnesium[...]
[147]
웹사이트
日本豆腐協会│豆腐のあれこれQ&A Q2. 凝固剤にはどんなものがあるのでしょうか?
http://www.tofu-as.c[...]
[148]
웹사이트
東工大クロニクルNo.402「太陽光レーザー、水、マグネシウムによる革新的エネルギーサイクル」
http://www.titech.ac[...]
2013-03-20
[149]
간행물
日本人の食事摂取基準(2015年版)の概要
https://www.mhlw.go.[...]
厚生労働省
2014-03-28
[150]
웹사이트
第6次改定日本人の栄養所要量について
https://www.mhlw.go.[...]
[151]
간행물
「日本人の食事摂取基準(2015 年版)の概要」 p.32
https://www.mhlw.go.[...]
[152]
웹사이트
マグネシウム
http://hfnet.nih.go.[...]
[153]
간행물
岐阜県街路樹等整備・管理の手引き
https://www.gifu.crc[...]
岐阜県建設研究センター、岐阜県造園緑化協会
2022-04-23
[154]
간행물
「日本人の食事摂取基準(2015年版)策定検討会」報告書 p.262
https://www.mhlw.go.[...]
[155]
웹사이트
8.マグネシウムの再吸収異常と生活習慣病との関連性について
http://w3pharm.u-shi[...]
[156]
서적
専門領域の最新情報 最新栄養学
建帛社
[157]
웹사이트
マグネシウム
[158]
웹사이트
製品安全データシート 0.01mol/1(M/100)-塩化マグネシウム溶液
http://www.kishida.c[...]
[159]
웹사이트
マグネシウム摂取と大腸がんとの関連について JPHC Study 多目的コホート研究
http://epi.ncc.go.jp[...]
[160]
뉴스
マグネシウム摂取不足の解消こそが糖尿病の増加を抑える
https://medical.nikk[...]
日経メディカルオンライン
2012-05-22
[161]
일반
[162]
논문
Efficacy and safety of oral magnesium supplementation in the treatment of depression in the elderly with type 2 diabetes: a randomized, equivalent trial
[163]
논문
Magnesium for treatment-resistant depression: a review and hypothesis
http://www.medical-h[...]
[164]
논문
Rapid recovery from major depression using magnesium treatment
http://www.medical-h[...]
[165]
논문
Relations of Dietary Magnesium Intake to Biomarkers of Inflammation and Endothelial Dysfunction in an Ethnically Diverse Cohort of Postmenopausal Women
http://www.medical-h[...]
[166]
웹사이트
FDA Announces Qualified Health Claim for Magnesium and Reduced Risk of High Blood Pressure
https://www.fda.gov/[...]
2022-01-10
[167]
웹사이트
Your "Prescription" - Sleep and the Brain
https://www.coursera[...]
2022-03-19
[168]
서적
日本災害史事典 1868-2009
日外アソシエーツ
[169]
뉴스
指導無視、マグネシウム届け出ず 町田工場火災、初動で消防隊が放水、爆発・炎上
https://www.sankei.c[...]
産経新聞
2014-05-27
[170]
뉴스
コンテナ火災、台風後1カ月鎮火せず 放水で爆発の恐れ
https://www.asahi.co[...]
朝日新聞DIGITAL
2018-10-05
[171]
웹인용
10 Most Abundant Elements in the Universe
http://education.jla[...]
[172]
웹인용
가장 가벼운 구조체용 금속, 마그네슘
http://navercast.nav[...]
2011-10-26
[173]
웹인용
Encyclopaedia Britannica: 마그네슘
http://preview.brita[...]
2014-10-29
[174]
논문
Condensed-phase modifications in magnesium particle combustion in air
[175]
웹인용
Magnesium Compounds
http://www.webelemen[...]
[176]
웹인용
Magnesium Encyclopedia - Properties
http://www.magnesium[...]
2014-10-30
[177]
웹인용
Chemical reactions of the elements - Magnesium
http://www.webelemen[...]
[178]
서적
완자 화학 Ⅰ(1권)
비유와상징
2006-07-01
[179]
웹인용
칼슘만큼 소중한 마그네슘의 재발견 - 당신의 건강가이드 헬스조선
http://health.chosun[...]
2019-05-11
[180]
저널
Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia
http://books.google.[...]
[181]
웹인용
Magnesium Encyclopedia - Useful Info
http://www.magnesium[...]
2014-10-30
[182]
웹인용
Abundance and form of the most abundant elements in Earth’s continental crust.
http://www.gly.uga.e[...]
2014-10-28
[183]
웹인용
10 Most Abundant Elements in the Earth's Crust
http://education.jla[...]
[184]
웹인용
10 Most Abundant Compounds in the Earth's Crust
http://education.jla[...]
[185]
웹인용
Magnesium - Element Information, properties, and uses
http://www.rsc.org/p[...]
[186]
서적
중학교 과학 3
두산동아
2012-03-01
[187]
서적
중학교 과학 3
두산동아
2012-03-01
[188]
웹인용
WebElements.com - Isotopes of Magnesium
http://www.webelemen[...]
[189]
웹인용
2011 Minerals Yearbook, Magnesium
http://minerals.usgs[...]
USGS
2014-10-31
[190]
웹인용
Magnesium Video – The Periodic Table of Videos – University of Nottingham
http://www.periodicv[...]
[191]
웹인용
Magnesium-Aluminum Alloys
http://www.magnesium[...]
2014-10-31
[192]
웹인용
Magnesium Alloys Encyclopedia - Introduction
http://www.magnesium[...]
2014-10-31
[193]
백과사전
Ullmann's Encyclopedia of Industrial Chemistry
Wiley-VCH
[194]
서적
Magnesium and magnesium alloys
Materials Information Society
[195]
저널
Magnesium Alloys Development towards the 21st Century
[196]
웹인용
It's Elemental - Magnesium
http://education.jla[...]
2014-10-31
[197]
웹인용
Encyclopaedia Britannica: 마그네슘의 주요화합물
http://preview.brita[...]
2014-10-31
[198]
웹인용
Magnesium - Uses
http://www.webelemen[...]
[199]
웹인용
Science Safety: Chapter 8
http://www.edu.gov.m[...]
Government of Manitoba
[200]
웹인용
Demo Lab: Reaction Of Magnesium Metal With Carbon Dioxide
http://www.ilpi.com/[...]
[201]
웹인용
International Chemical Safety Cards - Magnesium (Powder)
http://www.cdc.gov/n[...]
2014-11-02
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com