렉틴
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
렉틴은 특정 당 구조를 선택적으로 인식하여 결합하는 단백질로, 1888년 페터 헤르만 슈틸마르크에 의해 처음 발견되었다. 렉틴은 동물, 식물, 세균 등 다양한 생물체에서 발견되며, 세포 부착, 면역 반응 조절, 혈액형 판별 등 다양한 생물학적 기능을 수행한다. 렉틴은 의학 연구 및 혈액형 판별, 생화학적 도구로 활용되며, 일부 렉틴은 음식 섭취 시 소화 방해 및 영양 결핍을 유발할 수 있다. 렉틴은 결합하는 당의 종류에 따라 R형, C형, L형, P형, I형 렉틴 등으로 분류된다.
더 읽어볼만한 페이지
- 당단백질 - 프로테오글리칸
프로테오글리칸은 단백질에 글리코사미노글리칸이라는 다당류가 결합된 복합체로, 동물과 식물에서 구조적 차이를 보이며 동물의 세포외기질에서 세포 간 공간을 채우고 조직의 수분 유지 및 분자 이동을 조절하는 역할을 수행하며, 분해 능력에 문제가 생기면 뮤코다당증 같은 유전 질환을 유발할 수 있다. - 당단백질 - 인터페론
인터페론은 바이러스 감염에 대한 세포 방어에 중요한 단백질로, 1형, 2형, 3형으로 나뉘어 면역 수용체에 따라 항바이러스, 항암 효과, 면역 체계 활성화 등의 다양한 작용을 하며, 유전자 조작을 통해 대량 생산되어 바이러스성 간염, 일부 종양 및 백혈병 치료에 활용된다. - 탄수화물 - 단당류
단당류는 (CH₂O)ₓ 화학식을 가지는 더 이상 가수분해되지 않는 가장 기본적인 형태의 탄수화물로, 탄소 원자 수에 따라 분류되고 알데히드기 또는 케톤기를 가지며, 수용액 상태에서 고리형 구조를 형성하는 경향이 있고, 포도당, 리보스, 데옥시리보스 등이 대표적인 예이다. - 탄수화물 - 소당류
소당류는 2~10개의 단당류로 구성된 탄수화물로, 당단백질 및 당지질 형성에 중요하며 세포 인식, 혈액형 결정, 세포 부착 등의 생리적 기능과 모유 올리고당과 같은 기능성 물질로 활용된다. - 면역학 - 체취
체취는 인간의 피부상재균이 분비물을 대사하여 발생하는 냄새로, 유전자, 건강 상태 등에 따라 달라지며, 데오드란트 등으로 관리하거나 심한 경우 의학적 치료가 필요하다. - 면역학 - 면역계
면역계는 물리적 장벽, 선천 면역, 후천 면역으로 구성되어 감염으로부터 생물체를 보호하는 다층적인 방어 시스템이며, 기능 이상 시 자가면역 질환, 과민 반응, 면역 결핍 등 다양한 질병을 유발할 수 있다.
2. 용어
"렉틴"(lectin)이라는 이름은 "선택하다"라는 뜻의 라틴어 낱말 ''legere''에서 유래했다.[6] 윌리엄 C. 보이드와 엘리자베스 셰플리는 1954년에 이 용어를 도입했다.[5] 이는 렉틴이 특정 당 구조를 선택적으로 인식하여 결합하는 특성을 반영한다.
1888년, 에스토니아 타르투 대학교(구 도르파트 대학교)의 의사 페터 헤르만 슈틸마르크는 박사 학위 논문 연구[39]를 통해 피마자(''Ricinus communis'') 씨앗에서 독성 단백질 리신(ricin)과 적혈구 응집소 헤마글루티닌(HA)을 발견했다. 이것이 렉틴 연구의 출발점이 되었다.
렉틴은 당단백질이나 당지질과 같이 탄수화물 작용기에 결합하는 물질이다. 이들은 특정 동물 세포를 응집시키거나 당접합체를 침전시키는 특징을 가지며, 대부분 효소 활성은 없다.
3. 역사
이후 다양한 종류의 응집소가 식물에서 탐색되었고, 세포의 당단백질과 당지질의 당사슬과 결합하는 것이 밝혀졌다. 백혈구가 백혈병화되면 세포 표면의 당사슬 형태가 변화하고, 그 당사슬에 결합하는 Wheat_germ_agglutinin|밀 배아 응집소영어의 반응이 높아졌다.[40] 1950~70년대에는 많은 의학자들이 식물 렉틴을 연구하여 암과 당사슬의 관계가 밝혀졌다.
미국의 면역학자 윌리엄 C. 보이드와 엘리자베스 셰플리는 리마콩의 응집소가 A형 적혈구를 응집하는 현상을 관찰했다. 그리고 특정 혈액형을 "선택하는(라틴어: ''legere'')" 단백질(in)이라는 의미에서, 일련의 응집소를 렉틴(lectin)이라고 명명했다[41](1954년). 이로 인해 카를 란트슈타이너가 발견한 ABO식 혈액형에서 형 물질의 실체가 당사슬임이 밝혀졌다.
1960년대, 미국의 암 학자 피터 노웰은 강낭콩 렉틴 PHA를 말초 혈액 림프구에 투여하면 유사분열 촉진이 일어나 세포가 증식하는 현상을 밝혀냈다. 이 발견은 인간 염색체의 핵형 관찰을 용이하게 했다. 1980년대에는 동물 렉틴에 의한 세포사멸 활성이 연구되었고[42], 당사슬-단백질 간 작용에 의한 세포 증식 조절 기능이 이해되었다.
4. 생물학적 기능
렉틴의 주요 구조 패밀리는 다음과 같다:
동물 렉틴은 동물의 진화 계통수 전반에 걸쳐 발견되며, 식물, 균류, 원생생물 렉틴에 대한 연구도 활발히 진행되고 있다.
장어 혈액 속 렉틴은 사람 O형 적혈구를 응집시킨다. 1935년 일본에서 장어가 사람 O형 적혈구를 응집시킨다는 사실이 보고되었다.
4. 1. 동물
렉틴은 동물에서 다음과 같은 기능을 한다.
일부 C형 간염 바이러스 당단백질은 감염을 시작하기 위해 숙주 세포 표면(간 세포)의 C형 렉틴에 부착될 수 있다.[12] 선천 면역계에 의한 신체 정화를 피하기 위해, 병원체(예: 인간 세포를 감염시키는 바이러스 입자 및 세균)는 종종 숙주 세포 표면 당단백질 및 글리콜리피드에 있는 조직 특이적 글리칸에 결합하는 접착소 및 혈구응집소로 알려진 표면 렉틴을 발현한다.[13] 인플루엔자를 포함한 여러 바이러스와 파라믹소바이러스과에 속하는 여러 바이러스는 이 메커니즘을 사용하여 표적 세포에 결합하고 진입한다.[14]
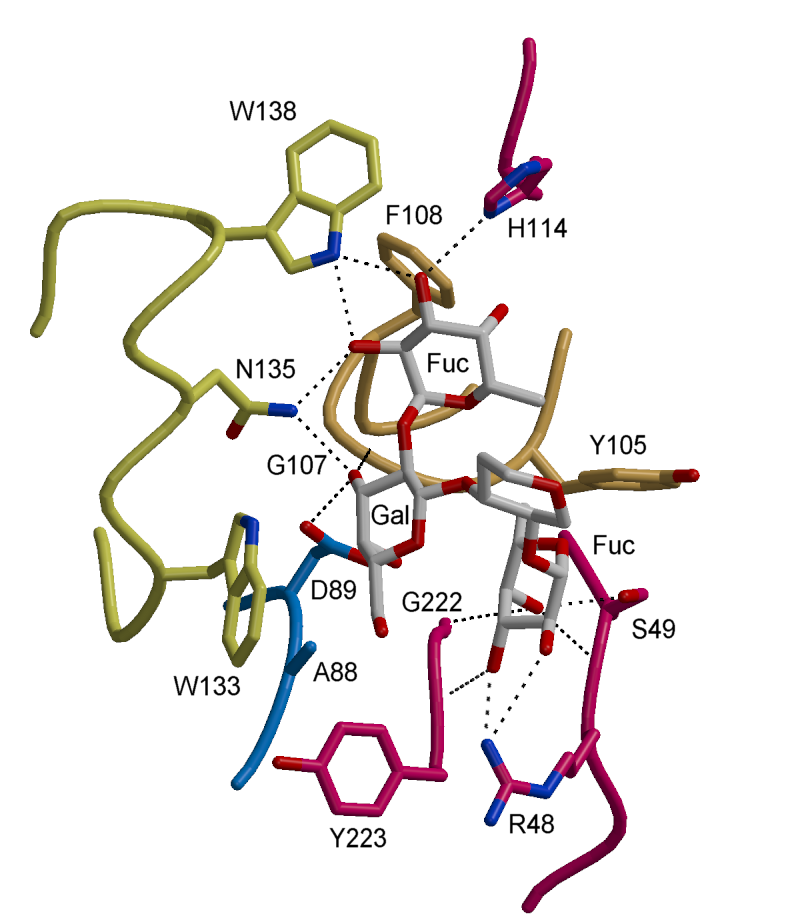
렉틴의 대표적인 1차 구조 패밀리에는 세균과 고세균을 포함한 생물계에 널리 존재하는 리신 B쇄 관련 'https://www.ncbi.nlm.nih.gov/books/NBK579951/ R형 렉틴', 진핵생물에 존재하며 당단백질의 폴딩에 관여하는 '칼넥신·칼레티큘린', 다세포 동물에 널리 존재하며 '셀렉틴'과 '콜렉틴' 등을 포함하는 칼슘 요구성의 'https://www.ncbi.nlm.nih.gov/books/NBK579916/ C형 렉틴', 동물과 균류에 존재하며 β-갈락토시드에 결합하는 'https://www.ncbi.nlm.nih.gov/books/NBK579987/ 갈렉틴', 렉틴 패밀리 중 최대이며 콩과 식물 종자나 동물 세포에 포함된 'https://www.ncbi.nlm.nih.gov/books/NBK579988/ L형 렉틴', 리소좀 효소의 세포 내 수송에 관여하는 만노스-6-인산 결합성의 'https://www.ncbi.nlm.nih.gov/books/NBK579952/ P형 렉틴', 글리코사미노글리칸 등의 산성 당쇄와 결합하는 '아넥신', 면역글로불린 골격을 갖는 '시글렉'을 포함하는 'https://www.ncbi.nlm.nih.gov/books/NBK579966/ I형 렉틴' 등이 있다.
동물 렉틴은 동물의 진화계통수 전반에 걸쳐 발견된다.
장어의 혈중에 포함된 렉틴은 사람의 O형 적혈구를 응집시킨다. 1935년 일본의 장어가 사람의 O형 적혈구를 응집시킨다는 사실이 보고되었다.
4. 2. 식물
식물 종자 내 렉틴은 높은 농도로 존재하다가 성장하면서 점차 감소하며, 식물 발아와 종자 자체의 생존에 중요한 역할을 하는 것으로 보인다. 또한 기생 세포 표면의 당단백질에 결합하는 기능도 수행하는 것으로 여겨진다.[10] 몇몇 식물 렉틴은 아데닌, 옥신, 사이토키닌, 인돌 아세트산 등 주로 소수성인 비탄수화물 리간드뿐만 아니라 수용성 포르피린도 인식하는 것으로 밝혀졌다. 이러한 상호작용은 이 분자들 중 일부가 식물 호르몬으로 작용하기 때문에 생리학적으로 의미가 있을 수 있다.[10]
렉틴 수용체 키나아제(LecRK)는 초식 동물의 공격으로 생성되거나 방출되는 손상 관련 분자 패턴(DAMP)을 인식하는 것으로 알려져 있다. 애기장대에서 콩과형 LecRKs Clade 1에는 11개의 LecRK 단백질이 존재한다. LecRK-1.8은 세포 외 NAD 분자를, LecRK-1.9는 세포 외 ATP 분자를 인식하는 것으로 보고되었다.
리조비아 결합에 렉틴이 필수적이라는 가설이 있었지만, 렉틴-넉아웃 유전자 변형 연구를 통해 이 기능은 배제되었다.[9]
4. 3. 세균 및 바이러스
세균 및 바이러스는 표면 렉틴(접착소, 혈구응집소)을 이용하여 숙주 세포 표면의 당사슬에 결합하여 감염을 일으킨다. 인플루엔자 바이러스 등이 이러한 기전을 이용하는 대표적인 예시이다.
5. 활용
렉틴은 그 특이성으로 인해 의학, 생화학 연구 등 다양한 분야에서 활용된다. 1954년 미국의 면역학자 윌리엄 C. 보이드와 엘리자베스 셰플리는 리마콩의 응집소가 A형 적혈구를 응집하는 현상을 관찰하고, 특정 혈액형을 "선택하는" 단백질이라는 의미에서 "렉틴"이라고 명명했다.[41]
1960년대 미국의 암 학자 피터 노웰은 강낭콩 렉틴 PHA를 말초 혈액 림프구에 투여하면 유사분열 촉진이 일어나 세포가 증식하는 현상을 밝혀냈다. 이를 통해 인간 염색체의 핵형 관찰이 용이하게 되었다. 1980년대에는 동물 렉틴에 의한 세포사멸 활성이 연구되었다.[42]
5. 1. 의학 및 의학 연구
정제된 렉틴은 수혈에 중요하게 사용된다.[15] 예를 들어, ''돌리코스 비플로루스''(Dolichos biflorus)에서 추출한 렉틴은 A1 혈액형 세포를 식별하는 데 사용되고, ''울렉스 유로파에우스''(Ulex europaeus)에서 추출한 렉틴은 H 혈액형 항원을 식별하는 데 사용된다.[15] ''비키아 그라미네아''(Vicia graminea)에서 추출한 렉틴은 N 혈액형 항원을, ''이베리스 아마라''(Iberis amara)에서 추출한 렉틴은 M 혈액형 항원을 식별한다.[15]신경과학에서 전진 표지 방법은 PHA-L(콩팥에서 추출한 렉틴)을 사용하여 원심성 신경 섬유 축삭의 경로를 추적하는 데 사용된다.[16]
바나나에서 추출한 렉틴(BanLec)은 ''체외''에서 HIV-1을 억제하는 효과가 있다.[17] ''Tachypleus tridentatus''에서 분리된 Achylectins는 인간 A형 적혈구에 대해 특정한 응집 활성을 보이며, ''Charybdis japonica''와 ''Lymantria dispar''에서 분리된 항-BCJ 및 항-BLD와 같은 항-B 응집소는 혈액형 검사와 연구에 유용하게 사용된다.[18]
1888년, 에스토니아 타르투 대학교의 의사 페터 헤르만 슈틸마르크는 피마자 씨앗에서 독소 단백질 리신과 적혈구 응집소 헤마글루티닌을 발견했다.[39] 이후 다양한 식물에서 응집소가 발견되었고, 세포의 당단백질 및 당지질과의 결합이 밝혀졌다. 1950~70년대에는 많은 의학자들이 식물 렉틴을 연구하여 암과 당쇄의 관계를 밝혀냈다.[40]
미국의 면역학자 [https://www.aai.org/About/History/Past-Presidents-and-Officers/WilliamCBoyd 윌리엄 C. 보이드]와 엘리자베스 셰플리는 리마콩의 응집소가 A형 적혈구를 응집하는 현상을 관찰하고, 특정 혈액형을 "선택하는 (라틴어: ''legere'' )" 단백질(in)이라는 의미에서 렉틴이라고 명명했다[41](1954년). 1960년대, 미국의 암 학자 피터 노웰은 강낭콩 렉틴 PHA를 말초 혈액 림프구에 투여하면 유사분열 촉진이 일어나 세포가 증식하는 현상을 발견했다. 1980년대에는 동물 렉틴에 의한 세포사멸 활성이 연구되었다.[42]
5. 2. 탄수화물 인식 연구
PHA 또는 콩카나발린 A와 같은 콩과 식물 렉틴은 비교적 쉽게 얻을 수 있고 다양한 당 특이성을 가지기 때문에, 단백질이 탄수화물을 인식하는 분자적 기초를 이해하기 위한 모델 시스템으로 널리 사용되어 왔다.[19] 콩과 렉틴의 많은 결정 구조는 탄수화물과 단백질 간의 원자 상호 작용에 대한 상세한 통찰력을 제공한다.5. 3. 생화학적 도구
콩카나발린 A와 같은 상업적으로 이용 가능한 렉틴은 친화성 크로마토그래피를 이용해 당단백질을 정제하는 데 널리 사용된다.[20]5. 4. 생화학 무기
리신은 피마자 씨앗에서 추출되는 렉틴으로, 생화학 무기로 사용될 수 있는 강력한 독성 물질이다.[39] 리신은 두 개의 단백질 도메인으로 구성되는데, 하나는 세포 표면에 결합하여 세포 내로 침투하는 역할을 하고, 다른 하나는 리보솜 RNA에서 뉴클레오베이스를 절단하여 단백질 합성을 억제함으로써 세포를 죽게 만든다. 애브린은 구슬아욱에서 추출한 것으로 리신과 유사하다.6. 식이 렉틴
렉틴은 자연계에 널리 분포하며, 많은 음식에 함유되어 있다. 일부 렉틴은 과다 섭취 시 소화 불량, 영양소 흡수 방해 등을 일으킬 수 있지만, 대부분은 끓이거나 물에 담가두는 등 적절한 조리 과정을 통해 무해화할 수 있다.[22] 그러나 슬로우 쿠커와 같이 낮은 온도에서는 렉틴이 완전히 제거되지 않을 수 있으므로 주의해야 한다.[22]
최근 렉틴을 피해야 한다는 렉틴 프리 다이어트가 등장하기도 했다. 렉틴 프리 다이어트를 처음 주장한 사람은 자연요법 의사인 피터 J. 다다모(Peter J. D'Adamo)였다. 그는 렉틴이 소화 등에 문제를 일으켜 사람의 혈액형에 손상을 줄 수 있다고 주장했다.[23] 스티븐 건드리(Steven Gundry)는 자신의 저서 ''The Plant Paradox''(2017)에서 렉틴 프리 다이어트를 제안하며, 통곡물, 콩류, 대부분의 과일, 가지과 채소를 피해야 한다고 주장했다.[25][26]
하지만 이러한 렉틴 프리 다이어트는 과학적 근거가 부족하며, 오히려 건강에 해로울 수 있다는 비판을 받고 있다. 건드리의 주장은 사이비 과학으로 여겨지며, 그의 책은 렉틴과 관련이 없거나 오히려 통곡물 섭취의 이점을 보여주는 연구를 인용하고 있다.[27][28][29]
특히 한국인이 즐겨 먹는 콩, 팥 등 콩과 식물에는 렉틴이 다량 함유되어 있으므로, 충분히 익혀 먹는 것이 중요하다.
6. 1. 렉틴의 독성
생 강낭콩에는 독성 렉틴(예: 피토헤마글루티닌)이 자연적으로 함유되어 있다. 렉틴 섭취 시 영양 결핍, 면역 (알레르기) 반응 등이 나타날 수 있다.[31] 렉틴은 열을 이용한 조리, 발효 등 적절한 처리 및 준비를 통해 비활성화할 수 있는 생 식물 성분 중 하나이다.[30]렉틴은 자연계에 널리 분포하며, 많은 음식에 함유되어 있다. 일부 렉틴은 제대로 조리하지 않거나 과다 섭취할 경우 해로울 수 있다. 날것일 때 가장 강력하며, 끓이거나, 뭉근히 끓이거나, 여러 시간 동안 물에 담가두면 대부분 비활성화된다. 그러나 생 콩을 슬로우 쿠커와 같이 낮은 열로 조리하면 모든 렉틴이 제거되지 않는다.[22]
일부 연구에 따르면 렉틴은 칼슘, 철, 인, 아연과 같은 미네랄 흡수를 방해할 수 있다. 렉틴이 소화관 세포에 결합하면 영양소 분해와 흡수를 방해하며, 오랫동안 세포에 결합할 경우 류마티스 관절염, 제1형 당뇨병 등 특정 염증 질환을 유발할 수 있다는 이론이 있다. 그러나 인체에 장기적인 건강 영향을 미친다는 주장을 뒷받침하는 연구는 제한적이며, 대부분 영양실조가 요인이거나 식단 선택이 제한적인 개발도상국에 초점을 맞추고 있다.[22]
6. 2. 혈구응집반응
렉틴은 항체와 유사하게 적혈구를 응집시키는 능력을 가지고 있다.[33]많은 콩과 식물 종자는 높은 렉틴 활성을 가지는 것으로 밝혀졌으며, 이러한 현상을 혈구응집반응이라고 한다.[34] 대두는 이 범주에서 가장 중요한 곡물 콩 작물이다. 대두 종자는 높은 활성의 대두 렉틴(대두 응집소 또는 SBA)을 함유하고 있다.
7. 렉틴의 종류
렉틴은 결합하는 당의 종류에 따라 다양하게 분류된다. 대표적인 1차 구조 패밀리로는 세균과 고세균을 포함한 생물계에 널리 존재하는 'https://www.ncbi.nlm.nih.gov/books/NBK579951/ R형 렉틴', 진핵생물에 존재하며 당단백질 폴딩에 관여하는 '칼넥신·칼레티큘린', 다세포 동물에 널리 존재하며 '셀렉틴'과 '콜렉틴' 등을 포함하는 칼슘 요구성 'https://www.ncbi.nlm.nih.gov/books/NBK579916/ C형 렉틴', 동물과 균류에 존재하며 β-갈락토시드에 결합하는 'https://www.ncbi.nlm.nih.gov/books/NBK579987/ 갈렉틴', 콩과 식물 종자나 동물 세포에 포함된 'https://www.ncbi.nlm.nih.gov/books/NBK579988/ L형 렉틴', 리소좀 효소의 세포 내 수송에 관여하는 만노스-6-인산 결합성 'https://www.ncbi.nlm.nih.gov/books/NBK579952/ P형 렉틴', 글리코사미노글리칸 등의 산성 당쇄와 결합하는 '아넥신', 면역글로불린 폴드를 갖는 '시글렉'을 포함하는 'https://www.ncbi.nlm.nih.gov/books/NBK579966/ I형 렉틴' 등이 있다.[4]
렉틴의 종류는 다음과 같다.
- 만노스 결합 렉틴
- 갈락토스/N-아세틸갈락토사민 결합 렉틴
- N-아세틸글루코사민 결합 렉틴
- N-아세틸뉴라민산 결합 렉틴
- 푸코스 결합 렉틴

