신경근 접합부
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
신경근 접합부는 운동 신경 세포와 근육 섬유 사이의 신호 전달이 일어나는 부위이다. 이 부위는 신경 말단, 시냅스 틈, 근육 세포막으로 구성되며, 아세틸콜린이라는 신경 전달 물질을 통해 신호가 전달된다. 신경근 접합부의 구조와 기능, 아세틸콜린 수용체, 발생 과정, 연구 방법, 영향을 미치는 독소, 그리고 신경근육질환과 같은 다양한 질병에 대해 설명한다.
더 읽어볼만한 페이지
- 골격근 - 미오신
미오신은 액틴 필라멘트를 따라 움직이며 힘을 생성하는 단백질 분자로, 근육 수축, 세포 운동, 소포 수송 등 다양한 생체 내 기능에 관여하며, 근육형, 비근육형, 프로세시브형, 논프로세시브형으로 분류된다. - 말초신경계 - 척수신경
척수신경은 척수의 분절에서 나오는 혼합 신경으로, 척추 위치에 따라 나뉘어 신체 부위의 운동, 감각, 자율신경 기능을 수행하며, 손상 시 다양한 임상적 문제를 일으킬 수 있다. - 말초신경계 - 아래운동신경세포
아래운동신경세포는 알파, 베타, 감마 운동 신경세포로 나뉘며 위운동신경세포로부터 신호를 받아 근육 수축을 유발하는 신경세포로, 손상 시 근위축증, 근력 감소, 반사 저하를 일으키고 벨 마비, 숨뇌마비, 소아마비, 근위축성 측삭경화증 등의 질병과 관련된다. - 신경생리학 - 신경가소성
신경가소성은 뇌의 구조와 기능이 경험, 학습, 손상에 따라 변화하는 능력이며, 시냅스 가소성, 구조적 가소성으로 나뉘어 뇌졸중, 학습 장애 등의 치료와 재활, 명상, 예술 활동 등 다양한 분야에 응용된다. - 신경생리학 - 알로이스 알츠하이머
알로이스 알츠하이머는 독일의 정신과 의사이자 신경병리학자로, 아밀로이드 플라크와 신경 원섬유 엉킴을 발견하여 알츠하이머병의 주요 특징을 밝혀냈으며, 브로츠와프 대학교에서 정신과 교수로 재직하다가 심부전으로 사망했다.
2. 구조 및 기능
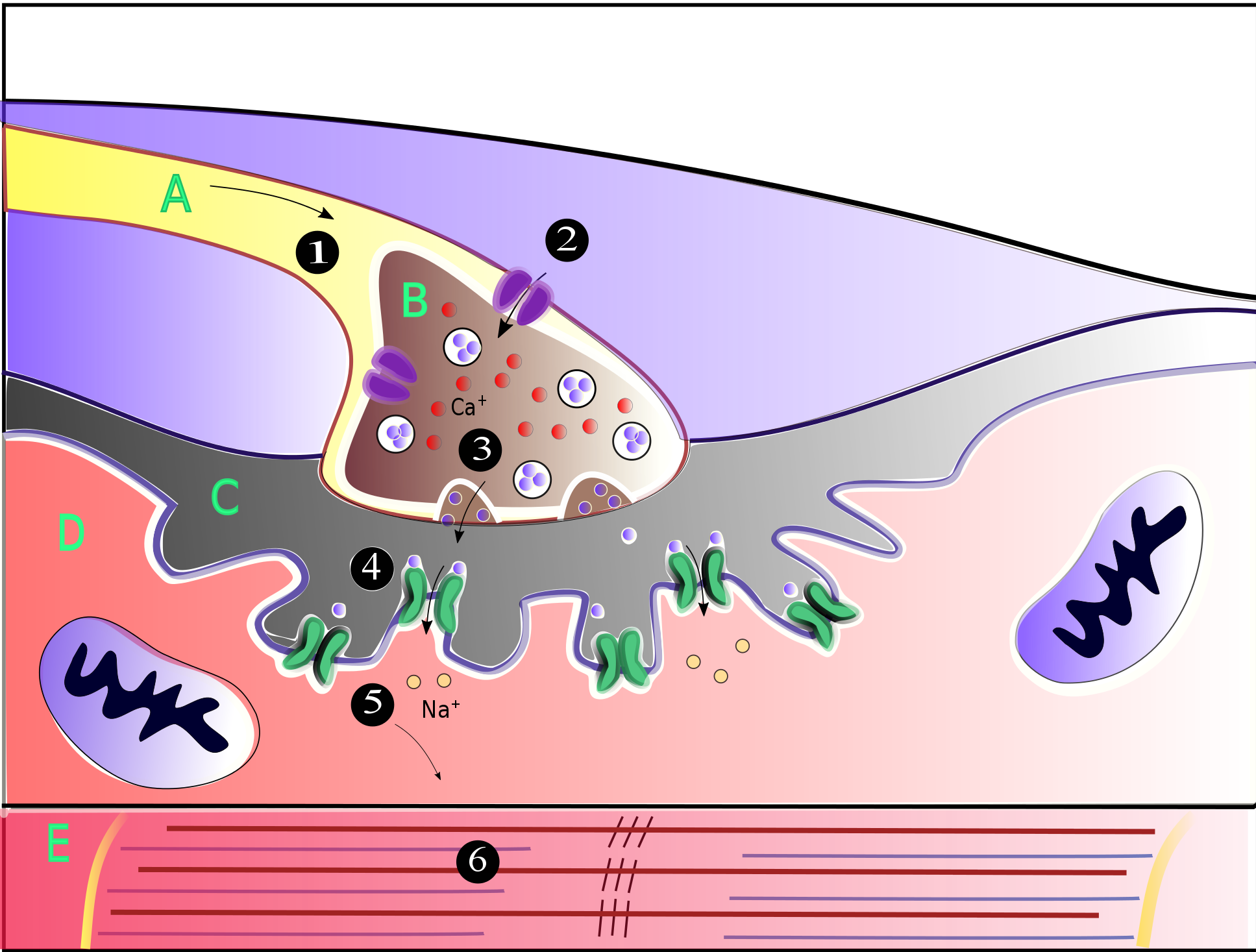
'''근육접합부'''에서, 시냅스전 운동 축삭은 근섬유의 세포막인 근초로부터 30나노미터 떨어진 곳에서 끝난다.[4] 접합부의 근초에는 시냅스 간극에 면한 표면적을 증가시키는 함입인 접합후 주름이 있는데, 이곳은 운동종판을 형성하며 μm2당 10,000개의 밀도로 니코틴성 아세틸콜린 수용체(nAChRs)가 박혀 있다.[5] 시냅스전 축삭은 근초의 접합후 주름을 향해 돌출되는 종말단추(또는 시냅스전 종말)라는 팽대부에서 끝난다.
신경 종말과 종판 사이의 30나노미터 간극에는 아세틸콜린에스터라아제(AChE)의 그물망이 μm2당 2,600개의 효소 분자 밀도로 존재하며, 디스트로핀과 랩신과 같은 구조 단백질에 의해 제자리에 고정되어 있다.[4] 또한, 근육접합부 발달에 관여하는 신호 전달 단백질인 MuSK 수용체 티로신 키나아제 단백질도 랩신에 의해 제자리에 고정되어 있다.[4]
신경근 접합부 발생에는 운동 뉴런의 종말과 근육 세포의 중심 영역 모두로부터의 신호 전달이 필요하다. 발생 과정에서 근육 세포는 아세틸콜린 수용체(AChRs)를 생성하여 사전 패터닝이라는 과정을 통해 중심 영역에 발현한다. 아그린(Agrin), 헤파린 프로테오글리칸, 그리고 MuSK 키나아제는 근세포 중심 영역에서 AChR의 축적을 안정화하는 데 기여한다. MuSK는 수용체 티로신 키나아제로, 티로신과 같은 자신 영역과 세포질의 다른 표적에 인산 분자를 결합하여 세포 신호 전달을 유도한다.[12] 아그린에 의해 활성화되면 MuSK는 "Dok-7"과 "랩신(rapsyn)"이라는 두 가지 단백질을 통해 신호를 보내 아세틸콜린 수용체의 "군집화"를 유도한다.[13] 발생 중인 운동 뉴런에 의한 ACh 방출은 근육 세포에서 시냅스 후 전위를 생성하여 발생 중인 신경근 접합부의 국재화와 안정화를 돕는다.[14]
아그린 또는 MuSK가 결핍된 쥐에서는 신경근 접합부가 형성되지 않으며, Dok-7이 결핍된 쥐에서는 아세틸콜린 수용체 군집이나 신경근 시냅스가 형성되지 않았다는 사실이 녹아웃 연구를 통해 입증되었다.[15]
신경근 접합부의 발생은 주로 설치류와 같은 모델 유기체에서 연구된다. 2015년에는 인간 배아줄기세포와 체세포 근육 줄기세포를 사용하여 시험관 내에서 전인간 신경근 접합부를 생성하였으며, 이 모델에서 시냅스 전 운동 뉴런은 광유전학에 의해 활성화되어 빛 자극 시 시냅스 연결 근육 섬유가 수축한다.[16]
호세 델 카스티요(José del Castillo)와 베르나르드 카츠(Bernard Katz)는 이온영동법을 사용하여 신경근 접합부에서 니코틴성 아세틸콜린 수용체(nAChRs)의 위치와 밀도를 결정했다. 카츠와 델 카스티요는 탈분극의 진폭(흥분성 시냅스 후 전위)이 ACh 이온을 방출하는 미세피펫이 종판에 얼마나 가까이 있는지에 따라 달라진다는 것을 보여주었다. 이를 통해 연구자들은 니코틴성 수용체가 운동종판에 고밀도로 국한되어 있음을 확인할 수 있었다.[4][5]
알파붕가로톡신(α-Bungarotoxin)과 같은 독소는 신경근 접합부에서 아세틸콜린 수용체의 위치를 결정하는 데에도 사용된다. Bungarus multicinctus 종의 뱀에서 발견되는 독소인 알파붕가로톡신은 ACh 길항제 역할을 하며 AChRs에 비가역적으로 결합한다. 말 래디쉬 과산화효소(horseradish peroxidase)(HRP) 또는 녹색 형광 단백질(green fluorescent protein)(GFP)과 같은 형광 단백질을 α-붕가로톡신에 결합시킴으로써 AChRs를 시각화하고 정량화할 수 있다.[4]
2. 1. 전송 (Quantal Transmission)
'''근육접합부'''에서 시냅스 전 운동 신경 세포의 축삭은 근육 섬유의 세포막(근초)에서 30nm 떨어진 지점에서 끝난다.[4] 신경근 접합부에 있는 근초에는 접합 후 접힘이라고 하는 함입된 부분이 있으며, 이 부분은 시냅스 틈을 향한 근초의 표면적을 증가시킨다.[5] 이러한 접합 후 접힘은 10,000개/μm2 정도의 밀도로 니코틴성 아세틸콜린 수용체(nAChR)가 박혀 있는 운동 종말판(motor end plate)을 형성한다.[5]개구리의 각 운동 신경 세포 말단에는 평균 직경이 0.05마이크로미터인 약 300,000개의 소포가 존재한다. 소포에는 신경전달물질인 아세틸콜린이 들어 있다.
신경 말단과 운동 종말판 사이의 30nm 정도 떨어진 시냅스 틈에는 2,600 효소 분자/μm2 밀도의 아세틸콜린에스터레이스(AChE)로 이루어진 망(meshwork)이 포함되어 있으며 구조 단백질인 디스트로핀과 랩신에 의해 고정되어 있다.[4]
SNARE 단백질에 의해 매개되는 과정에서, 시냅스 소포 중 하나가 무작위로 휴지 상태의 신경근 접합부에서 시냅스 전 신경 세포의 세포막과 융합한다. 소포가 융합되면 소포에 담겨 있던 아세틸콜린 7000-10,000분자가 시냅스 틈으로 방출되며, 이 과정을 세포외 배출이라고 한다.[6] 운동 종말판에 도달하는 아세틸콜린은 최대 2,000개의 아세틸콜린 수용체를 활성화하고, 이온 통로를 열어 나트륨 이온이 종말판으로 이동할 수 있도록 하여 MEPP(miniature endplate potential)로 알려진 ~0.5mV의 탈분극 상태를 형성한다. 아세틸콜린이 수용체에서 방출될 때까지 아세틸콜린에스터레이스는 약 0.16ms 동안 수용체에 결합된 ACh를 파괴한다.
운동 신경 세포가 자극되면 운동 신경 세포 말단에 신경 자극이 도달한 후 운동 종말판의 첫 번째 반응 사이에 0.5~0.8밀리초의 짧은 지연이 있다.[7] 운동 신경의 활동전위가 시냅스 전 신경 세포 말단에 도달하면 전압 개폐 칼슘 통로가 열려 Ca2+ 이온이 세포외액에서 시냅스 전 신경 세포의 세포질로 들어온다. Ca2+가 유입되면 신경전달물질이 들어 있는 수백 개의 소포가 SNARE 단백질을 통해 시냅스 이전 신경 세포의 세포막과 융합하여 세포외 배출에 의해 아세틸콜린을 방출하도록 한다. 방출된 아세틸콜린에 의해 형성되는 운동 종말판 탈분극을 종말판 전위(endplate potential, EPP)라고 한다. EPP는 ACh가 운동 종말판에서 니코틴성 아세틸콜린 수용체(nAChR)에 결합하여 나트륨 이온의 유입을 일으킬 때 발생한다. 나트륨 이온이 유입되면 EPP(탈분극)가 형성되고, EPP에 의한 활동전위는 근초를 따라 이동하여 가로세관(T세관)의 전압 개폐 나트륨 통로를 통해 근육 섬유로 이동한다.[8] 가로세관을 따라 활동전위가 전도되면 근소포체의 Ca 2+ 방출 통로에 기계적으로 연결된 전압 개폐 칼슘 통로를 자극하여 열리게 한다.[9] 그런 다음 Ca 2+는 근소포체에서 근육 원섬유로 확산되어 근수축을 자극할 수 있다.
2. 2. 아세틸콜린 수용체 (Acetylcholine Receptors)
아세틸콜린은 콜린과 아세틸-CoA(ACoA)에서 합성되는 신경전달물질로, 척추동물과 일부 무척추동물의 근육 조직 자극에 관여한다. 척추동물의 골격근 신경근 접합부에서 발견되는 아세틸콜린 수용체는 리간드 개폐 통로인 니코틴성 아세틸콜린 수용체(nAChR)이다.[37] 이 수용체의 각 소단위는 두 시스테인 잔기와 그 사이의 잘 보존된 13개의 아미노산 잔기로 구성된 특징적인 고리 모양 구조인 '시스 루프'(cys-loop)를 가지고 있다. 2개의 시스테인 잔기는 이황 결합을 형성하여 아세틸콜린 및 기타 리간드에 결합할 수 있는 시스 루프 수용체를 형성하며, 니코틴성 아세틸콜린 수용체도 이 시스 루프 수용체에 속한다. 이 시스 루프 수용체는 진핵생물에서만 발견되지만, 원핵생물은 유사한 특성을 가진 ACh 수용체를 가지고 있다.[37]
골격근 신경근 접합부의 AChR은 2개의 α, 1개의 β, 1개의 ɛ, 1개의 δ 소단위로 구성된 이종오합체(heteropentamer)를 형성한다.[36] 하나의 ACh 리간드가 ACh 수용체의 α 소단위 중 하나에 결합하면 두 번째 AChR α 소단위와의 경계면의 형태 변화를 유도한다. 이러한 형태 변화는 두 번째 ACh 리간드에 대한 두 번째 α 소단위의 친화도를 증가시킨다. AChR은 이런 협동결합으로 인해 S자형 해리 곡선을 나타낸다.[37] 단일 결합 리간드가 있는 비활성 중간 수용체 구조는 콜린에스터레이스에 의한 가수분해나 확산에 의해 손실될 수 있는 ACh를 시냅스에서 유지한다. 이런 방식으로 시냅스에서 ACh 리간드가 계속 존재하면 시냅스 후 반응이 연장될 수 있다.[38]
모든 종이 콜린성 신경근 접합부를 사용하는 것은 아니다. 예를 들어 가재와 초파리에는 글루탐산성 신경근 접합부가 있다.[44]
3. 발생
신경근 접합부의 발달은 운동 신경 세포의 말단과 근육 세포의 중심 영역 양쪽 모두로부터의 신호 전달을 필요로 한다. 근육 세포는 발달하는 동안 아세틸콜린 수용체(AChR)를 생성하고 프리패터닝(prepatterning)이라는 과정을 통해 중앙 영역에서 발현한다. 헤파린 프로테오글리칸인 아그린과 MuSK 인산화효소는 근세포의 중앙 영역에서 AChR가 축적되는 것을 안정화하는 데 도움이 되는 것으로 생각된다. MuSK는 수용체 타이로신 인산화효소로, 타이로신과 같은 자체 영역이나 세포질의 다른 표적에 인산염 분자를 결합하여 세포 신호를 유도한다.[39] 아그린을 리간드로 해서 활성화되면 MuSK는 Dok-7과 랩신이라는 두 단백질을 통해 신호를 보내 아세틸콜린 수용체의 군집화(clustering)를 유도한다.[40] 발달 중인 운동 신경 세포가 방출한 ACh는 근육 세포에서 발달 중인 신경근 접합부의 국소화(localization), 안정화(stabilization)를 강화하는 시냅스 후 전위를 생성한다.[41]
이러한 발견은 전이유전자를 통한 녹아웃 마우스 연구에 의해 부분적으로 입증되었다. 아그린이나 MuSK가 결핍된 마우스에서는 신경근 접합부가 형성되지 않았다. 또한, Dok-7이 결핍된 마우스는 아세틸콜린 수용체 군집이나 신경근 시냅스를 형성하지 않았다.[42]
신경근 접합부의 발달은 주로 설치류와 같은 모델 유기체를 통해 연구된다. 또한 2015년에는 인간 배아줄기세포와 몸근육줄기세포를 이용해 시험관 내에서 완전한 인간 신경근 접합부를 만들어 냈다.[43] 이 모델에서 시냅스 전 운동 신경 세포는 광유전학적인 기전에 의해 활성화되고 그에 대한 반응으로 시냅스로 연결된 근육 섬유는 빛 자극에 경련한다.
4. 연구 방법
호세 델 카스티요(José del Castillo)와 베르나르드 카츠(Bernard Katz)는 이온영동법(ionophoresis)을 사용하여 신경근 접합부에서 니코틴성 아세틸콜린 수용체(nAChR)의 위치와 밀도를 확인했다.[44][37] 이 기술은 근섬유의 운동 종말판 내부에 미세전극을 배치하고, 아세틸콜린(ACh)으로 채워진 마이크로피펫을 시냅스 틈의 종말판 바로 앞에 배치하는 방식으로 이루어졌다. 마이크로피펫 끝에 양전압을 가하면 양전하를 띤 ACh 분자가 피펫에서 방출되었다. 이 ACh 분자는 시냅스 틈으로 흘러 들어가 AChR에 결합했다. 세포 내 미세전극은 니코틴성 아세틸콜린 수용체에 ACh가 결합함에 따라 나타나는 운동 종말판의 탈분극 진폭(흥분성 연접후 전위)을 측정했다. 카츠와 델 카스티요는 탈분극의 진폭이 ACh 이온을 방출하는 마이크로피펫이 종말판에 얼마나 가까이 있는지에 따라 달라진다는 것을 발견했다. 즉, 마이크로피펫이 운동 종말판에서 멀어질수록 근육 섬유에서 발생하는 탈분극이 작아졌다. 이를 통해 연구자들은 nAChR이 운동 종말판에 고밀도로 모여 있다고 결론 내릴 수 있었다.[4][5]
독소는 신경근 접합부에서 아세틸콜린 수용체의 위치를 확인하는 데 사용되기도 한다. 알파 분가로톡신은 우산뱀(''Bungarus multicinctus'')에서 발견되는 독소로, AChR에 비가역적으로 결합하여 ACh 길항제 역할을 한다. 겨자무과산화효소(HRP)나 녹색 형광 단백질(GFP)과 같은 분석 가능한 효소나 형광 단백질을 알파 분가로톡신에 결합시켜 AChR을 시각화하고 정량화할 수 있다.[44]
5. 영향을 미치는 독소
신경근 접합부에 영향을 미치는 독소는 다음과 같다.
- 신경 가스: 아세틸콜린에스터라아제(AChE)를 비활성화시켜 시냅스 간극 내 아세틸콜린(ACh) 축적을 유발, 근육 세포를 지속적으로 수축시켜 마비 및 사망을 초래한다.
- 보툴리눔 독소(보톡스): SNARE 단백질에 영향을 미쳐 신경근 접합부에서 아세틸콜린 방출을 억제하여 이완성 마비를 유발한다.
- 파상풍 독소(테타노스파스민): 파상풍균이 생성하는 신경독소로, 경직성 마비를 유발한다. 보툴리눔 독소와 유사하게 작용하지만, 최종 상태에서 차이를 보인다.
- 라트로톡신(α-Latrotoxin): 과부거미 독에서 발견되며, 시냅스전 세포로부터 아세틸콜린 방출을 유발하여 통증, 근육 수축, 마비, 사망을 초래할 수 있다.
- 뱀 독: 시냅스 전 및 시냅스 후 신경 독소로 작용하여 신경근 접합부에 영향을 미친다.
- 시냅스 전 신경독소 (β-신경독소): 신경 전달 물질 방출을 억제하거나 증가시킨다. 신경근 차단을 생성하여 심각한 약화를 유발하며, 항독소에 잘 반응하지 않는다. 노텍신, 타이폭신 등이 이에 속한다.
- 시냅스 후 신경독소 (α-신경독소): 시냅스 후 아세틸콜린 수용체에 결합하여 아세틸콜린과의 상호작용을 방해한다. 신경근 차단을 유발하여 마비를 일으키지만, 항독소에 의해 비교적 쉽게 회복된다.
5. 1. 신경 가스 (Nerve Gases)
신경 가스는 아세틸콜린에스터라아제(AChE)에 결합하여 인산화시켜, 효과적으로 비활성화시킨다. 시냅스 간극 내 아세틸콜린(ACh)의 축적은 근육 세포를 지속적으로 수축시켜, 노출 후 수분 내에 마비 및 사망과 같은 심각한 합병증을 유발한다.[1]
5. 2. 보툴리눔 독소 (Botulinum Toxin)
보툴리눔 독소(상품명 보톡스로 판매됨)는 SNARE 단백질을 방해하여 신경근 접합부에서 아세틸콜린이 방출되는 것을 억제한다.[44] 이 독소는 세포내이입 과정을 통해 신경 말단을 가로질러 ACh 방출에 필요한 SNARE 단백질을 방해하고, 결국 영향을 받은 가로무늬근에 국한된 일시적인 이완성 마비와 화학적 신경 제거를 유발한다. ACh 방출 억제 효과는 주사 후 평균 일주일 정도 만에 시작된다.[45] 억제가 발생한 지 3개월이 지나면 신경 세포의 기능이 부분적으로 회복되기 시작하고 6개월이 지나면 완전히 뉴런의 기능이 회복된다.[46]5. 3. 파상풍 독소 (Tetanus Toxin)
파상풍 독소(테타노스파스민)는 파상풍균(''Clostridium tetani'')이 생성하는 강력한 신경독으로, 파상풍을 유발한다. 이 독소의 LD50은 대략 1ng/kg으로 측정되었고, 이는 세계에서 가장 치명적인 독소인 보툴리눔 독소 D에 이어 두 번째이다. 파상풍 독소는 시냅스 전 신경 말단에 부착되어 세포내이입되고, SNARE 단백질 복합체를 방해하는 방식으로 보툴리눔 독소와 매우 유사하게 기능한다. 그러나 몇 가지 면에서 보툴리눔 독소와 차이가 있으며, 가장 명백한 차이는 최종 상태이다. 테타노스파스민은 보툴리눔 독소가 이완성 마비를 일으키는 것과 반대로 경직성 마비를 일으킨다.5. 4. 라트로톡신 (Latrotoxin)
라트로톡신(α-라트로톡신)은 과부거미의 독에서 발견되는 성분으로, 신경근 접합부에 영향을 미친다. 시냅스 전 세포에서 아세틸콜린의 방출을 유발한다. 라트로톡신의 작용 기전은 시냅스 전 세포의 수용체에 결합하여 인지질분해효소 C가 매개하는 IP3/DAG 경로(이노시톨 삼인산/디아실글리세롤 경로)를 활성화하는 방식과, 세포 내의 저장 공간에서 칼슘 이온이 방출되게 하면서 구멍을 형성하여 칼슘이 직접 유입되게 하는 과정을 포함한다. 두 메커니즘 모두 시냅스 전 세포에서 칼슘을 증가시켜 아세틸콜린이 들어 있는 시냅스 소포를 방출한다. 라트로톡신은 통증, 근육 수축을 유발하며 치료하지 않으면 잠재적으로 마비나 사망에 이르게 할 수 있다.[1]5. 5. 뱀 독 (Snake Venom)
뱀의 독은 신경근 접합부에서 독소로 작용하여 쇠약과 마비를 유발할 수 있다. 뱀의 독은 시냅스 전과 시냅스 후 모두에서 신경독으로 작용할 수 있다.[47]일반적으로 β-신경독으로 알려진 시냅스 전 신경독은 신경근 접합부의 시냅스 전 영역에 영향을 미친다. 이 신경독은 대부분 아세틸콜린과 같은 신경 전달 물질이 신경 세포 사이의 시냅스로 방출되는 것을 억제한다. 그러나 일부는 신경전달물질 방출을 오히려 향상시키기도 한다. 신경전달물질 방출 억제는 신호 분자가 시냅스 후 표적 수용체에 도달하는 것을 막는 신경근 차단제와 같은 효과를 낸다. 따라서 뱀에 물린 사람은 심각한 근육 쇠약을 겪는다. 이러한 신경독은 해독제에 잘 반응하지 않는다. 노텍신이나 타이폭신과 같은 독소가 들어온 지 1시간이 지나면, 영향을 받은 많은 신경 말단은 돌이킬 수 없는 물리적 손상을 보이며, 신경전달물질을 전달하는 시냅스 소포가 없어진다.[47]
α-신경독으로 알려진 시냅스 후 신경독은 시냅스 후 아세틸콜린 수용체에 결합하여 시냅스 전 신경독과 반대로 작용한다. 즉, 시냅스 전 신경 세포 말단에서 방출되는 아세틸콜린과 시냅스 후 세포 수용체 사이의 상호작용을 막는다. 아세틸콜린 수용체와 관련된 나트륨 통로가 열리지 않아 시냅스 전 신경독과 유사한 신경근 차단 효과를 낸다. 이후 영향을 받은 신경근 접합부와 관련된 근육에 마비가 발생한다. 시냅스 전 신경독과 달리 시냅스 후 신경독은 해독제로 비교적 쉽게 회복되는데, 해독제가 수용체에서 독소의 빠른 해리를 유도하여 마비를 되돌린다. 이러한 신경독은 아세틸콜린 수용체 밀도 및 회전율 연구, 중증 근무력증 환자에서 질병의 영향을 받은 아세틸콜린 수용체에 대한 항체의 방향을 관찰하는 연구에 도움을 준다.[47]
6. 질병
운동 신경 세포와 근육 세포 사이의 시냅스 전달에 손상을 주는 모든 질병은 신경근육질환으로 분류된다. 이러한 장애는 유전되거나 후천적으로 생길 수 있으며, 심각도와 사망률은 각기 다르다. 일반적으로 이러한 장애의 대부분은 돌연변이나 자가 면역으로 인해 발생한다. 자가 면역 장애는 체액 면역과 B세포에 의해 매개되며, 시냅스 전달 또는 신호 전달에 관여하는 운동 신경 세포나 근섬유의 단백질에 대해 부적절한 항체가 만들어진다.[48]
6. 1. 자가면역 질환 (Autoimmune Diseases)
신경근 접합부 관련 자가면역 질환으로는 중증 근무력증, 람베르트-이튼 근무력 증후군(LEMS), 신경근긴장증(아이작 증후군) 등이 있다. 중증 근무력증과 람베르트-이튼 근무력 증후군은 특정 단백질을 표적으로 하는 자가항체에 의해 발생하며, 신경근긴장증은 운동 신경의 과흥분으로 인해 발생한다.6. 1. 1. 중증 근무력증 (Myasthenia Gravis)
중증 근무력증은 신체가 아세틸콜린 수용체(AchR)(80%의 경우) 또는 시냅스 후 근육 특이적 인산화효소(MuSK 단백질, 0-10%의 경우)에 대한 항체를 만드는 자가 면역 질환이다. 혈청음성 중증 근무력증에서 저밀도 지단백질 수용체 관련 단백질 4는 리간드의 경쟁적 억제제로 작용하여 리간드가 수용체에 결합하는 것을 방지하는 IgG1의 표적이 된다. 혈청음성 중증 근무력증이 표준 요법에 반응하는지 여부는 알려져 있지 않다.[48]6. 1. 2. 람베르트-이튼 근무력 증후군 (Lambert-Eaton Myasthenic Syndrome, LEMS)
람베르트-이튼 근무력 증후군(LEMS)은 신경근 접합부의 시냅스 전 부분에 영향을 미치는 자가 면역 질환이다. 이 희귀 질환은 몸쪽 근육 약화, 자율신경계이상, 무반사와 같은 독특한 3가지 증상이 특징적이다.[51][22] 몸쪽 근육 약화는 P/Q형 전압 개폐 칼슘 통로에 대한 병원성의 자가항체로 인한 결과이며, 이는 차례로 시냅스 전 세포의 운동 신경 말단에서 아세틸콜린 방출을 감소시킨다. LEMS로 인한 자율신경계 기능 장애의 예로는 남성의 발기부전, 변비, 가장 일반적으로 구강건조증 등이 있다. 덜 흔한 기능 장애로는 안구 건조와 땀 분비 변화가 있다. 무반사는 힘줄 반사가 감소하는 상태이며 운동 후에는 증상이 일시적으로 가라앉을 수 있다.[52][23]LEMS로 진단된 환자의 50-60%는 관련하여 종양도 보이는데, 가장 일반적으로는 소세포폐암(SCLC)이 나타난다. 이 유형의 종양은 전압 개폐 칼슘 통로를 나타낸다.[52][23] 종종 LEMS는 중증 근무력증과 함께 발생한다.[51][22]
LEMS에 대한 치료 시에는 3,4-디아미노피리딘을 첫 번째로 사용하며, 3,4-디아미노피리딘은 전압 개폐 칼륨 통로를 차단한 후 전압 개폐 칼슘 통로가 열린 상태로 유지되는 시간을 연장하여 근육의 활동전위와 근력을 증가시키는 역할을 한다. 미국에서는 자격이 있는 LEMS 환자에 대한 3,4-디아미노피리딘 치료가 확장 액세스 프로그램에 따라 무료로 제공된다.[57][58][24][25] 3,4-디아미노피리딘이 치료에 도움이 되지 않는 경우 추가 치료를 시행하며, 추가 치료에는 프레드니손과 아자티오프린 등을 사용한다.[52][23]
6. 1. 3. 신경근긴장증 (Neuromyotonia)
아이작 증후군으로도 알려진 신경근긴장증은 신경근 접합부에 걸리는 다른 많은 질병과 다르다. 신경근긴장증은 근육 약화가 아니라, 운동 신경의 과흥분을 유발한다. 신경근긴장증은 전압 개폐 칼륨 통로를 하향 조절하여 더 긴 탈분극을 생성하고 과흥분 상태에 빠뜨린다. 이로 인해 신경전달물질 방출이 늘어나고 반복적인 신경 발사가 일어난다. 이러한 발사 속도의 증가는 보다 적극적인 신호 전달을 유도하고, 결과적으로 영향을 받는 사람의 근육 활동을 증가시킨다. 신경근긴장증은 영향을 받는 사람의 자가 면역 증상과의 연관성이 있어 자가 면역이 원인으로 여겨진다.[49][20]6. 2. 유전병 (Genetic Diseases)
선천성 근무력증(CMS, Congenital myasthenic syndromes)은 중증근무력증(MG)과 람베르트-이튼 증후군(LEMS)과 증상이 매우 유사하지만, 유전적 원인으로 발생한다는 차이점이 있다. CMS는 신경근 접합부의 시냅스 전, 시냅스, 시냅스 후 단백질에 영향을 미치는 최소 10개의 유전자 중 하나에서, 일반적으로 열성 돌연변이로 인해 발생한다. 이러한 돌연변이는 주로 아세틸콜린 수용체(AChR)의 ε-소단위체에서 발생하여 수용체 자체의 운동 및 발현에 영향을 미친다.[20] 단일 염기 치환 또는 결실은 소단위체의 기능 상실을 야기할 수 있다. 아세틸콜린에스터레이스 및 아세틸기전이효소에 영향을 미치는 돌연변이도 CMS를 유발할 수 있으며, 특히 후자는 발작성 무호흡과 관련이 있다.[26] CMS는 태아기, 출생 전후 기간, 청소년기 또는 성인기 등 다양한 시기에 나타날 수 있다.[20]특정 CMS 아형(시냅스 후 빠른 채널 CMS)[27][28] 치료는 다른 신경근 질환 치료와 유사하다. LEMS의 1차 치료제인 3,4-디아미노피리딘은 미국에서 CMS 희귀의약품으로 개발 중이며,[29] 확대 접근 프로그램을 통해 자격이 있는 환자에게 무료로 제공된다.[24][25]
6. 2. 1. 선천성 근무력 증후군 (Congenital Myasthenic Syndromes, CMS)
선천성 근무력 증후군(CMS)은 중증 근무력증이나 람베르트-이튼 근무력 증후군과 증상이 매우 유사하지만, 유전적인 원인으로 발생한다는 큰 차이점이 있다. CMS는 신경근 접합부의 시냅스 전, 시냅스, 시냅스 후 단백질에 영향을 미치는 적어도 10개의 유전자 중 하나에서 돌연변이(일반적으로 열성)가 생겨 발생하는 질병이다. 이러한 돌연변이는 일반적으로 AChR의 ε 소단위에서 발생하여[49] 수용체 자체의 반응과 발현에 영향을 미친다. 단일 뉴클레오티드 치환 또는 결실은 소단위의 기능을 상실시킬 수 있다. 아세틸콜린에스터레이스나 아세틸기전이효소에 영향을 미치는 돌연변이 등 다른 돌연변이도 CMS를 유발할 수 있으며, 후자는 특히 간헐성 무호흡증과 관련이 있다.[53]이러한 증후군은 사람마다 다른 시기에 나타날 수 있다. 태아기에 발생하면 태아의 운동불능증이나, 출생 전후의 관절굽음증, 안검하수, 근긴장저하, 안근마비, 섭식 및 호흡 곤란과 같은 상태가 관찰될 수 있다. 청소년기나 성인기에 발생하면 slow-channel syndrome의 원인이 될 수 있다.[49]
CMS의 특정 아형(postsynaptic fast-channel CMS)[54][55]의 치료는 다른 신경근 장애에 대한 치료와 유사하다. LEMS의 1차 치료제인 3,4-Diaminopyridine은 미국에서 CMS의 희귀의약품으로 개발 중이다.[56][57][58]
참조
[1]
논문
The Neuron: Cell and Molecular Biology
Oxford University Press
2015-08-19
[2]
웹사이트
Physiology, Neuromuscular Transmission
https://pubmed.ncbi.[...]
StatPearls Publishing
2024-08-26
[3]
저널
The ageing neuromuscular system and sarcopenia: a mitochondrial perspective
2016-08
[4]
서적
From Neuron to Brain
Sinauer Associates
[5]
저널
End-plate acetylcholine receptor: structure, mechanism, pharmacology, and disease
2012-07
[6]
저널
Quantal acetylcholine release at the vertebrate neuromuscular junction
1994-10
[7]
서적
Nerve, muscle, and synapse
McGraw-Hill
1966
[8]
서적
Human Anatomy
McGraw-Hill Education
[9]
서적
Human Physiology
McGraw-Hill Education
[10]
서적
miller's anaesthesia
[11]
저널
Postsynaptic potentiation and desensitization at the vertebrate end-plate receptors
[12]
저널
Receptor tyrosine kinase specific for the skeletal muscle lineage: expression in embryonic muscle, at the neuromuscular junction, and after injury
1995-09
[13]
저널
Agrin acts via a MuSK receptor complex
1996-05
[14]
저널
Development of the neuromuscular junction
2006-11
[15]
저널
The muscle protein Dok-7 is essential for neuromuscular synaptogenesis
2006-06
[16]
저널
Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease
2016-01
[17]
저널
Botulinum toxin in movement disorders
2007-04
[18]
저널
Snake venoms and the neuromuscular junction
2004-06
[19]
저널
Motor neuron, nerve, and neuromuscular junction disease
2011-10
[20]
저널
The emerging diversity of neuromuscular junction disorders
2007-07
[21]
웹사이트
StatPearls
StatPearls
[22]
저널
Low rate repetitive nerve stimulation in Lambert-Eaton myasthenic syndrome: peculiar characteristics of decremental pattern from a single-centre experience
2013-04
[23]
저널
Lambert-Eaton myasthenic syndrome: from clinical characteristics to therapeutic strategies
2011-12
[24]
웹사이트
LEMS: Firdapse Study Shows Encouraging Results
http://mda.org/quest[...]
[25]
웹사이트
Catalyst Using the Expanded Access Program to Conduct Phase IV Study with LEMS Patients
http://www.raredr.co[...]
2014-10-30
[26]
저널
Congenital myasthenic syndromes
2004-03
[27]
저널
Congenital myasthenic syndromes: pathogenesis, diagnosis, and treatment
2015-04
[28]
저널
New horizons for congenital myasthenic syndromes
2012-12
[29]
웹사이트
Amifampridine phosphate for the treatment of congenital myasthenic syndromes
http://www.accessdat[...]
U.S. Food and Drug Administration
[30]
서적
[31]
저널
[32]
저널
https://archive.org/[...]
[33]
서적
https://archive.org/[...]
[34]
서적
https://archive.org/[...]
[35]
서적
https://archive.org/[...]
[36]
서적
miller's anaesthesia, 7th edition
[37]
저널
End-plate acetylcholine receptor: structure, mechanism, pharmacology, and disease
2012-07
[38]
저널
Postsynaptic potentiation and desensitization at the vertebrate end-plate receptors
https://archive.org/[...]
[39]
저널
Receptor tyrosine sinase specific for the skeletal muscle lineage: expression in embryonic muscle, at the neuromuscular junction, and after injury
[40]
저널
Agrin acts via a MuSK receptor complex
[41]
저널
Development of the neuromuscular junction
2006-11
[42]
저널
The muscle protein Dok-7 is essential for neuromuscular synaptogenesis
[43]
저널
Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease.
2016-01-07
[44]
서적
From Neuron to Brain
Sinauer Associates
[45]
저널
Time to onset and duration of botulinum toxin efficacy in movement disorders
https://doi.org/10.1[...]
2022-02-03
[46]
저널
Botulinum toxin in movement disorders
2007-04
[47]
저널
Snake venoms and the neuromuscular junction
2004-06
[48]
저널
Motor neuron, nerve, and neuromuscular junction disease
2011-10
[49]
저널
The emerging diversity of neuromuscular junction disorders
2007-07
[50]
서적
StatPearls
StatPearls
[51]
저널
Low rate repetitive nerve stimulation in Lambert-Eaton myasthenic syndrome: Peculiar characteristics of decremental pattern from a single-centre experience
2012-10
[52]
저널
Lambert-Eaton myasthenic syndrome: from clinical characteristics to therapeutic strategies
2011-12
[53]
저널
Congenital myasthenic syndromes
2004-03
[54]
저널
Congenital myasthenic syndromes: pathogenesis, diagnosis, and treatment.
2015-04
[55]
저널
New horizons for congenital myasthenic syndromes.
[56]
웹사이트
FDA orphan drug designation
http://www.accessdat[...]
[57]
웹사이트
LEMS Firdapse Study Shows Encouraging Results
http://mda.org/quest[...]
2016-01-18
[58]
웹사이트
Catalyst Expanded Access Program LEMS Patients
http://www.raredr.co[...]
2015-07-25
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

