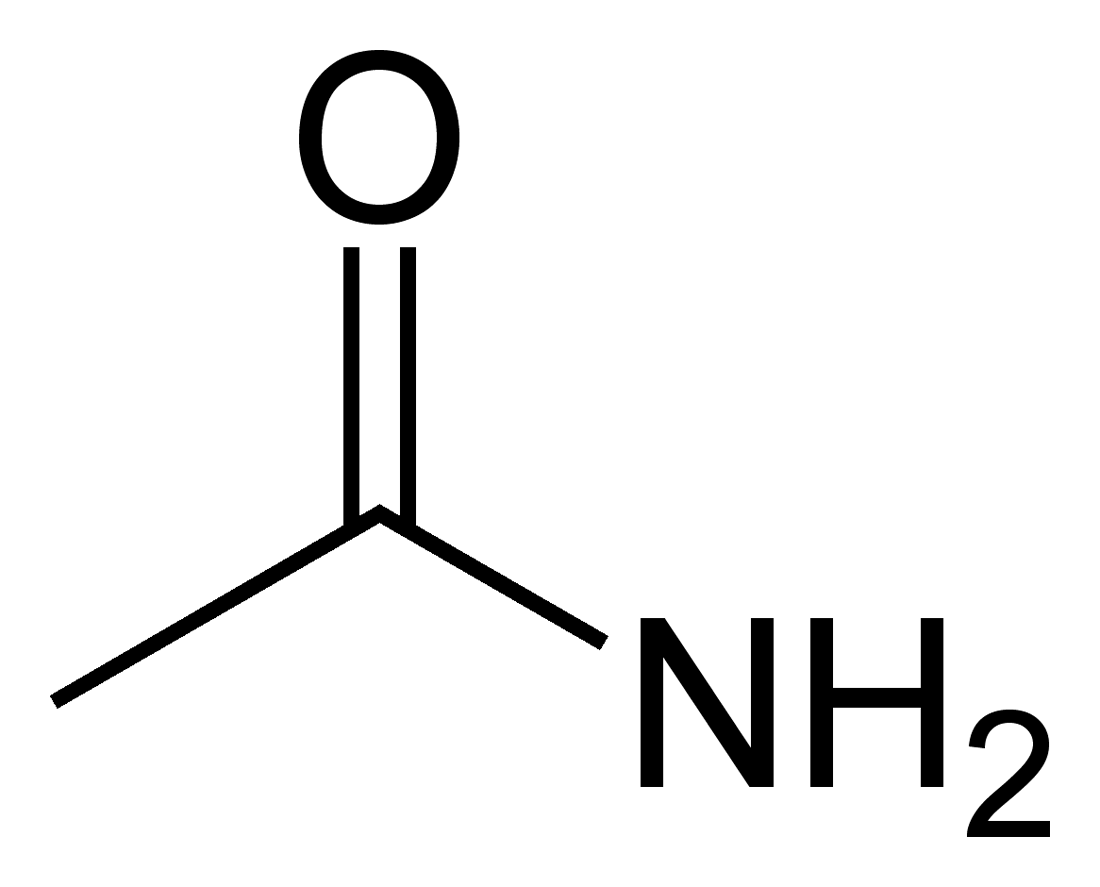
아실기
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아실기는 아실기를 포함하는 화합물을 총칭하는 용어이다. 아실 화합물에는 염화 아실, 아마이드, 에스터, 케톤, 알데하이드 등이 있으며, 염화 아실은 아실화 반응의 시약으로 널리 사용된다. 아실륨 이온은 유기 반응의 중간생성물로 중요한 역할을 하며, 아실 라디칼과 아실 음이온도 존재한다. 아실 화합물은 친핵성 아실 치환 반응을 통해 다양한 유도체를 생성하며, 반응성은 이탈기의 염기도에 따라 달라진다. 아실기는 생체분자, 유기금속화학 및 촉매 반응에서도 중요한 역할을 하며, IUPAC 명명법에 따라 명명된다.
더 읽어볼만한 페이지
- 아실기 - 아세틸기
아세틸기는 아세트산에서 유래된 작용기로, 생체 내 유전자 전사 조절 및 유기 합성에서 보호기로 사용되며, 약물 효과를 강화하는 데 기여한다. - 작용기 - 황화물
황화물은 황이 다른 원소와 결합한 화합물로, 금속 황화물, 황화광물, 유기 황화물 등 다양한 형태로 존재하며 반도체 특성, 안료, 촉매 등으로 활용되지만 부식성과 유해성을 지니기도 한다. - 작용기 - 에스터
에스터는 옥소산의 수산화기에서 수소 원자가 유기 원자단으로 치환된 화합물로, 카복실산 에스터가 대표적이며, 자연계에 널리 분포하고 향료 및 향수 산업에 사용되며 폴리에스터와 같은 중합체에서도 발견된다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다.
2. 아실 화합물
염화 아세틸(CH3COCl) 및 염화 벤조일(C6H5COCl)과 같은 염화 아실은 잘 알려진 아실 화합물이다. 이들은 아실륨 양이온을 제공하며, 다양한 기질에 아실기를 붙이는 시약으로 사용된다. 아마이드(R'''C(O)'''NR2), 에스터(R'''C(O)'''OR′), 케톤(R'''C(O)'''R), 알데하이드(R'''C(O)'''H)도 아실 화합물이다.
아실 유도체는 산 할라이드, 무수물, 에스터, 아마이드 순으로 친핵체에 대한 반응성이 크다. 카르복실레이트 이온은 이탈기가 없어 친핵성 치환 반응을 하지 않는다. 산 클로라이드와 아마이드의 반응 속도는 1013배 차이가 난다.[2]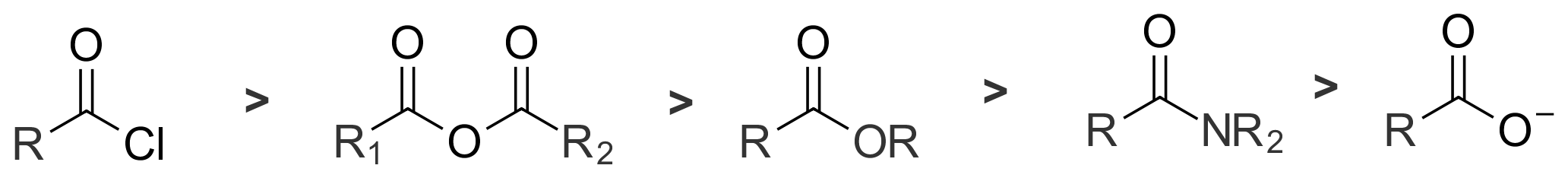
아실 유도체의 반응성은 이탈기의 염기도(산도와 관련됨)에 영향을 받는다. 강염기보다 약염기가 더 좋은 이탈기이다. 염산과 같은 강한 공액산을 가진 종은 아세트산과 같은 약한 공액산을 가진 종보다 더 좋은 이탈기이다. 따라서 염화물 이온은 아세테이트 이온보다 더 좋은 이탈기이다. 이탈기의 염기성이 증가하면 아실 화합물의 친핵체 반응성은 감소한다.[3]
아실륨 이온은 하위 섹션에서 자세히 다루고 있으므로, 여기서는 아실 라디칼과 아실 음이온에 대해 간략하게 설명한다.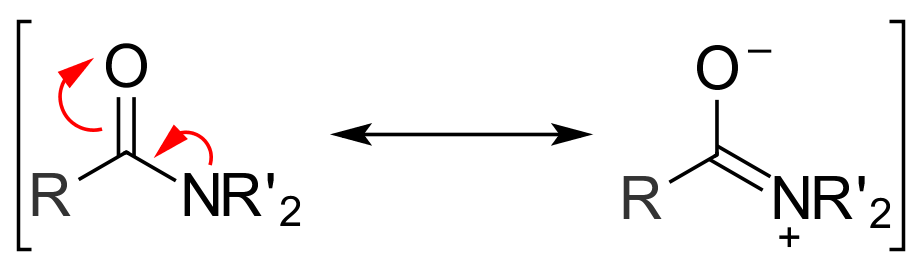
아실 화합물의 반응성은 공명의 영향도 받는다. 아마이드는 두 가지 주요 공명 형태를 가지며, 카르보닐 탄소와 아마이드 질소 사이의 결합은 상당한 이중 결합 특성을 갖는다. 아마이드 결합 회전의 에너지 장벽은 75~85 kJ/mol (18~20 kcal/mol)로, 에탄의 C-C 결합(12 kJ/mol, 3 kcal/mol)보다 훨씬 크다.[2] 친핵체가 공격하여 사면체 중간체가 형성되면 공명 효과가 사라진다. 이는 아마이드가 반응성이 낮은 이유 중 하나이다.[3]
에스터는 아마이드보다 공명 안정화가 적어 사면체 중간체 형성과 공명 상실이 에너지적으로 덜 불리하다. 무수물은 공명이 두 카르보닐기에 분산되어 더 약한 공명 안정화를 가지며, 에스터 및 아마이드보다 반응성이 크다. 산 할라이드는 공명이 거의 없어 사면체 중간체 형성에 따른 에너지 손실이 작아 반응성이 가장 크다.[3]
3. 아실륨 양이온, 라디칼 및 음이온
아실 라디칼은 알데하이드에서 수소 원자를 제거하여 쉽게 만들 수 있다. 하지만 아실 라디칼은 빠르게 탈카보닐화를 겪어 일산화 탄소(C≡O)를 잃고 알킬 라디칼(R•)을 생성한다.[18]
:RC(H)=O → RC•=O → R• + C≡O
아실 음이온은 불안정하여 일반적으로 관찰하기 어렵다.[9] 그러나 예외적으로 다이알킬폼아마이드(예: 다이아이소프로필폼아마이드)는 저온(−78 °C)에서 강한 염기(예: 리튬 다이아이소프로필아마이드)를 사용하여 카바모일 음이온을 형성할 수 있다.[19]
3. 1. 아실륨 이온
아실륨 이온은 R−C≡O+ 화학식을 갖는 양이온이다.[16][4][15][13] 프리델-크래프츠 아실화, 하야시 자리옮김(하야시 전위반응)과 같은 유기 반응에서 중간체로 중요한 역할을 한다.[15]
탄소-산소 결합 길이는 약 1.1 Å(110-112 pm)으로, 일산화 탄소 (112.8 pm)보다 짧아 삼중 결합 특성을 나타낸다.[17][5][6][7] 탄소 중심은 선형 기하 구조와 sp 원자 혼성화를 가지며, 산소에 양전하를 띠는 공명 구조[R–C≡O+]로 표현된다. 케톤의 EI-질량 스펙트럼에서 특징적인 단편으로 나타난다.
아실륨 이온을 포함하는 염은 아실 할라이드로부터 할라이드를 제거하여 생성될 수 있다.
:RC(O)Cl + SbCl5 → [RCO]+[SbCl6]–
3차 아민과 반응시켜서도 생성된다.
: RC(O)Cl + Et3N → [RC(O)NEt3+]Cl-
4. 아실 화합물의 반응성
아실 유도체는 친핵체에 대한 반응성이 다르다. 산 할라이드가 가장 반응성이 크고, 무수물, 에스터, 아마이드 순으로 반응성이 감소한다. 카르복실레이트 이온은 이탈기가 없어 친핵성 치환 반응에 대해 비활성이다. 산 클로라이드와 아마이드의 상대 반응 속도는 1013배나 차이가 난다.[2]
아실 유도체의 반응성은 이탈기의 염기도와 관련이 있다. 약염기일수록 더 좋은 이탈기이다. 예를 들어, 염화물 이온은 아세테이트 이온보다 더 좋은 이탈기이다. 아래 표는 이탈기의 염기성이 증가함에 따라 아실 화합물의 반응성이 감소하는 것을 보여준다.[3]
공명 또한 아실 화합물의 반응성에 영향을 미친다. 아마이드는 두 가지 주요 공명 형태를 가지며, 카르보닐 탄소와 아마이드 질소 사이의 결합은 상당한 이중 결합 특성을 갖는다. 이로 인해 아마이드 결합의 회전에는 큰 에너지 장벽이 필요하다. 친핵체가 공격하여 사면체 중간체가 형성되면 공명 효과가 사라지기 때문에 아마이드는 반응성이 낮다.[3]
에스터는 아마이드보다 공명 안정화가 적고, 무수물은 공명이 두 카르보닐기에 분산되어 더 약한 공명 안정화를 가진다. 산 할라이드는 공명이 거의 없어 사면체 중간체 형성에 따른 에너지 손실이 적다. 이러한 이유로 산 할라이드가 가장 반응성이 크다.[3]
4. 1. 반응 메커니즘
아실 화합물은 친핵체와 첨가 반응을 통해 반응한다. 친핵체는 카르보닐 탄소를 공격하여 사면체 중간체를 형성한다. 이 반응은 카르보닐을 더욱 친전자성으로 만드는 산성 조건이나, 더욱 음이온성이고 따라서 더 반응성이 높은 친핵체를 제공하는 염기성 조건에 의해 가속화될 수 있다. 사면체 중간체 자체는 반응의 pH에 따라 알코올 또는 알콕사이드일 수 있다.아실 화합물의 사면체 중간체에는 이탈기 역할을 할 수 있는 중심 탄소에 결합된 치환체가 포함되어 있다. 사면체 중간체가 형성된 후, 이는 붕괴되어 카르보닐 C=O 결합을 재생성하고 제거 반응에서 이탈기를 방출한다. 이러한 두 단계의 첨가/제거 과정의 결과로, 친핵체는 카르보닐을 포함하지 않는 중간 상태를 통해 카르보닐 화합물에서 이탈기의 자리를 차지한다. 두 단계 모두 가역적이며, 그 결과 친핵성 아실 치환 반응은 평형 과정이다.[11] 평형은 가장 좋은 친핵체를 포함하는 생성물을 선호하기 때문에, 반응이 실용적이려면 이탈기는 비교적 약한 친핵체여야 한다.
산성 조건 하에서 아실 화합물 '''1'''의 카르보닐기는 양성자화되고, 이는 친핵성 공격에 대한 활성화를 가져온다. 두 번째 단계에서 양성자화된 카르보닐 '''2'''는 친핵체(H−Z)의 공격을 받아 사면체 중간체 '''3'''를 생성한다. 친핵체(Z)에서 이탈기(X)로의 양성자 이동은 '''4'''를 생성하고, 이는 양성자화된 이탈기(H−X)를 방출하여 붕괴되어 양성자화된 카르보닐 화합물 '''5'''를 생성한다. 양성자의 손실은 치환 생성물 '''6'''을 생성한다. 마지막 단계가 양성자의 손실을 포함하기 때문에 친핵성 아실 치환 반응은 산에 대해 촉매적으로 여겨진다. 또한 산성 조건 하에서는 친핵체가 일반적으로 양성자화된 형태(즉, Z− 대신 H−Z)로 존재한다는 점에 유의한다.

염기성 조건 하에서, 친핵체(Nuc)가 아실 화합물 '''1'''의 카르보닐기에 공격하여 사면체 알콕사이드 중간체 '''2'''를 생성한다. 중간체는 붕괴되어 이탈기(X)를 방출하고 치환 생성물 '''3'''을 생성한다. 친핵성 아실 치환 반응은 염기 촉매 반응일 수 있지만, 이탈기가 친핵체보다 더 강한 염기인 경우(즉, 이탈기의 pKa가 친핵체보다 높은 경우) 반응이 일어나지 않는다. 산 촉매 반응과 달리, 염기성 조건 하에서는 친핵체와 이탈기 모두 음이온으로 존재한다.
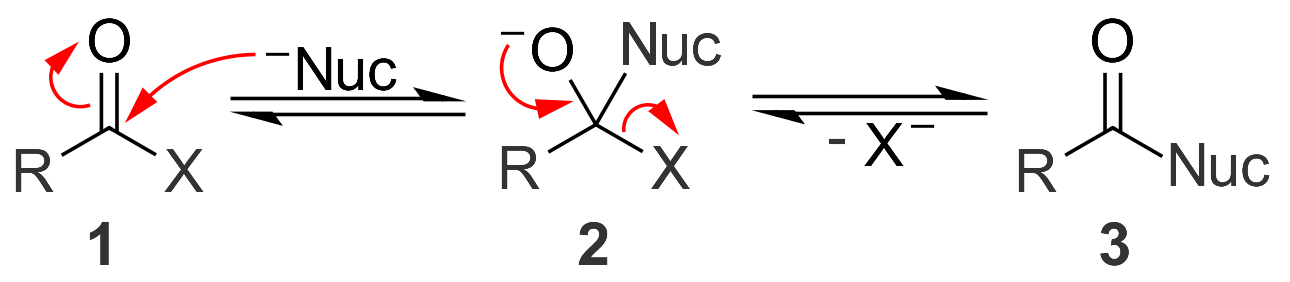
이 메커니즘은 동위원소 표지 실험으로 뒷받침된다. 산소-18 표지된 에톡시기를 갖는 프로피온산에틸을 수산화나트륨(NaOH)으로 처리하면, 산소-18 표지는 프로피온산에는 전혀 없고 에탄올에만 독점적으로 존재한다.[12]

5. 생화학에서의 아실기
생화학 분자의 모든 주요 부류에서 아실기를 많이 발견할 수 있다.
아실-CoA는 지방산 대사를 통해 형성되는 아실 유도체이다. 가장 일반적인 유도체인 아세틸-CoA는 많은 생합성 과정에서 아실기 공여체 역할을 한다. 이러한 아실 화합물은 싸이오에스터이다.
아미노산의 아실기 이름은 "-인(-ine)"을 접미사 "-일(-yl)"로 대체하여 형성한다. 예를 들어, 글리신의 아실기는 글리실이고, 리신의 아실기는 리실이다.
리보뉴클레오사이드 일인산인 AMP(5'-아데닐산), GMP(5'-구아닐산), CMP(5'-사이티딜산), UMP(5'-유리딜산)의 아실기는 각각 아데닐릴, 구아닐릴, 사이티딜릴, 유리딜릴이다.
인지질에서 포스파티드산의 아실기는 포스파티딜이라고 한다.
많은 당류들도 아실화된다.
6. 유기금속화학 및 촉매에서의 아실기
아실 리간드는 많은 카보닐화 반응에서 중간체 역할을 하며, 일부 촉매 반응에서 중요하다. 금속 아실은 일반적으로 금속-알킬 결합에 일산화 탄소가 삽입되거나, 염화 아실과 저원자가 금속 착물의 반응, 또는 유기 리튬 화합물과 금속 카보닐의 반응을 통해 생성된다. 금속 아실은 보통 2개의 공명 구조로 설명되며, 그 중 하나는 산소 중심의 염기성을 강조한다. 금속 아실의 ''O''-알킬화는 피셔 카벤 착물을 생성시킨다.[20]
7. 아실기 명명법
아실기의 관용명은 해당하는 카복실산의 관용명에서 "-산(-ic acid)" 접미사를 "-일(-yl)" 또는 "-오일(-oyl)"로 대체하여 명명한다. 유기화학의 IUPAC 명명법에서 아실기의 계통명은 해당하는 하이드로카빌기의 계통명에서 "-일(-yl)" 접미사를 "-오일(-oyl)"로 대체하여 명명한다. 벤조일기는 예외적으로 관용명과 계통명이 동일하다.
아실기는 하이드로카빌기와 카복실산 사이에 위치한다.
잘 알려진 아실 화합물에는 아실 클로라이드가 있으며, 예를 들어 아세틸 클로라이드(CH3COCl)와 벤조일 클로라이드(C6H5COCl)가 있다. 아실륨 양이온의 공급원으로 간주되는 이러한 화합물은 다양한 기질에 아실기를 부착하는 좋은 시약이다. 아마이드(RC(O)NR′2)와 에스터(RC(O)OR′)는 아실 화합물의 종류이며, 케톤(RC(O)R′)과 알데하이드(RC(O)H)도 마찬가지이다. 여기서 R과 R′는 유기기를 나타내며, 폼일기의 경우에는 수소이다.
7. 1. 주요 아실기 명명법 (표)
아실기의 일반적인 이름은 보통 해당 카복실산의 일반명에서 '-ic acid' 접미사를 '-yl'(또는 '-oyl')로 바꾸어 만든다. 유기화학 IUPAC 명명법에서 아실기의 계통명은 해당 하이드로카빌기의 계통명 (또는 해당 카복실산의 계통명의 '-oic acid' 접미사)의 '-yl' 접미사를 '-oyl'로 대체하여 만든다.
'-일(-yl)'로 끝나는 하이드로카빌기 이름은 아실기가 아니라 알케인에서 유도된 알킬기(메틸기, 에틸기, 프로필기, 뷰틸기 등), 알켄에서 유도된 알켄일기(프로펜일기, 뷰텐일기 등) 또는 알릴기(벤질기 등)이다.
참조
[1]
웹사이트
Acyl groups
2014-01-18
[2]
서적
Organic Chemistry
https://archive.org/[...]
McGraw-Hill
[3]
서적
Wade 2010
[4]
웹사이트
Acyl species
2014-01-18
[5]
저널
Synthesis of two crystalline species of the Friedel–Crafts intermediate antimony pentachloride-''p''-toluoyl chloride. Crystal structures of the donor–acceptor complex and of the ionic salt
[6]
저널
Structural effects of carbon monoxide coordination to carbon centers. π and σ bindings in aliphatic acyl versus aromatic aroylcations
[7]
저널
Silicon Tetrakis(trifluoromethanesulfonate): A Simple Neutral Silane Acting as a Soft and Hard Lewis Superacid
[8]
서적
March's Advanced Organic Chemistry
Wiley
[9]
저널
Direct Formation of the Carbonyl Anion of Diisopropyl Formamide
1974-01-01
[10]
서적
Organometallics
Wiley-VCH
2006
[11]
서적
Wade 2010
[12]
서적
Organic Chemistry
https://archive.org/[...]
Brooks/Cole Publishing Company
[13]
웹사이트
IUPAC Gold Book - acyl groups
http://goldbook.iupa[...]
[14]
서적
Organometallics
Wiley-VCH
[15]
웹사이트
Acyl groups
2014-01-18
[16]
웹사이트
Acyl species
2014-01-18
[17]
저널
Synthesis of two crystalline species of the Friedel–Crafts intermediate antimony pentachloride-''p''-toluoyl chloride. Crystal structures of the donor–acceptor complex and of the ionic salt
[18]
서적
March's Advanced Organic Chemistry
Wiley
[19]
저널
Direct Formation of the Carbonyl Anion of Diisopropyl Formamide
1974-01-01
[20]
서적
Organometallics
Wiley-VCH
2006
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com