산화적 인산화
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산화적 인산화는 전자전달계를 통해 NADH와 같은 전자 공여체에서 산소와 같은 전자 수용체로 전자가 이동하는 과정에서 에너지를 방출하고, 이 에너지를 이용하여 ATP를 합성하는 대사 경로이다. 이 과정은 미토콘드리아 내막에서 일어나며, 화학삼투 과정을 통해 H+의 이동으로 ATP 생성효소가 작동하여 ATP를 합성한다. 산화적 인산화는 해당과정보다 훨씬 많은 ATP를 생성하며, 지방산의 β 산화와 같은 다른 대사 경로와도 연결되어 있다. 전자전달계는 복합체 I부터 IV까지의 효소 복합체로 구성되며, 각 복합체는 전자를 전달하고 H+을 펌핑하여 막 간 공간에 전기화학적 기울기를 형성한다. ATP 생성효소(복합체 V)는 이 기울기를 이용하여 ATP를 합성한다. 산화적 인산화는 활성산소의 생성과 연관되어 있으며, 저해제에 의해 억제될 수 있다. 이 과정에 대한 연구는 20세기 초부터 시작되어 화학삼투설의 발견과 ATP 생성효소의 작동 메커니즘 규명으로 이어졌다.
더 읽어볼만한 페이지
- 내재성 막 단백질 - 광계
광계는 틸라코이드 막에 위치하며 빛 에너지를 화학 에너지로 전환하는 단백질 복합체로, 광수집 복합체에 둘러싸인 반응 중심을 가지며 물 분해를 통해 전자를 얻고 산소를 방출하는 광계 II와 NADPH를 생성하는 광계 I 두 가지 주요 유형으로 나뉜다. - 내재성 막 단백질 - 사이토크롬 b6f 복합체
사이토크롬 b6f 복합체는 광합성에서 광계 II와 광계 I 사이의 전자 및 에너지 전달을 매개하고 틸라코이드 막을 가로질러 양성자를 수송하여 ATP 합성을 촉진하는 단백질 복합체로서, 순환적 광인산화에도 중요한 역할을 하며 사이토크롬 bc1 복합체와 구조적 유사성을 갖는 8개의 소단위체로 구성된 이량체이다. - 세포 호흡 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 세포 호흡 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다. - 생화학 - 부패
부패는 미생물에 의한 유기체의 사후 분해 과정으로, 악취 물질 생성, 시신 외형 변화를 동반하며 환경적·내적 요인에 따라 속도가 달라지고 법의학 등에서 연구된다. - 생화학 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다.
2. 화학삼투
산화적 인산화는 혐기성 발효보다 훨씬 많은 에너지를 방출한다. 해당과정은 포도당 1분자당 2ATP를 생산하지만, 산화적 인산화는 포도당 1분자당 28~34ATP를 생산한다.[132] 지방산의 β 산화는 각 사이클당 약 14ATP를 생산한다. 이러한 ATP 수율은 이론적인 최대값이나, 실제로는 일부 H+(양성자)가 막을 통해 누출되어 ATP 수율이 감소한다.[133]
2. 1. 화학삼투의 구성 요소
산화적 인산화는 에너지 방출 반응을 사용하여 에너지 흡수 반응을 진행시킨다. 두 세트의 반응은 짝지어져 있는데, 이는 두 반응 중 하나가 작동하지 않으면 다른 하나도 작동할 수 없다는 것을 의미한다. NADH와 같은 전자 공여체에서부터 산소(O2)와 같은 전자 수용체에 이르기까지 전자전달계를 통한 전자의 흐름은 에너지를 방출하는 과정이다. 반면에 ATP 합성은 에너지를 흡수하는 과정이다. 전자전달계와 ATP 생성효소는 모두 미토콘드리아 내막에 존재하고, 미토콘드리아 내막을 통과하는 H+의 움직임에 의해 전자전달계에서 ATP 생성효소로 에너지가 전달되는데, 이러한 과정을 화학삼투라고 한다.[129] 실제로 이것은 단순한 전기 회로 같으며, H+는 전자전달계의 H+ 펌핑 효소들에 의해 미토콘드리아 기질(N쪽, 상대적으로 H+ 농도가 낮은 쪽)에서 막 사이 공간(P쪽, 상대적으로 H+ 농도가 높은 쪽)으로 능동수송된다. 이러한 효소들은 배터리와 같으며, 회로를 통해 전류를 흐르게 하는 일을 수행한다. H+(양성자)의 움직임은 막을 가로질러 전기화학적 기울기를 만들어 내는데, 이것은 종종 양성자 구동력이라고 불린다. 양성자 구동력은 H+의 농도 차이(양성자 기울기, ΔpH)로 인한 화학적인 위치 에너지와 H+가 상대 이온 없이 막을 지나 이동할 때, 전하의 분리 차이로 인한 전기적인 위치 에너지의 2가지 구성 요소를 갖는다.[130]H+가 전기화학적 기울기에 따라 막 사이 공간(P쪽)에서 미토콘드리아 기질(N쪽)로 ATP 생성효소를 통해 확산될 때 방출되는 에너지로 ATP를 합성한다.[131] 이러한 전기화학적 기울기는 ATP 생성효소의 일부를 회전시키는 구동력으로 작용하고, 이러한 움직임은 ATP 합성과 짝지워진다.
양성자 구동력의 2가지 구성 요소는 열역학적으로 동등하다. 미토콘드리아에서 에너지의 가장 큰 부분은 전위차에 의해 주어진다. 반면에 엽록체는 주로 ΔpH 차이에 의해 작동한다.
3. 전자전달계
해당과정, 시트르산 회로, 지방산의 β 산화와 같은 많은 생화학적 이화작용들은 환원된 조효소인 NADH를 생성한다. NADH는 고에너지 전자를 가지고 있어서 산화될 때 많은 양의 에너지를 방출한다. 그러나 세포는 이 에너지를 한꺼번에 방출하지 않고, NADH에서 전자를 떼어내어 일련의 전자전달효소들을 통해 산소로 전달하며, 각 과정에서 소량의 에너지를 방출한다. 복합체 I~IV로 구성된 효소 집합은 전자전달계라고 불리며, 미토콘드리아 내막에 존재한다. 석신산도 전자전달계에서 산화되지만, 복합체 II를 통해 유입된다.
전자전달계는 양성자와 전자를 모두 운반하며, 전자를 전자 공여체에서 전자 수용체로 전달하고, H+(양성자)를 막을 가로질러 능동수송한다. 이 과정에는 가용성 전달 분자 및 단백질에 결합된 전달 분자가 모두 사용된다.
- 진핵생물의 전자전달계
- 원핵생물의 전자전달계
- 전자 및 양성자 전달 분자
3. 1. 진핵생물의 전자전달계
해당과정, 시트르산 회로, 지방산의 β 산화와 같은 여러 생화학적 이화작용은 환원된 조효소인 NADH를 생성한다. NADH는 고에너지 전자를 가지고 있어 산화될 때 많은 양의 에너지를 방출한다. 세포는 이 에너지를 한꺼번에 방출하지 않고, NADH에서 전자를 떼어내어 일련의 전자전달효소들을 통해 산소로 전달하며 각 과정에서 소량의 에너지를 방출한다. 복합체 I~IV로 구성된 효소 집합은 전자전달계라고 불리며, 미토콘드리아 내막에 존재한다. 석신산도 전자전달계에서 산화되지만, 복합체 II를 통해 유입된다.진핵생물에서 전자전달계 효소는 NADH 산화 시 방출되는 에너지를 이용하여 미토콘드리아 기질에서 막 사이 공간으로 H+(양성자)를 능동수송한다. 이는 막 사이 공간의 H+ 농도를 증가시키고, 미토콘드리아 내막을 가로질러 전기화학적 기울기를 생성한다. 이 위치 에너지는 ATP 생성효소에 의해 ATP를 생성하는데 사용된다. 진핵생물의 미토콘드리아에서 일어나는 산화적 인산화는 이 과정의 가장 잘 알려진 예이다. 미토콘드리아는 질 트리코모나스(''Trichomonas vaginalis'')와 같은 혐기성 원생생물을 제외한 거의 모든 진핵생물에 존재한다. ''질 트리코모나스''는 하이드로게노솜(hydrogenosome, 수소발생소포)이라 불리는 미토콘드리아 잔존 세포소기관에서 H+를 수소로 환원시킨다.[142]
진핵생물의 전형적인 호흡 효소와 기질은 다음 표와 같다.
3. 1. 1. 복합체 I (NADH:유비퀴논 산화환원효소)
NADH:유비퀴논 산화환원효소 (NADH-Q 산화환원효소)는 NADH 탈수소효소 또는 복합체 I 이라고도 불리며, 전자전달계의 첫 번째 단백질이다.[144] 복합체 I은 46개의 소단위체로 구성되어 분자량이 약 1,000 kDa인 거대 효소이다.[145] 세균에서 복합체 I의 구조는 자세하게 알려져 있다.[146][147] 대부분의 생물에서 복합체 I은 큰 볼이 있는 부츠 모양을 하고 있다.[148][149] 미토콘드리아에 존재하는 많은 효소들과 마찬가지로, 복합체 I을 구성하는 개별 단백질을 암호화하는 유전자는 세포핵과 미토콘드리아 게놈 모두에 존재한다.복합체 I에 의해 촉매되는 반응은 NADH의 두 전자를 유비퀴논(조효소 Q10)으로 전달하는 산화 반응이다. 유비퀴논은 미토콘드리아 내막에서 발견되는 지용성 퀴논이다.
전자전달계의 시작은 NADH가 복합체 I에 결합하여 두 전자를 제공하는 것이다. 전자는 복합체 I에 결합된 보결분자단인 플라빈 모노뉴클레오타이드(FMN)를 통해 복합체 I으로 들어간다. FMN이 전자를 얻으면 환원형인 FMNH2로 변환된다. 그런 다음 전자는 복합체 I의 두 번째 보결분자단인 일련의 철-황 클러스터를 통해 전달된다.[146] 복합체 I에는 [2Fe–2S]와 [4Fe–4S] 철-황 클러스터가 모두 존재한다.
전자가 복합체 I을 통과함에 따라 4개의 H+(양성자)가 미토콘드리아 기질에서 막 사이 공간으로 능동수송된다. 이 과정이 정확히 어떻게 일어나는지는 분명하지 않지만, 복합체 I의 구조적 변화로 인해 단백질이 미토콘드리아 기질(N쪽)에서 H+를 결합시키고 막 사이 공간(P쪽)에서 H+를 방출하는 것으로 보인다.[150] 마지막으로 전자는 철-황 클러스터 사슬에서 미토콘드리아 내막의 유비퀴논으로 전달된다.[144] 유비퀴논의 환원은 H+ 농도 기울기 생성에도 기여하는데, 유비퀴논(Q)이 유비퀴놀(QH2)로 환원될 때 미토콘드리아 기질에서 2개의 H+가 감소하기 때문이다.

3. 1. 2. 복합체 II (석신산 탈수소효소)

석신산 탈수소효소는 복합체 II 또는 석신산:유비퀴논 산화환원효소라고도 불리며, 전자전달계의 두 번째 진입 지점이다.[151] 석신산 탈수소효소는 시트르산 회로와 전자전달계에 모두 관여하는 유일한 효소라는 특징을 가진다. 복합체 II는 플라빈 아데닌 다이뉴클레오타이드(FAD), 철-황 클러스터, 헴기를 보조 인자로 가지는 4개의 단백질 소단위체로 구성된다. 여기서 헴기는 유비퀴논으로 전자를 직접 전달하지는 않지만, 활성산소의 생성을 줄이는 데 중요한 역할을 한다고 알려져 있다.[152][153]
복합체 II는 석신산을 푸마르산으로 산화시키면서 유비퀴논을 환원시킨다. 이 반응은 NADH 산화 반응보다 에너지 방출량이 적기 때문에, 복합체 II는 미토콘드리아 막을 가로질러 H+(양성자)를 능동수송하지 않는다. 따라서 H+(양성자)의 농도 기울기 형성에는 직접적으로 기여하지 않는다.
돼지회충(''Ascaris suum'')과 같은 일부 진핵생물 기생충은 복합체 II와 유사한 효소인 푸마르산 환원효소(메나퀴놀:푸마르산 산화환원효소)를 가진다. 이 효소는 유비퀴놀을 산화시키고 푸마르산을 환원시키는 역반응을 촉매한다. 이를 통해 기생충은 대장 내 혐기성 환경에서 전자 수용체로 푸마르산을 이용, 혐기성 산화적 인산화를 수행하며 생존할 수 있다.[154] 말라리아원충(''Plasmodium falciparum'')에서도 복합체 II의 특이한 기능이 발견된다. 여기서는 복합체 II가 산화효소로써 역반응에 관여하여 유비퀴놀을 재생성하는데, 이는 기생충의 피리미딘 생합성에 중요한 역할을 한다.[155]
3. 1. 3. 복합체 III (유비퀴논:사이토크롬 c 산화환원효소)

유비퀴논:사이토크롬 c 산화환원효소는 사이토크롬 c 환원효소, 사이토크롬 bc1 복합체, 또는 간단하게 복합체 III로도 알려져 있다.[161][162] 포유류에서 복합체 III는 11개의 단백질 소단위체, [2Fe-2S] 철-황 클러스터, 3개의 사이토크롬(사이토크롬 c1 1개, 사이토크롬 b 2개)을 포함하는 동일한 소단위체 복합체 2개로 구성된 이합체 효소이다.[163] 사이토크롬은 적어도 하나의 헴기를 갖고 있는 전자전달 단백질의 일종이다. 복합체 III의 헴기 안에 있는 철 원자는 전자가 단백질을 통해 전달됨에 따라 환원된 Fe2+와 산화된 Fe3+ 상태 사이를 번갈아 나타낸다.
복합체 III에 의해 촉매되는 반응은 유비퀴놀 1분자의 산화와 미토콘드리아 내막과 느슨하게 결합한 헴단백질인 사이토크롬 c 2분자의 환원이다. 2개의 전자를 운반하는 유비퀴논과는 달리, 사이토크롬 c는 하나의 전자만을 운반한다.
+ 2H+_{matrix} -> {Q} + {2 Cyt\, c_{red}} + 4H+_{intermembrane}
유비퀴놀(QH2)로부터 사이토크롬 c로 한 번에 하나의 전자가 전달될 수 있기 때문에, 복합체 III의 반응 메커니즘은 다른 호흡 복합체보다 더 정교하며, Q 회로라고 하는 두 단계 반응으로 일어난다.[164] 첫 번째 단계에서 복합체 III는 3가지 기질(유비퀴놀, 사이토크롬 c, 유비퀴논)과 결합하는데, 첫 번째 기질인 유비퀴놀(QH2)에서 하나의 전자가 두 번째 기질인 사이토크롬 c로 전달된다. 유비퀴놀(QH2)에서 방출된 2개의 H+(양성자)는 막 사이 공간으로 이동한다. 세 번째 기질은 유비퀴논(Q)이며, 유비퀴논은 유비퀴놀(QH2)로부터 두 번째 전자를 받아들여 세미퀴논 라디칼(Q.−)로 환원된다. 유비퀴놀(QH2)과 유비퀴논(Q)은 방출되지만, 세미퀴논 라디칼(Q.−)은 복합체 III에 결합된 채로 남아있는다. 두 번째 단계에서 유비퀴놀(QH2)의 두 번째 분자가 결합되어 다시 첫 번째 전자를 사이토크롬 c로 전달한다. 두 번째 전자는 복합체 III에 결합된 세미퀴논으로 전달되고, 미토콘드리아 기질에서 2개의 H+(양성자)를 얻어 유비퀴놀(QH2)로 환원되는데 사용된다. 이렇게 생성된 유비퀴놀(QH2)은 복합체 III로부터 방출된다.[165]
유비퀴논이 미토콘드리아 내막의 안쪽 면(N쪽)에서 유비퀴놀로 환원되고, 다른쪽 면(P쪽)에서 유비퀴논으로 산화됨에 따라 미토콘드리아 내막을 가로지르는 H+(양성자)의 순이동이 일어나서 H+(양성자)의 농도 기울기 형성에 기여한다.[131] 복합체 III에서 일어나는 Q 회로의 다소 복잡한 두 단계 메커니즘은 H+(양성자) 운반의 효율성을 증가시키기 때문에 중요하다. Q 회로 대신에 유비퀴놀(QH2) 1분자가 사이토크롬 c 2분자를 직접적으로 환원시키는데 사용된다면, 사이토크롬 c 하나가 환원될 때 단지 하나의 H+(양성자)가 운반되므로 효율성은 절반으로 줄어들게 된다.[131]
3. 1. 4. 복합체 IV (사이토크롬 c 산화효소)
사이토크롬 c 산화효소 또는 복합체 IV는 전자전달계의 마지막 단백질 복합체이다.[166] 포유류의 효소는 매우 복잡한 구조를 가지고 있으며, 13개의 소단위체, 2개의 헴기, 구리 원자 3개, 마그네슘 원자 1개, 아연 원자 1개를 포함하는 금속 이온으로 구성된다.[167]
복합체 IV는 전자전달계에서 최종 반응을 수행하며, 미토콘드리아 내막을 가로질러 H+(양성자)를 미토콘드리아 기질에서 막 사이 공간으로 능동수송하면서 전자를 산소로 전달한다.[168] 최종 전자 수용체인 산소(O2)는 이 단계에서 물(H2O)로 환원된다. H+(양성자)를 직접 능동수송하는 것과 산소의 환원 과정에서 미토콘드리아 기질의 H+(양성자)를 소비하는 것은 H+(양성자)의 농도 기울기 형성에 기여한다. 촉매되는 반응은 사이토크롬 c의 산화 및 산소의 환원이다.
+ O2 + 8H+matrix → 4 Cyt cox + 2H2O + 4H+intermembrane
진핵생물에서 복합체 IV의 표준 환원 전위는 다음과 같다.
3. 2. 원핵생물의 전자전달계
진핵생물에서 전자전달계의 구조와 기능이 일반적으로 유사성을 가지고 있는 것과는 달리 세균과 고세균은 매우 다양한 전자전달효소들을 가지고 있다. 세균과 고세균은 다양한 화학 물질을 기질로 사용한다.[183] 진핵생물과 마찬가지로 원핵생물의 전자전달계는 기질의 산화로부터 방출된 에너지를 사용하여 막을 가로질러 이온을 능동수송하고 막을 경계로 전기화학적 기울기를 형성시킨다. 세균에서는 대장균(''Escherichia coli'')의 산화적 인산화가 가장 잘 연구되고 알려져 있는 반면 고세균의 산화적 인산화는 현재까지 잘 알려져 있지 않다.[184]진핵생물과 원핵생물의 산화적 인산화에서 주된 차이점은 원핵생물은 전자 공여체나 전자 수용체로 매우 다양한 물질을 사용한다는 점이다. 이것은 원핵생물이 다양한 환경 조건하에서 살아갈 수 있게 한다.[185] 예를 들어 대장균에서 산화적 인산화는 아래에 열거된 다양한 환원제와 산화제에 의해 작동할 수 있다. 화학 물질의 표준환원전위는 산화되거나 환원될 때 방출되는 에너지의 양으로 측정한다. 표준환원전위에서 환원제는 음의 값을 가지고, 산화제는 양의 값을 가진다.
위의 표에서와 같이 대장균은 전자 공여체로 폼산, 수소, 젖산과 같은 환원제를 사용하고 전자 수용체로 질산, 다이메틸 설폭사이드(DMSO), 산소를 이용해 살아갈 수 있다.[185] 산화제와 환원제 간의 표준환원전위 차가 클수록 반응할 때 더 많은 에너지가 방출된다. 이들 화합물들 중에서 석신산/푸마르산 쌍은 표준환원전위 값이 0에 가깝기 때문에 특이하다. 따라서 석신산은 산소와 같은 강한 산화제를 사용하여 푸마르산으로 산화될 수 있고, 푸마르산은 폼산과 같은 강한 환원제를 사용하여 석신산으로 환원될 수 있다. 이러한 대체 반응은 각각 석신산 탈수소효소 및 푸마르산 환원효소에 의해 촉매된다.[187]
일부 원핵생물은 표준환원전위 차가 작은 산화환원 쌍을 사용한다. 예를 들어 니트로박터(''Nitrobacter'')와 같은 질화세균은 아질산을 질산으로 산화시켜 산소에 전자를 제공한다. 이 반응에서 방출되는 소량의 에너지는 H+(양성자)를 능동수송하고 ATP를 생성하기에 충분하지만, 동화작용에 사용하기 위한 NADH 또는 NADPH를 직접 생산하기에는 충분하지 않다.[188] 이 문제는 아질산 산화환원효소를 사용하여 전자전달계의 일부를 역방향으로 진행시켜 복합체 I이 NADH를 생성하도록 하는 충분한 양성자 구동력을 생성함으로써 해결된다.[189][190]
원핵생물은 환경 조건에 따라 생성되는 효소를 변화시킴으로써 전자 공여체와 전자 수용체의 사용을 조절한다.[191] 다른 산화효소와 환원효소가 동일한 유비퀴논 풀을 사용하기 때문에 이러한 유연함이 가능하다. 이것은 일반적인 유비퀴놀 중간생성물에 의해 연결된 많은 효소들의 조합이 함께 작용할 수 있게 한다.[186] 따라서 이러한 호흡 사슬은 효소를 쉽게 교체할 수 있는 시스템으로 모듈식 디자인을 갖고 있다.
이러한 대사에서의 다양성에 더하여 원핵생물은 동질효소를 가지고 있다. 예를 들어 대장균에서 산소를 전자 수용체로 사용하는 유비퀴놀 산화효소에는 두 가지 유형이 있다. 고도의 호기성 조건하에서 대장균은 전자당 2개의 H+(양성자)를 운반할 수 있는 산소에 더해 낮은 친화성을 갖는 산화효소를 사용한다. 그러나 산소량이 감소하면 전자당 하나의 H+(양성자)만을 전달하지만, 산소에 대해 높은 친화성을 갖는 산화효소로 전환한다.[192]
3. 3. 전자 및 양성자 전달 분자
전자전달계는 양성자와 전자를 모두 운반하며, 전자를 전자 공여체에서 전자 수용체로 전달하고, H+(양성자)를 막을 가로질러 능동수송한다. 이 과정에서 가용성 전달 분자 및 단백질에 결합된 전달 분자를 사용한다. 미토콘드리아에서 전자는 수용성 전자전달 단백질인 사이토크롬 c에 의해 막 사이 공간 내에서 전달된다.[134] 전자전달 단백질 내의 헴기가 가지고 있는 철 원자의 산화와 환원에 의해 전자가 전달된다. 사이토크롬 c는 몇몇 세균의 주변세포질 공간에서도 발견된다.[135]미토콘드리아 내막에 존재하는 지용성 전자운반체인 유비퀴논(조효소 Q10 또는 Q)은 산화환원 회로에 의해 전자와 H+(양성자)를 둘 다 운반한다.[136] 유비퀴논은 작은 벤조퀴논 분자로 매우 소수성이어서 막 내부에서 자유롭게 확산된다. 유비퀴논(Q)이 2개의 전자와 2개의 H+를 받아들이면, 유비퀴놀(QH2)의 형태로 환원된다. 유비퀴놀(QH2)이 2개의 전자와 2개의 H+를 방출하면, 산화되어 다시 유비퀴논(Q)의 형태로 되돌아간다. 유비퀴논(Q)이 막의 한 쪽에서 환원되고, 다른 한 쪽에서 유비퀴놀(QH2)이 산화되면, 이러한 반응들을 결합시켜 막을 통해 H+를 능동수송한다.[137] 일부 세균의 전자전달계는 유비퀴논 외에 메나퀴논과 같은 다른 퀴논을 사용한다.[138]

단백질 내에서 전자는 플라빈 보조 인자, 철-황 클러스터 및 사이토크롬 사이에서 전달된다.[131][139] 철-황 클러스터에는 몇 가지 유형이 있다. 전자전달계에서 발견되는 가장 단순한 종류는 2개의 황 원자와 연결되어 있는 [2Fe-2S] 클러스터이다. 두 번째 종류인 [4Fe-4S]는 4개의 철 원자와 4개의 황 원자를 가진 정육면체 구조를 포함한다. 이들 클러스터의 철 원자는 일반적으로 시스테인의 황 원자와 배위 결합을 한다. 보조 인자인 금속 이온은 H+(양성자)와 결합하거나 또는 양성자를 방출하지 않고 산화환원반응을 거치기 때문에 전자전달계에서 단백질을 통해 전자를 전달하는 역할을 수행한다. 전자는 이러한 보조 인자의 사슬을 따라 단백질을 통해 도약함으로써 먼 거리를 이동한다.[140] 이것은 1.4×10-9 m 미만의 거리에서 급격한 양자 터널링에 의해 발생한다.[141]
4. ATP 생성효소 (복합체 V)
ATP 생성효소(복합체 V)는 산화적 인산화 경로의 마지막 효소이다. 이 효소는 거의 모든 생물에서 발견되며, 원핵생물과 진핵생물 모두에서 동일한 방식으로 기능한다.[67] ATP 생성효소는 막을 가로지르는 H+(양성자)의 농도 기울기에 저장된 에너지를 사용하여 ADP와 인산(Pi)로부터 ATP를 합성한다. ATP 하나를 합성하는 데 필요한 양성자 수는 3~4개로 추정되지만,[68][69] 세포가 서로 다른 조건에 맞게 이 비율을 조절할 수 있다는 주장도 있다.[70]
이 인산화 반응은 평형이며, 양성자 구동력을 변화시킴으로써 평형을 이동시킬 수 있다. 양성자 구동력이 없으면 ATP 생성효소 반응은 오른쪽에서 왼쪽으로 진행되어 ATP를 가수분해하고 기질에서 막을 가로질러 양성자를 펌핑한다. 그러나 양성자 구동력이 높으면 반응은 반대 방향으로 진행되어 양성자가 농도 기울기를 따라 흐르도록 하고 ADP를 ATP로 전환한다.[67] 실제로 밀접하게 관련된 액포형 H+-ATPase에서는 가수분해 반응을 사용하여 양성자를 펌핑하고 ATP를 가수분해함으로써 세포 내 구획을 산성화한다.[71]
일부 박테리아와 고균에서는 양성자의 이동이 아니라 세포막을 통한 나트륨 이온(Na+)의 이동에 의해 ATP 합성이 구동된다.[78][79] ''메타노코쿠스''와 같은 고세균은 다른 박테리아 및 진핵생물 ATP 생성효소 서브유닛과 서열 유사성이 거의 없는 추가 단백질을 포함하는 A1Ao 생성효소를 갖는데, 일부 종에서는 A1Ao 형태의 효소가 특수한 나트륨 구동 ATP 생성효소일 가능성이 있지만,[80] 모든 경우에 해당되는 것은 아니다.[79]
4. 1. ATP 생성효소의 구조
ATP 생성효소는 산화적 인산화 경로의 마지막 효소로, 거의 모든 생물에서 발견되며 원핵생물과 진핵생물에서 동일한 방식으로 작동한다.[193] ATP 생성효소는 ADP와 인산(Pi)으로부터 ATP를 합성하기 위해 막을 경계로 형성된 H+의 농도 기울기의 형태로 저장된 에너지를 사용한다. 하나의 ATP를 합성하는데 필요한 H+(양성자)의 수는 3~4 사이로 추정되며,[194][195] 일부 세포들은 다른 조건들에 맞추어 이 비율을 바꿀 수 있다.[196]ATP 생성효소는 버섯 모양의 거대한 단백질 복합체이다. 포유류의 ATP 생성효소는 16개의 소단위체를 포함하고, 약 600 kDa의 분자량을 갖는다.[198] Fo (o는 올리고마이신 민감성을 의미)는 막에 묻혀있는 부분으로 c 소단위체와 양성자(H+) 통로를 포함한다. F1은 기둥과 공 모양의 머리 부분으로 ATP를 합성하는 부위이다. F1은 9개의 소단위체로 구성되어 있고, 소단위체는 5종류가 있으며, 그 구성은 α3β3γδε이다. F1의 공 모양의 복합체는 2가지 종류의 6개의 단백질(3개의 α 소단위체와 3개의 β 소단위체)로 구성된다. F1의 γ 소단위체는 α 소단위체와 β 소단위체로 구성된 공 모양의 구조물 중앙을 관통하는 중심축 같은 구조이다.[199] F1의 α 및 β 소단위체는 둘 다 뉴클레오타이드와 결합하지만, β 소단위체만이 ATP 합성반응을 촉매한다. F1의 γ 소단위체와 ε 소단위체는 α 소단위체와 β 소단위체를 효소의 기저부에 고정시킨다.
H+(양성자)가 ATP 생성효소의 기저부에 있는 통로를 통해 막을 가로질러 통과함에 따라 Fo의 양성자 구동 모터가 회전한다.[200] 모터의 회전은 H+(양성자)가 통로를 지나갈 때 c 소단위체의 고리를 회전시키는 정전기적 상호작용과 이로 인한 c 소단위체 고리 내에서 아미노산의 이온화 상태의 변화로 인해 야기될 수 있다.[201] 이러한 회전 고리는 α 소단위체와 β 소단위체를 관통하는 중심 축(γ 소단위체)을 차례로 회전시킨다. α와 β 소단위체는 고정자 역할을 하는 측면 팔 구조에 의해 스스로 회전하는 것을 방지한다. α와 β 소단위체를 관통하는 γ 소단위체의 움직임은 β 소단위체 내의 활성 부위에서 ATP를 생성하고 ATP를 방출하기 위해 필요한 에너지를 제공한다.[202]
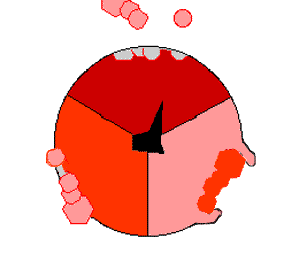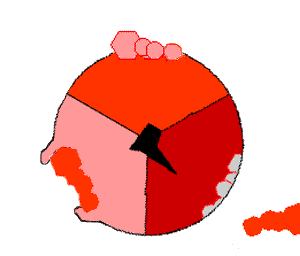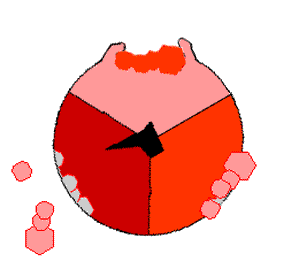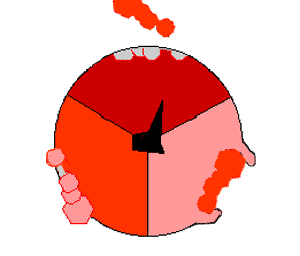
이러한 ATP 합성반응은 결합 변화 메커니즘이라고 불리며 각각의 β 소단위체가 3가지 입체 형태를 순환하도록 유도한다.[203] "열린" 상태에서 ADP와 인산(Pi)은 활성 부위로 들어간다. "느슨한" 상태에서 단백질은 분자들과 느슨하게 결합한다. 효소는 다시 구조를 변화시키고 새로 생성된 ATP를 효소의 활성부위에 매우 높은 친화력으로 결합시킨다("단단한" 상태). 마지막으로 효소의 활성 부위에서 ATP가 방출되고, 다시 "열린" 상태로 되돌아가 다음 사이클을 반복한다.
일부 세균과 고균에서 ATP 합성은 H+(양성자)의 이동이 아니라 나트륨 이온(Na+)의 막을 통한 이동에 의해서 이루어진다.[204][205] ''메타노코쿠스''와 같은 고균은 다른 세균 및 진핵생물의 ATP 생성효소 소단위체와는 다른 단백질을 포함하는 A1Ao 생성효소를 갖고 있다. 일부 종에서 A1Ao 형태의 효소가 나트륨(Na+)으로 구동되는 ATP 생성효소일 수도 있지만,[206] 이는 모든 경우에서 다 그러한 것은 아니다.[205]
4. 2. ATP 생성효소의 작동 방식
ATP 생성효소는 미토콘드리아 내막에 위치하며, 산화적 인산화 과정에서 핵심적인 역할을 수행하는 효소 복합체이다. 이 효소는 H+(양성자)의 농도 기울기를 이용하여 ADP와 인산(Pi)으로부터 ATP를 생성한다.[193] ATP 생성에 필요한 H+(양성자)의 수는 3~4개로 추정되며,[194][195] 세포는 조건에 따라 이 비율을 조절할 수 있다.[196]이 인산화 반응은 양성자 구동력에 의해 평형이 조절된다. 양성자 구동력이 낮으면 ATP 생성효소는 ATP를 가수분해하여 H+(양성자)를 막 사이 공간으로 능동수송하고, 반응은 오른쪽에서 왼쪽으로 진행된다. 반대로 양성자 구동력이 높으면 H+(양성자)가 농도 기울기에 따라 ATP 생성효소를 통해 확산되어 ADP를 ATP로 전환시키고, 반응은 왼쪽에서 오른쪽으로 진행된다.[193]
ATP 생성효소는 Fo와 F1의 두 부분으로 구성된 복합체이다. Fo는 막에 위치하며 c 소단위체와 H+(양성자) 통로를 포함하고, F1은 머리 부분으로 ATP 합성 부위이다. F1은 9개의 소단위체(α3β3γδε)로 구성되며, α 소단위체와 β 소단위체는 뉴클레오타이드와 결합하지만, β 소단위체만이 ATP 합성을 촉매한다.[199]
H+(양성자)가 Fo를 통과하면 Fo의 모터가 회전하고,[200] 이는 c 소단위체의 고리를 회전시키는 정전기적 상호작용과 아미노산의 이온화 상태 변화로 인해 발생한다.[201] 이 회전은 γ 소단위체를 회전시키고, γ 소단위체의 움직임은 β 소단위체의 활성 부위에서 ATP를 생성하고 방출하는 데 필요한 에너지를 제공한다.[202]
ATP 합성은 β 소단위체의 세 가지 상태 변화를 통해 이루어진다.[203] "열린" 상태에서 ADP와 Pi가 활성 부위에 들어가고, "느슨한" 상태에서 느슨하게 결합한다. 효소는 구조를 변화시켜 새로 생성된 ATP를 높은 친화력으로 결합시키는 "단단한" 상태를 만든다. 마지막으로 "열린" 상태로 돌아가 ATP를 방출하고 다음 사이클을 준비한다.
일부 세균과 고균에서는 H+(양성자) 대신 나트륨 이온(Na+)의 이동으로 ATP 합성이 이루어진다.[204][205] ''메타노코쿠스''와 같은 고균은 A1Ao 생성효소를 가지며, 이는 다른 세균 및 진핵생물의 ATP 생성효소와 다른 단백질을 포함한다.[206]
5. 활성산소
산소(O2)는 강력한 산화제이므로 이상적인 최종 전자 수용체이다. 하지만 산소가 환원되는 과정에서 초과산화물(superoxide)이나 과산화물(peroxide)과 같이 반응성이 크고 위험한 활성 산소가 생성될 수 있다.[207]
\begin{matrix}
\ce{O2 ->[\ce{e^-}] \underset{Superoxide}{O2^{\underline{\bullet}}} ->[\ce{e^-}] \underset{Peroxide}{O2^{2-}}}\\{}
\end{matrix}
이러한 활성산소와 그 반응 생성물(예: 하이드록실 라디칼)은 단백질을 산화시키고 DNA에 돌연변이를 유발하여 세포에 매우 해롭다. 이러한 세포 손상은 질병의 원인이 될 수 있으며, 노화의 원인 중 하나로 제시된다.[208][209]
전자전달계에서는 소량의 초과산화물 및 과산화물이 생성되는데, 특히 복합체 III에서 유비퀴논의 환원이 중요하다. 미토콘드리아는 ATP 생산과 산화제 생성의 균형을 이루는 좁은 범위 내에서 막전위를 유지하도록 조절한다.[212]
세포는 비타민 C, 비타민 E와 같은 항산화 비타민과 초과산화물 불균등화효소, 카탈레이스, 과산화효소와 같은 항산화 효소를 포함하는 수많은 항산화 시스템을 가지고 있어서 활성산소를 해독하여 세포 손상을 방지한다.[207]
5. 1. 활성산소의 생성 및 제거
산소(O2)는 강력한 산화제이기 때문에 이상적인 최종 전자 수용체이다. 산소의 환원 과정에는 잠재적으로 해로운 중간생성물이 형성될 수 있다.[207] 산소에 4개의 전자와 4개의 양성자가 전달되면 무해한 물(H2O)로 환원된다. 하지만 1개 또는 2개의 전자가 전달되면 초과산화물이나 과산화물이 생성되는데, 이들은 반응성이 커서 위험하다.\begin{matrix}
\ce{O2 ->[\ce{e^-}] \underset{Superoxide}{O2^{\underline{\bullet}}} ->[\ce{e^-}] \underset{Peroxide}{O2^{2-}}}\\{}
\end{matrix}
이러한 활성산소와 하이드록시 라디칼 같은 반응 산물들은 단백질을 산화시키고 DNA에 돌연변이를 유발하기 때문에 세포에 매우 해롭다. 이러한 세포 손상은 질병의 원인이 될 수 있으며, 노화의 원인 중 하나로 제시된다.[208][209]
사이토크롬 c 산화효소 복합체는 산소(O2)를 물(H2O)로 환원시키는데 매우 효율적이며, 부분적으로 환원된 중간생성물을 거의 방출하지 않는다. 그러나 전자전달계에 의해 소량의 초과산화물 및 과산화물이 생성된다.[210] 반응성이 큰 세미퀴논 라디칼이 Q 회로에서 중간생성물로 형성되기 때문에 복합체 III에서 유비퀴논의 환원이 특히 중요하다. 세미퀴논 라디칼은 불안정해서 전자가 산소로 직접 전달될 때 전자의 누출을 일으켜 초과산화물을 형성시킨다.[211] 이러한 양성자 펌핑 복합체에 의한 활성산소의 생성은 높은 막전위에서 가장 크기 때문에, 미토콘드리아가 ATP 생산과 산화제 생성의 균형을 이루는 좁은 범위 내에서 막전위를 유지하도록 활성을 조절하는 것이 제안되었다.[212] 예를 들어 산화제는 막전위를 감소시키는 짝풀림 단백질을 활성화시킬 수 있다.[213]
이러한 활성산소에 대응하기 위해 세포는 비타민 C, 비타민 E와 같은 항산화 비타민과 초과산화물 불균등화효소, 카탈레이스, 과산화효소와 같은 항산화 효소를 포함하는 수많은 항산화 시스템을 가지고 있어서 활성산소를 해독하여 세포 손상을 방지한다.[207]
6. 저해제
산화적 인산화를 저해하는 몇 가지 약물과 독소가 알려져 있다. 이러한 독소 중 하나가 산화적 인산화 경로의 특정 효소를 저해하면, 연쇄 반응으로 인해 나머지 과정도 멈추게 된다. 예를 들어, 올리고마이신이 ATP 생성효소를 저해하면, H+(양성자)는 미토콘드리아 기질로 돌아갈 수 없게 된다.[215] 그 결과 H+의 농도 기울기가 너무 강해져 펌프가 작동할 수 없게 된다. NADH는 더 이상 산화되지 못하고, NAD+ 농도가 낮아져 시트르산 회로도 멈춘다.
하지만 모든 산화적 인산화 저해제가 독소는 아니다. 갈색지방조직에는 짝풀림 단백질이라는 조절된 H+(양성자) 통로가 있어 호흡과 ATP 합성을 분리할 수 있다.[220] 이렇게 짝풀린 호흡은 열을 발생시키며, 동면 동물에게서 체온 유지에 중요한 역할을 한다.[221]
7. 역사
아서 하든이 1906년 발효에서 인산의 중요성을 발표하면서 산화적 인산화 연구가 시작되었지만, 처음에는 당인산만 관련있는 것으로 알려졌다.[222] 1940년대 초 헤르만 칼카르(Herman Kalckar)가 당의 산화와 ATP 생성 간의 연관성을 확립했고,[223] 1941년 프리츠 앨버트 리프먼은 에너지 전달에서 ATP의 핵심 역할을 확인했다.[224] 1949년 모리스 프리드킨(Morris Friedkin)과 앨버트 L. 레닌저(Albert L. Lehninger)는 NADH가 시트르산 회로 및 ATP 합성과 같은 대사 경로와 연결됨을 증명했다.[225] 1939년 소련의 볼로디미르 벨리체르(Volodymyr Belitser)가 산화적 인산화라는 용어를 만들었다.[226][227]
이후 20년간 ATP 생성 메커니즘은 수수께끼였고, 과학자들은 산화와 인산화 반응을 연결하는 "고에너지 중간산물"을 찾았다.[228] 1961년 피터 D. 미첼의 화학삼투설 발표로 이 수수께끼가 해결되었다.[229] 처음에는 논란이 있었지만, 점차 받아들여져 미첼은 1978년 노벨 화학상을 수상했다.[230][231] 이후 에프라임 랙커(Efraim Racker)의 ATP 생성효소 연구, 데이비드 E. 그린(David E. Green)의 전자전달계 복합체 연구 등 관련 효소 정제 및 특성 연구가 이어졌다.[232] 폴 D. 보이어는 1973년 결합 변화 메커니즘, 1982년 회전 촉매 방식을 제안하여 ATP 생성효소 작동 메커니즘 이론을 제시했다.[203][233] 이후 존 E. 워커가 산화적 인산화 관련 효소 구조를 연구했고, 워커와 보이어는 1997년 노벨 화학상을 수상했다.[234]
8. 더 읽을거리
- 넬슨(Nelson DL), 콕스(Cox MM) 공저, 《레닌저 생화학》(Lehninger Principles of Biochemistry), 제4판, W. H. Freeman, 2004, ISBN 0-7167-4339-6.
- 슈나이더(Schneider ED), 세이건(Sagan D) 공저, 《차가움 속으로: 에너지 흐름, 열역학 및 생명》(Into the Cool: Energy Flow, Thermodynamics and Life), 초판, 시카고 대학교 출판부, 2006, ISBN 0-226-73937-6.
- 레인(Lane N), 《힘, 섹스, 자살: 미토콘드리아와 생명의 의미》(Power, Sex, Suicide: Mitochondria and the Meaning of Life), 초판, 옥스퍼드 대학교 출판부, 미국, 2006, ISBN 0-19-920564-7.
- 니콜스(Nicholls DG), 퍼거슨(Ferguson SJ) 공저, 《생체에너지학 3》(Bioenergetics 3), 초판, Academic Press, 2002, ISBN 0-12-518121-3.
- 헤이니(Haynie D), 《생물학적 열역학》(Biological Thermodynamics), 초판, 케임브리지 대학교 출판부, 2001, ISBN 0-521-79549-4.
- 라잔(Rajan SS), 《생체에너지학 개론》(Introduction to Bioenergetics), 초판, Anmol, 2003, ISBN 81-261-1364-2.
- 윅스트롬(Wikstrom M) 편집, 《생체에너지학의 생물물리학적 및 구조적 측면》(Biophysical and Structural Aspects of Bioenergetics), 초판, Royal Society of Chemistry, 2005, ISBN 0-85404-346-2.
- 와일리 ''생화학 개념''의 산화적 인산화 애니메이션 [http://www.wiley.com/legacy/college/boyer/0470003790/animations/electron_transport/electron_transport.htm].
- 일리노이 대학교 어바나-샴페인 안토니 크로프츠의 온라인 생물물리학 강의.
- 그레이엄 존슨의 ATP 생성효소 [https://www.youtube.com/watch?v=PjdPTY1wHdQ].
- PDB 분자 목록:
- ATP 생성효소.
- 사이토크롬 c.
- 사이토크롬 c 산화효소.
- 페르난두 페소아 대학교의 대화형 분자 모델:
- NADH 탈수소효소.
- 석신산 탈수소효소.
- 조효소 Q-사이토크롬 c 환원효소.
- 사이토크롬 c 산화효소.
참조
[1]
뉴스
oxidative Meaning in the Cambridge English Dictionary
https://dictionary.c[...]
2018-04-28
[2]
서적
Biochemistry
Wiley
[3]
논문
Chemiosmotic hypothesis of oxidative phosphorylation
1967-01-01
[4]
논문
Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases
http://jeb.biologist[...]
2000-01-01
[5]
논문
Structures and proton-pumping strategies of mitochondrial respiratory enzymes
https://resolver.cal[...]
[6]
논문
The molecular machinery of Keilin's respiratory chain
2003-12-01
[7]
논문
Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes
1995-09-01
[8]
논문
The structure, function and evolution of cytochromes
[9]
논문
Why do c-type cytochromes exist?
1983-12-01
[10]
논문
Biochemical functions of coenzyme Q10
2001-12-01
[11]
논문
Keilin's respiratory chain concept and its chemiosmotic consequences
1979-12-01
[12]
논문
Microbial ubiquinones: multiple roles in respiration, gene regulation and oxidative stress management
http://mic.sgmjourna[...]
1999-08-01
[13]
논문
Structure, function, and formation of biological iron-sulfur clusters
[14]
논문
Natural engineering principles of electron tunnelling in biological oxidation-reduction
1999-11-01
[15]
논문
Electrical circuitry in biology: emerging principles from protein structure
2004-12-01
[16]
논문
An anaerobic mitochondrion that produces hydrogen
2005-03-01
[17]
서적
Medical CHEMISTRY Compendium
Aarhus University
[18]
논문
Energy transduction by respiratory complex I--an evaluation of current knowledge
2005-06-01
[19]
논문
Mitochondrial Complex I: structural and functional aspects
[20]
논문
Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus
2006-03-01
[21]
논문
The architecture of respiratory complex I
2010-05-01
[22]
논문
Projection structure of the membrane domain of Escherichia coli respiratory complex I at 8 A resolution
2007-02-01
[23]
논문
The gross structure of the respiratory complex I: a Lego System
2004-01-01
[24]
논문
Towards the molecular mechanism of respiratory complex I
2009-12-01
[25]
논문
Function and structure of complex II of the respiratory chain
[26]
논문
Architecture of succinate dehydrogenase and reactive oxygen species generation
2003-01-01
[27]
논문
Complex II from a structural perspective
2004-04-01
[28]
논문
Role of complex II in anaerobic respiration of the parasite mitochondria from Ascaris suum and Plasmodium falciparum
2002-01-01
[29]
논문
Specific role of mitochondrial electron transport in blood-stage Plasmodium falciparum
2007-03-01
[30]
논문
Reactions of electron-transfer flavoprotein and electron-transfer flavoprotein: ubiquinone oxidoreductase
1987-02-01
[31]
논문
Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool
2006-10-01
[32]
논문
Separation and properties of five distinct acyl-CoA dehydrogenases from rat liver mitochondria. Identification of a new 2-methyl branched chain acyl-CoA dehydrogenase
http://www.jbc.org/c[...]
1983-01-01
[33]
논문
A new iron-sulfur flavoprotein of the respiratory chain. A component of the fatty acid beta oxidation pathway
http://www.jbc.org/c[...]
1977-12-01
[34]
논문
The critical role of Arabidopsis electron-transfer flavoprotein:ubiquinone oxidoreductase during dark-induced starvation
2005-09-01
[35]
논문
Structure and function of cytochrome bc complexes
http://www.life.illi[...]
[36]
논문
The cytochrome bc1 complex: function in the context of structure
[37]
논문
Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex
1998-07-00
[38]
논문
The protonmotive Q cycle. Energy transduction by coupling of proton translocation to electron transfer by the cytochrome bc1 complex
http://www.jbc.org/c[...]
1990-07-00
[39]
논문
Protonmotive pathways and mechanisms in the cytochrome bc1 complex
2003-06-00
[40]
논문
The cytochrome oxidase superfamily of redox-driven proton pumps
1994-08-00
[41]
논문
The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A
1996-05-00
[42]
논문
Proton pumping mechanism of bovine heart cytochrome c oxidase
[43]
논문
Alternative NAD(P)H dehydrogenases of plant mitochondria
[44]
논문
Purification and characterization of a 43-kDa rotenone-insensitive NADH dehydrogenase from plant mitochondria
1996-09-00
[45]
논문
Branched mitochondrial electron transport in the Animalia: presence of alternative oxidase in several animal phyla
2004-06-00
[46]
논문
Alternative oxidase in the branched mitochondrial respiratory network: an overview on structure, function, regulation, and role
1998-06-00
[47]
논문
The regulation and nature of the cyanide-resistant alternative oxidase of plant mitochondria
1991-08-00
[48]
논문
ALTERNATIVE OXIDASE: From Gene to Function
1997-06-00
[49]
논문
Transcript levels of tandem-arranged alternative oxidase genes in rice are increased by low temperature
1997-12-00
[50]
논문
The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells
1999-07-00
[51]
논문
A critical appraisal of the mitochondrial coenzyme Q pool
2001-12-00
[52]
논문
A structural model of the cytochrome C reductase/oxidase supercomplex from yeast mitochondria
2007-04-00
[53]
논문
Supercomplexes in the respiratory chains of yeast and mammalian mitochondria
2000-04-00
[54]
논문
Respiratory chain supercomplexes of mitochondria and bacteria
2002-09-00
[55]
논문
The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes
http://www.jbc.org/c[...]
2001-10-00
[56]
논문
Relationship between lateral diffusion, collision frequency, and electron transfer of mitochondrial inner membrane oxidation-reduction components
1984-05-00
[57]
논문
Post-Viking microbiology: new approaches, new data, new insights
1999-01-00
[58]
논문
Bioenergetics of the Archaea
1999-09-00
[59]
논문
The respiratory chains of Escherichia coli
1984-09-00
[60]
논문
Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors
1997-07-00
[61]
논문
Succinate dehydrogenase and fumarate reductase from Escherichia coli
2002-01-00
[62]
논문
Energy conservation in Nitrobacter
[63]
논문
Genome sequence of the chemolithoautotrophic nitrite-oxidizing bacterium Nitrobacter winogradskyi Nb-255
2006-03-00
[64]
논문
The nitrite oxidizing system of Nitrobacter winogradskyi
1988-12-00
[65]
논문
Adaptation of Escherichia coli to redox environments by gene expression
1993-07-00
[66]
논문
Energetic efficiency of Escherichia coli: effects of mutations in components of the aerobic respiratory chain
http://jb.asm.org/cg[...]
1993-05-00
[67]
논문
The ATP synthase--a splendid molecular machine
[68]
논문
The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four
1996-02-00
[69]
논문
ATP synthase--a marvellous rotary engine of the cell
2001-09-00
[70]
논문
Effects of carbon source on expression of F0 genes and on the stoichiometry of the c subunit in the F1F0 ATPase of Escherichia coli
1998-06-00
[71]
논문
The cellular biology of proton-motive force generation by V-ATPases
http://jeb.biologist[...]
2000-01-01
[72]
논문
Structure of the mitochondrial ATP synthase by electron cryomicroscopy
2003-12-01
[73]
논문
Structural model of F1-ATPase and the implications for rotary catalysis
2000-04-01
[74]
논문
The rotary machine in the cell, ATP synthase
2001-01-01
[75]
논문
Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor
2002-03-01
[76]
논문
Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series
2006-03-01
[77]
논문
Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model
http://www.jbc.org/c[...]
1982-10-01
[78]
논문
Bacterial sodium ion-coupled energetics
[79]
논문
Delta mu Na+ drives the synthesis of ATP via an delta mu Na(+)-translocating F1F0-ATP synthase in membrane vesicles of the archaeon Methanosarcina mazei Gö1
1994-05-01
[80]
논문
An exceptional variability in the motor of archael A1A0 ATPases: from multimeric to monomeric rotors comprising 6-13 ion binding sites
2004-02-01
[81]
논문
Oxidative stress: the paradox of aerobic life
[82]
논문
Theories of biological aging: genes, proteins, and free radicals
http://www.link-age.[...]
2017-10-27
[83]
논문
Free radicals and antioxidants in normal physiological functions and human disease
[84]
논문
Mitochondria, oxygen free radicals, disease and ageing
2000-10-01
[85]
논문
Oxidants, oxidative stress and the biology of ageing
2000-11-01
[86]
논문
New extension of the Mitchell Theory for oxidative phosphorylation in mitochondria of living organisms
2010-03-01
[87]
논문
Superoxide activates mitochondrial uncoupling proteins
2002-01-01
[88]
논문
Acidosis Maintains the Function of Brain Mitochondria in Hypoxia-Tolerant Triplefin Fish: A Strategy to Survive Acute Hypoxic Exposure?
2019-01-01
[89]
논문
Mitochondrial Dysfunction and Myocardial Ischemia-Reperfusion: Implications for Novel Therapies
2017-01-01
[90]
논문
A radical approach to beating hypoxia: depressed free radical release from heart fibres of the hypoxia-tolerant epaulette shark (Hemiscyllum ocellatum)
2012-01-01
[91]
논문
Review: A history and perspective of mitochondria in the context of anoxia tolerance
2022-01-01
[92]
논문
Naked mole rat brain mitochondria electron transport system flux and H+ leak are reduced during acute hypoxia
2018-02-01
[93]
논문
Modulation of electron transport protects cardiac mitochondria and decreases myocardial injury during ischemia and reperfusion
2007-01-01
[94]
논문
Mitochondria as ATP consumers: cellular treason in anoxia
2000-07-01
[95]
논문
Metabolic adaptations during extreme anoxia in the turtle heart and their implications for ischemia-reperfusion injury
2019-02-01
[96]
논문
Are reactive oxygen species always bad? Lessons from hypoxic ectotherms
2024-03-01
[97]
논문
Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS
2014-11-01
[98]
논문
How mitochondria produce reactive oxygen species
2009-01-01
[99]
논문
Mitochondria and reactive oxygen species: physiology and pathophysiology
2013-03-01
[100]
논문
Naked Mole-Rat Cortex Maintains Reactive Oxygen Species Homeostasis During ''In Vitro'' Hypoxia or Ischemia and Reperfusion
2023-01-01
[101]
논문
Intermittent hypoxia leads to functional reorganization of mitochondria and affects cellular bioenergetics in marine molluscs
2016-06-01
[102]
논문
Oxygen consumption by mitochondria from an endotherm and an ectotherm
1999-09-01
[103]
논문
Beating oxygen: chronic anoxia exposure reduces mitochondrial F1FO-ATPase activity in turtle (Trachemys scripta) heart
2013-09-01
[104]
논문
Maintained mitochondrial integrity without oxygen in the anoxia-tolerant crucian carp
2024-10-01
[105]
논문
Low production of mitochondrial reactive oxygen species after anoxia and reoxygenation in turtle hearts
2023-05-01
[106]
저널
Metabolic adaptations to anoxia and reoxygenation: New lessons from freshwater turtles and crucian carp
https://linkinghub.e[...]
2020-04-00
[107]
서적
Biochemistry
Books and Allied
2002-00-00
[108]
저널
Fourier-transform infrared study of cyanide binding to the Fea3-CuB binuclear site of bovine heart cytochrome c oxidase: implication of the redox-linked conformational change at the binuclear site
1993-01-00
[109]
저널
ATP synthase complex from bovine heart mitochondria: the oligomycin sensitivity conferring protein is essential for dicyclohexyl carbodiimide-sensitive ATPase
1991-08-00
[110]
문서
2,4-Dinitrophenol#Dieting aid
2024-11-05
[111]
컨퍼런스
Uncouplers of oxidative phosphorylation
[112]
저널
Inhibitors of the quinone-binding site allow rapid superoxide production from mitochondrial NADH:ubiquinone oxidoreductase (complex I)
2004-09-00
[113]
저널
Studies on Succinate Dehydrogenase. I. Spectral Properties of the Purified Enzyme and Formation of Enzyme-Competitive Inhibitor Complexes
1964-11-00
[114]
저널
The uncoupling protein homologues: UCP1, UCP2, UCP3, StUCP and AtUCP
2000-01-00
[115]
저널
Plant uncoupling mitochondrial protein and alternative oxidase: energy metabolism and stress
[116]
저널
The alcoholic ferment of yeast-juice
[117]
저널
Origins of the concept oxidative phosphorylation
1974-11-00
[118]
저널
Metabolic generation and utilization of phosphate bond energy
[119]
저널
Esterification of inorganic phosphate coupled to electron transport between dihydrodiphosphopyridine nucleotide and oxygen
http://www.jbc.org/c[...]
1949-04-00
[120]
저널
50 years of biological research--from oxidative phosphorylation to energy requiring transport regulation
[121]
저널
About phosphorilation mechanism coupled with respiration
[122]
저널
Mechanism of phosphorylation in the respiratory chain
1953-11-00
[123]
저널
Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism
1961-07-00
[124]
서적
Peter Mitchell and the Vital Force
[125]
웹사이트
David Keilin's Respiratory Chain Concept and Its Chemiosmotic Consequences
http://nobelprize.or[...]
Nobel Foundation
2007-07-21
[126]
저널
Partial resolution of the enzymes catalyzing oxidative phosphorylation. I. Purification and properties of soluble dinitrophenol-stimulated adenosine triphosphatase
http://www.jbc.org/c[...]
1960-11-00
[127]
저널
A new concept for energy coupling in oxidative phosphorylation based on a molecular explanation of the oxygen exchange reactions
1973-10-00
[128]
웹사이트
The Nobel Prize in Chemistry 1997
http://nobelprize.or[...]
Nobel Foundation
2007-07-21
[129]
저널
Chemiosmotic hypothesis of oxidative phosphorylation
[130]
저널
Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases
http://jeb.biologist[...]
2000-01-01
[131]
저널
Structures and proton-pumping strategies of mitochondrial respiratory enzymes
[132]
저널
The molecular machinery of Keilin's respiratory chain
[133]
저널
Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes
[134]
저널
The structure, function and evolution of cytochromes
[135]
저널
Why do c-type cytochromes exist?
[136]
저널
Biochemical functions of coenzyme Q10
2001-12-01
[137]
저널
Keilin's respiratory chain concept and its chemiosmotic consequences
[138]
저널
Microbial ubiquinones: multiple roles in respiration, gene regulation and oxidative stress management
http://mic.sgmjourna[...]
[139]
저널
Structure, function, and formation of biological iron-sulfur clusters
https://archive.org/[...]
[140]
저널
Natural engineering principles of electron tunnelling in biological oxidation-reduction
[141]
저널
Electrical circuitry in biology: emerging principles from protein structure
[142]
저널
An anaerobic mitochondrion that produces hydrogen
[143]
서적
Medical CHEMISTRY Compendium
Aarhus University
[144]
저널
Energy transduction by respiratory complex I--an evaluation of current knowledge
http://www.biochemso[...]
[145]
저널
Mitochondrial Complex I: structural and functional aspects
[146]
저널
Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus
[147]
저널
The arcdhitecture of respiratory complex I
[148]
저널
Projection structure of the membrane domain of Escherichia coli respiratory complex I at 8 A resolution
[149]
저널
The gross structure of the respiratory complex I: a Lego System
[150]
저널
Towards the molecular mechanism of respiratory complex I
2010-01-01
[151]
저널
Function and structure of complex II of the respiratory chain
[152]
저널
Architecture of succinate dehydrogenase and reactive oxygen species generation
[153]
저널
Complex II from a structural perspective
[154]
저널
Role of complex II in anaerobic respiration of the parasite mitochondria from Ascaris suum and Plasmodium falciparum
[155]
저널
Specific role of mitochondrial electron transport in blood-stage Plasmodium falciparum
[156]
저널
Reactions of electron-transfer flavoprotein and electron-transfer flavoprotein: ubiquinone oxidoreductase
[157]
저널
Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool
[158]
저널
Separation and properties of five distinct acyl-CoA dehydrogenases from rat liver mitochondria. Identification of a new 2-methyl branched chain acyl-CoA dehydrogenase
http://www.jbc.org/c[...]
1983-01-25
[159]
저널
A new iron-sulfur flavoprotein of the respiratory chain. A component of the fatty acid beta oxidation pathway
http://www.jbc.org/c[...]
[160]
저널
The critical role of Arabidopsis electron-transfer flavoprotein:ubiquinone oxidoreductase during dark-induced starvation
[161]
저널
Structure and function of cytochrome bc complexes
http://www.life.illi[...]
[162]
저널
The cytochrome bc1 complex: function in the context of structure
https://archive.org/[...]
[163]
저널
Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex
[164]
저널
The protonmotive Q cycle. Energy transduction by coupling of proton translocation to electron transfer by the cytochrome bc1 complex
http://www.jbc.org/c[...]
[165]
저널
Protonmotive pathways and mechanisms in the cytochrome bc1 complex
[166]
저널
The cytochrome oxidase superfamily of redox-driven proton pumps
[167]
저널
The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A
[168]
저널
Proton pumping mechanism of bovine heart cytochrome c oxidase
[169]
저널
Alternative NAD(P)H dehydrogenases of plant mitochondria
https://archive.org/[...]
[170]
저널
Purification and characterization of a 43-kDa rotenone-insensitive NADH dehydrogenase from plant mitochondria
http://www.jbc.org/c[...]
[171]
저널
Branched mitochondrial electron transport in the Animalia: presence of alternative oxidase in several animal phyla
[172]
저널
Alternative oxidase in the branched mitochondrial respiratory network: an overview on structure, function, regulation, and role
[173]
저널
The regulation and nature of the cyanide-resistant alternative oxidase of plant mitochondria
[174]
저널
ALTERNATIVE OXIDASE: From Gene to Function
[175]
저널
Transcript levels of tandem-arranged alternative oxidase genes in rice are increased by low temperature
[176]
저널
The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells
http://www.pnas.org/[...]
[177]
저널
A critical appraisal of the mitochondrial coenzyme Q pool
[178]
저널
A structural model of the cytochrome C reductase/oxidase supercomplex from yeast mitochondria
http://www.jbc.org/c[...]
[179]
저널
Supercomplexes in the respiratory chains of yeast and mammalian mitochondria
[180]
저널
Respiratory chain supercomplexes of mitochondria and bacteria
[181]
저널
The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes
http://www.jbc.org/c[...]
[182]
저널
Relationship between lateral diffusion, collision frequency, and electron transfer of mitochondrial inner membrane oxidation-reduction components
[183]
저널
Post-Viking microbiology: new approaches, new data, new insights
[184]
저널
Bioenergetics of the Archaea
[185]
저널
The respiratory chains of Escherichia coli
[186]
저널
Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors
[187]
저널
Succinate dehydrogenase and fumarate reductase from Escherichia coli
[188]
저널
Energy conservation in Nitrobacter
[189]
저널
Genome sequence of the chemolithoautotrophic nitrite-oxidizing bacterium Nitrobacter winogradskyi Nb-255
http://aem.asm.org/c[...]
[190]
저널
The nitrite oxidizing system of Nitrobacter winogradskyi
[191]
저널
Adaptation of Escherichia coli to redox environments by gene expression
[192]
저널
Energetic efficiency of Escherichia coli: effects of mutations in components of the aerobic respiratory chain
http://jb.asm.org/cg[...]
[193]
저널
The ATP synthase--a splendid molecular machine
[194]
저널
The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four
[195]
저널
ATP synthase--a marvellous rotary engine of the cell
[196]
저널
Effects of carbon source on expression of F0 genes and on the stoichiometry of the c subunit in the F1F0 ATPase of Escherichia coli
[197]
저널
The cellular biology of proton-motive force generation by V-ATPases
http://jeb.biologist[...]
2000-01-01
[198]
저널
Structure of the mitochondrial ATP synthase by electron cryomicroscopy
[199]
저널
Structural model of F1-ATPase and the implications for rotary catalysis
[200]
저널
The rotary machine in the cell, ATP synthase
http://www.jbc.org/c[...]
[201]
저널
Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor
[202]
저널
Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series
[203]
저널
Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model
http://www.jbc.org/c[...]
1982-10-25
[204]
저널
Bacterial sodium ion-coupled energetics
https://archive.org/[...]
[205]
저널
Delta mu Na+ drives the synthesis of ATP via an delta mu Na(+)-translocating F1F0-ATP synthase in membrane vesicles of the archaeon Methanosarcina mazei Gö1
[206]
저널
An exceptional variability in the motor of archael A1A0 ATPases: from multimeric to monomeric rotors comprising 6-13 ion binding sites
[207]
저널
Oxidative stress: the paradox of aerobic life
[208]
저널
Theories of biological aging: genes, proteins, and free radicals
http://www.link-age.[...]
2018-06-07
[209]
저널
Free radicals and antioxidants in normal physiological functions and human disease
[210]
저널
Mitochondria, oxygen free radicals, disease and ageing
[211]
저널
Oxidants, oxidative stress and the biology of ageing
[212]
저널
New extension of the Mitchell Theory for oxidative phosphorylation in mitochondria of living organisms
2010-03-01
[213]
저널
Superoxide activates mitochondrial uncoupling proteins
2002-01-01
[214]
저널
Fourier-transform infrared study of cyanide binding to the Fea3-CuB binuclear site of bovine heart cytochrome c oxidase: implication of the redox-linked conformational change at the binuclear site
[215]
저널
ATP synthase complex from bovine heart mitochondria: the oligomycin sensitivity conferring protein is essential for dicyclohexyl carbodiimide-sensitive ATPase
[216]
문서
2,4-다이나이트로페놀(DNP)은 1930년대에 비만 치료제로 광범위하게 사용되었지만, 위함한 부작용으로 인해 결국 사용이 중단되었다.
[217]
저널
Uncouplers of oxidative phosphorylation
[218]
저널
Inhibitors of the quinone-binding site allow rapid superoxide production from mitochondrial NADH:ubiquinone oxidoreductase (complex I)
http://www.jbc.org/c[...]
[219]
저널
Studies on succinate dehydrogenase: I. Spectral properties of the purified enzyme and formation of enzyme-competitive inhibitor complexes
1964-11-01
[220]
저널
The uncoupling protein homologues: UCP1, UCP2, UCP3, StUCP and AtUCP
[221]
저널
Plant uncoupling mitochondrial protein and alternative oxidase: energy metabolism and stress
[222]
저널
The alcoholic ferment of yeast-juice
[223]
저널
Origins of the concept oxidative phosphorylation
[224]
저널
Metabolic generation and utilization of phosphate bond energy
[225]
저널
Esterification of inorganic phosphate coupled to electron transport between dihydrodiphosphopyridine nucleotide and oxygen
http://www.jbc.org/c[...]
1949-04-01
[226]
저널
50 years of biological research--from oxidative phosphorylation to energy requiring transport regulation
[227]
저널
About phosphorilation mechanism coupled with respiration
[228]
저널
Mechanism of phosphorylation in the respiratory chain
https://archive.org/[...]
[229]
저널
Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism
[230]
웹인용
Peter Mitchell and the Vital Force
http://www.worldcat.[...]
2014-05-25
[231]
웹인용
David Keilin's Respiratory Chain Concept and Its Chemiosmotic Consequences
http://nobelprize.or[...]
Nobel Foundation
2007-07-21
[232]
저널
Partial resolution of the enzymes catalyzing oxidative phosphorylation. I. Purification and properties of soluble dinitrophenol-stimulated adenosine triphosphatase
http://www.jbc.org/c[...]
1960-11-01
[233]
저널
A new concept for energy coupling in oxidative phosphorylation based on a molecular explanation of the oxygen exchange reactions
[234]
웹인용
The Nobel Prize in Chemistry 1997
http://nobelprize.or[...]
Nobel Foundation
2007-07-21
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com