외재성 막 단백질
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
외재성 막 단백질은 다른 단백질과의 상호작용 또는 지질 이중층과의 직접적인 상호작용을 통해 세포막에 결합하는 단백질이다. 이러한 단백질은 지질 이중층과 결합하여 양친매성 단백질로 작용하며, G 단백질, 단백질 키나아제, 호르몬, 항균 펩타이드, 신경독 등 다양한 기능을 수행한다. 외재성 막 단백질은 지질 이중층의 소수성 내부 코어와 친수성 계면 영역의 구조적 특징을 활용하여 막 결합 메커니즘을 가지며, 소수성 상호작용, 지질 앵커, 특정 단백질-지질 결합, 정전기적 상호작용 등의 방식으로 결합한다. 외재성 막 단백질은 효소, 막 표적화 도메인, 구조 도메인, 작은 소수성 분자의 운반체, 전자 전달체, 폴리펩타이드 호르몬, 독소, 항균 펩타이드 등 다양한 기능을 수행하며, 막의 공간적 위치에 따라 분류된다.
더 읽어볼만한 페이지
- 표재성 막 단백질 - 알파-시누클레인
알파-시누클레인은 신경 조직에서 발견되는 시누클레인 단백질로, 시냅스 소포 조절, 도파민 조절 등 다양한 기능을 수행하지만 응집되어 레비 소체를 형성하면 파킨슨병과 같은 시누클레인병증을 유발하며, 장-뇌 축을 통해 파킨슨병 발병에 영향을 미치고 유전자 돌연변이는 가족성 파킨슨병의 원인이 될 수 있다. - 표재성 막 단백질 - 신경독
신경독은 신경계에 손상을 일으키는 다양한 종류의 물질로, 중금속, 유기용매, 살충제, 생물 유래 독소 등이 있으며, 이들은 다양한 작용 메커니즘을 통해 신경계에 손상을 유발하여 신경퇴행성 질환, 인지 기능 저하, 정신 질환, 발달 장애 등 다양한 건강 문제를 야기하므로 예방과 치료를 위한 노력이 필요하고 신경과학 연구에도 활용된다.
2. 지질 이중층과의 결합
외재성 막 단백질은 다른 단백질과 상호작용하거나 지질 이중층과 직접 상호작용할 수 있다.[76]
2. 1. 양친매성 단백질
일부 말초 막 단백질은 소수성 영역과 친수성 영역을 모두 가지고 있어 지질 이중층과 직접 상호작용할 수 있으며, 이를 양친매성 단백질이라고 한다.[76] G-단백질 및 특정 단백질 키나아제와 같은 일부 단백질은 막횡단 단백질 및 지질 이중층과 동시에 상호작용한다. 일부 폴리펩티드 호르몬, 항균 펩티드 및 신경독은 세포 표면 수용체 표적을 찾아 상호작용하기 전에 막 표면에 축적되며, 이는 그 자체가 외재성 막 단백질일 수 있다.[6]2. 2. 막 표면 축적
일부 폴리펩타이드 호르몬, 항균 펩티드 및 신경독은 세포 표면 수용체 표적을 찾아 상호작용하기 전에 막 표면에 축적되며, 이는 그 자체가 외재성 막 단백질일 수 있다.[76]2. 3. 인지질 이중층의 구조적 특징
세포 표면 막을 형성하는 인지질 이중층은 친수성의 두 영역 사이에 끼워진 소수성 내부 코어 영역으로 구성된다. 하나는 내부 표면에, 다른 하나는 외부 표면에 있다. 모델 인지질 이중층의 내부 및 외부 표면 또는 계면 영역은 약 8 ~ 10Å 두께를 갖는 것으로 나타났지만, 이는 다량의 강글리오사이드 또는 지질다당류를 포함하는 생물학적 막에서 더 넓을 수 있다.[79] 전형적인 생물학적 막의 소수성 내부 코어 영역은 소각 X선 산란(SAXS)에 의해 추정되는 약 27 내지 32 Å의 두께를 가질 수 있다.[80] 소수성 내부 코어와 친수성 계면 영역 사이의 경계 영역은 약 3Å로 매우 좁다. 소수성 코어 영역에서 바깥쪽으로 이동하고 계면 친수성 영역으로 이동하면 물의 유효 농도가 이 경계층을 가로질러 거의 0에서 약 2M의 농도로 빠르게 변한다.[81][82] 인지질 이중층 내의 인산염 그룹은 물로 완전히 수화되거나 포화되어 소수성 코어 영역의 경계 외부에서 약 5 Å에 위치한다.[83]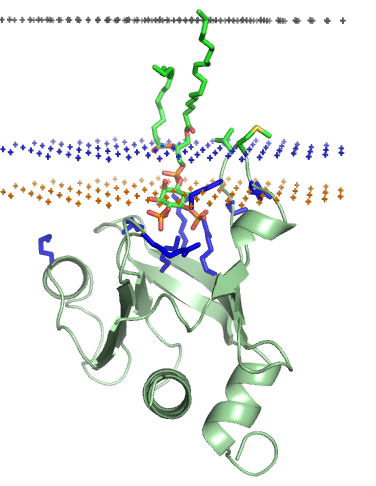
2. 4. 막 결합의 가역성
일부 수용성 단백질은 지질 이중층과 비가역적으로 결합하여 막횡단 알파-나선 또는 베타 배럴 채널을 형성할 수 있다. 이러한 변형은 공극 형성 독소 (예: 콜리신 A, 알파-용혈소) 등에서 발생한다. 또한 BcL-2 유사 단백질, 일부 양친매성 항균 펩타이드 및 특정 안넥신에서도 발생할 수 있다. 이러한 단백질은 구조적 상태 중 하나가 수용성이거나 막과 느슨하게 결합되어 있기 때문에 일반적으로 외재성으로 설명된다.[12] 하지만, 요약에서 언급된 것 처럼 대부분의 말초 막 단백질은 가역적으로 결합한다.3. 막 결합 메커니즘
외재성 막 단백질은 다른 단백질과의 상호작용이나 지질 이중층과의 직접적인 상호작용을 통해 막에 결합할 수 있다. G단백질이나 특정 단백질 키나아제와 같이 일부 단백질은 막횡단 단백질 및 지질 이중층과 동시에 상호작용한다. 또한, 일부 폴리펩티드 호르몬, 항균 펩티드, 신경독 등은 세포 표면 수용체와 상호작용하기 전에 막 표면에 축적되는데, 이 수용체 자체가 외재성 막 단백질일 수 있다.[76]
인지질 이중층은 친수성 영역 사이에 소수성 내부 코어 영역이 끼어 있는 구조를 가진다. 모델 인지질 이중층의 내부 및 외부 표면(계면 영역)은 약 8~10Å (옹스트롬)의 두께를 가지지만, 생물학적 막에서는 더 넓을 수 있다.[79] 생물학적 막의 소수성 내부 코어 영역은 약 27~32Å의 두께를 가진다.[80] 소수성 코어와 친수성 계면 영역 사이의 경계 영역은 약 3Å로 매우 좁다.[81][82] 인지질 이중층 내의 인산염 그룹은 물로 완전히 수화되어 소수성 코어 영역 경계 외부 약 5Å에 위치한다.[83]
일부 수용성 단백질은 지질 이중층과 비가역적으로 결합하여 막횡단 알파-나선 또는 베타-배럴 채널을 형성할 수 있다. 이러한 변형은 기공 형성 독소, BcL-2 유사 단백질, 일부 양친매성 항균 펩타이드, 특정 아넥신 등에서 발생한다. 이들은 구조적 상태 중 하나가 수용성이거나 막과 느슨하게 결합되어 있기 때문에 일반적으로 외재성으로 설명된다.[84]
일반적으로 양친매성 단백질은 생물학적 기능을 수행하기 위해 지질 이중층과 강하게 상호작용해야 한다. 여기에는 지질 및 기타 소수성 물질의 효소 처리, 막 고정, 서로 다른 세포막 사이의 작은 비극성 화합물의 결합 및 전달 등이 포함된다. 이러한 단백질은 소수성 상호작용, 조절 지질과의 특정 비공유 결합 상호작용, 또는 공유 결합 지질 앵커에 대한 부착을 통해 이중층에 고정될 수 있다.[13] 많은 외재성 단백질의 막 결합 친화도는 결합된 막의 특정 지질 조성에 의존한다.[14]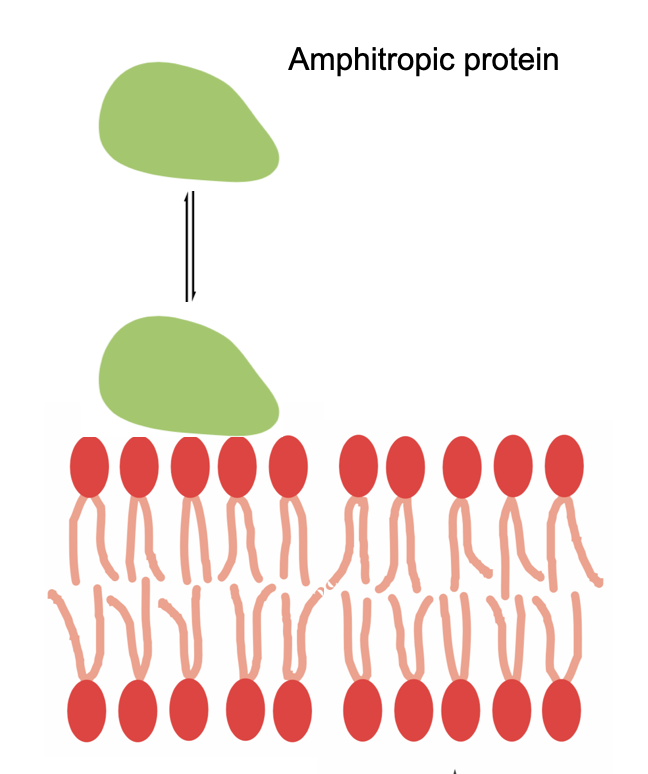
양전하를 띤 단백질은 비특이적 정전기적 상호작용에 의해 음전하를 띤 막에 끌린다. 원형질막의 세포질 측, 세균막 및 미토콘드리아 막의 외부 전단지 등이 음전하를 띤다. 정전기적 상호작용은 사이토크롬 c와 같은 전자 운반체의 막 표적화, 카리브도 톡신과 같은 양이온성 독소, 특정 막 표적화 도메인 등에서 중요한 역할을 한다.[85] 정전기적 상호 작용은 용액의 이온 강도에 크게 의존하며, 생리학적 이온 강도(0.14M NaCl)에서 상대적으로 약하다.[86][89][90]
3. 1. 구조적 변화
단백질과 지질 이중층의 결합은 단백질의 3차 구조 및 4차 구조 변화를 수반할 수 있다. 여기에는 이전에 펼쳐진 단백질 구조 영역의 접힘, 접힘의 재배열, 단백질의 막 관련 부분 재접힘, 올리고머 복합체의 형성 또는 해리, 이온, 리간드, 조절 지질의 특이적 결합이 포함될 수 있다.[85]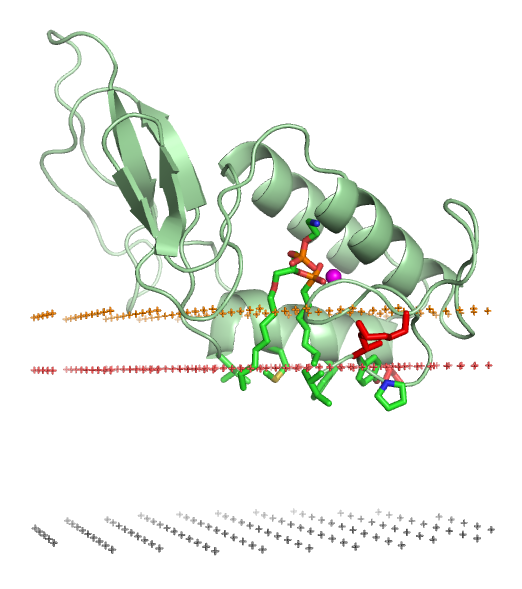
3. 2. 소수성 상호작용
양친매성 단백질은 다양한 소수성 앵커 구조를 통해 지질 이중층과 연결된다. 여기에는 양친매성 α-나선, 노출된 비극성 루프, 번역 후 아실화 또는 지질화된 아미노산 잔기, 포스파티딜이노시톨 인산염과 같이 특이적으로 결합된 조절 지질의 아실 사슬 등이 포함된다.[86] 소수성 상호작용은 천연 소수성 앵커가 존재하는 경우 MARCKS 단백질 또는 히스타토필린의 다염기성 도메인과 같은 높은 양이온성 펩타이드 및 단백질에 대해서도 중요한 것으로 나타났다.[86]3. 3. 지질 앵커
지질 닻 단백질은 팔미토일화, 미리스토일화, 프레닐화를 통해 세포막의 세포질 쪽에 있는 다양한 지방산 아실기 사슬에 공유 결합으로 부착된다. 세포막의 소포체 표면에서 지질 닻 단백질은 지질 글리코실포스파티딜이노시톨(GPI) 및 콜레스테롤에 공유 결합으로 부착된다.[87][88] 아실화된 잔기를 사용하여 막과 단백질의 결합은 가역 과정이다. 아실 사슬이 막에서 분리된 후 단백질의 소수성 결합 포켓에 묻힐 수 있기 때문이다. 이 과정은 G 단백질의 베타 소단위체 내에서 발생한다. 아마도 구조적 유연성에 대한 이러한 추가적인 필요성 때문에, 지질 닻은 일반적으로 단백질 결정학 연구에서 잘 해결되지 않는 단백질 3차 구조의 매우 유연한 세그먼트에 결합된다.3. 4. 특정 단백질-지질 결합
일부 세포질 단백질은 특정 유형의 지질을 인식하여 다른 세포막으로 이동한다.[120] 이러한 단백질-지질 결합은 단백질 내에 존재하는 특정 막 표적화 구조 도메인을 통해 일어난다. 이 도메인은 결합하는 지질의 지질 헤드 그룹에 대한 특정 결합 포켓을 가지고 있다. 이는 전형적인 생화학적 단백질-리간드 상호작용이며, 분자간 수소결합, 반데르발스 상호작용 및 단백질과 지질 리간드 사이의 소수성 상호작용 형성에 의해 안정화된다. 또한, 이러한 복합체는 칼슘 이온(Ca2+)을 통해 단백질의 아스파르테이트 또는 글루타메이트 잔기와 지질 인산염 사이의 이온성 다리 형성에 의해 안정화될 수 있다. 이러한 이온성 다리는 이온(Ca2+와 같은)이 지질 결합 이전에 용액에서 단백질에 이미 결합되어 있을 때 발생할 수 있고 안정적이다. 이러한 예시는 단백질 C2 유형 도메인과 안넥신 사이의 단백질-지질 상호작용에서 볼 수 있다.[17]3. 5. 정전기적 상호작용
양전하를 띤 단백질은 비특이적 정전기적 상호작용에 의해 음전하를 띤 막에 끌린다. 그러나 모든 외재성 펩타이드와 단백질이 양이온은 아니며 막의 특정 면만 음전하를 띤다. 여기에는 원형질막의 세포질 측, 세균막 및 미토콘드리아 막의 외부 전단지가 포함된다. 따라서 정전기적 상호작용은 사이토크롬 c와 같은 전자 운반체의 막 표적화, 카리브도 톡신과 같은 양이온성 독소 및 일부 PH 도메인, C1 도메인, C2 도메인과 같은 특정 막 표적화 도메인에서 중요한 역할을 한다.[85]정전기적 상호 작용은 용액의 이온 강도에 크게 의존한다. 이러한 상호 작용은 생리학적 이온 강도(0.14M NaCl)에서 상대적으로 약하다. 시토크롬 c, 카리브도 톡신 또는 히사토 필린과 같은 작은 양이온성 단백질의 경우 ~3~4kcal/mol이다.[86][89][90]
4. 막의 공간적 위치
단백질의 막 결합 방식은 크게 두 가지로 나뉜다. 일반적인 수용성 단백질은 비극성 잔기나 소수성 앵커가 없어 수용액에 머무르며, 지질 이중층으로 침투하지 않는다. 이들은 정전기적 상호작용을 통해서만 막과 결합한다. 리보뉴클레아제와 폴리리신이 이러한 예시이다. 반면, 양친매성 단백질은 다양한 소수성 앵커를 통해 막의 계면 영역을 뚫고 탄화수소 내부까지 도달한다. 이들은 지질 이중층을 "변형"시켜 지질 유체-겔 전이 온도를 낮추며,[101] 결합은 일반적으로 강한 발열 반응이다.[102] 멤브레인과 양친매성 α-나선의 결합도 이와 유사하게 발생한다.[96][103] 비극성 잔기나 지질 앵커를 가진, 본질적으로 구조화되지 않거나 전개되지 않은 펩티드는 특히 양이온성이면서 음으로 하전된 막과 상호작용할 때 막의 계면 영역을 뚫고 탄화수소 코어에 도달할 수 있다.[104][105][106]
4. 1. 연구 방법
막에 있는 많은 양친매성 단백질 및 펩타이드의 방향 및 침투 깊이는 다양한 실험적, 계산적 방법을 통해 연구된다. 사용되는 방법에는 부위 지향 스핀 라벨링,[91] 화학적 라벨링, 단백질 돌연변이의 막 결합 친화도 측정,[92] 형광 분광법,[93] 용액 또는 고체 상태의 NMR 분광법,[94] ATR FTIR 분광법,[95] X선 또는 중성자 회절,[96] 및 계산 방법[97][98][99][100] 등이 있다.단백질의 막 결합 방식은 크게 두 가지로 나뉜다. 일반적인 수용성 단백질은 비극성 잔기나 소수성 앵커가 없어 수용액에 머무르며, 지질 이중층으로 침투하지 않는다. 이들은 정전기적 상호작용을 통해서만 막과 결합한다. 예를 들어 리보뉴클레아제와 폴리리신이 이러한 방식으로 막과 상호작용한다. 반면, 양친매성 단백질은 다양한 소수성 앵커를 통해 막의 계면 영역을 뚫고 탄화수소 내부까지 도달한다. 이들은 지질 이중층을 "변형"시켜 지질 유체-겔 전이 온도를 낮추며,[101] 결합은 일반적으로 강한 발열 반응이다.[102] 멤브레인과 양친매성 α-나선의 결합도 유사하게 발생한다.[96][103] 비극성 잔기나 지질 앵커를 가진, 본질적으로 구조화되지 않거나 전개되지 않은 펩티드는 특히 양이온성이면서 음으로 하전된 막과 상호작용할 때 막의 계면 영역을 뚫고 탄화수소 코어에 도달할 수 있다.[104][105][106]
5. 분류
말초 막 단백질은 그 기능에 따라 다양한 종류로 분류할 수 있다. 주요 분류는 다음과 같다.
- 효소: 막 구성 요소의 대사에 관여한다.
- 포스포리파제, 콜레스테롤 산화효소와 같은 지질 대사 효소
- 세포벽 올리고당 대사 효소 (글리코실 트랜스퍼라제, 트랜스글리코시다제)
- 단백질 대사 효소 (신호 펩티다제, 팔미토일 단백질 티오에스테라제)
- 리파아제: 물에서 미셀이나 비극성 방울을 형성하는 지질을 소화[107][108][109][110][111][112][113][114][115][116][117][118][119]
- 막 표적화 도메인 ("지질 클램프"): 특정 지질 리간드와 결합하여 단백질을 특정 생물학적 막으로 유도한다.
- 구조 도메인: 다른 단백질이 막에 부착되도록 돕는다.
- 작은 소수성 분자의 운반체: 서로 다른 유형의 세포막 사이 또는 막과 세포질 단백질 복합체 사이에서 비극성 화합물을 운반한다.
- 전자 전달체: 전자전달계에 관여한다.
- 폴리펩타이드 호르몬, 독소 및 항균 펩타이드: 막관통 단백질 복합체와 특이적으로 상호작용하며, 지질 이중층 표면에 축적될 수 있다.
5. 1. 효소
외재성 효소는 지질(포스포리파제 및 콜레스테롤 산화효소), 세포벽 올리고당(글리코실 트랜스퍼라제 및 트랜스글리코시다제) 또는 단백질(신호 펩티다제 및 팔미토일 단백질 티오에스테라제)과 같은 다양한 막 구성요소의 대사에 참여한다. 리파아제는 또한 물에서 미셀 또는 비극성 방울을 형성하는 지질을 소화할 수 있다.[107][108][109][110][111][112][113][114][115][116][117][118][119]다음은 외재성 막 단백질 효소의 종류와 기능, 생리학적 역할 및 구조를 나타낸 표이다.
5. 2. 막 표적화 도메인 ("지질 클램프")
막 표적화 도메인은 특정 지질 리간드의 머리 부분과 특이적으로 결합하여, 단백질을 특정 생물학적 막으로 유도하는 역할을 한다. 이러한 지질 리간드는 생물학적 막의 종류에 따라 서로 다른 농도로 존재한다. 예를 들어, PtdIns3P는 주로 초기 엔도솜 막에서 발견되고, PtdIns(3,5)P2는 후기 엔도솜, PtdIns4P는 골지체에서 발견된다.[120] 따라서 각 도메인은 특정 막을 표적화한다.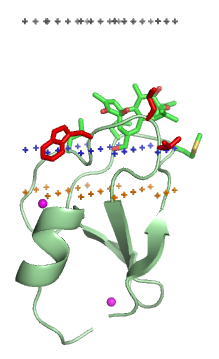
다음은 몇 가지 막 표적화 도메인의 예시이다.
- C1 도메인은 디아실글리세롤 및 포르볼 에스터와 결합한다.
- C2 도메인은 포스파티딜세린, 포스파티딜콜린, PtdIns(3,4)P2 또는 PtdIns(4,5)P2와 결합한다.
- 플렉스트린 상동성 도메인, PX 도메인, 터비 도메인은 다양한 포스포이노시티드와 결합한다.
- FYVE 도메인은 PtdIns3P에 대해 더 특이적으로 결합한다.
- ENTH 도메인은 PtdIns(3,4)P2 또는 PtdIns(4,5)P2와 결합한다.
- ANTH 도메인은 PtdIns(4,5)P2와 결합한다.
- ERM (에즈린/라딕신/모에신) 패밀리 단백질은 PtdIns(4,5)P2와 결합한다.
- 포스포티로신 결합 도메인과 특정 PDZ 도메인을 포함한 다른 포스포이노시티드 결합 단백질도 PtdIns(4,5)P2와 결합한다.
- 혈액 응고 인자의 디스코이딘 도메인
- ENTH, VHS, ANTH 도메인[17]
5. 3. 구조 도메인
구조 도메인은 다른 단백질이 막에 부착되도록 돕는 역할을 한다. 막과의 결합은 칼슘 이온(Ca2+)에 의해 매개될 수 있는데, 이는 아넥신이나 GLA 도메인에서처럼 산성 단백질 잔기와 지질의 인산기 사이에 다리를 형성한다.[121]
5. 4. 작은 소수성 분자의 운반체
이러한 외재성 단백질은 서로 다른 유형의 세포막 사이 또는 막과 세포질 단백질 복합체 사이에서 비극성 화합물의 운반체 역할을 한다. 수송되는 물질은 포스파티딜이노시톨, 토코페롤, 강글리오사이드, 당지질, 스테롤 유도체, 레티놀, 지방산, 물, 고분자, 적혈구, 인지질, 뉴클레오타이드이다.- 글리코지질 전달 단백질
- 리포칼린 (레티놀 결합 단백질 및 지방산 결합 단백질 포함)
- YceI 단백질 도메인과 같은 폴리이소프레노이드 결합 단백질
- 강글리오사이드 GM2 활성화 단백질
- CRAL-TRIO 도메인 (α-토코페롤 및 포스파티딜이노시톨 sec14p 전달 단백질)
- 스테롤 운반체 단백질
- 포스파티딜이노시톨 전달 단백질 및 STAR 도메인
- 옥시스테롤 결합 단백질
5. 5. 전자 전달체
이 단백질은 전자전달계에 관여한다. 여기에는 시토크롬 c, 쿠프레독신, 높은 잠재성 철 단백질, 아드레노독신 환원효소, 일부 플라보단백질 등이 포함된다.5. 6. 폴리펩타이드 호르몬, 독소 및 항균 펩타이드
많은 호르몬, 독소, 억제제 또는 항균 펩타이드는 막관통 단백질 복합체와 특이적으로 상호작용한다. 이들은 또한 단백질 표적에 결합하기 전에 지질 이중층 표면에 축적될 수 있다. 이러한 폴리펩티드 리간드는 종종 양전하를 띠고 음이온성 막과 정전기적으로 상호작용한다.일부 수용성 단백질과 펩티드는 막횡단 채널을 형성할 수 있다. 이들은 일반적으로 올리고머화, 상당한 구조적 변화를 겪으며, 막과 비가역적으로 결합한다. 그러한 막횡단 채널 중 하나인 α-헤모리신의 3D 구조가 결정되었다. 다른 경우에, 실험 구조는 주변에서 지질 이중층과 상호작용하는 수용성 형태를 나타내지만, 채널 형성 펩티드의 일부는 다소 소수성이므로 유기 용매 또는 미셀의 존재하에서 NMR 분광법에 의해 연구되었다.
참조
[1]
웹사이트
extrinsic protein ! biology ! Britannica
https://www.britanni[...]
2022-07-04
[2]
서적
Protein-Lipid Interactions: From Membrane Domains to Cellular Networks
https://books.google[...]
John Wiley & Sons
[3]
논문
Properties of the Group IV phospholipase A2 family
2006-11
[4]
논문
Evidence that membrane insertion of the cytosolic domain of Bcl-xL is governed by an electrostatic mechanism
2006-06
[5]
논문
Exocytic pathway-independent plasma membrane targeting of heterotrimeric G proteins
2004-06
[6]
논문
Amphitropic proteins: regulation by reversible membrane interactions (review)
[7]
서적
Current Topics in Membranes
Academic Press
[8]
논문
Modulation of the bilayer thickness of exocytic pathway membranes by membrane proteins rather than cholesterol
2004-03
[9]
논문
Polarity and permeation profiles in lipid membranes
2001-07
[10]
논문
Membrane water-penetration profiles from spin labels
2002-12
[11]
논문
Structure of lipid bilayers
2000-11
[12]
논문
Non-permanent proteins in membranes: when proteins come as visitors (Review)
[13]
논문
Hydrophobic coupling of lipid bilayer energetics to channel function
2003-05
[14]
논문
Roles of bilayer material properties in function and distribution of membrane proteins
[15]
서적
Current Topics in Membranes
Academic Press
[16]
서적
Biochemistry of Lipids, Lipoproteins and Membranes
Elsevier Science
[17]
논문
Membrane-protein interactions in cell signaling and membrane trafficking
2005-06
[18]
논문
Binding of hisactophilin I and II to lipid membranes is controlled by a pH-dependent myristoyl-histidine switch
1996-08
[19]
논문
Electrostatic binding of proteins to membranes. Theoretical predictions and experimental results with charybdotoxin and phospholipid vesicles
1997-10
[20]
서적
Protein-lipid interactions
Elsevier
[21]
논문
Use of EPR power saturation to analyze the membrane-docking geometries of peripheral proteins: applications to C2 domains
[22]
논문
The membrane binding domains of prostaglandin endoperoxide H synthases 1 and 2. Peptide mapping and mutational analysis
1999-11
[23]
논문
Changes in Ca2+ affinity upon activation of Agkistrodon piscivorus piscivorus phospholipase A2
2001-03
[24]
논문
Structural mechanism of endosome docking by the FYVE domain
2001-03
[25]
논문
Positioning membrane proteins by novel protein engineering and biophysical approaches
https://zenodo.org/r[...]
2005-09
[26]
논문
Electrostatic control of the membrane targeting of C2 domains
2002-01
[27]
논문
Peptides and proteins in membranes: what can we learn via computer simulations?
2004-09
[28]
논문
Positioning of proteins in membranes: a computational approach
2006-06
[29]
웹사이트
Comparison with experimental data
http://opm.phar.umic[...]
University of Michigan
2007-02-08
[30]
논문
Effects of proteins on thermotropic phase transitions of phospholipid membranes
1975-09
[31]
논문
Thermodynamics of lipid-peptide interactions
2004-11
[32]
논문
An amphipathic alpha-helix at a membrane interface: a structural study using a novel X-ray diffraction method
1999-07
[33]
논문
Interaction of tachykinins with phospholipid membranes: A neutron diffraction study
[34]
논문
Membrane position of a basic aromatic peptide that sequesters phosphatidylinositol 4,5 bisphosphate determined by site-directed spin labeling and high-resolution NMR
2004-11
[35]
논문
Interaction of the neuropeptide met-enkephalin with zwitterionic and negatively charged bicelles as viewed by 31P and 2H solid-state NMR
2003-07
[36]
논문
Binding of peptides with basic and aromatic residues to bilayer membranes: phenylalanine in the myristoylated alanine-rich C kinase substrate effector domain penetrates into the hydrophobic core of the bilayer
2003-06
[37]
웹사이트
Pfam entry Abhydrolase 1
http://www.sanger.ac[...]
2007-01-25
[38]
논문
The modular structure of α/β-hydrolases
2020-03
[39]
웹사이트
Pfam entry: Phospholipase A2
http://www.sanger.ac[...]
2007-01-25
[40]
간행물
Biochemistry, Phospholipase A2
http://www.ncbi.nlm.[...]
StatPearls Publishing
2023
[41]
웹사이트
Pfam entry: Phosphatidylinositol-specific phospholipase C, X domain
http://www.sanger.ac[...]
2007-01-25
[42]
웹사이트
Phospholipase C
https://en.wikipedia[...]
2023-08-16
[43]
웹사이트
Pfam entry: Cholesterol oxidase
http://www.sanger.ac[...]
2007-01-25
[44]
논문
Crystal Structure Determination of Cholesterol Oxidase from Streptomyces and Structural Characterization of Key Active Site Mutants
https://pubs.acs.org[...]
1999-04-01
[45]
웹사이트
Pfam entry: Retinal pigment epithelial membrane protein
http://www.sanger.ac[...]
2007-01-25
[46]
웹사이트
Carotenoid oxygenase
https://en.wikipedia[...]
2023-11-29
[47]
웹사이트
Pfam entry: Lipoxygenase
http://www.sanger.ac[...]
2007-01-25
[48]
논문
Structure and mechanism of lipoxygenases
1997-11-01
[49]
문서
PDBsum entry: Alpha Toxin
http://www.ebi.ac.uk[...]
[50]
웹사이트
Alpha Toxin - an overview {{!}} ScienceDirect Topics
https://www.scienced[...]
2023-11-29
[51]
웹사이트
Pfam entry: Type I phosphodiesterase
http://www.sanger.ac[...]
2007-01-25
[52]
논문
Structure of Human Acid Sphingomyelinase Reveals the Role of the Saposin Domain in Activating Substrate Hydrolysis
https://www.scienced[...]
2016-07-31
[53]
웹사이트
Pfam entry: Glycosyl transferases group 1
http://www.sanger.ac[...]
2007-01-25
[54]
논문
Glycosyltransferase structure and mechanism
https://www.scienced[...]
2000-10-01
[55]
웹사이트
Pfam entry: Ferrochelatase
http://www.sanger.ac[...]
2007-01-25
[56]
논문
Crystal structure of ferrochelatase: the terminal enzyme in heme biosynthesis
1997-11
[57]
웹사이트
Pfam entry:Myotubularin-related
http://www.sanger.ac[...]
2007-01-25
[58]
서적
Emery and Rimoin's Principles and Practice of Medical Genetics
https://www.scienced[...]
2023-11-29
[59]
웹사이트
Pfam entry:Dihydroorotate dehydrogenase
http://www.sanger.ac[...]
2007-01-25
[60]
논문
Structures of human dihydroorotate dehydrogenase in complex with antiproliferative agents
2000-01
[61]
웹사이트
Pfam entry: FMN-dependent dehydrogenase
http://www.sanger.ac[...]
2007-01-25
[62]
웹사이트
Glycolate oxidase - Proteopedia, life in 3D
https://proteopedia.[...]
2023-11-28
[63]
웹사이트
Pfam entry: Annexin
http://www.sanger.ac[...]
2007-01-25
[64]
웹사이트
Pfam entry Synapsin N
http://www.sanger.ac[...]
2007-01-25
[65]
웹사이트
Pfam entry Synuclein
http://www.sanger.ac[...]
2007-01-25
[66]
웹사이트
Pfam entry: Gla
http://www.sanger.ac[...]
2007-01-25
[67]
웹사이트
Pfam entry Spectrin
http://www.sanger.ac[...]
2007-01-25
[68]
서적
Animal toxins: facts and protocols
https://books.google[...]
Birkhũser Verlag
[69]
웹사이트
Sea Anemone Toxins
http://www.asanltr.c[...]
1999
[70]
논문
Bacterial toxins: friends or foes?
[71]
논문
Peptaibols: models for ion channels
2001-08
[72]
논문
Roles of antimicrobial peptides such as defensins in innate and adaptive immunity
2003-11
[73]
웹사이트
Pfam entry Tachykinin
http://www.sanger.ac[...]
2007-01-25
[74]
서적
Protein-Lipid Interactions: From Membrane Domains to Cellular Networks
https://books.google[...]
John Wiley & Sons
[75]
논문
Properties of group IV phospholipase A2 family (review)
[76]
논문
Amphitropic proteins: regulation by reversible membrane interactions (review)
[77]
논문
Evidence that membrane insertion of the cytosolic domain of Bcl-xL is governed by an electrostatic mechanism
[78]
논문
Exocytic pathway-independent plasma membrane targeting of heterotrimeric G proteins
[79]
서적
Current Topics in Membranes
Academic Press
[80]
논문
Modulation of the bilayer thickness of exocytic pathway membranes by membrane proteins rather than cholesterol
[81]
논문
Polarity and permeation profiles in lipid membranes
[82]
논문
Membrane water-penetration profiles from spin labels
[83]
논문
Structure of lipid bilayers
[84]
논문
Non-permanent proteins in membranes: when proteins come as visitors (Review)
[85]
논문
Roles of bilayer material properties in function and distribution of membrane proteins
[86]
논문
Binding of hisactophilin I and II to lipid membranes is controlled by a pH-dependent myristoyl-histidine switch
[87]
서적
Current Topics in Membranes
Academic Press
[88]
서적
Biochemistry of Lipids, Lipoproteins and Membranes
Elsevier Science
[89]
논문
Electrostatic binding of proteins to membranes. Theoretical predictions and experimental results with charybdotoxin and phospholipid vesicles
1997-10
[90]
서적
Protein-lipid interactions
https://archive.org/[...]
Elsevier
[91]
논문
Use of EPR power saturation to analyze the membrane-docking geometries of peripheral proteins: applications to C2 domains
[92]
논문
The membrane binding domains of prostaglandin endoperoxide H synthases 1 and 2. Peptide mapping and mutational analysis
[93]
논문
Changes in Ca2+ affinity upon activation of Agkistrodon piscivorus piscivorus phospholipase A2
[94]
논문
Structural mechanism of endosome docking by the FYVE domain
[95]
논문
Positioning membrane proteins by novel protein engineering and biophysical approaches
https://zenodo.org/r[...]
[96]
논문
An amphipathic alpha-helix at a membrane interface: a structural study using a novel X-ray diffraction method
1999-07-02
[97]
논문
Electrostatic control of the membrane targeting of C2 domains
[98]
논문
Peptides and proteins in membranes: what can we learn via computer simulations?
[99]
논문
Positioning of proteins in membranes: a computational approach
[100]
웹인용
Comparison with experimental data
http://opm.phar.umic[...]
University of Michigan
2007-02-08
[101]
논문
Effects of proteins on thermotropic phase transitions of phospholipid membranes
[102]
논문
Thermodynamics of lipid-peptide interactions
[103]
논문
Interaction of tachykinins with phospholipid membranes: A neutron diffraction study
[104]
논문
Membrane position of a basic aromatic peptide that sequesters phosphatidylinositol 4,5 bisphosphate determined by site-directed spin labeling and high-resolution NMR
2004-11
[105]
논문
Interaction of the neuropeptide met-enkephalin with zwitterionic and negatively charged bicelles as viewed by 31P and 2H solid-state NMR
[106]
저널
Binding of peptides with basic and aromatic residues to bilayer membranes: phenylalanine in the myristoylated alanine-rich C kinase substrate effector domain penetrates into the hydrophobic core of the bilayer
[107]
웹인용
Pfam entry Abhydrolase 1
http://www.sanger.ac[...]
2007-01-25
[108]
웹인용
Pfam entry: Phospholipase A2
http://www.sanger.ac[...]
2007-01-25
[109]
웹인용
Pfam entry: Phosphatidylinositol-specific phospholipase C, X domain
http://www.sanger.ac[...]
2007-01-25
[110]
웹인용
Pfam entry: Cholesterol oxidase
http://www.sanger.ac[...]
2007-01-25
[111]
웹인용
Pfam entry: Retinal pigment epithelial membrane protein
http://www.sanger.ac[...]
2007-01-25
[112]
웹인용
Pfam entry: Lipoxygenase
http://www.sanger.ac[...]
2007-01-25
[113]
웹사이트
PDBsum entry: Alpha Toxin
http://www.ebi.ac.uk[...]
[114]
웹인용
Pfam entry: Type I phosphodiesterase
http://www.sanger.ac[...]
2007-01-25
[115]
웹인용
Pfam entry: Glycosyl transferases group 1
http://www.sanger.ac[...]
2007-01-25
[116]
웹인용
Pfam entry: Ferrochelatase
http://www.sanger.ac[...]
2007-01-25
[117]
웹인용
Pfam entry:Myotubularin-related
http://www.sanger.ac[...]
2007-01-25
[118]
웹인용
Pfam entry:Dihydroorotate dehydrogenase
http://www.sanger.ac[...]
2007-01-25
[119]
웹인용
Pfam entry: FMN-dependent dehydrogenase
http://www.sanger.ac[...]
2007-01-25
[120]
저널
Membrane-protein interactions in cell signaling and membrane trafficking
http://arjournals.an[...]
2007-01-23
[121]
웹인용
Pfam entry: Annexin
http://www.sanger.ac[...]
2007-01-25
[122]
웹인용
Pfam entry Synapsin N
http://www.sanger.ac[...]
2007-01-25
[123]
웹인용
Pfam entry Synuclein
http://www.sanger.ac[...]
2007-01-25
[124]
웹인용
Pfam entry: Gla
http://www.sanger.ac[...]
2007-01-25
[125]
웹인용
Pfam entry Spectrin
http://www.sanger.ac[...]
2007-01-25
[126]
서적
Animal toxins: facts and protocols
https://books.google[...]
Birkhũser Verlag
[127]
웹사이트
Sea Anemone Toxins.
http://www.asanltr.c[...]
1999
[128]
저널
Bacterial toxins: friends or foes?
[129]
저널
Peptaibols: models for ion channels
http://people.cryst.[...]
2022-04-21
[130]
저널
Roles of antimicrobial peptides such as defensins in innate and adaptive immunity
[131]
웹인용
Pfam entry Tachykinin
http://www.sanger.ac[...]
2007-01-25
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
