아세틸-CoA
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아세틸-CoA는 세포 대사에서 중요한 역할을 하는 분자이다. 탄수화물, 지방산, 아미노산의 분해 과정에서 생성되며, 미토콘드리아 내에서 피루브산 탈수소효소 복합체와 지방산의 베타 산화 과정을 통해 생성된다. 세포질에서는 포도당의 농도, CoA, 에탄올, 아미노산 분해를 통해 생성될 수 있다. 아세틸-CoA는 시트르산 회로, 지방산 대사, 콜레스테롤 합성, 식물 대사, 신경 전달 물질 합성, 후성 유전 조절 등 다양한 생화학 반응에 관여한다. 또한, 미토콘드리아에서 세포질로의 아세틸-CoA 수송을 위한 쿠엔산-피루브산 셔틀에도 관여한다.
더 읽어볼만한 페이지
- 콜린성 제제 - 포스파티딜에탄올아민
포스파티딜에탄올아민은 세포막의 주요 인지질로서 동물세포에서 심장 기능, 지단백질 분비, 혈액 응고, 아난다마이드 합성에 관여하고, 세균에서는 막 인지질의 음전하 중화, 막 단백질 구조 형성, 다약물 수송체 기능에 필수적이며, 식품 내 마이야르 반응을 통해 산화 스트레스 유발 및 혈관 질환, 당뇨병과의 연관성이 연구된다. - 콜린성 제제 - 포스파티딜콜린
포스파티딜콜린은 콜린, 글리세로인산, 지방산으로 구성된 인지질의 일종으로, 세포막 구성, 효소 작용 등 다양한 생리적 기능을 하며, 궤양성 대장염 치료에 효과가 있을 수 있지만, 치매 치료 효과는 불분명하고 동맥경화증을 증가시킬 수 있다. - 조효소 A의 싸이오에스터 - 스테아로일-CoA
스테아로일-CoA는 스테아로일-CoA 불포화효소에 의해 생성되는 지방산의 일종이며, 포화 지방산을 불포화 지방산으로 전환하는 효소인 SCD의 활성 변화가 여러 질병과 연관되어 연구 가치가 높다. - 조효소 A의 싸이오에스터 - 석시닐-CoA
석시닐-CoA는 시트르산 회로의 중간생성물로서 α-케토글루타르산 탈수소효소에 의해 생성되고, 비타민 B12의 도움으로 프로피오닐-CoA로부터 합성되며, 포르피린 합성의 전구체로서 헤모글로빈 생합성에 중요한 역할을 하고, 대사 이상은 유전 질환과 관련될 수 있으며 건강기능식품으로서의 잠재력도 주목받는다. - 세포 호흡 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 세포 호흡 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다.
2. 생합성
아세틸-CoA의 생합성은 탄소 공급원에 따라 달라진다.[29][30]
- 포도당 농도가 높을 때: 해당과정을 통해 생성된 피루브산은 피루브산 탈수소효소 복합체에 의해 산화적 탈카복실화 반응을 거쳐 아세틸-CoA로 전환된다. 이 과정에서 카복실기(이산화 탄소)가 떨어져 나가고, 33.5kJ/mol의 에너지가 방출된다.[36] NADH의 산화로 방출된 고에너지 전자는 미토콘드리아 내막의 전자전달계를 통해 산소(O2)로 전달되어 물(H2O)을 생성한다.[37] 피루브산 포름산 분해효소는 피루브산을 아세틸-CoA와 포름산으로 전환시키기도 한다.
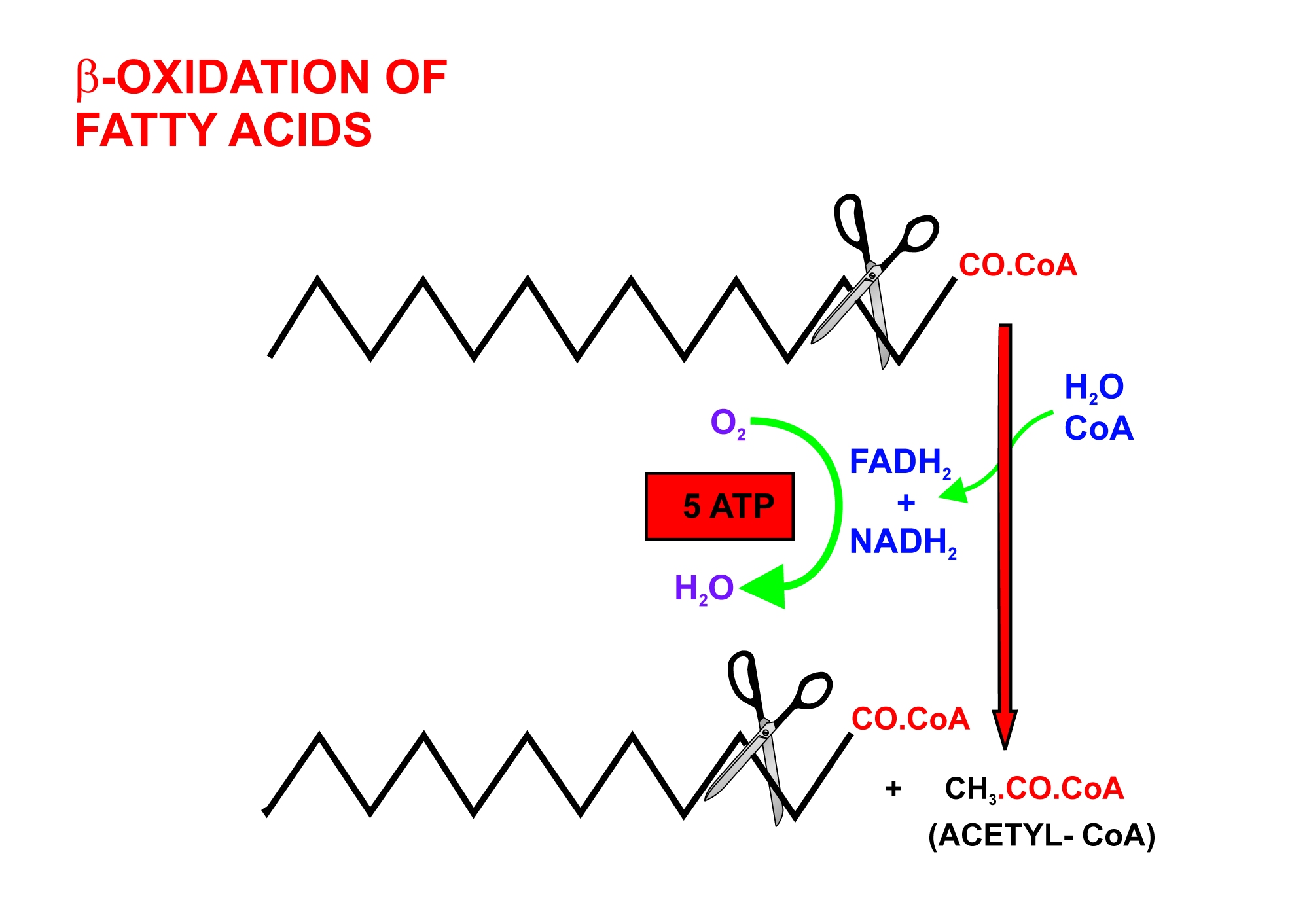
- 포도당 농도가 낮을 때: 지방산의 β 산화를 통해 아세틸-CoA가 생성된다. 지방산은 먼저 아실-CoA로 전환된 후, 아실-CoA 탈수소효소, 에노일-CoA 수화효소, β-하이드록시아실-CoA 탈수소효소, 아실-CoA 아세틸기 전이효소(싸이올레이스)의 4가지 효소에 의해 촉매되는 탈수소화, 수화, 산화, 싸이올 분해의 4단계 반응을 거쳐 분해된다. 이 과정에서 아세틸-CoA와 탄소 원자가 2개 적은 아실-CoA가 생성된다.[38]
2. 1. 미토콘드리아 내
CoA의 아세틸화는 탄소 공급원에 의해 결정된다.[29][30]- 포도당 농도가 높을 때, 해당과정을 통해 아세틸-CoA가 생성된다.[36] 피루브산은 산화적 탈카복실화를 거치면서 카복실기(이산화 탄소)를 소실하고 아세틸-CoA를 형성하는데, 이 과정에서 33.5kJ/mol의 에너지를 방출한다. 피루브산이 아세틸-CoA로 산화적 탈카복실화되는 반응은 피루브산 탈수소효소 복합체에 의해 촉매된다. NADH의 산화로 방출된 고에너지 전자는 미토콘드리아 내막에 있는 일련의 전자 운반체의 산화, 환원에 의해 차례로 전달되며 최종 전자수용체인 산소(O2)가 전자를 받아 물(H2O)로 환원된다.[37] 피루브산과 아세틸-CoA 사이의 다른 전환도 가능하다. 예를 들어, 피루브산 포름산 분해효소는 피루브산을 아세틸-CoA와 포름산으로 불균등화시킨다.
- 포도당 농도가 낮을 때, 아세틸-CoA의 생성은 지방산의 β 산화와 관련이 있다. 먼저 지방산은 아실-CoA로 전환된다. 아실-CoA는 4가지 효소, 즉 아실-CoA 탈수소효소, 에노일-CoA 수화효소, β-하이드록시아실-CoA 탈수소효소, 아실-CoA 아세틸기 전이효소(싸이올레이스)에 의해 촉매되는 4단계의 탈수소화, 수화, 산화, 싸이올 분해 과정에서 분해된다. 이 과정에서 아세틸-CoA와 탄소 원자가 2개가 적은 새로운 아실-CoA가 생성된다.[38]
2. 2. 미토콘드리아 밖
CoA의 아세틸화는 탄소 공급원에 의해 결정된다.[29][30]- 포도당 농도가 높을 때 해당과정이 빠르게 일어나서 시트르산 회로에서 생성되는 시트르산의 양이 증가한다. 세포질에서 시트르산은 ATP 시트르산 분해효소(ATP citrate lyase)에 의해 아세틸-CoA와 옥살아세트산으로 분해되고, 이 과정에서 ATP는 ADP와 Pi로 가수분해된다.[31][32]
- 포도당 농도가 낮을 때:
- CoA는 아세틸-CoA 합성효소에 의해 아세트산을 사용하여 아세틸화되고, ATP 가수분해와 짝지워진다.[33]
- 에탄올은 알코올 탈수소효소에 의해 CoA의 아세틸화를 위한 탄소 공급원 역할을 한다.[34]
- 발린, 류신, 아이소류신과 같은 가지사슬 케톤 생성 아미노산의 분해가 일어난다. 이들 아미노산은 가지사슬 아미노기 전이효소(branched-chain aminotransferase)에 의해 α-케토산으로 전환되고, 결국 가지사슬 α-케토산 탈수소효소 복합체(branched-chain α-ketoacid dehydrogenase complex)에 의해 산화적 탈카복실화를 통해 아이소발레릴-CoA로 전환된다. 아이소발레릴-CoA는 아세틸-CoA 및 아세토아세트산으로 분해되기 전에 다른 CoA 유도체를 형성하기 위해 탈수소화, 카복실화 및 수화를 거친다.[35]
3. 기능
아세틸-CoA는 생물체 내의 여러 대사 경로에 관여하는 대사 중간체이다. 포도당, 지방산, 아미노산의 분해 과정에서 생성되며, 콜레스테롤, 지방산, 케톤체 등 여러 생체 분자 합성에 사용된다. 아세틸-CoA는 세포의 미토콘드리아에서 일어나는 시트르산 회로의 핵심 분자로, ATP 형태의 에너지를 생성한다.[5][6]
아세틸-CoA는 다양한 아세틸 화합물의 생합성을 위한 전구체로, 아세틸기를 전달하는 중간체 역할을 한다. 또한 단백질의 번역 후 아세틸화 반응에서 아세틸기를 제공하여 다양한 세포 메커니즘을 조절한다.
아세틸-CoA는 시트르산 회로에서 중요하며, 지방산 대사와 콜레스테롤 합성에도 관여한다. 식물에서는 지방산 합성과 폴리케타이드 합성에 사용되며, 스테로이드 합성, 아세틸콜린 합성, 멜라토닌 합성에도 쓰인다. 아세틸-CoA는 히스톤 단백질 아세틸화에 관여하며, 피루브산 탈수소효소 키네이스와 피루브산 카복실화효소의 다른 자리 입체성 조절인자로 작용한다.
3. 1. 시트르산 회로
아세틸-CoA는 옥살아세트산과 반응하여 시트르산을 형성하고, 시트르산 회로에서 산화되어 이산화 탄소(CO2)를 방출한다.[35]지방산 대사에서 아세틸-CoA는 탄수화물의 분해(해당과정 및 피루브산의 산화)와 지방의 분해(β 산화)를 통해 생성된다. 생성된 아세틸-CoA는 미토콘드리아 기질에서 옥살아세트산과 결합하여 시트르산을 형성하고 시트르산 회로를 시작한다.[40][41]
아세틸-CoA 2분자가 축합하여 아세토아세틸-CoA를 형성하고, 이는 후속 반응을 통해 아세토아세트산과 β-하이드록시뷰티르산을 생성한다.[40] 아세토아세트산, β-하이드록시뷰티르산 및 이들의 자발적인 분해 산물인 아세톤[42]은 케톤체로 알려져 있으며, 간에서 혈액으로 방출된다. 미토콘드리아가 있는 모든 세포는 혈액에서 케톤체를 흡수하여 아세틸-CoA로 전환하고, 이를 시트르산 회로에서 연료로 사용할 수 있다.
혈액 내 인슐린 농도가 높고 글루카곤 농도가 낮을 때(식사 후), 해당과정에서 생성된 아세틸-CoA는 미토콘드리아 기질에서 옥살아세트산과 축합하여 시트르산을 생성한다. 이 시트르산은 시트르산 회로를 통해 이산화 탄소(O2)와 물(H2O)로 전환되는 대신, 미토콘드리아 기질에서 세포질로 운반된다.[40]
3. 2. 지방산 대사
아세틸-CoA는 탄수화물 분해 과정인 해당과정과 피루브산의 산화, 그리고 지방 분해 과정인 β 산화를 통해 생성된다.[40][41] 아세틸-CoA는 미토콘드리아 기질에서 옥살아세트산과 결합하여 시트르산을 형성함으로써 시트르산 회로를 시작한다.[40][41]2분자의 아세틸-CoA는 축합하여 아세토아세틸-CoA를 형성하고, 이는 이후의 반응을 통해 아세토아세트산과 β-하이드록시뷰티르산을 생성한다.[40] 아세토아세트산, β-하이드록시뷰티르산 및 이들의 자발적인 분해 산물인 아세톤은 케톤체로 알려져 있다.[42] 간에서 혈액으로 방출된 케톤체는 미토콘드리아가 있는 모든 세포에서 흡수되어 다시 아세틸-CoA로 전환될 수 있으며, 시트르산 회로에서 연료로 사용될 수 있다. 포유동물은 아세틸-CoA를 포도당신생합성의 전구물질로 사용할 수 없다. 케톤체는 혈액뇌장벽을 통과할 수 있어 뇌와 같은 중추신경계 세포에서 연료로 사용될 수 있다.[40] 굶주림, 저탄수화물 식이, 장기간의 심한 운동, 치료받지 않은 제1형 당뇨병에서 혈액 중 케톤체의 농도가 높아지는 상태를 케톤증이라 하고, 통제되지 않은 제1형 당뇨병의 극단적인 형태는 케톤산증이라 한다.
반면, 혈액 내 인슐린 농도가 높고 글루카곤 농도가 낮을 때(즉, 식사 후), 해당과정을 통해 생성된 아세틸-CoA는 미토콘드리아 기질에서 옥살아세트산과 축합하여 시트르산을 생성한다. 그러나 시트르산 회로를 통해 이산화 탄소(O2)와 물(H2O)로 전환되는 대신, 시트르산은 미토콘드리아 기질에서 세포질로 운반된다.[40] 세포질에서 시트르산은 ATP 시트르산 분해효소에 의해 아세틸-CoA와 옥살아세트산으로 분해된다. 옥살아세트산은 말산으로 전환되어 미토콘드리아 기질로 다시 돌아오고, 더 많은 아세틸-CoA의 아세틸기를 미토콘드리아 밖으로 운반하기 위해 말산은 옥살아세트산으로 전환된다.[43] 세포질의 아세틸-CoA는 아세틸-CoA 카복실화효소에 의한 말로닐-CoA로의 카복실화를 통해 지방산을 합성하는데 사용될 수 있다.[43][44] 이러한 전환은 간, 지방 조직, 젖을 분비하는 젖샘에서 주로 일어난다. 지방산은 글리세롤과 결합하여 대부분의 동물에서 연료의 주된 저장 형태인 트라이글리세라이드를 형성한다. 또한 지방산은 모든 세포막의 지질 이중층을 구성하는 인지질의 구성 요소이다.[40]
식물에서 새로이 생성되는 지방산의 합성은 색소체에서 일어난다. 많은 종자들은 종자의 발아 및 어린 식물의 초기 생장을 지원하기 위해 기름(oil)을 저장하고 있다.
세포질의 아세틸-CoA는 아세토아세틸-CoA와 축합하여 β-하이드록시-β-메틸글루타릴-CoA(HMG-CoA)를 형성한다. 이 반응은 콜레스테롤 합성을 조절하는 속도제한단계이다.[40] 콜레스테롤은 동물 세포막의 구성 성분으로 그대로 사용되거나, 스테로이드 호르몬, 담즙산, 비타민 D를 합성하는데 사용될 수 있다.[40][44]
아세틸-CoA는 세포질에서 아세틸-CoA 카복실화효소에 의해 카복실화되어 말로닐-CoA가 된다. 말로닐-CoA는 플라보노이드 및 그와 관련된 폴리케타이드(polyketide)를 합성하고, 단백질과 기타 식물화학물질(phytochemical)을 말로닐화 하는데 쓰인다. 말로닐-CoA는 왁스, 큐티클을 생성하기 위한 지방산의 신장과 배추속 식물의 종자 기름 생성에 필요한 기질인 말로닐-CoA를 생성한다.[45] 세스퀴테르펜(sesquiterpene), 브라시노스테로이드(식물 호르몬) 및 막 스테롤이 역시 이러한 방법으로 합성된다.
3. 3. 콜레스테롤 합성
세포질의 아세틸-CoA는 아세토아세틸-CoA와 축합하여 β-하이드록시-β-메틸글루타릴-CoA(HMG-CoA)를 형성한다. 이 반응은 콜레스테롤 합성을 조절하는 속도제한단계이다.[40] 콜레스테롤은 동물 세포막의 구성 성분으로 그대로 사용되거나, 스테로이드 호르몬, 담즙산, 비타민 D를 합성하는데 사용될 수 있다.[40][44]3. 4. 식물에서의 기능
식물에서 새로이 생성되는 지방산의 합성은 색소체에서 일어난다. 많은 종자들은 발아 및 어린 식물의 초기 생장을 지원하기 위해 기름(oil)을 저장하고 있다.[40]세포질의 아세틸-CoA는 아세토아세틸-CoA와 축합하여 β-하이드록시-β-메틸글루타릴-CoA(HMG-CoA)를 형성한다. 이 반응은 콜레스테롤 합성을 조절하는 속도제한단계이다.[40]
아세틸-CoA는 세포질에서 아세틸-CoA 카복실화효소에 의해 카복실화되어 말로닐-CoA가 된다. 말로닐-CoA는 플라보노이드 및 그와 관련된 폴리케타이드(polyketide)를 합성하고, 단백질과 기타 식물화학물질(phytochemical)을 말로닐화 하는데 쓰인다. 말로닐-CoA는 왁스, 큐티클을 생성하기 위한 지방산의 신장과 배추속 식물의 종자 기름 생성에 필요한 기질이다.[45] 세스퀴테르펜(sesquiterpene), 브라시노스테로이드(식물 호르몬) 및 막 스테롤도 역시 이러한 방법으로 합성된다.
3. 5. 기타 기능
식물과 동물에서 세포질의 아세틸-CoA는 ATP 시트르산 분해효소(ATP citrate lyase)에 의해 합성된다.[39] 동물의 경우 혈당량이 높으면 포도당은 세포질에서 피루브산으로 분해되고(해당과정), 미토콘드리아에서 아세틸-CoA로 전환된다. 아세틸-CoA가 과다하면 시트르산의 양이 증가하고, 여분의 시트르산은 세포질로 운반되어 세포질의 아세틸-CoA의 양을 증가시킨다.- '''스테로이드 합성:''' 아세틸-CoA는 β-하이드록시-β-메틸글루타릴-CoA(HMG-CoA)의 합성에 관여함으로써 메발론산 경로에 참여한다. 메발론산 경로는 2분자의 아세틸-CoA가 축합반응을 통해 아이소프레노이드를 합성하는 경로이다. 이 경로의 속도제한단계 효소는 HMG-CoA 환원효소이다. 동물의 경우 HMG-CoA는 콜레스테롤과 케톤체 합성의 주요 전구체이다.
- '''아세틸콜린 합성:''' 아세틸-CoA는 신경전달물질인 아세틸콜린의 생합성에 주요 성분이다. 콜린 아세틸기 전이효소에 의해 콜린은 아세틸-CoA와 반응하여 아세틸콜린과 조효소 A(CoA)를 생성한다.
- '''멜라토닌 합성'''
- '''아세틸화:''' 아세틸-CoA는 번역 후 변형의 아세틸화에서 히스톤 단백질과 비히스톤 단백질의 특정 라이신 잔기를 아세틸화시키는 아세틸기의 공급원이다. 이러한 아세틸화 반응은 아세틸기 전이효소에 의해 촉매된다. 아세틸화는 세포 생장, 체세포 분열, 세포자살에 영향을 미친다.[46]
- '''다른 자리 입체성 조절인자'''
- 아세틸-CoA는 피루브산 탈수소효소 키네이스의 다른 자리 입체성 조절인자로 작용한다. 이는 아세틸-CoA 대 CoA의 비율을 통해 조절된다. 아세틸-CoA의 농도 증가는 피루브산 탈수소효소 키네이스를 활성화시킨다.[47]
- 아세틸-CoA는 피루브산 카복실화효소의 다른 자리 입체성 활성인자이다.[48]
4. 쿠엔산-피루브산 셔틀
아세틸-CoA는 미토콘드리아에서 세포질로 수송되어 지방산이나 테르페노이드의 생합성에 이용된다.[26] 이러한 수송 과정을 쿠엔산-피루브산 셔틀이라고 한다.
참조
[1]
서적
Data for Biochemical Research
Clarendon Press
2002
[2]
웹사이트
Acetyl CoA Crossroads
http://chemistry.elm[...]
2016-11-08
[3]
웹사이트
Fatty Acids -- Structure of Acetyl CoA
http://library.med.u[...]
2017-06-02
[4]
웹사이트
All Nobel Prizes in Physiology or Medicine
https://www.nobelpri[...]
[5]
논문
Metabolic engineering for efficient supply of acetyl-CoA from different carbon sources in Escherichia coli
2019-08-00
[6]
웹사이트
5.12G: The Acetyl-CoA Pathway
https://bio.libretex[...]
2017-05-09
[7]
논문
ATP-Citrate Lyase Is Required for Production of Cytosolic Acetyl Coenzyme A and Development in Aspergillus nidulans
2010-07-01
[8]
논문
A two-way street: reciprocal regulation of metabolism and signalling
2012-04-01
[9]
서적
Functional Metabolism: Regulation and Adaptation
https://books.google[...]
John Wiley & Sons
2005-02-25
[10]
웹사이트
ACLY ATP citrate lyase [Homo sapiens (human)] - Gene - NCBI
https://www.ncbi.nlm[...]
2016-11-06
[11]
논문
Life with carbon monoxide
2004
[12]
서적
Textbook of Biochemistry for Dental/Nursing/Pharmacy Students
https://archive.org/[...]
Jaypee Brothers Publishers
2004-01-01
[13]
서적
Biochemistry
https://archive.org/[...]
W. H. Freeman
[14]
서적
Guide to Biochemistry
https://books.google[...]
Butterworth-Heinemann
2014-06-28
[15]
논문
A general introduction to the biochemistry of mitochondrial fatty acid β-oxidation
2010-03-02
[16]
서적
Biochemistry.
W.H. Freeman and Company
1995
[17]
웹사이트
Oxidation of fatty acids
http://pharmaxchange[...]
2013-10-11
[18]
웹사이트
Ketone body metabolism
http://watcut.uwater[...]
University of Waterloo
[19]
논문
SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective
[20]
서적
Fundamentals of Biochemistry, 2nd Edition
https://archive.org/[...]
John Wiley and Sons, Inc.
[21]
논문
Reverse Genetic Characterization of Cytosolic Acetyl-CoA Generation by ATP-Citrate Lyase in Arabidopsis
[22]
논문
Integration of Apoptosis and Metabolism
2011-01-01
[23]
논문
Regulation of pyruvate dehydrogenase kinase and phosphatase by acetyl-CoA/CoA and NADH/NAD ratios
1975-07-22
[24]
논문
Structure, Mechanism and Regulation of Pyruvate Carboxylase
2008-08-01
[25]
웹사이트
第5回 5.エネルギーの生産-サイトゾールとミトコンドリア
http://www.tmd.ac.jp[...]
2002-04-08
[26]
논문
Kinetic Simulation of Malate-Aspartate and Citrate-Pyruvate Shuttles in Association with Krebs Cycle
[27]
웹인용
Acetyl CoA Crossroads
http://chemistry.elm[...]
2016-11-08
[28]
웹인용
Fatty Acids -- Structure of Acetyl CoA
http://library.med.u[...]
2017-06-02
[29]
저널 인용
ATP-Citrate Lyase Is Required for Production of Cytosolic Acetyl Coenzyme A and Development in Aspergillus nidulans
http://ec.asm.org/co[...]
2010-07-01
[30]
저널 인용
A two-way street: reciprocal regulation of metabolism and signalling
http://www.nature.co[...]
2012-04-01
[31]
서적 인용
Functional Metabolism: Regulation and Adaptation
https://books.google[...]
John Wiley & Sons
2005-02-25
[32]
웹인용
ACLY ATP citrate lyase [Homo sapiens (human)] - Gene - NCBI
https://www.ncbi.nlm[...]
2016-11-06
[33]
논문
Life with carbon monoxide
2004
[34]
서적 인용
Textbook of Biochemistry for Dental/Nursing/Pharmacy Students
https://books.google[...]
Jaypee Brothers Publishers
2004-01-01
[35]
서적 인용
Biochemistry
https://www.ncbi.nlm[...]
W. H. Freeman
[36]
서적
Guide to Biochemistry
https://books.google[...]
Butterworth-Heinemann
2014-06-28
[37]
서적
Lehninger Principles of Biochemistry
W.H. Freeman and Company
[38]
저널
A general introduction to the biochemistry of mitochondrial fatty acid β-oxidation
https://link.springe[...]
2010-03-02
[39]
저널
Molecular Characterization of a Heteromeric ATP-Citrate Lyase That Generates Cytosolic Acetyl-Coenzyme a in Arabidopsis
[40]
서적
Biochemistry.
https://archive.org/[...]
W.H. Freeman and Company
1995
[41]
웹인용
Oxidation of fatty acids
http://pharmaxchange[...]
[42]
웹인용
Ketone body metabolism
http://watcut.uwater[...]
University of Waterloo
2018-08-01
[43]
저널
SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective
http://content.karge[...]
2010-08-30
[44]
서적
Fundamentals of Biochemistry, 2nd Edition
https://archive.org/[...]
John Wiley and Sons, Inc.
[45]
저널
Reverse Genetic Characterization of Cytosolic Acetyl-CoA Generation by ATP-Citrate Lyase in Arabidopsis
[46]
저널
Integration of Apoptosis and Metabolism
http://symposium.csh[...]
2018-08-01
[47]
저널
Regulation of pyruvate dehydrogenase kinase and phosphatase by acetyl-CoA/CoA and NADH/NAD ratios
http://www.sciencedi[...]
1975-07-22
[48]
저널
Structure, Mechanism and Regulation of Pyruvate Carboxylase
2008-08-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


