산-염기 항상성
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산-염기 항상성은 생명체의 내부 환경에서 pH를 일정하게 유지하려는 생리적 조절 기전을 의미한다. 인간을 포함한 많은 동물은 화학적 완충 작용, 호흡기 방어 작용, 대사 방어 작용의 세 가지 주요 방어선을 통해 산-염기 항상성을 유지한다. 화학적 완충 작용은 pH 변화를 즉각적으로 최소화하며, 호흡기 방어 작용은 혈액 내 탄산 농도를 조절하고, 대사 방어 작용은 신장을 통해 중탄산염 이온을 조절한다. 혈액은 다양한 완충계를 갖추고 있으며, 중탄산염 완충계, 인산염 완충계, 단백질 완충계 등이 pH 변화에 저항하는 데 중요한 역할을 한다. 또한, 호흡계통은 이산화탄소 배출을 통해, 콩팥은 오줌의 조성을 조절하여 산-염기 균형을 유지한다. 산-염기 장애는 혈액 pH가 정상 범위를 벗어날 때 발생하며, 호흡성 및 대사성 원인으로 나뉜다. 산-염기 장애를 평가하기 위해 다양한 접근법이 사용되며, 전통적인 중탄산염 중심 접근법, 코펜하겐 접근법, 보스턴 접근법, 스튜어트 접근법 등이 있다. 역사적으로 산-염기 생리학은 17세기 의화학자들의 연구에서 시작되어 헨더슨, 하셀바흐, 반 슬라이크 등의 연구를 거쳐 발전해왔으며, 현재까지도 연구가 활발히 진행되고 있다.
더 읽어볼만한 페이지
- 산염기 생리학 - 중탄산염 완충계
중탄산염 완충계는 이산화탄소, 탄산, 중탄산염 이온 간의 반응을 통해 체액의 pH를 일정하게 유지하는 완충 시스템으로, 특히 혈액에서 호흡과 콩팥 작용을 통해 pH 항상성을 유지하는 데 중요한 역할을 한다. - 산염기화학 - 산 무수물
산 무수물은 두 분자의 산에서 물 분자가 제거되어 생성된 화합물로, 카르복실산 무수물과 무기산 무수물로 나뉘며 폴리에스터 합성 및 의약품 제조 등에 사용되는 다양한 종류가 존재하고, 가수분해 반응, 에스터 및 아미드 형성 반응 등 높은 반응성을 지닌다. - 산염기화학 - 중화 반응
중화 반응은 산과 염기가 반응하여 염과 물을 만드는 화학 반응으로, 넓게는 양성자 교환 반응을, 좁게는 수소 이온과 수산화 이온이 물을 생성하는 반응을 뜻하며, 다양한 종류와 응용 분야를 가진다.
2. 항상성 유지 기제
사람을 비롯한 동물에서 산-염기 항상성은 세 가지 주요 기제를 통해 유지된다.[44][45]
- 화학적 완충계: 혈액 속 화학적 완충계는 산이나 염기가 유입될 때 르 샤틀리에의 원리에 따라 pH 변화를 완화한다. 중탄산염 완충계, 인산염 완충계, 단백질 완충계 등이 있으며, 수 초 이내에 작용한다.[38] 하지만 이는 일시적인 완화일 뿐, 실제로 산·염기를 제거하는 것은 아니다.[26][38]
- 호흡계: 호흡계는 세포 대사로 생기는 이산화탄소를 날숨으로 배출하여 탄산 농도를 조절한다. 호흡은 수 분 이내에 탄산을 제거하는 효과적인 기제이다.[26][36]
- 콩팥: 콩팥은 오줌의 조성을 조절하여 호흡으로 제거되지 않는 비휘발성 산을 배설한다. 콩팥의 작용은 수 시간에서 수 일이 걸리지만, 가장 강력한 산-염기 항상성 유지 기제이다.[26]
이 세 가지 방어선은 화학 완충제, 호흡계, 콩팥에 의해 조절되며, 혈장을 포함한 세포외액의 pH를 7.32에서 7.42 사이로 엄격하게 유지한다.[9][10][11][12][1]
2. 1. 화학적 완충계
사람을 비롯한 동물에서 산-염기 항상성에 관여하는 기제 중 하나는 혈액 속 화학적 완충계이다.[112][109] 혈액의 완충 작용은 약산과 그 짝염기 혹은 약염기와 그 짝산이 함께 있으면 르 샤틀리에의 원리에 의해 변동을 되돌리는 방향으로 반응이 진행되기 때문에 일어난다.[38] 혈액의 완충 능력에 기여하는 주된 약산-짝염기 쌍으로는 중탄산염 완충계, 인산염 완충계, 단백질 완충계 등이 있다. 이들 완충계는 산·염기가 유입되면 수 초 이내에 중화하여 pH 변화를 완화한다.[26][38]세포외액의 여러 완충계 중 특히 중탄산염 완충계의 역할을 강조하여, 전통적인 산염기 생리학은 중탄산염 중심 접근법이라고도 불린다.[39] 중탄산염 완충계는 H2CO3―HCO3- 쌍으로 이루어져 있으며, 탄산의 해리 반응을 통해 산염기 변동을 완충한다.
:
체액에 산이 유입되어 H+가 늘어나면 반응의 평형이 왼쪽으로 치우쳐 HCO3-가 H+를 중화한다. 반대로 염기가 유입되면 OH-가 H2CO3와 반응하여 물과 HCO3-를 만들어 탄산이 OH-를 중화한다.[26]
중탄산염 완충계의 평형은 헨더슨-하셀바흐 방정식을 이용하여 정량적으로 나타낼 수 있다. 용해된 기체의 농도가 공기 중 이산화탄소 분압에 비례한다는 헨리의 법칙 및 탄산 해리 반응의 평형 조건을 결합하면 다음과 같다.
:
여기서 상수 는 약 10-6.1이고, 는 이산화탄소의 용해도계수(solubility coefficient영어)로 체온(37℃)에서 약 0.03 mM/mmHg이다. 양변의 상용로그를 취해 변형하기도 한다.
:
이때 p''K''는 로 정의되므로 6.1이다.[58][46]


화학이 발전함에 따라 산과 염기의 정의도 변했는데, 생리학·의학에서는 여전히 브뢴스테드-로우리 등 전통적인 산·염기 정의가 유용하게 쓰인다.[26][39][55][56]
수소 이온과 가역적으로 결합하는 물질로 이루어진 용액인 완충 용액은 수소 이온 농도 변화에 저항하는 원리를 설명한다.[26][57]
:
이 용액에 강산 HA를 첨가하면 H+와 A-로 이온화하는데, 해리된 수소 이온 중 일부는 B(n)과 결합하여 HB(n+1)이 되므로 pH 변화가 완화된다.
:
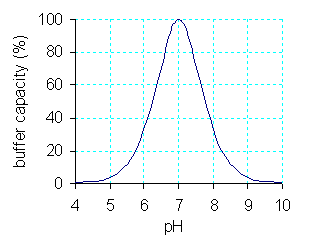
완충 작용이 일어나는 정도를 나타내는 척도로 완충용량이 쓰인다. 완충용량은 용액의 pH를 1 올리기 위해 첨가해야 하는 강염기의 양, 또는 pH를 1 떨어뜨리기 위해 필요한 강산의 양으로 정의된다.[57]
완충용량은 여러 요인에 영향을 받는데, 질량작용의 법칙에 따르면 화학 평형 상태에서 다음 식의 값은 온도에만 의존하는 상수이며, 이를 산 해리 상수라고 부른다.
:
HB(n+1) 및 B(n)이 많을수록 완충용량도 커진다.[57] 완충용량은 HB(n+1), B(n)의 총량에 비례하며, 총량이 일정하면 두 화학종의 농도비가 1:1일 때 완충용량이 극대화된다. 이는 [H+] = Ka일 때와 같으며, pKa = -log Ka라고 정의하면 pH가 pKa와 같을 때이다.[38][57]
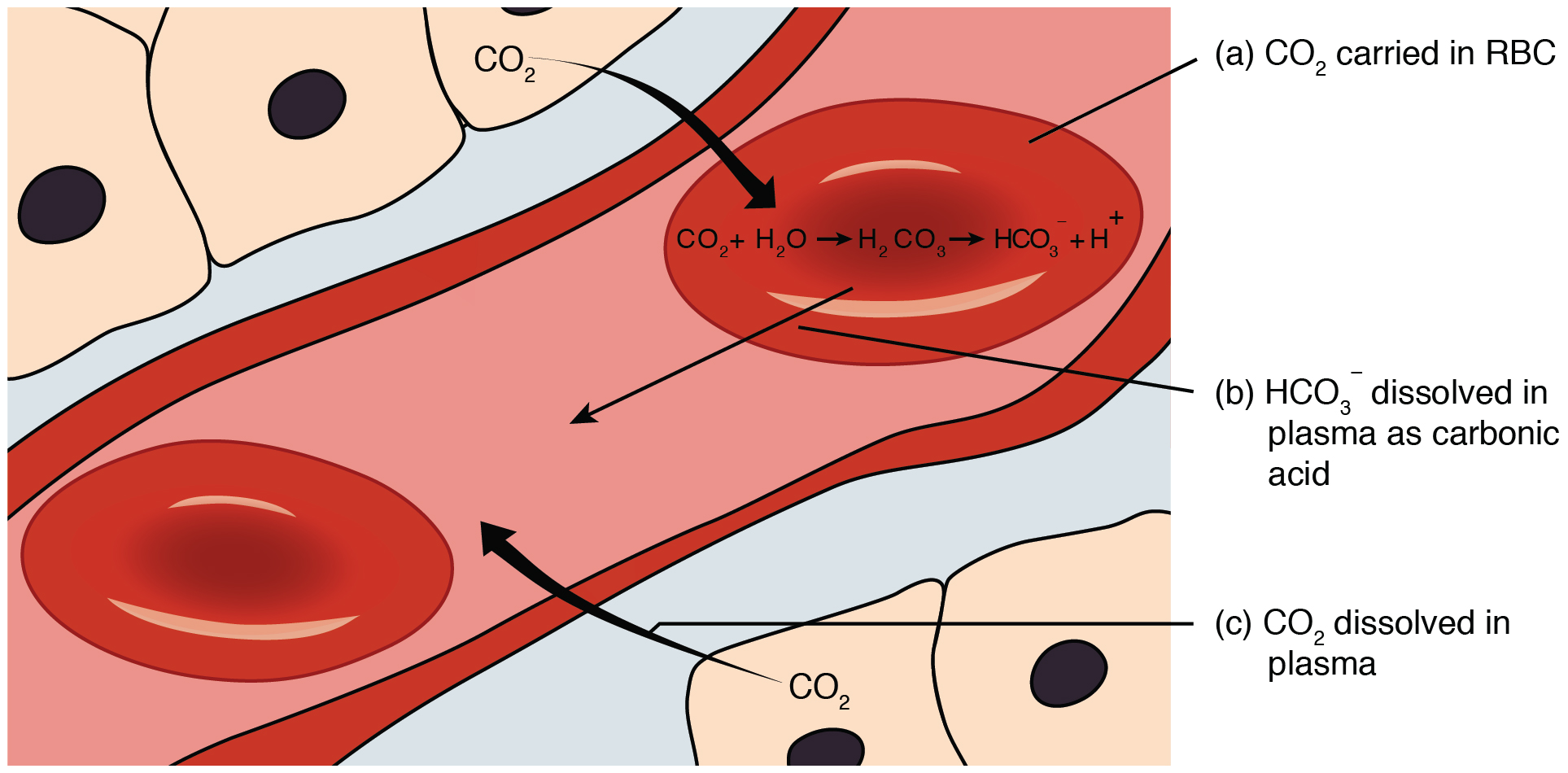
중탄산염 완충계는 H2CO3―HCO3- 쌍으로 이루어진 완충계이다. 세포외액에 H2CO3는 많지 않으며, pKa 값도 혈액의 정상 pH와 달라 H2CO3와 HCO3-의 농도 비는 보통 1:20이다. 그럼에도 중탄산염 완충계는 세포외액의 완충 작용에서 가장 중요한 역할을 하는데, 열린 계이기 때문이다. HCO3-가 H+를 제거하면서 H2CO3가 만들어지면, 이산화탄소가 되어 날숨으로 배출된다. 혈액이 알칼리화되는 경우에도 호흡을 통해 H2CO3가 쉽게 공급된다.[58] 이처럼 이산화탄소 농도가 외부 공기와 평형을 이루고 있기에 중탄산염 완충계의 완충 능력은 크게 향상된다.[59]
물과 이산화탄소가 탄산을 만드는 반응 및 그 역반응은 매우 느려서 탄산무수화효소가 없으면 거의 일어나지 않는다.[58] 적혈구 세포질에는 탄산무수화효소가 많아 이산화탄소가 탄산이 된다. 이산화탄소가 소모되어 세포 안팎의 이산화탄소 농도 기울기가 가파르기 때문에 확산이 활발히 일어난다. 반대로 이산화탄소가 적은 허파에서는 탄산무수화효소의 촉매 작용으로 탄산이 이산화탄소가 되어 날숨으로 빠져나간다. 적혈구는 '이산화탄소 싱크(sink)' 구실을 하면서 조직과 허파 사이에서 이산화탄소를 옮겨나른다.[38]
인산염 완충계는 H2PO4-―HPO42- 쌍으로 이루어진 완충계이다.
:
pKa 값이 6.8로 혈액의 정상 pH인 7.4에 가깝지만, 세포외액 중 농도가 낮아 전체 완충 능력은 중탄산염 완충계에 비해 약하다. 하지만 세포내액 및 세뇨관을 흐르는 액체 속에서는 중요한 역할을 한다.[58]
단백질은 세포 내에 매우 풍부하여 완충 능력이 뛰어나다. 체액 완충 용량의 60-70%는 세포내액의 완충 능력에서 비롯하며, 이는 대부분 세포 내 단백질 덕분이다. 세포 내 완충 작용에 기여하는 대표적인 단백질은 적혈구의 헤모글로빈이다.[58]
:
체내 조직에서 만들어진 이산화탄소가 적혈구 세포질로 들어오면, 탄산무수화효소의 촉매로 탄산수소 이온과 수소 이온이 만들어진다. 이때 헤모글로빈의 완충 작용으로 적혈구 안의 pH 변화가 완화된다.[38]
알부민은 아미노산 곁사슬이 많이 있는 고분자 물질로, 분자 하나마다 해리 가능한 잔기가 200개 넘게 있는 다양성자 산이다.[141][60] 등전점이 약 4.7이므로 pH 7.4인 혈장에서는 알짜로 음전하를 띤다.[61] 히스티딘 이미다졸 잔기는 pKa 값이 6.75로 7.4에 비교적 가까워 pH에 따라 수소 이온을 받기도 하고 내어주기도 한다.[141][62]
2. 2. 호흡계통
호흡계통은 조직에서 끊임없이 만들어내는 이산화탄소를 환기를 통해 제거한다. 대사와 환기의 균형이 혈액의 이산화탄소 기체 분압을 결정한다.[68] 호흡수는 이산화탄소 기체 분압에 반응해서 조절된다. 대사가 활발해지면 환기도 덩달아 빨라지므로 조직에 이산화탄소가 쌓이지 않고 그대로 제거된다.[69] 이러한 음성 되먹임에 의해 이산화탄소 기체 분압이 일정하게 유지되기 때문에 혈액의 중탄산염 완충계를 일정 압력의 기체와 평형을 이루고 있는 열린 계로 간주할 수 있고, 탄산으로 대사되는 각종 유기산을 휘발성 산이라고 부를 수 있는 것이다.한편 호흡수는 혈중 수소 이온(H+) 농도에 의해서도 조절된다. 세포 대사로 이산화탄소가 많이 생산되면 탄산의 해리 반응에 의해 H+ 역시 많아지므로, H+ 농도에 의한 환기 조절은 이산화탄소 분압의 균형을 이루는 데에 기여한다. 그런데 H+ 농도는 다른 산·염기에 의해서도 변한다. 산을 섭취하여 H+가 많아지면, 설령 대사량이 이전과 똑같더라도 호흡수가 증가하여 이산화탄소를 더 빠르게 제거한다. 혈중 이산화탄소 기체 분압이 감소하므로 H+ 농도도 감소한다. 반대로 염기를 섭취하여 H+가 적어지면 호흡이 느려져 이산화탄소 분압이 상승하고 H+도 다시 많아진다. 이처럼 호흡계통은 혈중 H+ 농도에 반응하여 환기를 통한 이산화탄소 제거 속도를 조절함으로써, 혈액의 완충계에 이어 사람의 산-염기 항상성을 유지하는 제2방어선 역할을 한다.[68]
호흡을 조절하여 H+ 농도를 되돌리는 데에는 한계가 있다. 호흡보상의 효율은 보통 50-75% 정도라고 보는데, 이를테면 산혈증으로 pH가 7.4에서 7.0으로 떨어지면 호흡을 빨리 해서 pH를 7.2-7.3 정도까지는 되돌릴 수 있다는 것이다. 알칼리혈증에 대한 호흡보상은 덜 효과적이다. 환기는 이산화탄소를 제거할 뿐만 아니라 산소를 공급하는 역할도 하기 때문에, 호흡이 가빠지기는 쉬워도 너무 느려져서는 위험하다. 따라서 pH가 증가하더라도 호흡수는 많이 감소하지 않는다.[68]
혈중 이산화탄소 기체 분압 및 H+ 농도를 감지하여 호흡계통에 전달하는 것은 주로 호흡 중추의 화학감수성영역(chemosensitive area영어)이다. 숨뇌의 배쪽 표면 가까이에 좌우 각 한 무리씩 신경 세포가 모여 있어, H+ 농도에 민감하게 반응하여 호흡 중추의 나머지 부위를 자극한다. 실제로 혈액에서 화학감수성영역을 더 효과적으로 자극하는 것은 H+가 아니라 오히려 이산화탄소인데, 수소 이온은 혈액뇌장벽을 쉽게 넘나들지 못하는 반면 이산화탄소 기체는 자유롭게 확산하기 때문이다. 한편 목동맥토리·대동맥토리 등에 있는 말초 화학수용기도 부수적인 역할을 한다. 주로 산소 농도를 감지하는 데에 관여하지만 이산화탄소 및 H+에도 반응하여 호흡 중추로 신호를 전달한다. 호흡을 조절하는 효과는 중추 화학감수성영역이 말초 화학수용기보다 훨씬 크지만, 빠르기로 따지면 말초 화학수용기의 반응이 다섯 배나 빠르다. 따라서 갑자기 운동을 시작할 때처럼 이산화탄소 분압이 급격하게 변할 때 기민하게 대응하도록 돕는 것으로 보인다.[68]
2. 3. 콩팥
콩팥은 오줌의 조성을 조절하여 산-염기 항상성을 유지한다. 산성 소변이 배설되면 체액에서 산이 제거되고, 염기성 소변이 배설되면 체액에서 염기가 제거된다. 콩팥은 산성 소변을 내보내 하루에 70-80 mEq만큼 산을 제거함으로써 균형을 맞춘다. 또한 산혈증이 있으면 소변을 더욱 산성화하고, 반대로 알칼리혈증이 있으면 덜 산성화하거나 심지어 알칼리화하는 콩팥보상을 통해 혈액의 수소 이온 농도를 정상으로 되돌린다.[36][70]콩팥이 소변의 산염기 상태를 조절하는 주된 분자 기제는 수소 이온 분비이다.[36][70] 토리에서 갓 여과한 액체는 혈액과 거의 조성이 비슷하여 중탄산염 농도가 약 24 mEq/L인 염기성 용액이다. 토리거름률이 정상이면 혈액이 하루에 약 180 L 걸러지므로, 중탄산염은 하루에 약 4320 mEq 여과된다. 평상시에 산-염기 균형을 유지하려면 산 80 mEq를 배출해야 하니, 수소 이온(H+)을 하루에 약 4400 mEq 분비하여야 한다. 이때 H+ 4320 mEq만큼은 중탄산염을 적정하므로 소변 pH를 크게 변화시키지 않지만, 나머지 80 mEq는 만일 완충되지 않으면 pH를 급격하게 떨어뜨린다.[70] 소변 1.5 L에 H+가 80 mEq 있으면 pH로는 1.3 정도에 해당한다.[36] 그런데 소변이 너무 산성이면 H+가 세뇨관 밖으로 확산하기 시작하기 때문에 소변의 pH는 4.5 미만으로 떨어지기 어렵다. 실제로 소변에는 인산염 등 완충계가 있어, 소변으로 분비한 H+는 수용액 속을 자유롭게 돌아다니는 것이 아니라 예컨대 HPO42-와 결합하여 H2PO4-로 있다. 이로써 pH를 심하게 낮추지 않으면서 산을 다량 배설할 수 있다.[70]
산-염기 불균형은 혈액 pH가 정상 범위(7.32~7.42)를 벗어날 때 발생한다. 세포 외액(ECF)의 pH가 비정상적으로 낮으면 산혈증, 높으면 알칼리혈증이라고 한다.[10] 산증과 알칼리증은 호흡성 또는 대사성 구성 요소의 통상적인 영향을 나타내는 반면,[24] 산혈증과 알칼리혈증은 세포 외액의 pH가 실제로 변동된 것을 명확하게 나타낸다.[24] 산증은 그 자체로 산혈증을 유발하고(알칼리증에 의해 "보상되지 않은" 경우),[24] 알칼리증은 그 자체로 알칼리혈증을 유발한다.[24] 산-염기 문제는 대사성 산증, 호흡성 산증, 대사성 알칼리증, 호흡성 알칼리증의 네 가지가 있으며,[5] 이들 중 하나 또는 조합이 동시에 발생할 수 있다. 예를 들어, 조절되지 않는 당뇨병과 같은 대사성 산증은 과호흡(호흡성 알칼리증)에 의해 부분적으로 보상될 수 있다.
소변 속 완충계의 완충 능력은 각 완충계의 농도와 p''K''a 값, 그리고 소변의 pH에 따라서 달라진다. 소변을 더 산성화하면 p''K''a 값이 더 낮은 요산염과 크레아티닌이 주로 수소 이온을 적정하는 역할을 한다.[36][70]
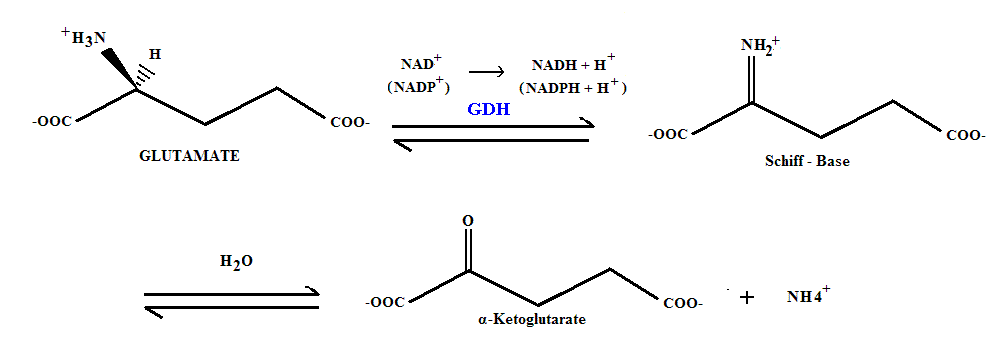
또다른 중요한 성분은 암모늄이다. 세뇨관 벽 세포가 글루타민을 α-케토글루타르산으로 대사할 때 생성되어 소변으로 확산해 나가거나 능동수송으로 분비된다.[70] 이를 암모니아생성(ammoniagenesis영어)이라고 한다. 글루타민은 가장 흔한 비필수 아미노산으로 각종 음식에 풍부하게 들어 있다. 이처럼 기질이 풍부하기에, 암모니아생성은 필요에 따라 탄력적으로 조절되어 산 제거에 크게 기여할 수 있다.[71]
콩팥의 산염기 조절을 정량적으로 분석하는 지표는 알짜산배설량(net acid excretion영어, NAE)으로, 다음처럼 계산된다.
:
여기서 (NH4+)와 ( HCO3- )는 각각 소변을 통한 암모늄과 중탄산염의 배설량을 가리킨다. 암모늄을 배설할수록 산을 제거하는 것이고, 중탄산염을 배설할수록 염기를 잃어버리는 셈이다. 한편 TA는 적정산도(titratable acidity영어)로, 암모늄과 중탄산염 이외의 다른 완충계가 적정한 산의 양을 가리킨다. 평상시에 콩팥은 중탄산염을 대부분 재흡수하여 배설량은 0에 가깝다. 그런데 산혈증이 있어서 산을 더 많이 제거해야 하는 경우, 인산염 등은 여과되는 양 자체에 한계가 있으므로 적정산도가 크게 증가하기는 어렵다. 반면 암모늄 분비는 탄력적으로 조절되어 많게는 하루에 500 mEq까지도 늘어날 수 있다. 따라서 만성 산혈증 상황에서는 암모늄 분비가 콩팥의 산 제거에서 가장 큰 비중을 차지한다. 반대로 알칼리혈증이 있으면 암모늄 분비가 0에 가까워지고 중탄산염 분비가 늘어나 NAE가 음수가 되므로 알짜로 염기가 제거된다.[70][73]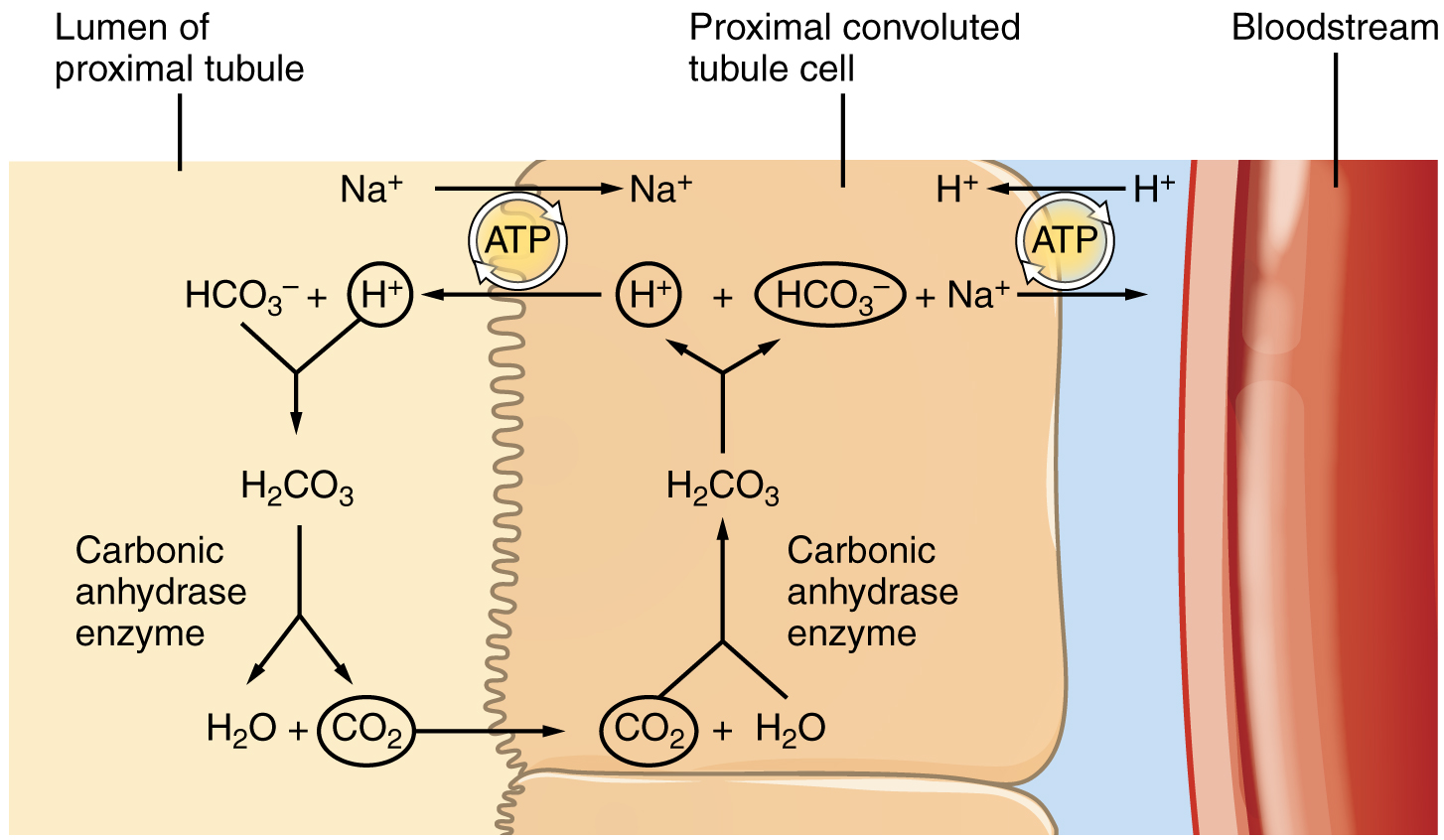
생리학에서는 콩팥의 산염기 조절 작용을 흔히 수소 이온 배설, 중탄산염 재흡수, 그리고 중탄산염 생성으로 나누어 설명하는데, 따지고 보면 모두 수소 이온 분비라는 한 가지 기제에서 비롯하는 현상이다. 세뇨관 벽 세포로는 이산화탄소가 자유롭게 확산해 들어올 수 있으며, 이산화탄소가 용해하여 된 H2CO3는 세포 안의 탄산무수화효소에 의해 HCO3-와 H+로 해리한다. H+를 세포 밖으로 분비해 없앨수록 반응의 평형이 치우치므로, HCO3-도 많이 만들어져 세포 바닥면의 통로를 통해 확산하여 나간다. 따라서 H+를 하나 분비할 때마다 중탄산염을 하나씩 얻는다. [70]
3. 산-염기 조절에 대한 다양한 관점
3. 1. 전통적인 중탄산염 중심 접근법
전통적인 산염기 생리학은 세포외액의 여러 완충계 중에서도 특히 중탄산염 완충계의 역할을 강조하기 때문에 중탄산염 중심 접근법(bicarbonate-centered approach)이라고도 불린다.[39] 중탄산염 완충계는 ― 쌍으로 이루어진 완충계로, 탄산의 해리 반응을 통해 산염기 변동을 완충한다.
:
체액에 산이 유입되어 가 늘어나면 반응의 평형이 왼쪽으로 치우쳐 가 를 중화한다. 반대로 염기가 유입되면 가 와 반응하여 물과 를 만들어 탄산이 를 중화한다.[26] 중화되지 않고 남은 극소량의 또는 에 의해 체액의 pH가 변동한다.[57]
중탄산염 완충계의 평형을 정량적으로 파악하기 위해 헨더슨-하셀바흐 방정식을 이용한다. 용액에 용해된 기체의 농도가 공기 중 이산화탄소 분압에 비례한다는 헨리의 법칙 및 탄산 해리 반응 각 단계의 평형 조건을 결합하면 다음과 같은 수식을 얻는다.
:
여기서 상수 의 값은 약 10-6.1이고, 는 이산화탄소의 용해도계수(solubility coefficient영어)로 체온(37℃)에서 약 0.03 mM/mmHg이다. 양변의 상용로그를 취해 변형하기도 한다.
:
보통 이 형태로 나타낸 것을 헨더슨-하셀바흐 방정식이라고 부른다. 이때 p''K''는 로 정의되므로 그 값은 6.1이다.[58][46]
전통적인 중탄산염 중심 접근법에서 헨더슨-하셀바흐 방정식은 pH, , 의 상관관계를 나타낼 뿐만 아니라, pH가 와 의 비에 의해 결정된다는 인과관계를 보여준다. 호흡계통과 콩팥이 각각 와 를 일정하게 유지함으로써 항상성이 유지된다.[38][47]
:
인체의 방어선은 체액의 pH를 일정하게 유지한다. 전통적인 관점에 따르면, 그 값이 7.4인 이유는 헨더슨-하셀바흐 방정식에서 와 의 비가 20:1이기 때문이다.[47]
헨더슨-하셀발흐 방정식은 탄산-중탄산염 완충계에 적용될 때, 다음과 같은 관계를 나타낸다:[15]
:
여기서:
그러나 탄산 농도는 세포외액 내 이산화 탄소의 분압()에 직접적으로 비례하므로, 다음과 같이 다시 쓸 수 있다:[5][15]
:
여기서:
따라서 세포외액의 pH는 및 다른 대사성 산의 조절을 통해 제어될 수 있다.
3. 2. 스튜어트 접근법

1980년대에 캐나다의 생리학자 피터 스튜어트는 중탄산염 중심의 전통적인 접근법이 불만족스럽다고 느끼고, 산-염기 생리학을 새롭게 이해하는 방법을 고안했다.[140] 독립변수인 이산화탄소 분압 , 비휘발성 약산 총량 ATOT, 강이온차이 SID의 값이 주어지면 체액의 산염기 상태는 다음 6가지 방정식에 의해 하나로 결정된다.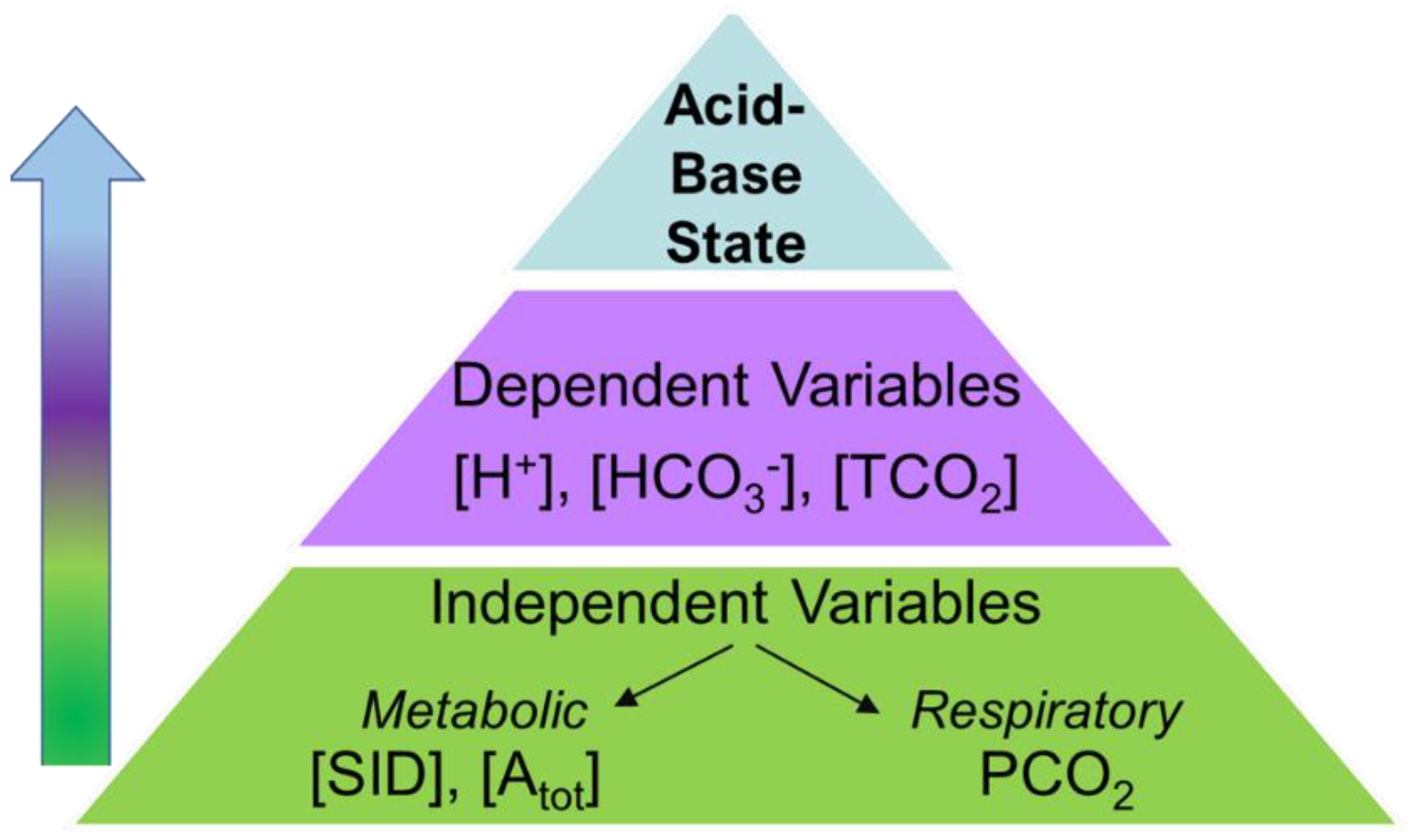

1. 물의 자동 이온화 반응(H2O
2. 탄산 해리 반응의 평형 조건, 즉 헨더슨-하셀바흐 방정식: .
3. 탄산수소 이온 해리 반응(HCO3-
4. 비휘발성 약산 전체를 HA로 뭉뚱그려 생각할 수 있다고 했을 때, 그 해리 반응(HA
5. 비휘발성 약산 전체의 질량 보존 법칙: . 이 값은 물질의 출입에 의해 변할 뿐 반응이 진행함에 따라 변하지는 않는 상수이다.
6. 전기 중성 원리: .
모두 연립하면 에 대한 사차방정식을 얻고, 이를 수치적으로 풀면 각종 평형 상수 및 , ATOT, SID의 값에 따라 가 어떻게 변화하는지 분석할 수 있다.[141][142]
스튜어트 접근법은 지금까지도 논쟁의 대상이 되고 있다.[39] 한 가지 중요한 쟁점은 스튜어트 접근법이 임상적으로 유용한지 여부이다. 스튜어트 접근법의 지지자들은 강이온차이 개념을 바탕으로 환자의 대사성 산-염기 이상을 한결 정확히 평가하는 척도를 마련하고, 나아가 산-염기 이상을 진단하는 유용한 기준을 새롭게 발굴하고자 하였다.[50][143][144] 일부 연구에서는 스튜어트 이론에 기반한 새로운 임상 접근법이 전통적인 방법에 비해 더 바람직한 결과를 낳지 않은 것으로 나타난 반면[145][146], 다른 한 연구는 혈액투석을 통해 염화 이온을 선택적으로 제거함으로써 산혈증을 교정하는 데에 성공했다고 보고해[147] 편집자들로 하여금 “중탄산염 시대의 끝”이 도래한 것이 아닌지 조심스레 질문하게 만들었다.[148]
인체의 방어선은 체액의 pH를 일정하게 유지한다. 전통적인 관점에 따르면, 그 값이 하필 7.4인 까닭은 헨더슨-하셀바흐 방정식에서 와 의 비가 20:1이기 때문이다.[47] 그런데 등수소이온농도 원칙(isohydric principle영어)에 따르면 어떤 완충계에 대해서도 같은 꼴의 수식을 도출할 수 있으므로, HCO3-와 CO2의 농도비가 예컨대 HPO42-와 H2PO4-의 농도비보다 특별히 더 중요하다고 볼 까닭은 없다.[39][42]
:
미국 생리학자 피터 스튜어트는 등의 변수란 반드시 다른 요인에 의해 결정되는 종속변인이라고 강조하며, 독립변수를 중심으로 체액의 산-염기 상태를 이해하자고 제안했다. 온도와 각종 평형 상수를 제외하면 세 가지 독립변수가 있다.[39][42][141][49]
1. 이산화탄소 분압. 전통적인 관점과 같이 호흡계통에 의해 조절된다고 간주된다.
2. 비휘발성 약산 총량. 예컨대 혈중에 HA
3. 강이온차이. 수용액에서 완전히 이온화하는 강한 전해질의 알짜 전하량, 즉 강한 양이온 전하량 총합과 강한 음이온 전하량 총합의 차이로 정의된다. 이들 구경꾼이온은 유입되거나 배출되지 않는 한 농도가 변할 일이 없으니 독립변수 구실을 한다는 것이다. 주로 콩팥에 의해 조절된다.
혈액의 산염기 상태를 바꿀 수 있는 요인은 오로지 이 셋뿐이며, [H+], [OH-], 등은 모두 이들에 의해 결정되는 종속변수이다. 세 독립변수 가운데 앞의 두 가지는 역할을 쉽게 짐작할 수 있다. 이산화탄소 분압이 높아지거나 비휘발성 약산이 더해지면 체액이 산성화될 것이다. 세 번째 독립변수인 강이온차이가 체액의 pH에 영향을 주는 이치는 대강 다음과 같다. 전기 중성 원리(electroneutrality principle영어)에 따르면 혈중 양전하 총합과 음전하 총합은 서로 같아야 한다. 비휘발성 약산을 HA로 뭉뚱그려 생각하면 다음이 성립한다.
:
생리학적인 상황에서 [H+], [OH-], [CO32-]는 매우 작으므로, 근사적으로 다음이 성립한다.[42][141]
:
즉 강이온차이는 중탄산염 완충계와 그 밖의 다른 완충계의 평형에 제약을 부과한다. 이산화탄소 분압과 비휘발성 약산 총량이 일정할 때, 예컨대 HCl과 같은 강산이 유입되어 SID가 감소하면 약한 음이온의 총합은 적어져야만 한다. HCO3-와 A-가 '쥐어짜져서(squeezed)' 적어지면 이들 완충계의 평형 조건에 따라 H+는 늘어나야만 한다. 혈액이 산성이 되는 것은 이처럼 강한 음이온인 Cl-가 SID를 감소시키기 때문이다.[42][50]
스튜어트 접근법은 거센 논쟁의 대상이지만, 적어도 강이온차이 개념은 같은 현상을 바라보는 다른 방법이라고 해석할 수 있다.[51] 용액에 HCl과 같은 강산을 첨가하여 H+와 Cl-로 해리하면, H+는 다른 분자와 반응하여 완충되지만 Cl-는 반응하지 않고 남아 있다. 그러므로 짝염기 Cl-는 강산 HCl이 첨가되었음을 알리는 '발자국(footprint)'이다.[52] 이처럼 강한 음이온과 양이온은 각각 강산과 강염기의 '발자국'이기 때문에[52], 전통적인 관점에서 보면 강이온차이란 첨가된 강산 총량과 강염기 총량의 차이를 반영하는 일종의 대리변수(surrogate variable)이다.[51][53][54] 첨가한 강산과 강염기의 양이 용액의 pH를 결정하는 요인인 것은 당연하므로, 강이온차이가 용액의 pH를 결정하는 독립변수라는 관점은 전통적인 산염기 생리학과 양립 가능하다.[54]
4. 혈액의 완충 작용
혈액의 pH는 화학 완충제, 호흡계, 신장 계통에 의해 7.32에서 7.42 사이로 엄격하게 조절된다.[9][10][11][12][1] 이러한 산-염기 항상성은 세 가지 방어선을 통해 유지된다.
# 화학적 방어: 즉각적으로 pH 변화를 최소화하는 다양한 화학적 완충액으로 구성된다. 중탄산염 완충 시스템, 인산염 완충 시스템, 단백질 완충 시스템이 이에 해당한다.[7]
# 호흡기 방어: 과호흡 또는 저호흡을 통해 호흡 속도와 깊이를 조절하여 탄산 (H2CO3) 농도를 조절한다. 이를 통해 혈장 내 이산화 탄소 (및 탄산)를 배출하거나 유지한다.[5][19]
# 대사 방어: 신장 계통에 의존하며, 중탄산염 이온 (HCO3-)을 세포외액에 추가하거나 제거하여 염기 과잉을 조절한다. 중탄산염 이온은 대사 탄산에서 파생되며, 신세뇨관 세포에서 효소적으로 탄산으로 전환된다. 탄산은 수소 이온과 중탄산염 이온으로 해리된다.[5] 세포외액의 pH에 따라 수소 이온 또는 중탄산염 이온이 소변으로 배설되거나 혈장으로 분비되어 혈장 pH가 조절된다.[17]
이러한 방어 기전에서 두 번째와 세 번째 방어선은 완충액을 통해 작동하며, 각 완충액은 약산과 그 짝염기의 두 가지 성분으로 구성된다.[5][9] 용액의 pH는 약산과 그 짝염기의 농도 비율에 따라 결정된다.[15] 따라서 약산과 짝염기의 농도를 조작하여 세포외액 (ECF)의 pH를 조절할 수 있다. 탄산-중탄산염 완충제는 세포외액에서 가장 풍부하며, 산과 염기의 비율을 빠르고 쉽게 변경할 수 있다.[14]
수용액 완충 용액은 과도한 H+ 이온 또는 OH- 이온을 흡수하여 강산 또는 강염기와 반응하여 강산과 염기를 약산과 약염기로 대체한다.[9] 이는 pH 변화의 영향을 완화하는 효과가 있다. 그러나 완충제는 용액의 비정상적인 pH 수준을 보정할 수는 없다. 완충제는 일반적으로 용액 내에 약산과 약염기, 두 종류의 화합물로 구성된다.[9] 세포외액에서 가장 풍부한 완충제는 탄산(H2CO3)과 중탄산염(HCO3-) 염 용액(주로 나트륨(Na+) 염)으로 구성된다.[5] 과도한 OH- 이온은 탄산에 의해 ''부분적으로'' 중화되어 H2O와 중탄산염(HCO3-) 이온을 형성한다.[5][14] 과도한 H+ 이온은 중탄산염 성분에 의해 ''부분적으로'' 중화되어 탄산(H2CO3)을 형성하는데, 이는 약산이기 때문에 주로 해리되지 않은 형태로 남아 H+ 이온 방출량이 적다.[5]
완충 용액의 pH는 약산과 약염기의 몰 질량 농도의 ''비율''에만 의존한다. 약산의 농도가 높을수록(약염기에 비해) pH는 낮아지고, 약염기가 우세하면 pH가 높아진다. 세포외액의 pH가 7.4일 때 탄산 대 중탄산염 이온의 비율은 1:20이다.[15]
4. 1. 산·염기와 완충용액의 화학
화학이 발전하면서 산과 염기에 대한 정의도 여러 차례 바뀌었다. 19세기에 스반테 아레니우스는 수용액에서 해리하여 수소 이온을 내놓는 물질을 산, 수산화 이온을 내놓는 물질을 염기라고 정의했다. (아레니우스 산·염기 정의)[39] 이후 수소 이온을 주고받는 관계에 주목한 브뢴스테드-로우리 산염기 이론, 전자쌍 개념을 바탕으로 더 일반화한 루이스 산염기 이론 등이 등장했다.[39] 그러나 생체 내에서는 대부분의 산-염기 반응이 수용액에서 일어나고, 루이스 산염기 정의가 포괄하는 예외적인 경우는 거의 발생하지 않기 때문에, 생리학·의학에서는 여전히 브뢴스테드-로우리 등 전통적인 산·염기 정의가 유용하게 쓰인다.[26][39][55][56]
브뢴스테드-로우리 정의에 따르면, 혈액이 수소 이온 농도 변화에 저항하는 원리를 설명하는 데 중요한 화학 개념은 완충 용액이다. 완충 용액은 수소 이온과 가역적으로 결합하는 물질로 이루어진 용액을 말한다.[26][57]
:
이 용액에 강산 HA를 첨가하면 H+와 A-로 이온화하는데, 해리된 수소 이온 중 일부는 B(n)과 결합하여 HB(n+1)이 되므로 pH 변화가 완화된다. 이것이 완충 작용이다.
:
완충 작용의 정도를 나타내는 척도로는 완충용량이 흔히 쓰인다. 완충용량은 용액의 pH를 1 올리기 위해 첨가해야 하는 강염기의 양, 또는 pH를 1 낮추기 위해 필요한 강산의 양으로 정의된다. 완충 작용이 많이 일어날수록 pH를 같은 만큼 변화시키기 위해 강산·강염기를 더 많이 첨가해야 하므로 완충용량이 크다.[57]
완충용량은 여러 요인에 영향을 받는데, 그 중 하나는 각 화학종의 농도이다. 질량작용의 법칙에 따르면 화학 평형 상태에서 다음 식의 값은 온도에만 의존하는 상수이며, 이를 산 해리 상수라고 부른다.
:
생리학적인 상황에서 [H+], [OH-]는 나노몰 단위이다. [HB(n+1)], [B(n)]이 이보다 충분히 크기만 하면, 농도가 같은 만큼 변하더라도 상대적인 변화율은 HB(n+1), B(n)의 경우가 H+보다 훨씬 작다. [HB(n+1)]과 [B(n)]을 변화시키기가 [H+]를 변화시키기보다 훨씬 쉬우므로, 강산을 첨가하여 생긴 H+는 대부분 B(n)과 결합하여 제거된다. 따라서 HB(n+1) 및 B(n)이 많을수록 완충용량도 커진다.[57] 정량적으로 보면 완충용량은 HB(n+1), B(n)의 총량에 비례하며, 총량이 일정하면 두 화학종의 농도비가 1:1일 때 완충용량이 최대가 된다. 산 해리 상수의 식을 참고하면 이는 [H+] = Ka일 때와 같다. 즉, pKa = -logKa라고 정의하면, pH가 pKa와 같을 때 완충용량이 최대가 된다.[38][57]
4. 2. 중탄산염 완충계
중탄산염 완충계는 ― 쌍으로 이루어진 세포외액의 중요한 완충계이다. 세포외액에는 가 많지 않고, p''K''a 값도 혈액의 정상 pH와 차이가 있어 와 의 농도 비는 보통 1:20이다. 그럼에도 중탄산염 완충계가 중요한 역할을 하는 이유는 열린 계이기 때문이다. 가 를 제거하여 가 만들어지면, 혈액에 남지 않고 이산화 탄소가 되어 날숨으로 배출된다. 혈액이 알칼리화될 때도 호흡을 통해 가 쉽게 공급된다.[58] 이산화탄소 농도가 외부 공기와 항상 평형을 이루기 때문에 중탄산염 완충계의 완충 능력은 닫힌 계에 비해 수십 배 증폭된다.[59]물과 이산화탄소가 탄산을 만드는 반응 및 그 역반응은 탄산무수화효소 없이는 매우 느리다.[58] 사람 몸에서 탄산무수화효소는 적혈구 세포질 등 특정 부위에 풍부하게 존재한다. 조직에서 세포 대사의 산물로 만들어진 이산화탄소는 확산을 통해 적혈구 세포질로 유입되어 탄산무수화효소의 작용으로 탄산이 된다. 이산화탄소가 소모되어 세포 안팎의 이산화탄소 농도 기울기가 커지면서 확산이 활발해진다. 반대로 이산화탄소가 적은 허파에서는 탄산무수화효소의 촉매 작용으로 탄산이 이산화탄소가 되어 날숨으로 배출된다. 적혈구는 '이산화탄소 싱크(sink)' 역할을 하며 조직과 허파 사이에서 이산화탄소를 운반한다.[38]
4. 3. 다른 완충계
인산염 완충계는 세포내액 및 세뇨관을 흐르는 액체 속에서 중요한 역할을 한다. 인산염 완충계는 ― 쌍으로 이루어져 있으며, p''K''a 값은 6.8이다. 이는 혈액의 정상 pH인 7.4에 가깝지만, 세포외액에서의 농도는 낮아 중탄산염 완충계에 비해 완충 능력이 약하다. 그러나 세포내액과 세뇨관에서는 인산염 농도가 높고 pH가 낮아 인산염 완충계의 p''K''a 값에 더 가깝기 때문에 중요한 역할을 수행한다.[58]단백질은 세포 내에 풍부하게 존재하여 뛰어난 완충 능력을 제공한다. 체액 완충 용량의 60-70%는 세포 내 단백질에 의한 것이다. 적혈구의 헤모글로빈은 세포 내 완충 작용에 기여하는 대표적인 단백질이다.[58] 헤모글로빈의 완충 작용은 적혈구 내 pH 변화를 완화시킨다.[38]
알부민은 아미노산 곁사슬이 많이 있는 고분자 물질로, 다양한 해리 가능한 잔기를 가지고 있다. 특히 히스티딘 이미다졸 잔기 덕분에 완충 작용을 나타내며, pH에 따라 수소 이온을 주고받는다.[141][62]
4. 4. 모형: 데이븐포트 그림과 염기과잉
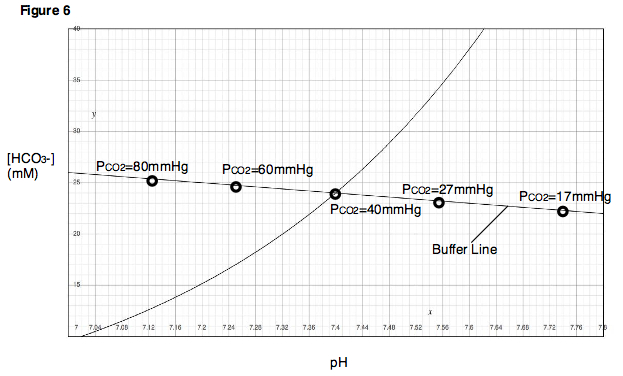
여러 완충계가 함께 있는 혈액에서 완충 작용이 어떻게 일어나는지 이론적으로 따지기란 까다롭다. 헨더슨-하셀바흐 방정식에는 pH, , 등 세 가지 미지수가 있는데, 가 상수라고 해도 pH와 값은 다양하게 정해질 수 있다.[48] 이 다양한 조합 중 체액의 산-염기 상태를 결정하는 요인을 알기 위해서는 비-중탄산염 완충계의 평형 조건을 모두 연립하여 pH와 의 관계식을 도출해야 한다.[48] 가로축에 pH, 세로축에 농도를 나타낸 데이븐포트 그림(Davenport diagram영어)[48] 또는 산-염기 계산도표(acid-base nomogram영어)[84][87]를 활용하면 이 과정을 쉽게 이해할 수 있다.
헨더슨-하셀바흐 방정식을 변형하면 다음과 같다.
:
가 일정할 때 가능한 pH― 값의 조합들을 데이븐포트 그림에 나타내면 지수함수 꼴의 곡선을 이룬다. 이를 이산화 탄소 등치선(isopleth)이라고 부른다. 이산화탄소 분압이 일정하게 유지되는 한, 체액의 산-염기 상태가 어떻게 변동하든지 데이븐포트 그림에서는 이산화 탄소 등치선을 따른 이동으로 나타난다. 이산화탄소 분압이 변화하면 이산화 탄소 등치선 자체가 이동한다. 즉 값마다 등치선이 한 종류씩 존재한다.[48]
한편 비-중탄산염 완충계의 평형 조건 역시 데이븐포트 그림에서 어떠한 곡선으로 나타내어지는데, 이를 완충선(buffer line)이라고 부른다.[63] 이산화 탄소 등치선이 가 일정하게 유지되는 경우를 나타내는 것과 정반대로, 완충선은 오로지 이산화 탄소 분압만이 변화하는 경우를 나타낸다고 이해할 수 있다. 이산화 탄소 이외에 다른 물질이 출입하지 않는다면, 중탄산염 완충계 말고는 영향을 받을 이유가 없으니 평형 조건 역시 동일할 것이기 때문이다. 따라서 이산화 탄소 분압만을 다양하게 변화시켜 가며 혈액의 pH 및 농도가 어떻게 달라지는지 관찰하여 도표에 나타내면 이것이 바로 완충선이 된다. 이런 까닭에 완충선을 이산화 탄소 평형화 곡선(CO2영어 equilibration curve)이라고도 부른다.[134]
다른 물질의 출입 없이 이산화 탄소 분압만 변화하는 경우 완충염기(buffer base영어, BB)의 총량이 일정하게 유지된다.[134][64][65] 완충염기란 혈액에 산이 유입되었을 때 완충할 수 있는 짝염기를 통틀어 가리키는 말로, 혈중에 중탄산염 완충계 이외에 HA― 완충계만 있다고 가정하면 다음처럼 계산된다.[66]
:
스튜어트 접근법을 이용하면 이 값이 일정한 까닭을 쉽게 이해할 수 있는데, 앞서 설명했듯이 전기 중성 원리에 따르면 이 값은 근사적으로 강이온차이(SID)와 같다.[141] 물질 출입이 없다면 SID가 변할 일도 없으므로 BB의 값도 일정할 수밖에 없다. 따라서 완충선을 BB 또는 SID에 대한 등치선으로 이해할 수 있다. 이 조건으로부터 완충선의 수식을 이끌어내려면 를 pH에 대해 나타내어야 하는데, 실제로는 갖가지 다른 완충계가 함께 있을 것이므로 까다롭다. 완충선을 구하는 가장 정확한 방법은 실제로 환자의 혈액 표본을 채취하여 이산화 탄소 평형화(CO2영어 equilibration)를 통해 경험적으로 결정하는 것이지만[48][63], 이 역시 매우 번거로운 일이다. 따라서 임상에서는 와 pH의 관계에 대한 경험적 관찰을 활용하여 완충선의 식을 추정하곤 한다.[66]
혈중 비-중탄산염 완충계의 총 완충용량 β는 생리학적인 pH 범위에서 상당히 일정한 것으로 관찰된다.[48] pH 7.4, 24 mEq/L, 40 mmHg인 정상 상태와 비교하여 , , 의 변화량을 각각 , , 라고 하면
:
인데, β가 일정하다면
:
이다. 물질 출입 없이 이산화 탄소 분압만 변화하는 경우 이라고 하였으므로, 결국 다음을 얻는다.
:
이것이 pH 7.4, 24 mEq/L인 지점을 지나는 완충선의 수식이다. 한편 혈액에 비휘발성 산이나 염기가 더해지면 BB 및 SID의 값이 달라지므로 이라고 놓을 수 없고, 따라서 완충선 자체가 다음처럼 변경된다.[134][65]
:
이때 완충염기 BB의 값이 정상에서 벗어난 정도를 가리키는 를 염기과잉(base excess영어, BE)으로 정의한다.[66]
:
이것이 일반적인 완충선의 식이다. 혈액 표본에서 pH와 를 측정하면 완충선 위의 한 점을 구할 수 있으므로, 기울기 β와 절편 BE 중 하나를 알면 완충선이 결정된다. 혈중 완충계의 조성을 바탕으로 β를 경험적으로 추정하는 것이 보통인데, 헤모글로빈 농도를 중요한 변인으로 간주하는 이른바 반 슬라이크 방정식(van Slyke equation)이 흔히 이용된다.[134][67]
:
체액의 산-염기 상태는 데이븐포트 그림에서 이산화 탄소 등치선과 완충선이 만나는 지점으로 정해진다. 환기가 잦아서 이산화탄소 분압이 낮으면 이산화 탄소 등치선이 오른쪽으로 이동하고, 환기가 뜸해서 이산화탄소 분압이 높으면 등치선이 왼쪽으로 이동한다. 한편 혈액에 비휘발성 산을 첨가하면 완충선이 아래로 내려가고 염기를 첨가하면 완충선이 위로 올라간다.[63] 이산화 탄소 등치선 및 완충선의 위치가 정상에서 벗어난 정도를 살핌으로써 체액의 산-염기 상태를 따질 수 있다.[86] 물론 이는 혈액의 화학적 완충 작용만 감안한 것이다. 예컨대 이산화 탄소 분압이 낮은 상황에서 완충선이 아래로 이동하였다면, 비휘발성 산이 유입되었기 때문인지 아니면 이산화 탄소 분압 변동에 대한 콩팥 보상 때문인지 알 수 없다. 이처럼 데이븐포트 그림에서 드러난 산-염기 변동이 정상적인 보상 반응인지 아니면 병적인 상황인지는 추가적인 판단이 필요하다.[86]
5. 호흡계통의 역할
호흡계통은 환기를 통해 조직에서 끊임없이 만들어지는 이산화탄소를 제거한다. 대사와 환기의 균형은 혈액의 이산화탄소 기체 분압을 결정한다. 대사가 활발해져 이산화탄소가 많이 생성되면 이산화탄소 기체 분압이 증가하고, 반대로 호흡이 가빠져 환기로 이산화탄소를 빨리 제거하면 분압이 감소한다.[68] 그런데 호흡수는 이산화탄소 기체 분압에 반응하여 조절된다. 대사가 활발해지면 환기도 덩달아 빨라지므로 조직에 이산화탄소가 쌓이지 않고 그대로 제거된다.[69] 이러한 음성 되먹임에 의해 이산화탄소 기체 분압이 일정하게 유지되므로 혈액의 중탄산염 완충계를 일정 압력의 기체와 평형을 이루는 열린 계로 간주할 수 있고, 탄산으로 대사되는 각종 유기산을 휘발성 산이라 부를 수 있다.
한편 호흡수는 혈중 수소 이온(H⁺) 농도에 의해서도 조절된다. 세포 대사로 이산화탄소가 많이 생산되면 탄산의 해리 반응에 의해 H⁺ 역시 많아지므로, H⁺ 농도에 의한 환기 조절은 이산화탄소 분압의 균형을 이루는 데에 기여한다. 그런데 H⁺ 농도는 다른 산·염기에 의해서도 변한다. 산을 섭취하여 H⁺가 많아지면, 설령 대사량이 이전과 똑같더라도 호흡수가 증가하여 이산화탄소를 더 빠르게 제거한다. 혈중 이산화탄소 기체 분압이 감소하므로 H⁺ 농도도 감소한다. 반대로 염기를 섭취하여 H⁺가 적어지면 호흡이 느려져 이산화탄소 분압이 상승하고 H⁺도 다시 많아진다. 이처럼 호흡계통은 혈중 H⁺ 농도에 반응하여 환기를 통한 이산화탄소 제거 속도를 조절함으로써, 혈액의 완충계에 이어 사람의 산-염기 항상성을 유지하는 제2방어선 역할을 한다.[68]
호흡을 조절하여 H⁺ 농도를 되돌리는 데에는 한계가 있다. 호흡보상의 효율은 보통 50-75% 정도라고 보는데, 이를테면 산혈증으로 pH가 7.4에서 7.0으로 떨어지면 호흡을 빨리 해서 pH를 7.2-7.3 정도까지는 되돌릴 수 있다는 것이다. 알칼리혈증에 대한 호흡보상은 덜 효과적이다. 환기는 이산화탄소를 제거할 뿐만 아니라 산소를 공급하는 역할도 하기 때문에, 호흡이 가빠지기는 쉬워도 너무 느려져서는 위험하다. 따라서 pH가 증가하더라도 호흡수는 많이 감소하지 않는다.[68]
혈중 이산화탄소 기체 분압 및 H⁺ 농도를 감지하여 호흡계통에 전달하는 것은 주로 호흡 중추의 화학감수성영역(chemosensitive area영어)이다. 숨뇌의 배쪽 표면 가까이에 좌우 각 한 무리씩 신경 세포가 모여 있어, H⁺ 농도에 민감하게 반응하여 호흡 중추의 나머지 부위를 자극한다. 실제로 혈액에서 화학감수성영역을 더 효과적으로 자극하는 것은 H⁺가 아니라 오히려 이산화탄소인데, 수소 이온은 혈액뇌장벽을 쉽게 넘나들지 못하는 반면 이산화탄소 기체는 자유롭게 확산하기 때문이다. 한편 목동맥토리·대동맥토리 등에 있는 말초 화학수용기도 부수적인 역할을 한다. 주로 산소 농도를 감지하는 데에 관여하지만 이산화탄소 및 H⁺에도 반응하여 호흡 중추로 신호를 전달한다. 호흡을 조절하는 효과는 중추 화학감수성영역이 말초 화학수용기보다 훨씬 크지만, 빠르기로 따지면 말초 화학수용기의 반응이 다섯 배나 빠르다. 따라서 갑자기 운동을 시작할 때처럼 이산화탄소 분압이 급격하게 변할 때 기민하게 대응하도록 돕는 것으로 보인다.[68]
항상성 조절은 몇 초 안에 이산화탄소 분압 (''P''CO2)를, 따라서 동맥 혈장의 pH를 변화시킬 수 있다.[5] 동맥 혈액의 이산화탄소 분압은 숨뇌의 중추 화학수용체에 의해 모니터링된다.[5][16] 이 화학수용체는 뇌척수액의 이산화탄소 농도와 pH에 민감하다.[15][17][16]
중추 화학수용체는 정보를 뇌간의 숨뇌와 교뇌에 있는 호흡 중추로 보낸다.[17] 호흡 중추는 동맥 혈액의 ''P''CO2를 일정하게 유지하기 위해 폐포의 평균 환기율을 결정한다. 호흡 중추는 운동 신경을 통해 그렇게 하며, 이 신경은 호흡근 (특히, 가로막)을 활성화한다.[5][18] 동맥 혈장 내 ''P''CO2가 5.3kPa 이상으로 상승하면 반사적으로 호흡의 속도와 깊이가 증가한다. 이산화탄소 분압이 5.3 kPa로 돌아오면 정상 호흡이 재개된다.[19] 이산화탄소 분압이 정상 범위를 벗어나 감소하면 반대 현상이 일어난다. 일시적으로 호흡이 중단되거나 느려져 폐와 동맥 혈액에 이산화탄소가 다시 축적될 수 있다.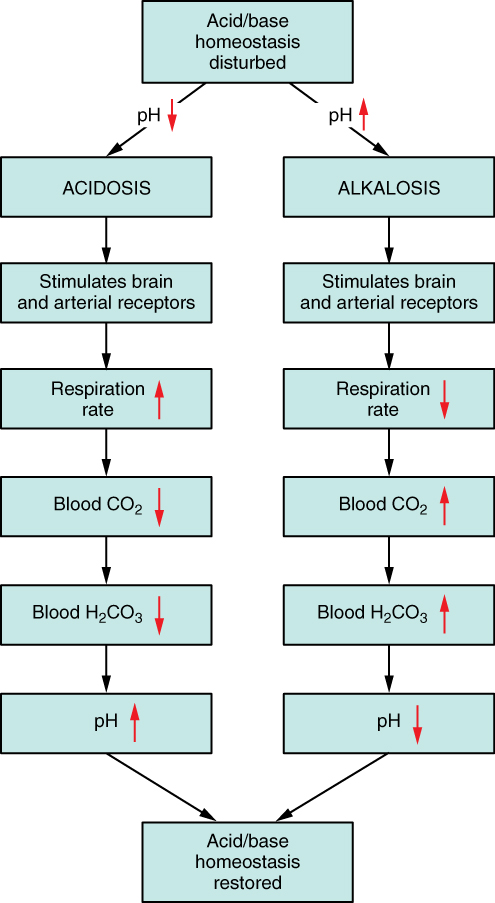
6. 콩팥의 역할
콩팥은 오줌의 조성을 조절함으로써 산-염기 항상성을 유지한다. 산성 소변이 배설되면 체액에서 산이 제거되고, 염기성 소변이 배설되면 체액에서 염기가 제거된다. 보통 사람은 하루에 70-80 mEq 정도의 비휘발성 산을 섭취하는데, 호흡으로 제거하지 못하니 소변으로 내보내야 한다. 콩팥은 산성 소변을 내보내 하루에 70-80 mEq만큼 산을 제거함으로써 균형을 맞춘다. 또한 산혈증이 있으면 소변을 더욱 산성화하고, 반대로 알칼리혈증이 있으면 덜 산성화하거나 심지어 알칼리화하는 콩팥보상을 통해 혈액의 수소 이온 농도를 정상으로 되돌린다.[36][70]
콩팥이 소변의 산염기 상태를 조절하는 주된 분자 기제는 수소 이온 분비이다.[36][70] 토리에서 갓 여과한 액체는 혈액과 거의 조성이 비슷하여 중탄산염 농도가 약 24 mEq/L인 염기성 용액이다. 토리거름률이 정상이면 혈액이 하루에 약 180 L 걸러지므로, 중탄산염은 하루에 약 4320 mEq 여과된다. 수소 이온(H+)을 그보다 많이 분비하면 알짜로 산을 배출하는 것이고, 그보다 적게 분비하면 염기를 잃어버리게 된다. 평상시에 산-염기 균형을 유지하려면 산 80 mEq를 배출해야 하니, H+를 하루에 약 4400 mEq 분비하여야 한다. 이때 H+ 4320 mEq만큼은 중탄산염을 적정하므로 소변 pH를 크게 변화시키지 않지만, 나머지 80 mEq는 만일 완충되지 않으면 pH를 급격하게 떨어뜨린다.[70] 소변 1.5 L에 H+가 80 mEq 있으면 pH로는 1.3 정도에 해당한다.[36] 그런데 소변이 너무 산성이면 H+가 세뇨관 밖으로 확산하기 시작하기 때문에 소변의 pH는 4.5 미만으로 떨어지기 어렵다.
소변에는 인산염 등 완충계가 있어, 소변으로 분비한 H+는 수용액 속을 자유롭게 돌아다니는 것이 아니라 예컨대 HPO42-와 결합하여 H2PO4-로 있다. 이로써 pH를 심하게 낮추지 않으면서 산을 다량 배설할 수 있다.[70] 소변 속 완충계의 완충 능력은 각 완충계의 농도와 p''K''a 값, 그리고 소변의 pH에 따라서 달라진다. 인산염 완충계의 p''K'' 값은 6.8이므로, pH 7.4인 혈액에서는 20%가량이 HPO42-로 있는 반면, pH 6.2에서는 80%가 HPO42-로 존재한다. 즉 소변의 pH가 6.2가 될 때까지 H+를 분비하면 인산염의 60%를 적정하게 된다. 소변을 더 산성화하면 p''K''a 값이 더 낮은 요산염과 크레아티닌이 주로 수소 이온을 적정하는 역할을 한다.[36][70]
암모늄은 콩팥에서 중요한 완충 작용을 한다. 세뇨관 벽 세포가 글루타민을 α-케토글루타르산으로 대사할 때 암모늄이 생성되어 소변으로 확산해 나가거나 능동수송으로 분비된다.[70] 이를 암모니아생성(ammoniagenesis영어)이라고 한다. 글루타민은 가장 흔한 비필수 아미노산으로 각종 음식에 풍부하게 들어 있다. 암모니아생성은 필요에 따라 탄력적으로 조절되어 산 제거에 크게 기여할 수 있다.[71]
콩팥의 산염기 조절을 정량적으로 분석하는 지표는 알짜산배설량(net acid excretion영어, NAE)으로, 다음처럼 계산된다.
:
여기서 (NH4+)와 ( HCO3- )는 각각 소변을 통한 암모늄과 중탄산염의 배설량을 가리킨다. 암모늄을 배설할수록 산을 제거하는 것이고, 중탄산염을 배설할수록 염기를 잃어버리는 셈이다. 한편 TA는 적정산도(titratable acidity영어)로, 암모늄과 중탄산염 이외의 다른 완충계가 적정한 산의 양을 가리킨다. 소변의 pH가 7.4가 될 때까지 첨가해 주어야 하는 강염기의 양으로 측정할 수 있다. 평상시에 콩팥은 중탄산염을 대부분 재흡수하여 배설량은 0에 가깝다. 나머지 두 항인 적정산도와 암모늄 배설량은 항상성을 유지하기 위해 제거하여야 하는 산 80 mEq를 대략 40 mEq씩 나누어 맡는다.[70] 그런데 산혈증이 있어서 산을 더 많이 제거해야 하는 경우, 인산염 등은 여과되는 양 자체에 한계가 있으므로 적정산도가 크게 증가하기는 어렵다. 반면 암모늄 분비는 탄력적으로 조절되어 많게는 하루에 500 mEq까지도 늘어날 수 있다. 따라서 만성 산혈증 상황에서는 암모늄 분비가 콩팥의 산 제거에서 가장 큰 비중을 차지한다. 반대로 알칼리혈증이 있으면 암모늄 분비가 0에 가까워지고 중탄산염 분비가 늘어나 NAE가 음수가 되므로 알짜로 염기가 제거된다.[70][73]
6. 1. 중탄산염 중심 해석
콩팥은 오줌의 조성을 조절하여 산-염기 항상성을 유지하며, 콩팥의 산염기 조절 작용은 수소 이온 배설, 중탄산염 재흡수, 중탄산염 생성으로 나누어 설명할 수 있다. 이들은 모두 수소 이온 분비라는 한 가지 기제에서 비롯한다.[70]토리에서 갓 여과된 액체는 혈액과 조성이 비슷하여 중탄산염 농도가 약 24 mEq/L인 염기성 용액이다. 토리거름률이 정상이면 혈액이 하루에 약 180 L 걸러지므로, 중탄산염은 하루에 약 4320 mEq 여과된다. 수소 이온(H+)을 그보다 많이 분비하면 알짜로 산을 배출하는 것이고, 그보다 적게 분비하면 염기를 잃어버리게 된다. 평상시에 산-염기 균형을 유지하려면 산 80 mEq를 배출해야 하니, H+를 하루에 약 4400 mEq 분비하여야 한다. 이때 H+ 4320 mEq만큼은 중탄산염을 적정하므로 소변 pH를 크게 변화시키지 않지만, 나머지 80 mEq는 만일 완충되지 않으면 pH를 급격하게 떨어뜨린다.[70]
세뇨관 벽 세포로는 이산화탄소가 자유롭게 확산해 들어올 수 있으며, 이산화탄소가 용해하여 된 탄산(H2CO3)은 세포 안의 탄산무수화효소에 의해 중탄산염(HCO3-)과 H+로 해리한다. H+를 세포 밖으로 분비해 없앨수록 반응의 평형이 치우치므로, HCO3-도 많이 만들어져 세포 바닥면의 통로를 통해 확산하여 나간다. 따라서 H+를 하나 분비할 때마다 중탄산염을 하나씩 얻는다. 분비한 H+가 소변의 중탄산염을 적정하는 데 쓰이면 결과적으로는 소변에서 혈액으로 중탄산염을 재흡수하는 셈이다. 한편 다른 완충계가 수소 이온을 흡수하는 경우, 소변의 중탄산염은 변하지 않았는데 혈액에만 중탄산염이 많아지므로 중탄산염 생성이라고 보는 것이다.[70]
6. 2. 암모니아 생성의 역할
콩팥에서 글루타민이 α-케토글루타르산으로 대사될 때 암모늄 (NH4+)이 생성된다. 이 과정을 암모니아생성(ammoniagenesis영어)이라고 한다. 글루타민은 비필수 아미노산으로 여러 음식에 풍부하게 들어있어, 필요에 따라 암모니아생성을 조절하여 산 제거에 기여한다.[71]
암모니아-암모늄의 p''K''a 값은 9.2로 매우 높아, 혈액과 소변에는 대부분 암모늄만 존재한다. 암모늄이 어떻게 산 제거에 기여하는지에 대해서는 여러 가지 설명이 있다.[72][73]
전통적인 설명은 콩팥에서 만들어진 암모니아가 소변으로 확산되어 나가고, 소변이 혈액보다 산성이므로 암모니아가 즉시 암모늄이 된다는 것이다. 암모늄은 세뇨관 벽을 통과하기 어려워 소변에 갇히고, 결과적으로 수소 이온이 배설되는 효과가 있다.[72][70][73]
:
하지만 암모니아-암모늄의 p''K''a는 9.2로 높아 완충 능력이 거의 없고, 콩팥에서 만들어지는 것은 암모니아 기체가 아니라 암모늄 이온이다. 다른 설명은 암모늄과 함께 만들어지는 중탄산염(
또 다른 견해는 간의 역할을 강조한다. 간에서 아미노산이 분해되면 탄산수소 이온과 암모늄 이온이 만들어진다. 콩팥에서는 암모늄이 몸 밖으로 분비된다는 점이 간과 다르다. 분비되지 않은 암모늄은 요소로 대사될 때
:
따라서 콩팥 암모니아생성은
6. 3. 조절
콩팥은 오줌의 조성을 조절하여 산-염기 항상성을 유지한다. 산성 소변이 배설되면 체액에서 산이, 염기성 소변이 배설되면 염기가 제거된다. 콩팥은 산성 소변을 배설하여 하루에 70-80 mEq만큼 산을 제거함으로써 균형을 맞춘다. 또한 콩팥보상을 통해 혈액의 수소 이온 농도를 정상으로 되돌린다.[36][70]콩팥이 소변의 산염기 상태를 조절하는 주된 분자 기제는 수소 이온 분비이다.[36][70] 토리에서 갓 여과한 액체는 혈액과 거의 조성이 비슷하며, 중탄산염 농도가 약 24 mEq/L인 염기성 용액이다. 토리거름률이 정상이면 혈액이 하루에 약 180 L 걸러지므로, 중탄산염은 하루에 약 4320 mEq 여과된다. 수소 이온(H+)을 그보다 많이 분비하면 산을 배출하는 것이고, 그보다 적게 분비하면 염기를 잃어버리게 된다. 평상시 산-염기 균형을 유지하려면 산 80 mEq를 배출해야 하니, H+를 하루에 약 4400 mEq 분비하여야 한다. 이때 H+ 4320 mEq만큼은 중탄산염을 적정하므로 소변 pH를 크게 변화시키지 않지만, 나머지 80 mEq는 만일 완충되지 않으면 pH를 급격하게 떨어뜨린다.[70] 소변 1.5 L에 H+가 80 mEq 있으면 pH로는 1.3 정도에 해당한다.[36] 그런데 소변이 너무 산성이면 H+가 세뇨관 밖으로 확산하기 시작하기 때문에 소변의 pH는 4.5 미만으로 떨어지기 어렵다. 실제로 소변에는 인산염 등 완충계가 있어, 소변으로 분비한 H+는 수용액 속을 자유롭게 돌아다니는 것이 아니라 인산염과 결합하여 존재한다. 이로써 pH를 심하게 낮추지 않으면서 산을 다량 배설할 수 있다.[70]
소변 속 완충계의 완충 능력은 각 완충계의 농도와 p''K''a 값, 그리고 소변의 pH에 따라서 달라진다. 인산염 완충계의 p''K'' 값은 6.8이므로, pH 7.4인 혈액에서는 20%가량이 HPO42-로 있는 반면, pH 6.2에서는 80%가 HPO42-로 존재한다. 소변을 더 산성화하면 p''K''a 값이 더 낮은 요산염과 크레아티닌이 주로 수소 이온을 적정하는 역할을 한다.[36][70]
또다른 중요한 성분은 암모늄이다. 세뇨관 벽 세포가 글루타민을 α-케토글루타르산으로 대사할 때 생성되어 소변으로 확산해 나가거나 능동수송으로 분비된다.[70] 이를 암모니아생성(ammoniagenesis영어)이라고 한다. 글루타민은 가장 흔한 비필수 아미노산으로 각종 음식에 풍부하게 들어 있다. 암모니아생성은 필요에 따라 탄력적으로 조절되어 산 제거에 크게 기여할 수 있다.[71]
콩팥의 산염기 조절을 정량적으로 분석하는 지표는 알짜산배설량(net acid excretion영어, NAE)으로, 다음처럼 계산된다.
:
여기서 (NH4+)와 ( HCO3- )는 각각 소변을 통한 암모늄과 중탄산염의 배설량을 가리킨다. 암모늄을 배설할수록 산을 제거하는 것이고, 중탄산염을 배설할수록 염기를 잃어버리는 셈이다. 한편 TA는 적정산도(titratable acidity영어)로, 암모늄과 중탄산염 이외의 다른 완충계가 적정한 산의 양을 가리킨다. 소변의 pH가 7.4가 될 때까지 첨가해 주어야 하는 강염기의 양으로 측정할 수 있다. 평상시에 콩팥은 중탄산염을 대부분 재흡수하여 배설량은 0에 가깝다. 나머지 두 항인 적정산도와 암모늄 배설량은 항상성을 유지하기 위해 제거하여야 하는 산 80 mEq를 대략 40 mEq씩 나누어 맡는다.[70] 그런데 산혈증이 있어서 산을 더 많이 제거해야 하는 경우, 인산염 등은 여과되는 양 자체에 한계가 있으므로 적정산도가 크게 증가하기는 어렵다. 반면 암모늄 분비는 탄력적으로 조절되어 많게는 하루에 500 mEq까지도 늘어날 수 있다. 따라서 만성 산혈증 상황에서는 암모늄 분비가 콩팥의 산 제거에서 가장 큰 비중을 차지한다. 반대로 알칼리혈증이 있으면 암모늄 분비가 0에 가까워지고 중탄산염 분비가 늘어나 NAE가 음수가 되므로 알짜로 염기가 제거된다.[70][73]
콩팥은 체액의 산염기 상태에 따라 오줌의 조성을 조절함으로써 산염기 변동을 되돌린다. 산혈증이 있으면 H+ 분비 및 암모니아생성을 늘림으로써 산을 많이 제거하고 중탄산염을 많이 만든다. 반대로 알칼리혈증이 있으면 H+ 분비를 줄여 중탄산염이 재흡수되지 않고 그대로 빠져나가도록 하며, 암모늄 역시 분비하지 않는다. 이로써 염기를 제거한다.[74]
토리쪽곱슬세관 세포는 세뇨관 내강을 마주하는 꼭대기면의 수소 이온 운반 단백질 개수, 그리고 반대쪽인 바닥면의 중탄산염 운반 단백질 개수를 조절함으로써 H+ 분비를 늘리거나 줄인다. 토리쪽곱슬세관 세포의 바닥면과 맞닿는 용액의 이산화탄소 분압이 높으면 외포작용이 활발하게 일어나 세포막에 이온 운반 단백질이 많아져 내강으로 H+를 많이 분비하고, 이산화탄소 분압이 낮으면 반대로 운반 단백질이 덜 활성화되어 H+를 적게 분비한다.[75]
토리쪽곱슬세관 세포에서는 산염기 변동에 반응하여 암모니아생성도 조절한다. 세포내액이 산성화되면 암모니아생성에 관여하는 각종 효소의 활성이 증가한다. 미토콘드리아의 글루탐산분해효소가 활성화되면 글루타민이 암모늄과 글루탐산으로 분해되는 반응이 더 활발하게 일어난다. 포스포에놀파이루브산 카르복실레이스(PEPCK) 효소가 활성화되면 포도당신생합성이 촉진되어, 글루탐산 탈아미노화의 산물인 α-케토글루타르산을 포도당으로 전환하는 반응이 더 활발하게 일어난다. 이로써 산혈증 상황에서 암모늄 생성·분비가 촉진된다.[75]
한편 집합세관에는 A형과 B형 사이세포라는 두 종류 세포가 있다. A형 사이세포는 꼭대기면에 양성자 펌프가 있고 바닥면에 Cl--HCO3- 교환체가 있어 내강으로 H+를 분비한다. B형 사이세포는 꼭대기면과 바닥면의 이온 운반 단백질 분포가 이와 반대로 되어 있어 내강으로 HCO3-를 분비한다. 만성 산혈증 상황에서는 A형 사이세포가 늘고 B형 사이세포가 줄어 H+ 분비가 촉진된다. 반대로 만성 알칼리혈증 상황에서는 B형 사이세포가 많아지고 A형 사이세포가 적어져 H+ 분비가 억제되고 오히려 HCO3-가 분비된다.[75]
6. 4. 스튜어트 해석
스튜어트 산-염기 이론에서는 콩팥이 강한 이온의 출입을 조절하여 산-염기 항상성에 관여한다고 설명한다.[73][77] 수소 이온(H+)과 탄산수소 이온(HCO3-)은 다른 요인에 의해 농도가 결정되는 종속변인이므로, 콩팥이 이 이온들을 직접 조절하여 산-염기 균형을 유지한다는 설명은 부적절하다.[141]세포막을 가로질러 H+만 이동한다면, H+ 농도 변화 대신 막 전위가 변동할 것이다. 따라서 H+의 이동은 전기적 중성을 위해 다른 이온의 움직임을 동반해야 한다. 막 안팎의 산-염기 상태 변화는 H+ 이동 자체가 아니라, 강한 이온이 H+와 함께 움직여 막 안팎의 강이온차이(SID)를 변화시키기 때문이다.[76]
콩팥은 체액보다 SID가 큰 소변, 혹은 작은 소변을 배출하여 체액의 SID를 조절한다. 강한 양이온을 재흡수하고 강한 음이온을 분비하여 소변 SID를 줄임으로써, 대사나 음식 섭취로 인한 체액 SID 감소에 대응한다.[78] 산혈증과 같은 상황에서는 소변 SID를 키워 체액 pH를 정상으로 되돌린다.[77][79]
세뇨관 벽의 H+ 및 HCO3- 수송 단백질은 직간접적으로 강한 이온을 함께 운반한다.[79] 강한 음이온 없이 나트륨(Na)이나 칼륨(K) 이온을 재흡수하거나, 강한 양이온 없이 염화 이온(Cl)을 분비할 때마다 소변 SID가 감소한다.[73][77] 먼쪽곱슬세뇨관에서 H+ 분비와 Na+ 재흡수는 밀접하게 연관되어 있으며, 소변의 산-염기 상태 변화는 H+와 함께 움직이는 Na+ 때문이다.[80][81]
Na+는 체액 부피, K+는 막 전위 항상성 조절과 관련이 깊으므로, 산-염기 항상성 유지에 가장 중요한 기제는 Cl- 출입 조절로 추측된다.[73][77][82] 암모니아 생성은 암모늄 이온 분비를 통해 Na+ 없이 Cl-만 분비할 수 있게 하므로 중요하다.[79][83]
7. 산-염기 장애
인체는 체액의 pH를 일정하게 유지하기 위해 방어 기전을 작동시킨다. 전통적인 관점에서는 헨더슨-하셀바흐 방정식에서 와 의 비가 20:1이기 때문에 pH가 7.4로 유지된다고 보았다.[47] 그러나 등수소이온농도 원칙(isohydric principle영어)에 따르면 어떤 완충계에 대해서도 같은 꼴의 수식을 도출할 수 있으므로, 와 의 농도비가 와 의 농도비보다 특별히 중요하다고 볼 이유는 없다.[39][42]
:
미국의 생리학자 피터 스튜어트는 등의 변수가 다른 요인에 의해 결정되는 종속변인이라고 강조하며, 독립변수를 중심으로 체액의 산-염기 상태를 이해해야 한다고 주장했다. 온도와 각종 평형 상수를 제외하면 세 가지 독립변수가 존재한다.[39][42][141][49]
# 이산화탄소 분압: 호흡계통에 의해 조절된다.
# 비휘발성 약산 총량: 주로 인산과 혈장 단백질, 특히 알부민이 기여하며, 간에서 조절된다.
# 강이온차이: 강한 전해질의 알짜 전하량으로, 주로 콩팥에서 조절된다.
혈액의 산-염기 상태를 변화시키는 요인은 이 세 가지뿐이며,
:
생리학적인 상황에서
:
로 근사할 수 있다. 즉, 강이온차이는 중탄산염 완충계와 다른 완충계의 평형에 영향을 준다. 예를 들어, HCl과 같은 강산이 유입되어 SID가 감소하면 약한 음이온의 총합이 적어져야 한다. 와 가 줄어들면 평형 조건에 따라 는 늘어나 혈액이 산성화된다. 는 강산 HCl이 첨가되었음을 알리는 '발자국(footprint)' 역할을 한다.[52]
스튜어트 접근법은 논쟁의 대상이지만, 강이온차이 개념은 현상을 다른 시각으로 보는 방법이라고 해석할 수 있다.[51] 강이온차이는 첨가된 강산 총량과 강염기 총량의 차이를 반영하는 대리변수(surrogate variable)이므로,[51][53][54] 전통적인 산-염기 생리학과 양립 가능하다.[54]
산-염기 장애는 원인에 따라 크게 호흡성과 대사성으로 나뉜다. 자세한 내용은 하위 섹션을 참고하라.
1980년대에 캐나다의 생리학자 피터 스튜어트는 중탄산염 중심의 전통적인 접근법에 불만을 느끼고, 산-염기 생리학을 새롭게 이해하는 방법을 고안했다.[140] 독립변수인 이산화탄소 분압 (), 비휘발성 약산 총량 (ATOT), 강이온차이 (SID)의 값이 주어지면 체액의 산-염기 상태는 다음 6가지 방정식에 의해 하나로 결정된다.
# 물의 자동 이온화 반응 (H2O
# 탄산 해리 반응의 평형 조건 ( 헨더슨-하셀바흐 방정식 ): .
# 탄산수소 이온 해리 반응 (
# 비휘발성 약산 (HA)의 해리 반응 (HA
# 비휘발성 약산의 질량 보존 법칙: . (물질 출입에 의해 변하는 상수)
# 전기 중성 원리: .
위의 식을 연립하면 에 대한 사차방정식을 얻고, 수치적으로 풀면 각종 평형 상수 및 , ATOT, SID 값에 따라 가 어떻게 변화하는지 분석할 수 있다.[141][142]
스튜어트 접근법은 지금까지도 논쟁의 대상이다.[39] 임상적 유용성이 주요 쟁점 중 하나인데, 지지자들은 강이온차이 개념을 바탕으로 대사성 산-염기 이상을 더 정확히 평가하고 진단 기준을 발굴하고자 했다.[50][143][144] 스튜어트 이론 기반의 임상 접근법이 전통적인 방법보다 더 나은 결과를 낳지 않았다는 연구도 있지만,[145][146] 혈액투석을 통해 염화 이온을 선택적으로 제거하여 산혈증을 교정했다는 연구는 "중탄산염 시대의 끝"을 조심스럽게 질문하게 만들었다.[147][148]
세포외액, 특히 혈장의 pH는 화학 완충제, 호흡계, 신장에 의해 7.32에서 7.42 사이로 조절된다.[9][10][11][12][1] 태아의 정상 pH는 성인과 다르다. 제대 정맥의 pH는 7.25에서 7.45 사이, 제대 동맥의 pH는 7.18에서 7.38 사이이다.[13]
수용액 완충 용액은 과도한 또는 이온을 흡수하여 강산 또는 강염기와 반응, 약산과 약염기로 대체한다.[9] 이는 pH 변화를 완화한다. 완충제는 용액의 비정상적인 pH를 보정할 수는 없고, 약산과 약염기 두 종류의 화합물로 구성된다.[9] 세포외액에서 가장 풍부한 완충제는 탄산(H2CO3)과 나트륨(Na+)의 중탄산염() 염 용액이다.[5] 이온이 과도하면 탄산은 H2O와 중탄산염() 이온을 형성하여 ''부분적으로'' 중화한다.[5][14] 과도한 H+ 이온은 중탄산염 성분에 의해 ''부분적으로'' 중화되어 탄산(H2CO3)을 형성하며, 약산이므로 주로 해리되지 않은 형태로 남아 H+ 이온 방출량이 적다.[5]
완충 용액의 pH는 약산과 약염기의 몰 질량 농도 ''비율''에만 의존한다. 약산 농도가 높을수록 pH는 낮아지고, 약염기가 우세하면 pH는 높아진다.
탄산-중탄산염 완충제는 이 원리를 이용하여 세포외액의 pH를 ''조절''한다. 약산 대 약염기의 몰 비율이 1:20이면 pH는 7.4가 된다. 세포외액의 pH가 7.4일 때 탄산 대 중탄산염 이온의 비율은 1:20이다.[15]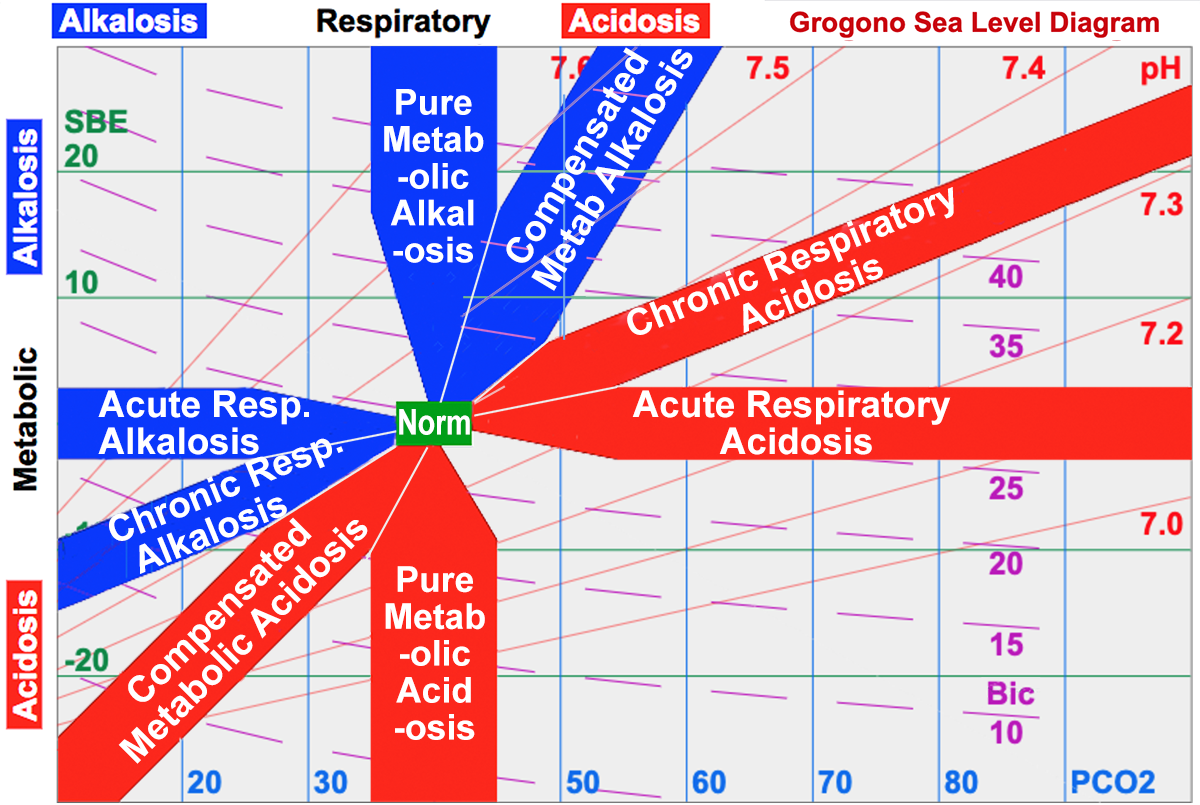
산-염기 불균형은 혈액 pH가 정상 범위(7.32~7.42[10])를 벗어날 때 발생한다. 세포 외액의 낮은 pH는 ''산혈증'', 높은 pH는 ''알칼리혈증''이라고 한다.
''산혈증''과 ''알칼리혈증''은 세포 외액(ECF) pH의 변동을 나타낸다.[24] ''산증''과 ''알칼리증''은 호흡성 또는 대사성 구성 요소의 영향을 나타낸다. ''산증''은 ''산혈증''을 유발하고(알칼리증에 의해 "보상되지 않은" 경우),[24] ''알칼리증''은 ''알칼리혈증''을 유발한다.[24]
전통적인 관점과 스튜어트 관점을 가르는 핵심은 pH를 정상으로 되돌리기 위해 조절되는 독립변수가 SID인지 ATOT인지이다. 시험관에서는 둘 다 조작 가능하지만, 생체에서는 SID는 콩팥으로 빠르게, 알부민 농도는 간으로 느리게 조절된다. 저알부민혈증이 있는데 SID가 정상과 비슷해서 알칼리증인 환자는, 간이 알부민 농도를 잘못 조절한 것이 아니라 콩팥이 보상 작용을 못한 것이다.[98] 일부 스튜어트 이론 지지자는 SID 정상 값이 상황에 따라 달라질 수 있다고 인정한다. 저알부민혈증 등으로 ATOT이 감소하면 SID가 따라 감소해 pH를 일정하게 유지하는 것이 정상이며, 실제 SID가 새로운 정상 값에서 벗어난 정도인 가 대사성 산-염기 장애의 척도이다.[97][98][99] 이 는 코펜하겐 학파의 염기과잉과 같다.[97][98]
비휘발성 약산의 증감이 체액 산-염기 균형에 영향을 미친다는 스튜어트 이론은 간의 알부민 합성 기능을 산-염기 항상성 기제로 보기 어렵더라도, 간 질환의 산-염기 변동 이해에 중요하며,[100][101] 전통적 방식으로 산-염기 장애를 평가해도 알부민 농도를 감안해야 한다.[52][102][103]
7. 1. 병인에 따른 분류
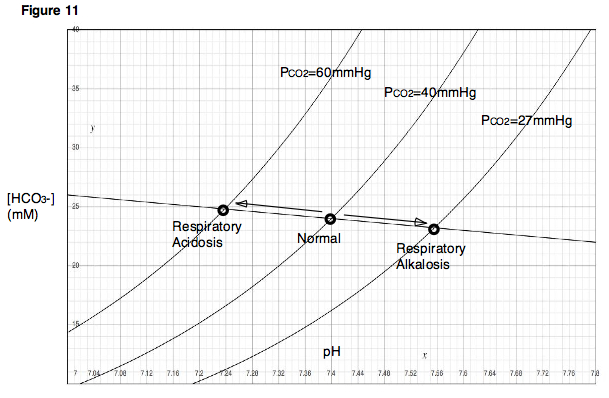
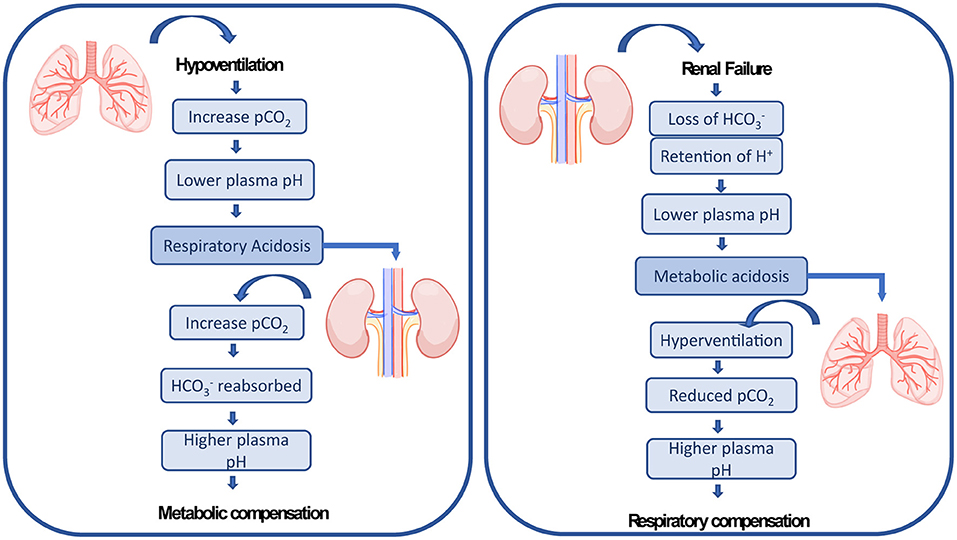
산-염기 장애는 병의 원인에 따라 크게 호흡성과 대사성으로 나뉜다. 호흡성 산-염기 장애는 호흡에 문제가 생겨 이산화탄소 분압이 달라져서 발생하는 이상을 말하며, 대사성 산-염기 장애는 이산화탄소 분압 변화 외의 다른 이유로 발생하는 이상을 모두 포함한다. 변화의 방향에 따라 산증과 알칼리증으로 구분되므로, 산-염기 장애는 크게 호흡성 산증, 호흡성 알칼리증, 대사성 산증, 대사성 알칼리증의 네 가지로 분류할 수 있다.[84]이산화탄소 분압은 이론적으로 휘발성 산이 몸 안에서 너무 많이, 혹은 너무 적게 만들어져서 변화할 수도 있지만, 이런 경우는 드물다.[87] 보통은 호흡계통이 환기를 통해 이산화탄소를 제거하는 기능에 문제가 있을 때 호흡성 산-염기 장애가 생긴다. 호흡 중추나 호흡계통에 질병이 생겨 환기가 잘 안 되면 이산화탄소를 제거하지 못해 호흡성 산증이 발생한다. 반대로 호흡성 알칼리증은 환기가 너무 많이 될 때 발생하는데, 정신 질환 등으로 과호흡을 하는 경우가 그 예이다.[84] 기계환기를 할 때에도 흔히 발생한다.[85] 호흡성 산-염기 변화에 대한 보상 기전으로는 혈액의 완충 작용과 콩팥보상이 있다. 이러한 작용을 통해 호흡성 산증에서는 농도가 증가하고, 호흡성 알칼리증에서는 농도가 감소한다.[84][85]
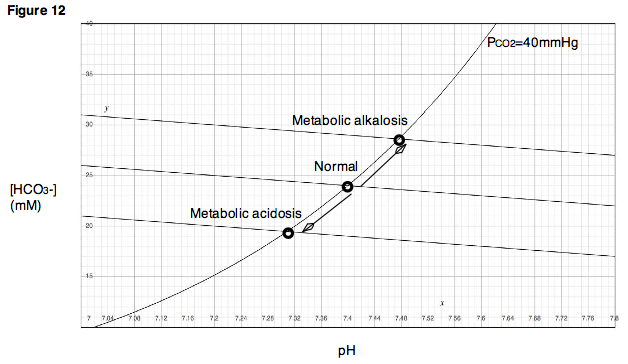
대사성 산-염기 장애는 이산화탄소 분압 변화가 아닌 다른 이유로 체액에 산이나 염기가 더해지거나 빠지는 경우를 의미한다.[86] 헨더슨-하셀바흐 식을 중요하게 생각하는 전통적인 관점에서는 가 너무 많거나 부족한 상태로 이해된다.[84][87][88] 대사성 산증은 메탄올 등의 비휘발성 산을 많이 섭취하거나 설사 등으로 염기를 잃어버리는 경우, 당뇨병성 케톤산증 등으로 몸 안에서 비휘발성 산을 많이 만드는 경우, 콩팥요세관산증이나 만성콩팥병 등으로 콩팥의 산 제거 기능이 제대로 작동하지 않는 경우에 발생할 수 있다. 반대로 대사성 알칼리증은 제산제 등의 염기를 많이 섭취하거나 구토 등으로 산을 잃어버리는 경우, 또는 이뇨제를 투여하여 콩팥에서 산 제거와 염기 재흡수가 너무 활발해지는 경우에 발생할 수 있다.[84][87] 대사성 산-염기 변화에 대한 보상 기전은 호흡보상이다. 대사성 산증에서는 환기가 활발하게 일어나 이산화탄소 분압이 감소하고, 대사성 알칼리증에서는 환기가 잘 일어나지 않아 이산화탄소 분압이 증가한다.[87] 물론 대사성 변화가 콩팥의 문제 때문에 생긴 것이 아니라면, 콩팥보상 역시 대사성 산-염기 장애에 대응하는 데 도움을 줄 수 있다.[84][86]
하나의 원인으로 산-염기 장애가 발생하면 단순 산-염기 장애라고 하고, 여러 원인이 함께 있으면 복합 산-염기 장애라고 한다.[84][87] 산-염기 변화가 일어나면 여러 보상 기제가 작동하는 것이 정상이므로, 복합 산-염기 장애를 판단하는 것은 다소 복잡하다. 산혈증이나 알칼리혈증이 나타났다면 적어도 한 가지 이상의 산증이나 알칼리증이 있었을 것이고, 그에 대한 보상 현상은 원래의 산-염기 변화를 완전히 정상으로 되돌리기에는 부족했을 것이다. 따라서 가장 심한 산-염기 장애를 일차성이라고 부른다.[88] 나머지 변화 중 정상적인 보상 현상에 미치지 못하거나, 그것을 넘어서는 정도로 일어난 것을 이차성이라고 부르며,[88] 단순한 보상이 아닌, 실제로 이차성인 변화가 함께 나타난 경우만 복합 산-염기 장애라고 한다.[87]
7. 2. 코펜하겐 접근법: 대사성 장애의 척도
덴마크 학자들은 CO₂ 분압 및 다른 완충계의 영향을 보정하고 비휘발성 산의 출입량을 정확하게 평가하기 위한 이론적 모형을 개발했다. 이들은 중탄산염 완충계뿐만 아니라 혈액 속 다른 완충계도 산-염기 변동을 중화하는 데 기여한다는 점을 고려했다. 또한, CO₂ 분압만 변해도 중탄산염 완충계의 평형이 이동하여 [HCO₃⁻] 농도가 변한다는 사실을 주목했다. 이러한 방법론을 코펜하겐 접근법(Copenhagen approach)이라고 부른다.[136]코펜하겐 접근법에서는 혈액 속 완충계를 중탄산염 완충계와 나머지로 나누어 생각한다.[86] 이때, 두 계의 평형 조건은 각각 헨더슨-하셀바흐 방정식과 반 슬라이크 방정식으로 표현된다.[134] pH를 가로축, [HCO₃⁻]를 세로축으로 하는 데이븐포트 그림에서 이 수식들은 각각 지수함수 꼴의 CO₂ 등치선과 직선형의 완충선으로 나타난다. 체액의 산-염기 상태는 이 두 곡선이 만나는 지점으로 결정된다.[48][134]

순수한 대사성 산-염기 변동은 나머지 완충계의 평형 조건에만 영향을 미치므로, 데이븐포트 그림에서 완충선이 이동하는 것으로 나타난다. 따라서 완충선의 세로 절편에 해당하는 염기과잉 값을 대사성 산-염기 장애의 척도로 삼는다.[86]
7. 3. 보스턴 접근법: 보상 반응에 대한 경험적 규칙
미국 보스턴 학파는 혈액 속 완충계가 복잡하게 얽혀 있어, 이를 수학적으로 엄밀하게 분석하기 어렵다고 보았다. 대신 이들은 여러 산-염기 불균형 환자들의 생리적 보상 반응을 통계적으로 분석하여, 데이븐포트 그림에 95% 신뢰구간을 표시하였다.[87] 이 그림은 환자 간 개인차를 고려하여 넓은 영역으로 표시되므로, 보스턴 학파는 특정한 곡선보다는 대략적인 경향을 참고해야 한다고 주장한다. 또한, 이들은 데이븐포트 그림보다 경험적 수식을 우선시해야 한다고 강조한다.[87]보스턴 접근법에서는 환자의 병력과 진찰을 통해 임상적 판단을 내리는 것이 가장 중요하다고 본다. 그러나 복합 산-염기 불균형과 같이 병인을 파악하기 어려운 경우에는 정량적 분석이 필요하다.[89] 호흡성 장애는 이산화탄소() 분압으로 간단히 판단할 수 있지만, 대사성 장애는 비휘발성 산·염기의 양을 측정해야 하므로 간접적인 방법이 필요하다. 전통적인 접근법에서는 탄산수소 이온()이 비휘발성 산을 중화하는 주된 역할을 하므로, 감소량을 통해 비휘발성 산의 유입량을 추정한다.[136]
하지만 실제로는 탄산수소 이온 완충계 외에도 다른 완충계들이 산-염기 변동을 중화하며, 분압 변화에 따라서도 농도가 변한다. 따라서 감소량이 반드시 비휘발성 산 유입량을 의미하지는 않는다.[136]
7. 4. 스튜어트 접근법: 비휘발성 약산의 역할
스튜어트 이론은 전통적인 산-염기 장애 해석 방식과 달리 비휘발성 약산, 특히 알부민의 역할을 중요하게 다룬다.[42] 기존에는 혈장 pH 변화에 초점을 맞추어 알부민과 같은 비휘발성 약산의 완충 능력이 헤모글로빈보다 미미하다고 보았지만,[59] 스튜어트 이론에서는 비휘발성 약산 자체가 혈액을 산성화하는 요인이라고 강조한다.[50][60][79]예를 들어, pH 7.4인 혈장에 알부민 농도가 4.4 g/dL일 때, 알부민의 총 전하량은 약 -10 ~ -13 mEq/L로 추산된다.[50][60][79] 강이온차이(SID)가 일정할 때 알부민 농도가 증가하면 음전하가 많아져 중탄산염()이 감소하고 혈액이 산성화된다.[50] 반대로 알부민 농도가 감소하면 혈액은 알칼리화된다.[79]
일부 학자들은 스튜어트 이론에 따라 대사성 산-염기 장애를 강이온차이(SID)와 비휘발성 약산 총량(ATOT)의 변화에 따라 네 가지로 구분할 것을 제안했다.[93][94][95] 기존의 대사성 산증 및 알칼리증은 SID 감소 및 증가에 해당하며, 추가로 ATOT 증가에 의한 대사성 산증(고알부민혈증, 고인산혈증 등)과 ATOT 감소에 의한 대사성 알칼리증(저알부민혈증 등)이 존재한다는 것이다.[93][94][95] 특히 중환자에게 흔한 저알부민혈증으로 인한 알칼리증을 고려하지 않으면, 동반된 대사성 산증을 진단하기 어렵다고 주장한다.[50][94]
8. 역사
물질 중에 산성인 것과 염기성인 것이 있다는 사실은 고대에도 알려져 있었다. 산(acidusla)은 신맛을 내는 물질, 알칼리(اَلْقِلْيar)는 산의 작용을 거슬러 중화할 수 있는 물질로 생각되었다. 16세기부터 화학이 연금술과 구별되면서 의화학(iatrochemistry)을 내세우는 사람들이 나타났고, 이들은 산과 알칼리의 개념을 생리학·의학에 적용하기 시작했다.[104]
19세기에는 혈액의 알칼리성이 화학계에 널리 알려졌고, 혈액이 산·염기를 중화하는 능력이 뛰어나다는 사실도 밝혀졌다. 그러나 당시 산·염기 이론은 정의가 모호하여 연구 결과를 올바로 해석하기 어려웠다.[109]
19세기 말 스반테 아레니우스는 수용액에서 수소 이온을 내놓는 물질이 산, 수산화 이온을 내놓는 물질이 염기라고 정의했다.[104] 아레니우스의 이론에 따라 학자들이 혈액의 이온 조성을 측정한 결과, 혈액은 실제로는 수소 이온과 수산화 이온이 거의 같은 농도로 존재하여 중성에 가깝다는 사실이 밝혀졌다.[109]
20세기 초 로런스 조지프 헨더슨은 완충용액의 이론을 통해 혈액의 완충 작용을 설명했다. 그는 화학 평형에 대한 질량작용의 법칙을 바탕으로, 혈액의 완충 작용이 생체가 산염기 변동에 대응하는 제1방어선이라고 결론지었다.[112]
헨더슨이 완충용액 이론을 정립할 무렵, 허파와 콩팥이 혈액의 장기적인 산-염기 항상성에 중요하다는 사실은 잘 알려져 있었다.[113][116] 클로드 베르나르는 허파와 콩팥의 역할을 인지했던 학자 중 하나였다.[104][117] 존 스콧 홀데인은 호흡수를 조절하는 기제에 관심을 기울였다.[104][121]
도널드 반 슬라이크는 혈액에서 방출된 기체의 압력을 효과적으로 측정하는 장치를 개발하여 혈중 탄산수소 이온 농도를 측정하고, 대사성 산-염기 장애를 진단하는 데 기여했다.[112]
1950년대 중반에는 온도까지 보정하여 pH를 정확하게 측정할 수 있는 유리 전극이 상업적으로 판매되었다.[110][122][129]
1952년 덴마크 코펜하겐에서 발생한 소아마비 유행은 산-염기 생리학 발전에 중요한 계기가 되었다. 폴 아스트럽은 염기과잉 개념을 도입하여 산-염기 장애 평가 도구를 개발했다.[39][134][133]
1963년 슈바르츠와 렐만은 염기과잉 개념을 비판하며, 중탄산염 중심의 경험적 접근법을 제시했다.[137] 이들의 비판은 '코펜하겐 학파'와 '보스턴 학파' 간의 논쟁("횡대서양 산염기 대논쟁")을 일으켰다.[139]
8. 1. 혈액의 산염기 성질
고대에는 산(acid)을 신맛을 내는 물질로, 알칼리(alkali)는 산을 중화하는 물질로 여겼다. 16세기부터 산과 알칼리의 개념이 생리학과 의학에 영향을 주기 시작했다. 의화학자들은 화학 반응으로 생명 현상을 설명하려 했으며, 얀 밥티스타 판 헬몬트는 모든 물질이 산 또는 알칼리이며, 생리학적 과정은 산-염기 반응으로 일어난다고 주장했다. 17세기 프란시스퀴스 실비우스 등 의화학자들은 질병을 산이나 알칼리의 과잉으로 보고, 반대 성질의 약물로 치료할 수 있다고 믿었다.[105][106]의화학자들은 혈액의 화학적 조성을 밝히는 데 중요성을 부여했다. 로버트 보일은 혈액을 증류하여 알칼리 성분을 추출했다고 보고했고,[108] 19세기에는 혈액의 알칼리성이 널리 알려지게 되었다.[109][110] 그러나 당시 산·염기 이론은 모호하여 혈액이 산·염기를 효과적으로 중화하는 능력은 수수께끼였다.[109]
19세기 말, 스반테 아레니우스는 이온화 이론을 바탕으로 산을 수소 이온을 내놓는 물질, 염기를 수산화 이온을 내놓는 물질로 정의했다.[104] 이를 통해 산·염기의 세기와 양 개념이 구분되었다. 이후 학자들의 측정 결과, 혈액은 수소 이온과 수산화 이온 농도가 거의 같아 중성에 가깝다는 사실이 밝혀졌다.[109]
로런스 조지프 헨더슨은 완충용액 이론을 통해 혈액의 완충 작용을 설명했다. 그는 화학 평형에 대한 질량작용의 법칙을 바탕으로, 용액의 수소 이온 농도가 산과 염의 농도 비에 의존한다는 수식을 유도했다.[112][115] 헨더슨은 혈액의 완충 작용이 생체의 산염기 변동에 대한 제1방어선이며, 중탄산염 완충계가 가장 중요하고, 인산염 완충계와 헤모글로빈 등이 부수적으로 기여한다고 보았다.[112][104][116]
클로드 베르나르는 허파와 콩팥이 혈액의 장기적인 산-염기 항상성에 중요하다고 보았고,[104][117] 존 스콧 홀데인은 호흡수 조절 기제가 혈액의 pH와 산소 분압을 정상으로 유지한다고 결론지었다.[104][121]
8. 2. 산염기 생리학의 태동
19세기 말 세포대사 과정에서 황산, 인산, 탄산, 젖산 등이 만들어진다는 사실이 실험으로 확인되었다.[109] 그럼에도 혈액이 중성을 유지하는 원리에 대한 다양한 추론이 있었는데, 혈액 속 단백질이 산·염기와 결합하여 중화한다는 가설과 중탄산염 완충계가 중요하다는 가설이 제기되었다.[114]하버드 대학교의 생화학자 로런스 조지프 헨더슨은 화학 평형에 대한 질량작용의 법칙을 바탕으로 용액의 수소 이온 농도가 산과 염의 농도 비에 의존한다는 수식을 이끌어냈다. 용액에 다른 산이나 염기를 첨가하더라도 이 농도 비가 비교적 일정하기에 용액의 중성이 유지된다는 것이 헨더슨의 설명이었다.[112][115] 헨더슨은 혈액의 완충 작용이야말로 생체가 산염기 변동에 대응하는 제1방어선이라고 결론 지었다. 이때 혈액의 여러 완충계 가운데 가장 중요한 것은 중탄산염 완충계, 버금가는 것은 인산염 완충계이며, 그 밖에 헤모글로빈 등 단백질이 부수적으로 기여한다고 보았다.[112][104][116]
헨더슨이 완충용액의 이론을 정립하던 무렵, 혈액의 장기적인 산-염기 항상성에 허파와 콩팥이 중요하다는 사실은 잘 알려져 있었다.[113][116] 내부 환경(milieu intérieur프랑스어)의 개념을 창안한 생리학자 클로드 베르나르는 동물 실험을 통해 식단에 따라 소변의 산성도가 변화함을 관찰하였다.[117][118][119]
한편 헨더슨과 동시대에 활동한 영국 생리학자 존 스콧 홀데인은 호흡수를 조절하는 기제에 관심을 기울였다. 그는 호흡이 혈액의 pH 및 산소 분압을 정상으로 유지하는 방향으로 조절된다고 결론 지었다.[104][121]
8. 3. 추정과 측정: 대사성 산-염기 장애를 평가하다
쇠렌 쇠렌센이 pH를 정의하고, 카를 알베르트 하셀바흐가 헨더슨-하셀바흐 방정식을 개발하면서 혈액의 pH를 정확하게 측정하는 기술이 발전했다. 초기에는 수소 전극을 사용하기 위해 혈액에서 산소를 제거하고 수소 기체로 포화시키는 복잡한 과정이 필요했기에, 주로 생리학 연구에서만 사용되었다.[122]도널드 반 슬라이크는 혈액에서 방출된 기체의 압력을 측정하는 "반 슬라이크 압력 측정 장치"를 개발하여 혈중 탄산수소 이온 농도를 측정하고, 대사성 산-염기 장애를 진단하는 데 기여했다. 이 장치는 1960년경까지 생리학 및 임상의학 실험실의 표준으로 사용되었다.[112] 반 슬라이크는 pH 측정 없이 산-염기 상태를 평가하는 다양한 방법을 고안하는 한편, 헨더슨-하셀바흐 방정식을 이용하여 pH를 추정하는 방법도 연구했다. 그는 측정만으로 혈중 이산화탄소 분압과 pH를 추정할 수 있음을 보였다. 이후 존 퍼넷 피터스는 ― 관계가 더욱 선형에 가깝다고 지적했다.[127]
1930년대부터 유리 전극 기술이 발달하면서 혈액의 pH를 직접 측정하는 것이 가능해졌다. 1950년대 중반에는 온도까지 보정하여 pH를 정확하게 측정할 수 있는 유리 전극이 상업적으로 판매되었다.[110][122][129] 유리 전극이 보편화되면서 대사성 산-염기 장애의 척도를 찾는 문제가 중요해졌다. 여러 학자들이 다양한 척도를 제안했지만, 기술적, 이론적 발전에도 불구하고 임상에서 동맥혈 채취 및 pH 측정은 드물었다.
1952년 덴마크 코펜하겐에서 발생한 소아마비 유행은 상황을 바꾸는 계기가 되었다. 마취과 의사 비외른 입센은 호흡성 산증을 추론했고, 폴 아스트럽은 pH 측정을 통해 이를 확인했다. 아스트럽은 산-염기 상태와 호흡 상태를 정확히 평가하기 위해 유리 전극으로 pH를 측정하여 를 추정하는 방법을 고안했다.[122][132] 아스트럽은 소아마비 유행 극복 이후, 염기과잉 개념을 도입하여 산-염기 장애 평가 도구를 개발했다. 올레 시고르-안데르센은 혈액에서 측정 가능한 변수만으로 염기과잉 값을 계산할 수 있는 공식을 연구했다.[135]
1963년 슈바르츠와 렐만은 염기과잉 개념을 비판하고, 중탄산염 중심의 경험적 접근법을 제시했다. 이들은 '코펜하겐 학파'와 '보스턴 학파' 간의 논쟁을 일으켰고, 이 논쟁으로 인해 오늘날 많은 의료기기와 교과서는 염기과잉 등의 개념을 활용하지 않는다.[39][138]
8. 4. 1952년 소아마비 유행과 횡대서양 대논쟁
1952년 코펜하겐에 닥친 소아마비 유행으로 10월부터 12월 사이에만 3천여 명의 환자가 입원했다. 대부분 블레그담 병원(Blegdamshospitaletda)에 입원했는데, 이 가운데 3백여 명이 호흡마비 증세를 보였다. 환자들의 혈액에서는 이산화탄소 총량이 높아져 있었다. 를 대략 대사성 산-염기 이상의 척도로 보던 관행에 따르면 이는 원인 미상의 대사성 알칼리증을 시사했다. 마취과 의사 비외른 입센은 오히려 호흡성 산증 때문에 이산화탄소 총량이 증가했다고 추론하였고, 감염병 중앙 실험실 총책임자였던 폴 아스트럽(Poul Astrupda)은 pH를 측정하여 이를 확증했다. 입센이 기관절개술로 인공 환기를 실시하자 이산화탄소 총량은 곧 감소했다.[131][132][133]
아스트럽은 환자들의 산-염기 상태와 호흡 상태를 정확히 평가할 필요를 느꼈다. 그는 먼저 ― 관계뿐만 아니라 pH― 관계 역시 선형임을 확인했다. 그런 다음 반 슬라이크와 피터스 등이 발전시킨 외삽법을 변형하여, 가 저마다 다른 기체와 혈액이 평형을 이루도록 한 다음 유리 전극으로 pH를 측정함으로써 미지 시료의 를 추정하는 방법을 고안하였다. 이렇게 해서 환자들이 호흡을 통해 이산화탄소를 적절하게 제거하고 있는지 평가하고 필요에 따라 인공환기 속도를 조절할 수 있었다.[122][132]
아스트럽은 소아마비 유행을 극복한 데서 그치지 않고 산-염기 장애를 평가하는 새로운 도구를 마련하고자 하였다. 그는 용액에 강염기나 강산을 첨가하면 pH― 관계를 나타내는 직선 자체가 평행이동한다는 사실을 관찰했다.[133] 반 슬라이크의 완충선이 정상 위치에서 얼마나 벗어나 있는지야말로 호흡을 뺀 나머지 요인만을 반영한 산-염기 상태의 척도가 되어 줄 수 있었다. 이에 착안하여 아스트럽과 올레 시고르-안데르센(Ole Siggaard-Andersenda)은 혈액의 를 40 mmHg로 맞춘 상태에서 pH를 7.40으로 되돌리기 위해 첨가해 주어야 하는 강산의 양을 염기과잉으로 정의하였다.[39][134][133] 20세기 중반까지 대사성 산-염기 상태의 척도로 제안되었던 숱한 후보 가운데 오늘날까지 살아남아 임상에서 널리 쓰이는 것은 사실상 염기과잉뿐이다.[138]
물론 임상에서 실제로 중화 적정을 실시하기는 번거로우므로, 시고르-안데르센은 정의와 별개로 혈액에서 측정 가능한 변수만 가지고 염기과잉 값을 계산할 수 있는 공식을 연구해 내세웠다.[135] 이때 pH― 완충선의 기울기를 구한 반 슬라이크의 연구 결과를 활용했으므로, 시고르-안데르센은 이를 반 슬라이크 방정식이라고 부르자고 제안했다. 이제 혈액의 산-염기 상태는 헨더슨-하셀바흐 방정식과 반 슬라이크 방정식이라는 두 가지 수식에 의해 결정된다고 말할 수 있었다.[134][133]
1963년 보스턴 터프츠 대학교의 슈바르츠와 렐만은 염기과잉 개념을 비판하며, 중탄산염 중심의 경험적 접근법을 제시했다.[137] 첫 번째 비판은 생체 내에서 혈액은 완충 능력이 상대적으로 떨어지는 간질액과 맞닿아 있으므로, 혈액만 분리하여 시험관 내에서 산염기 성질을 평가해서는 안 된다는 것이었다. 두 번째 비판은 호흡성 산염기 장애가 만성적으로 지속되는 경우에 대사성 보상이 일어나는데, 염기과잉 계산에서는 정상적인 보상이 별도의 대사성 산염기 장애처럼 다루어지므로 부적절하다는 것이었다.[39][138] 이들은 대신 정상적인 보상 반응의 정도를 경험적으로 관찰함으로써 도출한 6가지 간단한 규칙을 사용해서 산-염기 장애를 평가하자고 제안했다.[90] 보스턴 방법에 따르면 이러한 규칙으로 계산된 정상적인 보상 반응을 고려하고도 남는 만큼의 이산화탄소·탄산수소 이온 농도 변화만이 산-염기 장애라고 간주된다.[138]
보스턴 학파의 비판에 대응하여 시고르-안데르센은 혈액의 헤모글로빈 농도를 5 g/dL라는 낮은 값으로 고정해서 염기과잉을 계산하는 방법을 고안했는데, 이렇게 셈한 값을 표준염기과잉(standard base excess영어, SBE)이라고 한다. 덴마크 학자들은 보상 반응의 정도에 대한 경험적 연구의 가치를 인정하면서도, 표준염기과잉 수치를 가지고도 얼마든지 실용적인 규칙을 도출할 수 있다고 주장했다.[138] 염기과잉 개념의 유용성을 둘러싼 '코펜하겐 학파'와 '보스턴 학파'의 이러한 대립은 횡대서양 산염기 대논쟁(great trans-atlantic acid base debate영어)이라고 불렸다.[139] 논쟁의 결과로 보스턴 학파의 경험적 접근이 큰 호응을 얻어, 오늘날 많은 의료기기와 교과서는 염기과잉 등의 개념을 활용하지 않는다.[39][138]
8. 5. 스튜어트의 물리화학적 접근
1980년대에 캐나다의 생리학자 피터 스튜어트는 중탄산염 중심의 전통적인 접근법에 불만을 느끼고, 산-염기 생리학을 새롭게 이해하는 방법을 고안했다.[140] 스튜어트는 이산화탄소 분압(), 비휘발성 약산 총량(ATOT), 강이온차이(SID)를 독립변수로 설정하고, 이 값들이 주어지면 체액의 산염기 상태가 다음 6가지 방정식에 의해 하나로 결정된다고 보았다.
# 물의 자동 이온화 반응 (H2O
# 탄산 해리 반응의 평형 조건 (헨더슨-하셀바흐 방정식): .
# 탄산수소 이온 해리 반응 (HCO3-
# 비휘발성 약산(HA)의 해리 반응 (HA
# 비휘발성 약산 전체의 질량 보존 법칙: . (물질 출입에 의해서만 변하는 상수)
# 전기 중성 원리: .
위 방정식들을 연립하면 에 대한 사차방정식을 얻을 수 있다. 이를 수치적으로 풀면 각종 평형 상수 및 , ATOT, SID 값에 따라 가 어떻게 변화하는지 분석할 수 있다.[141][142]
스튜어트 접근법은 지금까지도 논쟁의 대상이다.[39] 주요 쟁점 중 하나는 이 접근법의 임상적 유용성이다. 지지자들은 강이온차이 개념을 바탕으로 환자의 대사성 산-염기 이상을 더 정확히 평가하고, 나아가 산-염기 이상 진단에 유용한 기준을 새로이 발굴하고자 하였다.[50][143][144] 그러나 일부 연구에서는 스튜어트 이론에 기반한 새로운 임상 접근법이 전통적인 방법에 비해 더 나은 결과를 낳지 못했다.[145][146] 반면, 혈액투석을 통해 염화 이온을 선택적으로 제거하여 산혈증을 교정하는 데 성공했다는 연구 결과도 있어,[147] "중탄산염 시대의 끝"이 도래한 것이 아닌지 조심스럽게 প্রশ্ন하는 편집자들도 있었다.[148]
9. 세포내액의 항상성 조절
체액 구획 가운데 세포질에서 갖가지 생화학적 반응이 가장 활발하게 일어나기에, 세포내액이야말로 pH 조절이 가장 필요한 구획이다.[149] 세균에서 사람에 이르기까지 거의 모든 생물이 세포 내 pH(이하 pHi)를 대략 비슷한 값으로 유지하는 기제를 갖춘 것을 보면 세포내액의 산-염기 항상성 조절이 얼마나 중요한지 짐작할 수 있다.[150] 사람을 비롯한 척추동물에서 pHi는 대체로 세포외액의 pH(이하 pHe)에 의존하여 조절된다. 즉 산염기 변동이 일어났을 때 pHe가 정상으로 되돌아오지 않으면 pHi 역시 완전히 회복되지 못한다.[149][151] 그러나 pHe와 pHi는 단지 서로를 따라가기만 하는 것은 아니며, 서로 영향을 주고받으면서 복잡하게 조절된다.[149][150] 또한 일부 어류 등에서는 pHi만이 선택적으로 조절되는 사례가 보고된 바 있다.[151]
사람에서 pHi는 (적혈구 등 일부 예외를 제외하면) 대체로 6.8에서 7.2 사이이다. 만약 세포막 안팎의 H+가 전기화학적 평형을 이룬다면, 세포외액의 pH가 7.4이고 막 전위가 -60 ㎷일 때 네른스트 식에 의해 pHi는 6.4가 되어야 한다. 즉 세포내액은 H+가 수동적 평형을 이룬다고 가정했을 때 예상되는 것보다 훨씬 알칼리성이다. H+는 다른 양이온에 비해 빠르게 확산하며 세포막도 제법 쉽게 통과한다. 세포막의 H+에 대한 투과도(permeability영어)는 10-4-10-2 cm/s 정도로 추산되는데, 통상적인 K+ 투과도보다 104배가량 높은 값이다. 그럼에도 pHi가 평형에서 벗어난 값으로 유지될 수 있는 까닭은 H+의 농도가 나노몰 단위로 매우 낮기 때문이다. 이는 밀리몰 단위인 K+에 비하면 10-6배에 지나지 않는 값이므로, 투과도와 농도의 곱인 전도도는 H+가 K+보다 100배 작다. H+가 전기화학적 기울기를 따라 세포 안으로 끊임없이 들어오더라도, 이처럼 양이 적으므로 손쉽게 도로 내보낼 수 있다.[152] 다만 작은 흐름이라도 계속되면 언젠가는 세포를 산성화할 터이므로 능동수송으로 제거하여야만 한다.[153]
10. 체온의 영향
체온이 변하면 체액의 산-염기 균형도 변화한다. 해리는 흡열 반응이므로 온도가 높아지면 해리가 더 잘 일어나고, 낮아지면 덜 일어난다. 따라서 저체온증에서는 알칼리증이 흔히 나타난다.[167]
20세기 중반, 심장 수술에서 저체온증을 치료 목적으로 사용하는 방법이 널리 쓰이면서, 저체온 상태인 환자의 호흡을 어떻게 조절해야 하는지가 중요한 문제로 떠올랐다.[155] 연구 결과, 혈액 온도가 1℃ 변할 때마다 pH는 약 0.0147만큼 반대로 변하는 것으로 나타났다.[156]
변온동물 연구에서는 주변 온도 변화에 따라 혈액 pH가 변한다는 사실이 관찰되었고,[158] 추가 연구를 통해 변온동물의 혈액 pH 변화가 포유류 혈액의 pH 변화와 매우 유사하다는 것이 밝혀졌다.[159]
이러한 연구 결과를 바탕으로, 체온에 따른 혈액 pH 조절의 생리적 의미를 설명하기 위해 여러 가설이 제시되었다. 그 중 하나는 농도 자체가 아니라 과의 농도비, 즉 상대적 알칼리도(relative alkalinity영어)가 중요하다는 가설이었다.[113][161][162]
오늘날 가장 큰 영향을 미치는 가설은 산-염기 항상성의 목적이 단백질 이온화도 조절이라고 보는 알파 조절 장치 가설(alpha-stat hypothesis영어)이다.[157] 이 가설에 따르면, 중요한 것은 pH 자체가 아니라 이미다졸의 이온화도(α)이므로, 보정하지 않은 동맥혈 가스 분석값을 사용해야 한다.[167][168] pH 조절 장치와 알파 조절 장치 방법 중 어느 것이 환자에게 더 유용한지는 아직 명확히 밝혀지지 않았다.[169]
10. 1. 산-염기 균형은 온도에 달렸다
체온이 정상 값인 37℃로 유지된다고 전제할 때, 체온이 변화하면 체액의 산-염기 균형 역시 변화한다. 해리는 흡열 반응이기 때문에, 온도가 높아지면이러한 현상을 이해하려고 여러 학자가 노력했는데, 한 부류는 사람 혈액의 산-염기 상태를 올바로 평가하는 방법을 궁리하던 의사들이었고[155], 다른 한 부류는 변온동물의 산-염기 항상성을 연구하던 비교생리학자들이었다.[157]
20세기 중반에 접어들어 심장 수술에서 치료적 목적으로 저체온증을 유도하는 방법이 널리 쓰이기 시작했다. 수술 중 마취되어 있는 환자는 스스로 숨을 쉬지 않으므로 마취과 의사가 호흡을 통제한다. 따라서 저체온증 상태인 환자의 호흡을 어느 정도로 유지해야 가장 적절한지가 문제로 떠올랐다.[155] 동맥혈 가스 분석 장치는 검체의 원래 온도가 무엇이었든지 상관 없이 37℃에서 측정을 진행한다.[168]
그러므로 학자들은 밀폐된 시험관에 담긴 사람 혈액이 식거나 데워질 때 pH가 어떻게 변화하는지 알고자 했다. 연구 결과 검체의 온도가 1℃ 상승(감소)할 때마다 pH는 약 0.0147만큼 감소(상승)하는 것으로 나타났다. 이때 온도에 따른 혈액 pH 변화율은 사람·개·고양이 등 여러 포유류에서 매우 비슷하게 측정되었으며, 적혈구용적률이나 단백질·중탄산염 농도 등 혈액의 산-염기 균형에 영향을 미칠 만한 요인을 바꾸어 가며 측정해도 결과는 크게 달라지지 않았다.[156]
한편 변온동물을 연구하던 학자들은 주변 온도가 변할 때 혈액 pH도 크게 변화한다는 사실을 관찰했다. 1927년에는 앨리게이터[165], 1962년에는 붉은귀거북에서 체온이 감소함에 따라 혈장 pH가 상승한다는 사실이 보고되었다.[158] 처음에 이러한 결과는 변온동물의 산-염기 항상성이 정온동물에 비해 덜 정밀하게 조절된다는 뜻이라고 여겨졌다.[157] 예컨대 붉은귀거북을 연구한 학자는 “생명이 비교적 좁은 pH 범위에서만 살 수 있다는 격언은 거북에게는 해당되지 않는 것이 분명해 보이며, 어쩌면 정온동물에게만 해당될는지도 모른다.”고 논평하였다.[158]
그런데 더 자세히 살펴보니, 변온동물의 혈액 pH는 그저 온도에 따라 저절로 변하는 것이 아니라 어떠한 규칙으로 조절되는 듯했다. 놀랍게도 살아 있는 붉은귀거북 혈액의 pH 변화 양상이 밀폐된 시험관에 담긴 포유류 혈액의 pH 변화 양상과 매우 유사했던 것이다.[159] 이후 황소개구리·사탕수수두꺼비·늑대거북에서도 같은 현상이 확인되었다.[157][160]
이러한 연구 결과로 정온동물이든 변온동물이든 혈액 pH가 체온에 따라 특정한 방식으로 조절된다는 사실이 명백해지기는 했지만, 그 생리적 의미가 무엇인지는 분명하지 않았다.[157][161] 이를 해명하고자 여러 가설이 제안되었다.
10. 2. 알파 조절 장치 가설
20세기 중반, 심장 수술에서 치료 목적으로 저체온증을 유도하는 방법이 널리 쓰이면서, 저체온 상태 환자의 호흡을 어떻게 조절해야 하는지가 문제로 떠올랐다.[155] 연구 결과, 혈액 온도가 1℃ 변할 때마다 pH는 약 0.0147만큼 반대로 변하는 것으로 나타났다.[156]한편, 변온동물 연구에서는 주변 온도 변화에 따라 혈액 pH가 변한다는 사실이 관찰되었다.[158] 처음에는 변온동물의 산-염기 항상성이 덜 정밀하다고 여겨졌으나,[157] 추가 연구를 통해 변온동물의 혈액 pH 변화가 포유류 혈액의 pH 변화와 매우 유사하다는 것이 밝혀졌다.[159]
이러한 연구 결과들을 바탕으로, 체온에 따른 혈액 pH 조절의 생리적 의미를 설명하기 위해 여러 가설이 제시되었다. 그중 하나는 농도 자체가 아니라 와 의 농도비, 즉 상대적 알칼리도(relative alkalinity영어)가 중요하다는 가설이었다.[113][161][162]
오늘날 가장 큰 영향을 미치는 가설은 산-염기 항상성의 목적이 단백질 이온화도 조절이라고 보는 알파 조절 장치 가설(alpha-stat hypothesis영어)이다.[157] 이 가설은 다음 두 가지 조건을 전제로 한다.
- 첫째, 혈중에 다량 존재하는 완충계의 pK 값은 온도에 따라 -0.015 (pK 단위)/℃만큼 변화해야 한다.
- 둘째, 동물은 체온에 따라 호흡을 조절하여 혈중 이산화탄소 총량을 일정하게 유지해야 한다.[168][166]
버펄로 대학교의 로버트 블레이크 리브스(Robert Blake Reeves)는 히스티딘의 이미다졸 잔기가 첫 번째 조건을 만족시키며,[166] 혈중 비-중탄산염 완충계에서 중요한 역할을 한다고 보았다.[155] 또한, 체온 변화에 따른 산-염기 균형 변화의 목적은 이미다졸 잔기의 이온화도(α)를 일정하게 유지하는 것이며, 호흡 조절은 혈중 농도를 유지하는 방식으로 이루어진다고 주장했다. 이 가설의 이름은 이온화도를 나타내는 그리스 문자 알파(α)에서 유래했다.[168][166]
동맥혈 가스 분석 장치는 검체를 37℃에서 측정하므로, 환자의 산염기 상태를 평가하기 위해 보정된 값을 사용해야 한다는 견해가 일반적이다(pH 조절 장치, pH-stat영어).[168] 그러나 알파 조절 장치 가설에 따르면, 중요한 것은 pH 자체가 아니라 이미다졸의 이온화도(α)이므로, 보정하지 않은 값을 사용해야 한다.[167][168]
pH 조절 장치와 알파 조절 장치 방법 중 어느 것이 환자에게 더 유용한지는 아직 명확히 밝혀지지 않았다.[169]
10. 3. 임상적 의미
동맥혈 가스 분석 장치는 모든 검체를 37℃로 맞춘 뒤에 각종 변수를 측정한다. 장치에 따라서는 온도의 영향을 보정하여, 원래 온도에서 쟀더라면 얼마였을지 추정한 값을 함께 보고하기도 한다. 이때 주로 온도에 따른 혈액 시료의 pH 변화율이 약 -0.015 (pH 단위)/℃라는 결과를 이용한다.[168] 환자의 산염기 상태를 올바로 평가하려면 이렇게 보정한 값을 37℃에서의 참고치와 견주어야 한다는 것이 통상적인 견해이다. 예컨대 체온이 20℃인 환자에게서 혈액을 뽑아 37℃로 데운 다음에 pH를 측정하였더니 7.4였다고 하면, 실제 환자의 혈액 pH는 이보다 높은 약 7.65였을 터이므로 알칼리혈증이 있다고 판단하는 식이다. 환자의 체온이 어떻든지 간에 혈액 pH를 '정상 값' 7.4에 맞추려고 하므로 pH 조절 장치(pH-stat영어) 접근법이라고 부를 수 있다.[168] 반면 알파 조절 장치 가설(alpha-stat hypothesis영어)에 따르면 보정하지 않은 값을 그대로 사용하여야 옳다. 중요한 것은 이미다졸의 이온화도 α이지 pH 그 자체가 아니며, 따라서 pH의 값이 얼마이어야 정상인지는 체온에 따라 달라지기 때문이다. 밀폐된 시험관에 담긴 혈액이 데워질 때 α는 변하지 않으므로, 37℃에서 측정한 값을 따로 보정하지 않고 그대로 37℃에서의 참고치와 비교하면 된다.[167][168]pH 조절 장치와 알파 조절 장치 방법 가운데 어떤 것이 환자에게 더 유용한지는 아직 명확히 검증되지 않았다.[169]
11. 다른 생물에서
식물과 세균 등 다른 생물들도 각자의 방식으로 산-염기 항상성을 유지한다. 식물 세포는 pH를 정밀하게 조절하며, 화학적 완충 작용, 대사 활동, 양성자 펌프 등을 통해 산-염기 균형을 유지한다. 특히 식물은 세포벽과 그 사이 공간인 전세포벽을 통해 수소 이온(H+)을 내보내거나, 주변 환경의 pH에 영향을 주기도 한다.
세균은 세포 안팎의 pH 차이를 견디는 전략을 택한다. 생존 가능한 pH 범위에 따라 호중성, 호산성, 호염기성 등으로 나뉘며, 대장균과 같은 일부 세균은 극한 환경에서도 생존할 수 있다.
11. 1. 식물
식물 세포는 생존에 필수적인 단백질 기능을 유지하기 위해 세포 내 pH를 7.1에서 7.5 사이로 정밀하게 조절한다.[170] 식물 세포는 대사 과정에서 가 생성되고, 영양소 흡수가 와 함께 일어나는 경우가 많아 산성화되는 경향이 있다.[33] 이러한 pH 변화에 대응하여 산-염기 항상성을 유지하는 기제는 크게 세 가지로 나뉜다.첫째, 화학적 완충 작용이다. 식물 세포내액에는 중탄산염, 인산염, 단백질 등 다양한 완충계가 존재하며, 이들의 완충 용량은 20 ~ 100 mEq/L/(pH 단위) 정도로 추산된다. 완충 작용은 pH 변화를 즉시 완화하는 1차 방어선 역할을 하지만, 소모된 완충제를 보충하기 위해서는 다른 방식으로 산·염기를 제거해야 한다.[177]
둘째, 를 소모하거나 생성하는 대사 활동이다. 효소는 pH에 따라 활성이 변하며, 효소가 촉매하는 반응 또한 pH에 영향을 줄 수 있다. 두 효소가 한 기질을 공유하고, pH 변동 시 각 효소가 촉매하는 반응이 pH 변동을 되돌리는 방향으로 변화하면, 이 체계는 생화학적 pH 조절 장치(biochemical pH-stat)를 이룬다.[33] 예를 들어, 산성 환경에서는 말산효소가 말산을 탈카복실화하여 세포내액을 알칼리화하고, 염기성 환경에서는 포스포에놀파이루브산 카르복실레이스(phospho-enolpyruvate carboxylase, PEPC)가 옥살로아세테이트를 생성하여 강산인 말산을 만들어 pH 변동을 완화한다.[171]

셋째, 양성자 펌프와 이온 펌프를 통한 능동 수송이다. 이를 생물리학적 pH 조절 장치(biophysical pH-stat)라고도 한다.[33][170] 전통적으로 양성자 펌프가 ATP를 사용하여 를 밖으로 내보내 세포질의 농도를 낮춘다고 알려져 왔다. 일부 학자들은 스튜어트 이론을 바탕으로, 자체보다 강한 이온의 움직임이 세포 안팎의 pH 조절에 더 중요하다고 주장한다. 이들은 양성자 펌프가 세포막 안팎에 양성자 구동력을 형성하여 다른 이온 통로를 통한 2차 능동 수송에 에너지를 제공한다고 본다.[177][172][173]
식물 세포내액에서 를 내보내는 경로는 액포로 방출하거나, 세포 바깥(세포벽과 그 사이 공간인 전세포벽)으로 방출하는 것이다.[177][175] 전세포벽은 동물의 세포외액과 달리 완충 용량이 약하고(약 5 mEq/L/(pH 단위)), pH가 쉽게 변하며, 부피도 크지 않아 배출구로 효과적이지 않다. 따라서 낙엽처럼 조직 자체를 제거할 수 있는 경우가 아니라면, 전세포벽으로 내보낸 를 주변 환경으로 다시 방출해야 항상성을 유지할 수 있다. 육상식물은 수생식물보다 세포내액에서 전세포벽으로 를 펌프질하여 내보내는 정도가 훨씬 약하다.[177]

식물의 전세포벽은 세포내액의 pH를 일정하게 유지하기보다 상황에 따라 pH를 변화시켜 신호 및 전령 역할을 하는 것으로 보인다.[175][176][179] 전세포벽 pH가 변해도 세포내액 pH 변화는 매우 작다.[177] 전세포벽 pH가 신호 전달에 관여하는 대표적인 사례는 산성 생장 가설이다. 식물 생장 호르몬인 옥신은 세포막의 양성자 펌프를 활성화하여 전세포벽 pH를 낮추고, 이는 익스팬신 등 세포벽을 느슨하게 만드는 단백질을 활성화하여 생장을 촉진한다.[181][182]
식물은 개체를 둘러싼 외부 환경 pH에도 영향을 준다. 잎 주변 엽권 pH는 토양 pH와 무관하게 종마다 일정하게 조절된다. 식충식물은 벌레잡이주머니 표면을 pH 1 정도의 강산성으로 유지하여 먹이를 소화한다.[183] 뿌리 주변 토양인 근권의 산-염기 항상성은 식물에게 특히 중요한데, 이는 근권 산성도가 인산염, 철, 알루미늄, 아연, 망가니즈 등 영양소 흡수 정도에 영향을 미치기 때문이다.[184][185]
11. 2. 세균
세균은 세포 안팎의 pH 차이를 잘 견뎌내기 위한 장치를 갖추는 전략을 택한다. 세균은 생존하기 용이한 pH 범위에 따라 호중성, 호산성, 호염기성 등으로 구분된다. 호중성 세균은 5.5 ~ 9.0 사이의 pH에서 생장하지만, 세포 내 pH는 7.5 ~ 7.7 사이로 유지한다. 즉 산성 환경에서는 주변보다 세포질을 염기성으로 유지하고, 염기성 환경에서는 주변보다 세포질을 산성으로 유지하는 기제를 갖추고 있다. 세균은 생장 범위 바깥의 pH 환경에서도 생존하는 능력이 있다. 예컨대 대장균 등 장내세균은 산성인 위 속을 지나갈 때 생장을 멈출지언정 생존하여 창자에 도착한다.[186][187]참조
[1]
학술지
Acid-Base Homeostasis
2015-12
[2]
서적
Principles of anatomy & physiology.
Wiley
2012
[3]
학술지
Paraesthesiae and tetany induced by voluntary hyperventilation. Increased excitability of human cutaneous and motor axons
1991-02
[4]
서적
Biochemistry
W.H. Freeman and Company
1995
[5]
서적
Human physiology. An integrated approach
Pearson
[6]
학술지
Acid-base physiology
2001-04
[7]
웹사이트
184 26.4 Acid-Base Balance {{!}} Anatomy and Physiology {{!}} OpenStax
https://opentextbc.c[...]
2020-07-01
[8]
웹사이트
Terminology
https://acid-base.co[...]
Grog LLC
2021-04-09
[9]
서적
Principles of anatomy and physiology
https://archive.org/[...]
Harper & Row, Publishers
1987
[10]
서적
in: Scientific Tables
CIBA-GEIGY Ltd.
1970
[11]
MedlinePlusEncyclopedia
Blood gases
[12]
서적
Nancy Caroline's Emergency care in the streets
Jones & Bartlett Learning
[13]
학술지
Umbilical cord pH, PCO2, and bicarbonate following uncomplicated term vaginal deliveries
1985-03
[14]
서적
Biochemistry
https://books.google[...]
Cengage Learning
[15]
서적
Lecture notes on human physiology
Blackwell Science
[16]
서적
Principles of anatomy and physiology
John Wiley & Sons
2010
[17]
서적
Principles of anatomy and physiology
https://archive.org/[...]
Harper & Row, Publishers
1987
[18]
서적
Pulmonary physiology
McGraw-Hill Medical
2013
[19]
MedlinePlusEncyclopedia
Metabolic acidosis
[20]
서적
Principles of anatomy and physiology
https://archive.org/[...]
Harper & Row, Publishers
1987
[21]
서적
Biochemistry.
W.H. Freeman and Company
1995
[22]
서적
Renal Pathophysiology
https://archive.org/[...]
Williams & Wilkins
[23]
학술지
Acid-Base Reports Need a Text Explanation
2019-04
[24]
서적
Dorland's illustrated medical dictionary
Saunders
[25]
웹사이트
Acid-base physiology
http://www.anaesthes[...]
[26]
문서
Hall, Hall, & Guyton, 2021, pp. 403-405.
[27]
문서
Stewart, 2009, pp. 35-36.
[28]
서적
Principles of anatomy and physiology
https://archive.org/[...]
Harper & Row, Publishers
1987
[29]
서적
Scientific Tables
CIBA-GEIGY Ltd.
1970
[30]
MedlinePlusEncyclopedia
Blood gases
[31]
서적
Nancy Caroline's Emergency care in the streets
Jones & Bartlett Learning
[32]
학술지
Umbilical cord pH, PCO2, and bicarbonate following uncomplicated term vaginal deliveries
1985-03
[33]
학술지
pH regulation in plants
https://www.jstor.or[...]
1985
[34]
학술지
Molecular aspects of bacterial pH sensing and homeostasis
https://www.nature.c[...]
2011-05
[35]
문서
Danziger, Zeidel, & Parker, 2012, pp. 155-157.
[36]
논문
Giebisch, Windhager, & Aronson, 2017, pp. 821-825
[37]
웹인용
What is meant by "acid-base balance"
https://derangedphys[...]
Yartsev
2024-06-16
[38]
논문
Danziger, Zeidel, & Parker, 2012, pp. 157-162
[39]
저널
Bench-to-bedside review: A brief history of clinical acid–base
http://ccforum.biome[...]
2004
[40]
저널
A quantitative physicochemical approach to acid-base physiology
https://linkinghub.e[...]
1990-06
[41]
저널
Clinical Utility of Stewart's Method in Diagnosis and Management of Acid-Base Disorders
https://journals.lww[...]
2009-07
[42]
저널
An introduction to Stewart acid–base: Clinically useful or chemical bookkeeping?
https://www.physoc.o[...]
2021-06-01
[43]
저널
Acid-base analysis: a critique of the Stewart and bicarbonate-centered approaches
https://www.physiolo[...]
2008-05
[44]
서적
Human physiology: An integrated approach
https://archive.org/[...]
Pearson
[45]
저널
Acid-base physiology
2001-04
[46]
논문
Boron, 2017, pp. 629-630
[47]
저널
An Easy Approach to Understanding Acid-Base Balance in a Blood Buffer System
https://online.ucpre[...]
2021-10-01
[48]
논문
Boron, 2017, pp. 635-637
[49]
웹인용
Quantitative Acid-Base Analysis: The Variables
https://www.anaesthe[...]
Brandis
2024-09-11
[50]
저널
Stewart Acid-Base: A Simplified Bedside Approach
https://journals.lww[...]
2016-08
[51]
저널
Analytic calculation of physiological acid-base parameters in plasma
https://www.physiolo[...]
1999-01-01
[52]
저널
Diagnosing metabolic acidosis in the critically ill: bridging the anion gap, Stewart, and base excess methods
http://link.springer[...]
2009-03
[53]
저널
Integration of acid-base and electrolyte disorders
https://pubmed.ncbi.[...]
2015-01-22
[54]
저널
Strong Relationships in Acid-Base Chemistry – Modeling Protons Based on Predictable Concentrations of Strong Ions, Total Weak Acid Concentrations, and pCO2
https://dx.plos.org/[...]
2016-09-15
[55]
논문
Stewart, 2009, pp. 36-38
[56]
웹인용
Lewis' definition, and the modern concept of acids and bases
https://derangedphys[...]
Yartsev
2023-12-18
[57]
논문
Boron, 2017, pp. 628-629
[58]
논문
Hall, Hall, & Guyton, 2021, pp. 405-408
[59]
논문
Boron, 2017, pp. 630-633
[60]
논문
Figge, 2009, pp. 219-225
[61]
저널
Stewart's approach: Just a heresy or another lens into acid‐base physiology?
https://onlinelibrar[...]
2021-06
[62]
저널
The clinical use of albumin: the point of view of a specialist in intensive care
https://doi.org/10.2[...]
2009
[63]
저널
Acid–base quantification: a review of developing technology
https://linkinghub.e[...]
2022-11
[64]
저널
AN IMPROVED CLINICAL METHOD FOR THE ESTIMATION OF DISTURBANCES OF THE ACID-BASE BALANCE OF HUMAN BLOOD:
http://journals.lww.[...]
1948-05
[65]
저널
Analytic calculation of physiological acid-base parameters in plasma
https://www.physiolo[...]
1999-01-01
[66]
저널
Understanding base excess (BE): merits and pitfalls
https://link.springe[...]
2022-08
[67]
저널
Stewart and beyond: New models of acid-base balance
https://linkinghub.e[...]
2003-09
[68]
논문
Hall, Hall, & Guyton, 2021, pp. 408-409
[69]
논문
Hall, Hall, & Guyton, 2021, pp. 533-536
[70]
논문
Hall, Hall, & Guyton, 2021, pp. 409-414
[71]
문서
Danziger, Zeidel, & Parker, 2012, pp. 165-167
[72]
저널
Acid-Base Homeostasis
https://journals.lww[...]
2015-12
[73]
웹인용
Renal Regulation of Acid-Base Balance -continued
https://www.anaesthe[...]
2024-06-23
[74]
문서
Hall, Hall, & Guyton, 2021, pp. 414-415
[75]
문서
Giebisch, Windhager, & Aronson, 2017, pp. 832-834
[76]
웹인용
Quantitative Acid-Base Analysis - The System
https://www.anaesthe[...]
2024-07-21
[77]
문서
Stewart, 2009, pp. 184-188
[78]
저널
Strong ion difference in urine: new perspectives in acid-base assessment
http://ccforum.biome[...]
2006
[79]
저널
Acid-base physiology: comments on 10 contentious assertions
https://pubmed.ncbi.[...]
2015-09
[80]
문서
Ring, 2009, pp. 410-413
[81]
웹인용
Quantitative Acid-Base Balance : The Implications
https://www.anaesthe[...]
2024-06-23
[82]
문서
Calzavacca, Licari, & Bellomo, 2009, p. 394
[83]
문서
Ring, 2009, pp. 408-409
[84]
문서
Hall, Hall, & Guyton, 2021, pp. 416-420
[85]
문서
Dubose, Jr., 2018, pp. 322-324
[86]
문서
Boron, 2017, pp. 638-644
[87]
문서
Dubose, Jr., 2018, pp. 315-316
[88]
웹인용
Terminology of Acid-Base Disorders
https://www.anaesthe[...]
2024-06-23
[89]
웹인용
Structured Approach to Assessment
https://www.anaesthe[...]
2024-08-28
[90]
저널
Using quantitative acid-base analysis in the ICU
https://pubmed.ncbi.[...]
2006-03
[91]
웹인용
Assessment of compensation: Boston and Copenhagen methods
https://derangedphys[...]
2024-06-17
[92]
저널
Human PaCO2 and standard base excess compensation for acid-base imbalance
https://pubmed.ncbi.[...]
1998-07
[93]
저널
Stewart's quantitative acid-base chemistry: Applications in biology and medicine
https://linkinghub.e[...]
1993-01
[94]
저널
Diagnosis of Metabolic Acid–Base Disturbances in Critically Ill Patients
https://www.atsjourn[...]
2000-12-01
[95]
저널
Clinical Assessment of Acid‐Base Status: Comparison of the Henderson‐Hasselbalch and Strong Ion Approaches
https://onlinelibrar[...]
2000-12
[96]
저널
Base excess or buffer base (strong ion difference) as measure of a non‐respiratory acid‐base disturbance
https://onlinelibrar[...]
1995-09
[97]
저널
Science review: Quantitative acid–base physiology using the Stewart model
https://ccforum.biom[...]
2004
[98]
저널
"[Base excess] vs [strong ion difference]. Which is more helpful?"
http://link.springer[...]
[99]
문서
Kellum, 2009, pp. 426-428
[100]
서적
Fluid, electrolyte and acid-base disorders in small animal practice
Elsevier Saunders
2012
[101]
저널
Acid-base disorders in liver disease
https://linkinghub.e[...]
2017-11
[102]
저널
Anion gap and hypoalbuminemia:
http://journals.lww.[...]
1998-11
[103]
저널
Anion gap, anion gap corrected for albumin, base deficit and unmeasured anions in critically ill patients: implications on the assessment of metabolic acidosis and the diagnosis of hyperlactatemia
https://bmcemergmed.[...]
2008-12
[104]
저널
Acid–base homeostasis: a historical inquiry of its origins and conceptual evolution
https://academic.oup[...]
2022-09-22
[105]
저널
Chemical and mechanical theories of digestion in early modern medicine
https://linkinghub.e[...]
2012-06
[106]
논문
Acid spirits and alkaline salts: the iatrochemistry of Franciscus dele Boë, Sylvius
https://www.sartonch[...]
1999
[107]
문서
Parascandola, 1968, pp. 41-44
[108]
논문
From van Helmont to Boyle. A study of the transmission of Helmontian chemical and medical theories in seventeenth-century England
https://www.cambridg[...]
1993-09
[109]
문서
Parascandola, 1968, pp. 44-46
[110]
논문
Blood Gas Analysis and Critical Care Medicine
https://www.atsjourn[...]
1998-04-01
[111]
서적
Acid Base Chemistry and Related Topics
Oesper Collection
2016
[112]
논문
Historical review: concept of acid-base balance in medicine
https://pubmed.ncbi.[...]
2003
[113]
논문
Acid-Base Homeostasis: Past and Present Perspectives
https://www.journals[...]
1989-07
[114]
문서
Parascandola, 1968, pp. 46-49
[115]
문서
Parascandola, 1968, pp. 49-56
[116]
문서
Parascandola, 1968, pp. 63-66
[117]
논문
Kidney metabolism and acid–base control: back to the basics
https://link.springe[...]
2022-08
[118]
논문
Turbid urine and beef-eating rabbits: Claude Bernard (1813-78)--a founder of modern physiology
https://academic.oup[...]
2010-08-01
[119]
논문
Have the principles of experimental medicine become obsolete in the era of big data?
https://linkinghub.e[...]
2017-09
[120]
논문
On the origins of experimental renal physiology
https://academic.oup[...]
2021-02-20
[121]
문서
Parascandola, 1968, p. 81
[122]
논문
History of blood gas analysis. II. pH and acid-base balance measurements
http://link.springer[...]
1985-10
[123]
논문
STUDIES OF ACIDOSIS: I. THE BICARBONATE CONCENTRATION OF THE BLOOD PLASMA; ITS SIGNIFICANCE, AND ITS DETERMINATION AS A MEASURE OF ACIDOSIS
https://linkinghub.e[...]
1917-06
[124]
논문
STUDIES OF ACIDOSIS: XVII. THE NORMAL AND ABNORMAL VARIATIONS IN THE ACID-BASE BALANCE OF THE BLOOD
https://linkinghub.e[...]
1921-09
[125]
논문
THE DETERMINATION OF GASES IN BLOOD AND OTHER SOLUTIONS BY VACUUM EXTRACTION AND MANOMETRIC MEASUREMENT. I
https://linkinghub.e[...]
1924-09
[126]
논문
THE EFFECT OF ETHER ANESTHESIA ON THE ACID-BASE BALANCE OF THE BLOOD
http://dx.doi.org/10[...]
1922-08
[127]
논문
STUDIES OF THE CARBON DIOXIDE ABSORPTION CURVE OF HUMAN BLOOD
https://linkinghub.e[...]
1923-07
[128]
논문
A GASOMETRIC METHOD FOR THE DETERMINATION OF pH IN BLOOD
https://linkinghub.e[...]
1927-02
[129]
논문
History of blood gas analysis. I. The development of electrochemistry
http://link.springer[...]
1985-07
[130]
논문
Standard Bicarbonate, its Clinical Significance, and a new Method for its Determination
http://www.tandfonli[...]
1957-01
[131]
논문
The physiological challenges of the 1952 Copenhagen poliomyelitis epidemic and a renaissance in clinical respiratory physiology
https://www.physiolo[...]
2005-08
[132]
논문
Measurement of blood gases
http://journals.sage[...]
2022-07
[133]
문서
Corey, 2009, pp. 267-272
[134]
논문
The Van Slyke Equation
http://www.tandfonli[...]
1977-01
[135]
논문
Understanding base excess (BE): merits and pitfalls
https://link.springe[...]
2022-08
[136]
웹인용
The Great Trans-Atlantic Acid-Base Debate
https://www.anaesthe[...]
2024-06-17
[137]
논문
A Critique of the Parameters Used in the Evaluation of Acid-Base Disorders: Whole-Blood Buffer Base and Standard Bicarbonate Compared with Blood pH and Plasma Bicarbonate Concentration
http://www.nejm.org/[...]
1963-06-20
[138]
논문
Siggaard-Andersen and the “Great Trans-Atlantic Acid-Base Debate”
http://www.tandfonli[...]
1993-01
[139]
논문
THE GREAT TRANS-ATLANTIC ACID-BASE DEBATE
https://pubmed.ncbi.[...]
1965
[140]
논문
Modern quantitative acid–base chemistry
http://www.nrcresear[...]
1983-12-01
[141]
저널
The Stewart approach--one clinician's perspective
https://pubmed.ncbi.[...]
2009-05
[142]
문서
Stewart, 2009, pp. 134-135.
[143]
저널
Stewart's quantitative acid-base chemistry: Applications in biology and medicine
https://linkinghub.e[...]
1993-01
[144]
서적
Rational Use of Intravenous Fluids in Critically Ill Patients
https://link.springe[...]
Springer International Publishing
2024
[145]
저널
Has Stewart approach improved our ability to diagnose acid-base disorders in critically ill patients?
http://www.wjgnet.co[...]
2015
[146]
저널
Traditional approach versus Stewart approach for acid–base disorders: Inconsistent evidence
http://journals.sage[...]
2018-01
[147]
저널
Extracorporeal Chloride Removal by Electrodialysis. A Novel Approach to Correct Acidemia
https://www.atsjourn[...]
2020-04-01
[148]
저널
The End of the Bicarbonate Era? A Therapeutic Application of the Stewart Approach
https://www.atsjourn[...]
2020-04-01
[149]
문서
Boron, 2017, pp. 644-646.
[150]
문서
Magder, 2009, pp. 247-249.
[151]
저널
Preferential intracellular pH regulation: hypotheses and perspectives
2016-10-01
[152]
문서
Putnam, 2001, p. 359.
[153]
문서
Putnam, 2001, p. 362.
[154]
문서
Magder, 2009, pp. 257-262.
[155]
저널
Assessment of acid-base disturbances in hypothermia and their physiologic consequences
https://linkinghub.e[...]
1989-01
[156]
저널
THE EFFECT OF TEMPERATURE ON THE pH OF BLOOD AND PLASMA IN VITRO
https://www.scienced[...]
1948-03
[157]
저널
How and why pH changes with body temperature: the α-stat hypothesis
https://journals.bio[...]
2016-04-15
[158]
저널
Relationship Between Temperature and Plasma pH and Carbon Dioxide Tension in the Turtle
https://www.nature.c[...]
1962-07
[159]
저널
Some aspects of the evolution of vertebrate acid-base regulation.
https://www.ncbi.nlm[...]
1969-06
[160]
저널
Acid-base balance in cold-blooded vertebrates as a function of body temperature
https://www.physiolo[...]
1970-02-01
[161]
문서
Constable, 2009, pp. 308-310.
[162]
서적
Gas Transport from the External Environment to the Cell
https://onlinelibrar[...]
Wiley
1967-01
[163]
문서
Constable, 2009, pp. 315-316.
[164]
서적
Variation of Chemical Potential with Temperature
https://onlinelibrar[...]
Wiley
1967-01
[165]
저널
STUDIES IN SERUM ELECTROLYTES: II. THE ELECTROLYTE COMPOSITION AND THE pH OF SERUM OF A POIKILOTHERMOUS ANIMAL AT DIFFERENT TEMPERATURES
https://linkinghub.e[...]
1927-04
[166]
저널
An imidazole alphastat hypothesis for vertebrate acid-base regulation: Tissue carbon dioxide content and body temperature in bullfrogs
https://linkinghub.e[...]
1972-03
[167]
웹인용
Alpha-stat and pH-stat models of blood gas interpretation
https://derangedphys[...]
2024-09-24
[168]
웹인용
Alphastat Hypothesis
https://www.anaesthe[...]
2024-09-24
[169]
저널
Respiratory management during therapeutic hypothermia for hypoxic-ischemic encephalopathy
https://www.nature.c[...]
2019-06
[170]
저널
Regulation of Cytosolic pH: The Contributions of Plant Plasma Membrane H+-ATPases and Multiple Transporters
https://www.mdpi.com[...]
2021-11-30
[171]
저널
The fine control of cytosolic pH
https://onlinelibrar[...]
1986-08
[172]
저널
Physicochemical aspects of ion relations and pH regulation in plants—a quantitative approach
[173]
저널
Origins of root-mediated pH changes in the rhizosphere and their responses to environmental constraints: A review
https://link.springe[...]
2003-01
[174]
저널
Plant nitrogen uptake and assimilation: regulation of cellular pH homeostasis
https://academic.oup[...]
2020-06-25
[175]
저널
pH: Signal and Messenger in Plant Cells
https://onlinelibrar[...]
2001-11
[176]
논문
Sensing and regulation of plant extracellular pH
https://linkinghub.e[...]
2023-12
[177]
논문
pH Regulation in Anoxic Plants
https://academic.oup[...]
2005-07-15
[178]
웹인용
Curious Chemistry Guides Hydrangea Colors
https://www.american[...]
2024-09-17
[179]
논문
The root apoplastic pH as an integrator of plant signaling
https://www.frontier[...]
2022-08-23
[180]
논문
Uncovering pH at both sides of the root plasma membrane interface using noninvasive imaging
https://pnas.org/doi[...]
2018-06-19
[181]
논문
The Acid Growth Theory of auxin-induced cell elongation is alive and well.
https://academic.oup[...]
1992-08-01
[182]
논문
Acid growth: an ongoing trip
http://academic.oup.[...]
2018-01-04
[183]
논문
Acid or base? How do plants regulate the ecology of their phylloplane?
https://academic.oup[...]
2021-08-01
[184]
논문
Availability of Mn, Zn and Fe in the rhizosphere
http://www.scielo.cl[...]
2015
[185]
논문
The effects of pH on nutrient availability depend on both soils and plants
https://link.springe[...]
2023-06
[186]
논문
Life in acid: pH homeostasis in acidophiles
https://linkinghub.e[...]
2007-04
[187]
논문
Understanding How Microorganisms Respond to Acid pH Is Central to Their Control and Successful Exploitation
https://www.frontier[...]
2020-09-24
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com